IgA신혈증
IgA nephropathy| IgA신혈증 | |
|---|---|
| 기타 이름 | IgA신염, 버거병 |
 | |
| 면역글로불린 A 어둑어지다 | |
| 전문 | 신약학 류머티스학 종양학 |
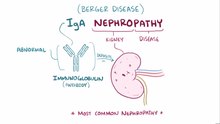
IgA 신장염(IgAN)은 버거병(/bɛrˈʒee//) (및 변이) 또는 구심성 글루머로네프염으로도 알려져 있으며 신장(또는 신장염)과 면역계의 병으로 특히 글루머룰론염의 일종이나 신장의 글루머룰리의 염증이다. 공격적인 버거병(이 병의 희귀한 형태)은 간, 피부, 심장 등 다른 주요 장기를 공격할 수 있다.
IgA 신우울증은 전 세계적으로 가장 흔한 글루머루온염이지만, 공격적인 버거병은 희귀질환의 NOD 목록에 올라 있다.[1] 일차 IgA 신혈증은 글루머룰루스에 IgA 항체가 퇴적되는 것이 특징이다. 글루머형 IgA 퇴적물과 관련된 다른 질병도 있는데, 가장 흔한 질환은 IgA 혈관염(이전에는 헤노크-숄레인 자반증[HSP]으로 알려져 있다)으로, 많은 사람들이 이를 IgA 신증후군의 전신적 형태라고 여긴다.[2] IgA 혈관염은 자줏빛 피부 발진, 관절염, 복통 등을 특징적으로 나타내며 어린이들에게 더 많이 발생한다. HSP는 IgA 신경증보다 더 양성적인 예후와 관련이 있다. 비침습성 IgA 신우울증에서는 전통적으로 20년 동안 25~30%의 경우 만성 신부전증으로 진행이 느리다.
징후 및 증상
비침습성형(사례의 40~50%)의 고전적 증상은 삽상혈뇨로, 초기 감염 후(주) 일정 시간(주)에 발생하는 후기상구체성 글루머론피염과는 달리 보통 특정되지 않은 상부 호흡기 감염(헨체 신파린기)의 하루나 이틀 내에 시작된다. 공격적이고 공격적이지 않은 버거의 질병인 루인 통증도 발생할 수 있다. 며칠 후에 총혈뇨가 해결될 수도 있지만, 미세혈뇨가 지속되기는 하지만, 총혈뇨가 미세혈뇨보다 지속되는 것은 공격적인 버거의 병과 더 흔하다. 신장기능은 대개 비침습성 버거병으로 정상 상태를 유지하지만 급성신부전증은 거의 발생하지 않을 수 있다(아래 참조). 이 발표는 젊은 사람들에게 더 흔하다.[citation needed]
일반적으로 고령인구가 적은 비율(20~30%)은 미세혈뇨와 단백뇨(하루 2g 미만)를 가진다. 이 환자들은 무증상일 수도 있고 소변 검사 때문에만 고쳤을 수도 있다. 따라서, 이 병은 소변 검진이 의무적인 상황(예: 일본의 학생)에서 더 흔히 진단된다.[citation needed]
매우 드물게(각각 5%), 제시 이력은 다음과 같다.[citation needed]
- 네프리트 증후군
- 급성신부전증(정확한 혈뇨의 합병증으로 보통 회복되거나 만성신부전증을 자주 일으키는 급속한 진행성 글루머론염으로 인해)
- 만성 신부전(이전 증상 없음, 빈혈, 고혈압 및 기타 신부전 증상이 나타남, 오랫동안 발견되지 않은 현미경 혈뇨 및/또는 단백뇨가 있는 사람)
각종 전신질환은 간기능부전, 암, 셀리악병, 전신 루푸스 홍반, 류마티스성 관절염, 심부전, 반응성 관절염, 안키로싱 척추염, HIV와 같은 공격적인 IgA 신혈증(베르거병)과 연관되어 있다. 버거병의 진단과 관련 질병에 대한 탐색은 때때로 그러한 근본적인 심각한 전신 질환을 드러낸다. 때때로, Henoch-Schönlein pappura의 동시 증상이 나타난다. 자세한 연관성은 아래를 참조하라. 일부 HLA 주장은 보완적 표현형과 함께 유전적 요인으로 의심받고 있다. 불침투성 버거병은 위의 어떤 전신 질환과도 연관이 있을 수 있지만, 이것은 드문 일이다.[citation needed]
형태학
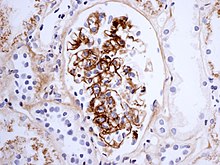
역사학적으로 IgA 신혈증은 중간의 확대와 초점 및 부분 염증을 보일 수 있다. 확산성 중간증식이나 초승달성 글루머론증후군도 있을 수 있다. 면역플루오렌스는 C3와 적절한 din과 적은 양의 다른 면역글로불린(IgG 또는 IgM)으로 IgA의 중내 침적을 자주 보여준다. 고전적 보완 경로(C1q 또는 C4)의 초기 구성요소는 대개 보이지 않는다. 전자 현미경 검사는 작은 부분집합(보통 초점 증식이 있는 경우)에서 인접 모세혈관 벽의 내피 부위로 확장될 수 있는 중상섬유의 전자-감지 침전물을 확인한다.[citation needed]
병리학
이 질병은 신장 글루머룰루스의 한 지역인 중창의 미세한 패턴으로 면역글로불린 A(IgA)가 퇴적된 데서 유래한다. 가벼운 현미경 검사에 의한 중상실은 초세포일 수 있으며 세포외 매트릭스 단백질의 증착이 증가함을 보여준다. 헤노크-슈n레인 자반증의 신장 발현에 있어서는 IgA 신혈증과 같은 조직학적 스펙트럼을 공유하지만, 활체 괴사, 초승달과 같은 심각한 병변의 빈도가 더 많이 관찰된 것으로 밝혀졌다. 이에 상응하여 HSP신염은 IgAN에 비해 섬유소에 대한 글루머성 점착 빈도가 높지만, 다른 면역이 유사한 프로파일을 가지고 있다.[3]
IgA의 축적에 대한 명확한 설명은 없다. IgA를 위한 외생 항원은 신장에서 확인되지 않았지만, 이 항원이 질병이 나타나기 전에 제거되었을 가능성이 있다. IgA 자체가 항원이 될 수도 있다는 제안도 나왔다.[citation needed]
최근의 한 진보된 이론은 IgA1 분자의 이상에 초점을 맞추고 있다. IgA1은 두 개의 면역글로불린 하위 분류(다른 하나는 IgD) 중 하나로, 특수 프로라인이 풍부한 힌지 영역의 세린과 트레오닌 잔류물에 O-글리코실린이다. IgA의 이상 글리코실레이션은 조직 내 IgA 분자, 특히 글루머성 중합체(glomerular mesangium)의 중합화로 이어지는 것으로 보인다.[4] 비슷한 메커니즘이 주로 어린이들에게 영향을 미치고 IgA 신장염과 거의 구별할 수 없는 신장 관여를 특징으로 할 수 있는 혈관염인 헤노크-셰른린 자반증의 기저에 있다고 주장되어 왔다. 그러나 인간 연구 결과 IgA1의 탈락토실화는 장 항원 피폭(전통이 아닌)에만 반응하여 IgA 신혈증을 가진 환자에게서 발생하며, 건강한 사람에게서 덜 발생한다는 것이 밝혀졌다.[5] 이는 IgA1의 탈락토실화가 기저 현상(비정상 점막 항원 취급)의 결과물이며 IgA 신증(nephropathy)의 궁극적인 원인이 아님을 강력히 시사한다. IgA1의 힌지 영역에 있는 갈락토스-피질 오글리칸과 IgA1에 대한 항체의 합성 및 결합이 모두 면역글로불린 단지가 형성되어 글로뮬리에 축적되려면 필요하다는 것이 지배적인 증거다.[6]
신장이식 후 IgAN이 재발할 수 있다는 사실에서 보면 신장 자체보다는 면역체계에 문제가 생겨 발병한다고 가정할 수 있다. 눈에 띄게 신장에 축적된 IgA1은 대부분의 상부 호흡기 감염 부위인 점막 관련 림프조직(MALT)에서 유래한 것이 아니라 골수에서 유래한 것으로 보인다. 이것 역시 외부 요인에 의한 직접적인 간섭보다는 면역 병리학을 시사한다.[7][8]
박물학
IgA 신우울증은 소변검사에서 비정상적인 소견을 통해 증상 없이 나타나는 경우가 많기 때문에 선별방침에 따라 연구 대상인구의 변동 가능성이 상당히 높다. 이와 유사하게 신장 조직검사를 수행하는 국소 정책은 중요한 역할을 담당한다. 만약 이것이 혈뇨가 격리된 환자를 단순히 관찰하는 정책이라면, 일반적으로 바람직한 예후를 가진 그룹은 제외될 것이다. 대조적으로, 그러한 모든 환자들이 생체시술된다면, 격리된 미세혈뇨와 격리된 중간의 IgA를 가진 집단이 포함되고 그 특정 시리즈의 예후를 개선할 것이다.[citation needed]
그럼에도 불구하고 초기에 양성 질환으로 생각되었던 IgA 신우울증은 특히 환자가 공격적인 형태로 나타날 경우 양성 질환이 아닌 것으로 나타났다. 대부분의 보고에 따르면 버거의 병은 치유나 신장 손상을 향해 나태한 진화를 가지고 있다고 하지만, 때때로 더 공격적인 진화가 광범위한 초승달과 연관되어 있으며, 급성 신부전으로 나타난다. 일반적으로 만성 신부전증의 진입은 30년 이상의 시간 척도(다른 글러머론프리티드의 5~15년과는 대조적으로)에 걸쳐 발생하는 대부분의 다른 글러머론프리티드에 비해 느리지만, 공격적인 버거병에서 시간 척도는 5~10년 이내, 그리고 종종 더 빠르다. 이것은 솔직한 혈뇨로 인한 이전의 진단을 반영할 수 있다.[citation needed]
공격적인 버거의 질병의 완전한 완화는 성인에게서 거의 일어나지 않는다. 그러나 약 5%의 경우 불침투성 버거병으로 완치될 확률이 높다(이는 약 7.4%로 추정된다). 특히 공격적인 버거병으로 재발할 가능성이 높다. 그러나 이 질병의 진화를 고려할 때, 그러한 환자의 장기(10~20년) 결과는 아직 확정되지 않았다.[citation needed]
전체적으로 현재 공격성 버거병의 10년 생존율은 25%, 불침투성 버거병의 생존율은 73%이다.[citation needed]
진단
격리된 혈뇨를 가진 성인 환자의 경우 보통 신장 초음파, 낭포경 등의 검사를 먼저 실시해 출혈의 원인을 정확히 파악한다. 이 검사들은 혈뇨의 다른 흔한 비뇨기과 원인인 신장결석과 방광암을 제외시킬 것이다. 어린이와 청소년들에게 호흡기 감염의 역사와 연관성은 IgA 신우울증 의혹을 제기할 수 있다. 진단확인을 위해서는 신장 조직검사가 필요하다. 생체검사 표본은 중상섬유의 증식을 보여주며 IgA가 면역불황과 전자현미경 검사에서 퇴적한다. 그러나 격리된 미세혈뇨(즉, 관련 단백뇨가 없고 정상적인 신장 기능이 있는) 환자들은 뛰어난 예후와 연관되기 때문에 보통 생체시술을 받지 않는다. 소변 검사에서 적혈구, 보통 적혈구 비뇨기 깁스로 나타난다. 보통 하루에 2그램 미만인 단백뇨도 존재할 수 있다. 고립된 혈뇨의 다른 원인으로는 얇은 지하막질환과 알포트증후군이 있는데, 후자는 청각장애와 안구질환과 관련된 유전성 질환이다.[citation needed]
진단에 도움을 주기 위해 시행된 다른 혈액 검사에는 CRP 또는 ESR, 보충수치, ANA, LDH 등이 포함된다. 단백질 전기영동증과 면역글로불린 수치는 모든 환자의 50%에서 IgA 증가가 나타날 수 있다.
치료
IgAN에 대한 이상적인 치료는 IgA를 글로머룰루스에서 제거하고 IgA의 추가 침적을 막을 것이다. 이 목표는 아직 요원한 전망으로 남아 있다. IgA 신우울증을 치료하는 동안 고려해야 할 몇 가지 추가 주의사항이 있다. IgA 신우울증은 양성 재발 혈뇨에서 만성 신부전 및 기타 주요 장기의 기능 상실까지 매우 가변적인 코스를 가지고 있다. 따라서 어떤 환자를 치료할지에 대한 결정은 예측적 요인과 진행의 위험에 기초해야 한다. 또한 IgA 신혈증은 이러한 환자들에게 시클로스포린, 아자티오프린 또는 마이코페놀레이트 모페틸, 사이클로인산아미드, 이소트레티노인, 스테로이드를 사용함에도 불구하고 이식에 재발한다. 현재까지 수행된 소수의 통제된 무작위화된 연구에 포함된 제한된 환자 수 때문에 불확실성이 지속되고 있다. 이러한 연구들은 IgA 신우울증 환자의 이질성, 연구 치료 프로토콜의 다양성 및 추적 기간과 관련하여 통계적으로 유의미한 증거를 거의 제시하지 못한다.
편도선염이 삽화혈뇨를 촉진시키는 요인인 경우 편도선절제술로 그 발생 빈도를 줄인다고 주장되어 왔다. 그러나 신장 기능 부전의 진행률을 낮추지는 않는다.[9] 점막 항원 도전을 줄이는 데 사용되는 식이성 글루텐 제한도 신장 기능을 보존하는 것으로 나타나지 않고 있다. 페니토인 또한 아무런 이득도 없이 시도되었다.[10]
가벼운 현미경 검사에서 최소한의 변화 질환을 가지고 있고 임상적으로 신피로틱 증후군을 가지고 있는 IgA 신피로병 환자들 중 일부는 스테로이드에 대해 정교한 반응을 보이며, 거의 최소한의 변화 질환에 가까운 행동을 한다. 다른 환자들에서는 스테로이드제에 대한 증거가 설득력이 없다. 스테로이드가 많이 함유된 짧은 코스는 효과가 없는 것으로 입증되었다. 그러나 공격적인 버거병 환자의 경우 다른 약 외에 6개월의 스테로이드 처방전이 단백뇨를 감소시키고 신장 기능을 보존할 수 있다.[11] 이 연구는 10년 동안의 환자 추적 데이터를 가지고 있었고 스테로이드 치료의 장점을 보여주었는데 스테로이드 그룹에서 말기 신장병(신체 기능이 떨어져 투석이 필요했다)에 도달할 가능성이 낮았다. 중요한 것은, 안지오텐신 변환 효소 억제제가 두 그룹 모두에서 동일하게 사용되었다.
사이클로인산화(내독산 & 시톡산)와 이소스트레티노인(Endoxan & Cytoxan)은 흔히 사용되어 왔으며, 종종 공격적인 버거병 환자에게는 항혈소판/항응고제를 사용하였으나, 이러한 약물의 부작용 프로파일은 악성 및 불임성의 장기 위험을 포함하여 젊은이들에게 사용을 위한 좋지 않은 선택으로 만들었다. 그러나 GFR이 감소하는 환자의 고위험군에서 엄선된 최근의 한 연구는 초기 3개월 동안 스테로이드와 사이클로인산화물의 조합이 최소 2년 동안 아자티오프린에 이어 신기능을 유의하게 보존하는 결과를 초래했다는 것을 보여주었다.[12] 마이코페놀레이트 모페틸, 시클로스포린, 미조리빈과 같은 다른 에이전트들도 다양한 결과를 가지고 시도되었다.
Mayo Clinic의 연구는 장기간의 오메가-3 지방산 치료는 신장 기능 악화의 위험이 높은 환자의 부분집합에서 단백뇨를 감소시키지 않고 신장 기능 상실로의 진행을 약간 감소시킨다는 것을 보여주었다.[13] 그러나 이러한 결과는 다른 연구 그룹과 후속 메타 분석에서 재현되지 않았다.[14][15] 그러나 어유 요법은 면역억제 요법의 단점이 없다. 또한 불쾌한 맛과 복부 불편과는 별개로 비교적 안심하고 섭취할 수 있다.[citation needed]
신장 기능 부전을 진행시키는 경향이 있는 사건들은 IgA 신우울증에만 국한되지 않으며, 이를 감소시키기 위한 비특이적인 조치들도 똑같이 유용할 것이다. 여기에는 저단백질 식이요법과 혈압의 최적 조절이 포함된다. 고혈압 치료제의 선택은 혈압이 원하는 수준으로 조절되는 한 열려 있다. 다만 항단백질 효과로 효소 억제제를 변환하는 안지오텐신과 안지오텐신2 수용체 길항제가 선호된다.
2021년 12월 미국에서 급속한 질병 진행의 위험이 있는 일차 IgA신혈증을 가진 성인의 단백뇨를 줄이기 위해 버데소니드(Tarpeyo)가 의료용으로 승인되었다.[16]
예후
남성 성별, 단백뇨(특히 > 2g/일), 고혈압, 흡연, 고지혈증, 노년기, 가족성 질환, 높아진 크레아티닌 농도가 나쁜 결과를 나타낸다. 프랭크 혈뇨는 대부분의 연구에서 더 나은 예후를 보여주며 불협화음을 보여왔는데, 아마도 초기 진단과 관련이 있을 것이다. 단, 더 나쁜 예후를 보고한 한 집단을 제외하고는 말이다. 단백뇨와 고혈압은 이 그룹에서 가장 강력한 예후 요인이다.[17]
신장 조직 검사에는 좋지 않은 예후와 관련이 있는 간 흉터와 같은 다른 특징들이 있다. ACE 유전자 다형성은 최근 신장 결함으로의 진행과 더 흔히 관련된 DD 유전자형에 영향을 미치는 것으로 나타났다.
역학
남자는 여자보다 세 배나 더 자주 영향을 받는다. 또한 전 세계적으로 IgA 신우울증이 만연하는 지리적 변화도 두드러진다. 극동·동남아시아에서 가장 흔한 글루머성 질환으로 전체 글루머성 질환 환자의 거의 절반을 차지한다.[citation needed] 그러나 유럽에서는 약 25%, 북미에서는 약 10%를 차지하는데 그쳐 아프리카계 미국인은 약 [citation needed]2%의 매우 낮은 유병률을 보이고 있다. 이 분석에서 교란 요인은 신장 조직검사의 조사 도구로서 검사와 이용이라는 기존의 정책이다. 일본의 학교 아이들은 정기적인 소변 검사를 받고 (싱가포르에서 군 신병이 그렇듯이) 의심스러운 이상은 신장 조직 검사로 추구된다. 이는 이들 국가에서 IgA 신우울증의 높은 관찰된 발병률을 부분적으로 설명할 수 있다.[citation needed]
유전학
다양한 연관성이 설명되었지만 현재까지 단일 취약한 유전자를 가리키는 일관된 패턴은 확인되지 않았다. 기술된 연관성에는 C4 null alle, 인자 Bf alles, MHC 항원 및 IgA 이형 등이 포함된다. ACE 유전자 다형성(D allele)은 만성 신부전의 다른 원인과 연관된 것과 유사하게 신장 기능 부전의 진행과 관련이 있다. 그러나 IgA 신증후군의 90% 이상은 산발적으로 나타나며, 켄터키와 이탈리아에서 유래한 몇 개의 큰 혈통(Online Mendelian Usistry in Man(OMIM: 온라인 멘델리안 상속: 161950)이 있다.[citation needed]
역사
장로 윌리엄 헤버든은 1801년 복통, 혈뇨, 혈뇨, 다리의 자반증이 있는 5세 어린이에게서 처음으로 이 병을 묘사했다.[18] 1837년 요한 루카스 숄레인은 어린이들의 관절통 및 비뇨기 침전물과 관련된 자반증후군을 묘사했다. 쇤레인의 제자 에두아르 하인리히 헤노치는 복통과 신체의 관여를 증후군과 더욱 연관시켰다.
1968년 공동저자인 전자 현미경학자 니콜 힝글라이스와 함께 프랑스의 선구적인 신피질학자 장 버거(1930~2011년)가 IgA 침적을 이런 형태의 글로머룰론증(Glomerulonephonis)으로 가장 먼저 서술해 버거병이라고도 한다.[19]
참조
- ^ D'Amico, G (1987). "The commonest glomerulonephritis in the world: IgA nephropathy". Q J Med. 64 (245): 709–27. PMID 3329736.
- ^ C, Davin J (2001). "What is the difference between IgA nephropathy and Henoch-Schönlein purpura nephritis?". Kidney International. 59 (3): 823–34. doi:10.1046/j.1523-1755.2001.059003823.x. PMID 11231337.
- ^ Magistroni, Riccardo (2015). "New developments in the genetics, pathogenesis, and therapy of IgA nephropathy". Kidney International. 88 (5): 974–89. doi:10.1038/ki.2015.252. PMC 4653078. PMID 26376134.
- ^ Maverakis E, Kim K, Shimoda M, Gershwin M, Patel F, Wilken R, Raychaudhuri S, Ruhaak LR, Lebrilla CB (2015). "Glycans in the immune system and The Altered Glycan Theory of Autoimmunity". J Autoimmun. 57 (6): 1–13. doi:10.1016/j.jaut.2014.12.002. PMC 4340844. PMID 25578468.
- ^ Smith AC, Molyneux K, Feehally J, Barratt J (2006). "O-glycosylation of serum IgA1 antibodies against mucosal and systemic antigens in IgA nephropathy". J Am Soc Nephrol. 17 (12): 3520–28. doi:10.1681/ASN.2006060658. PMID 17093066.
- ^ Suzuki, Hitoshi; Kiryluk, Krzysztof; Novak, Jan; Moldoveanu, Zina; Herr, Andrew; Renfrow, Matthew; Wyatt, Robert; Scolari, Francesco; Mestecky, Jiri; Gharavi, Ali; Julian, Bruce (October 1, 2011). "The Pathophysiology of IgA Nephropathy". Journal of the American Society of Nephrology. 22 (10): 1795–1803. doi:10.1681/ASN.2011050464. PMC 3892742. PMID 21949093.
- ^ "IgA Nephropathy". The Lecturio Medical Concept Library. Retrieved 27 July 2021.
- ^ "IgA Nephropathy". National Kidney Foundation. 24 December 2015. Retrieved 27 July 2021.
- ^ Xie Y, Chen X, Nishi S, Narita I, Gejyo F (2004). "Relationship between tonsils and IgA nephropathy as well as indications of tonsillectomy". Kidney Int. 65 (4): 1135–44. doi:10.1111/j.1523-1755.2004.00486.x. PMID 15086452.
- ^ Clarkson AR, Seymour AE, Woodroffe AJ, McKenzie PE, Chan YL, Wootton AM (1980). "Controlled trial of phenytoin therapy in IgA nephropathy". Clin. Nephrol. 13 (5): 215–18. PMID 6994960.
- ^ Kobayashi Y, Hiki Y, Kokubo T, Horii A, Tateno S (1996). "Steroid therapy during the early stage of progressive IgA nephropathy. A 10-year follow-up study". Nephron. 72 (2): 237–42. doi:10.1159/000188848. PMID 8684533.
- ^ Ballardie FW, Roberts IS (2002). "Controlled prospective trial of prednisolone and cytotoxics in progressive IgA nephropathy". J. Am. Soc. Nephrol. 13 (1): 142–48. doi:10.1681/ASN.V131142. PMID 11752031.
- ^ Donadio JV, Bergstralh EJ, Offord KP, Spencer DC, Holley KE (1994). "A controlled trial of fish oil in IgA nephropathy. Mayo Nephrology Collaborative Group". N. Engl. J. Med. 331 (18): 1194–99. doi:10.1056/NEJM199411033311804. PMID 7935657.
- ^ Strippoli GF, Manno C, Schena FP (2003). "An "evidence-based" survey of therapeutic options for IgA nephropathy: assessment and criticism". Am. J. Kidney Dis. 41 (6): 1129–39. doi:10.1016/S0272-6386(03)00344-5. PMID 12776264.
- ^ Dillon JJ (1997). "Fish oil therapy for IgA nephropathy: efficacy and interstudy variability". J. Am. Soc. Nephrol. 8 (11): 1739–44. doi:10.1681/ASN.V8111739. PMID 9355077.
- ^ "FDA approves first drug to decrease urine protein in IgA nephropathy, a rare kidney disease". U.S. Food and Drug Administration (FDA). 17 December 2021. Retrieved 18 December 2021.
 이 글은 공개 도메인에 있는 이 출처의 텍스트를 통합한다..
이 글은 공개 도메인에 있는 이 출처의 텍스트를 통합한다.. - ^ Bartosik LP, Lajoie G, Sugar L, Cattran DC (2001). "Predicting progression in IgA nephropathy". Am. J. Kidney Dis. 38 (4): 728–35. doi:10.1053/ajkd.2001.27689. PMID 11576875.
- ^ 헤버든 W. 코멘타리 디 모르보리움 히스토리아 엣 큐레이션. 런던: 페인, 1801년.
- ^ Berger J, Hinglais N (1968). "Les depots intercapillaires d'IgA-IgG". J Urol Nephrol. 74: 694–95.
외부 링크
- IGA Nephropathy in National Institute of 당뇨병과 소화기 및 신장 질환 연구소의 네프로패스