세포독성T세포
Cytotoxic T cell
세포독성 T세포(T, 세포독성 T림프구, CTL, T-킬러 세포, 세포용해 T세포+, CD8 T세포 또는 킬러 T세포라고도C 함)는 암세포, 세포 내 병원체(바이러스 또는 박테리아 [1]등)에 의해 감염되는 T림프구(일종의 백혈구)이다.
대부분의 세포독성 T세포는 특정 항원을 인식할 수 있는 T세포 수용체(TCR)를 발현한다.항원은 면역반응을 자극할 수 있는 분자로 암세포, 바이러스, 박테리아 또는 세포내 신호에 의해 종종 생성된다.세포 내부의 항원은 I급 MHC 분자에 결합되어 있으며, I급 MHC 분자에 의해 세포의 표면에 나타나 T세포에 의해 인식될 수 있다.TCR이 해당 항원에 특이할 경우 I급 MHC 분자와 항원의 복합체에 결합하고 T세포가 세포를 파괴한다.
TCR이 클래스 I MHC 분자에 결합하기 위해서는 전자는 클래스 I MHC 분자의 일정한 부분에 결합하는 CD8이라고 불리는 당단백질을 동반해야 합니다.따라서, 이 T 세포들은 CD8 T 세포라고 불립니다+.
CD8과 MHC 분자 사이의 친화력은 항원 특이적 활성화 동안 T세포와C 표적세포가 밀접하게 결합되도록 한다.CD8+ T세포는 활성화되면 T세포로C 인식되며 일반적으로 면역계 내에서 미리 정의된 세포독성 역할을 하는 것으로 분류된다.그러나 CD8+ T 세포는 또한 항종양 및 항균 효과와 함께 TNF-α 및 IFN-γ와 같은 일부 사이토카인을 만드는 능력을 가지고 있다.
발전
면역체계는 수백만 개의 잠재적 항원을 인식해야 한다.인체에는 3만 개 미만의 유전자가 있기 때문에 항원마다 하나의 유전자를 갖는 것은 불가능하다.대신에, 골수에 있는 수백만 개의 백혈구의 DNA는 각각 다른 항원과 결합할 수 있는 독특한 수용체를 가진 세포를 만들기 위해 섞인다.어떤 수용체들은 인체 자체의 조직에 결합하기 때문에, 신체가 자신을 공격하는 것을 막기 위해, 그 자체 반응성 백혈구는 흉선에서 더 발달하는 동안 파괴되고, 요오드는 성장과 [2]활동에 필요하다.
TCR은 보통 알파와 베타 체인의 두 부분으로 구성됩니다.(일부 TCR에는 감마 및 델타 체인이 있습니다.이들은 스트레스에 대해 작용하고 상피[3] 장벽의 일부를 형성하기 위해 내재되어 있다.골수에 있는 조혈모세포는 흉선으로 이동하고, 거기서 그들은 그들의 베타 사슬 TCR DNA의 V(D)J 재조합을 거쳐 TCR 단백질의 발달 형태를 형성하고, 프리 TCR로 알려져 있습니다.만약 그 재배치가 성공하면, 세포들은 기능적인 알파 베타 TCR 복합체를 만들기 위해 그들의 알파 사슬 TCR DNA를 재배열한다.TCR 유전자의 이 매우 가변적인 유전자 재배열 제품은 다른 TCR을 가진 수백만 개의 다른 T세포를 만드는데 도움을 주고, 신체 면역 체계가 침입자의 거의 모든 단백질에 반응하도록 도와줍니다.대부분의 T 세포는 알파 베타 TCR(αβ T 세포)을 발현하지만, 상피 조직의 일부 T 세포는 비단백질 항원을 인식하는 감마 델타 TCR(감마 델타 T 세포)을 발현한다.후자는 제시되지 않은 항원을 인식하는 능력에 의해 특징지어진다.또한 미생물 독성 쇼크 단백질과 자가 세포 스트레스 [4]단백질을 인식할 수 있습니다.T세포는 사이토카인(IFN-γ, TNF-α, IL-17)과 케모카인(IP-10, 림프탁틴)을 생성하고 표적세포(페린, 과립자임...)의 세포분해를 트리거할 수 있으며, 다른 단핵세포와 상호작용할 수 있기 때문에 감염 또는 변환된 세포를 인식한 후 광범위한 기능적 가소성을 가진다.ils와 B세포.인간 사이토메갈로바이러스와 같은 일부 감염에서는 특정 TCR을 가진 말초 δδT세포의 복제팽창이 있어 이러한 [5]세포에 의해 매개되는 면역반응의 적응성을 나타낸다.
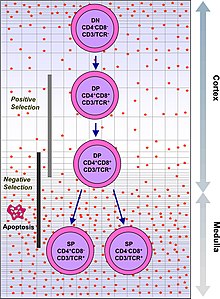
기능적으로 안정된 TCR을 가진 T세포는 CD4와 CD8의 공동수용체를 모두 발현하므로 "이중양성" T세포(CD4CD8++)로 불린다.이중 양성 T 세포는 흉선에서 다양한 자가 항원에 노출되며 두 가지 선택 기준을 거칩니다.
- 양성 선택, 자가 MHC의 존재 하에서 외래 항원과 결합하는 이중 양성 T세포.제시된 항원과 관련된 MHC(CD8의 경우 MHC1, CD4의 경우 MHC2)에 따라 CD4+ 또는+ CD8로 구분됩니다.이 경우, 세포는 MHC1의 맥락에서 항원으로 제시되었을 것이다.양성 선택은 자가 MHC 분자를 인식할 수 있는 TCR을 선택하는 것을 의미합니다.
- 음성 선택, MHC가 존재하는 자기 항원에 너무 강하게 결합하는 이중 양성 T세포가 아포토시스(apotosis)를 겪는 경우, 그렇지 않으면 자가 면역이 될 수 있기 때문이다.
MHC-자기항원복합체에 약하게 결합하는 T세포만이 양성선택된다.양성 및 음성 선택에서 살아남은 세포는 TCR이 MHC 등급 I-존재 항원(CD8) 또는 MHC 등급 II-존재 항원(CD4)을 인식하느냐에 따라 단일 양성 T 세포(CD4+ 또는 CD8+)로 분화한다.CD8+ T세포는 성숙하여 클래스 I 제한 항원으로 활성화된 후 세포독성 T세포가 된다.
액티베이션[clarification needed]
T세포는 항원과 접촉한 횟수에 따라 다른 단계를 거친다.우선 순진한 T림프구는 흉선에서 아직 항원을 만나지 않은 세포이다.그리고 나서, T림프구는 기억 T세포가 된다.이 타입의 T세포는 항원과 적어도 한 번 접촉한 적이 있지만 그 후에 대기 또는 비활성 상태로 돌아와 자극받은 항원에 다시 반응할 준비가 된 세포이다.마지막으로, 특정 면역 반응이 유발되면, 이러한 순진한 기억 T세포가 활성화되어 병원체나 종양 [6][7]세포를 죽이는 능력을 가진 이펙터 T세포를 생성한다.
이러한 세포의 활성화 역치는 매우 높으며, 이 과정은 흉선 비의존적(감염된 APC에 의한) 또는 흉선 의존적(CD4+T 세포에 의한)의 두 가지 경로를 통해 발생할 수 있다.흉선비의존성 경로에서는 APC가 감염되었기 때문에 매우 활성화되어 다수의 공활성화용 공수용체를 발현한다.APC가 감염되지 않은 경우 CD4 세포가 관여해야 합니다. 즉, 공동 자극을 통해 APC를 활성화하거나(좀 더 일반적인 경우), IL-2를 분비하여 Tc 세포를 직접 활성화해야 합니다.
활성화가 발생하면 림프구는 과립을 시냅스 부위로 분극시켜 방출시켜 "치명적 타격"을 일으킨다.이 시점에서 타깃셀에서 분리되어 다른 셀로 이동할 수 있습니다.표적 세포는 보통 아포토시스에 [8]의해 약 6시간 후에 죽는다.
Class I MHC는 적혈구와 같은 비핵세포를 제외한 모든 숙주세포에 의해 발현된다.이들 세포가 세포 내 병원체에 감염되면 항원 처리를 통해 외부 단백질을 분해한다.이로 인해 펩타이드 조각이 생성되고, 그 중 일부는 MHC Class I에 의해 CD8+ T세포의 T세포 항원 수용체(TCR)에 제시됩니다.
세포독성 T세포의 활성화는 T세포의 표면에 발현된 분자와 항원제시세포(APC)의 표면에 발현된 분자 사이의 여러 가지 동시 상호작용에 따라 달라진다.예를 들어, T셀 활성화의C 2가지 신호 모델을 고려합니다.
| 신호. | T세포 | APC | 묘사 |
| 첫 번째 신호 | TCR | 펩타이드결합MHC클래스I분자 | CD8 코어 수용체와 클래스 I MHC 분자 사이에는 이 신호를 안정시키기 위한 두 번째 상호작용이 있습니다. |
| 두 번째 신호 | T세포상의 CD28 분자 | CD80 또는 CD86(B7-1 및 B7-2라고도 함) | CD80 및 CD86은 T세포 활성화를 위한 비용 자극제로 알려져 있습니다.이 두 번째 신호는 T 도우미 세포에서 방출된 사이토카인으로 T 세포를C 자극함으로써 보조될 수 있습니다. |
순진한+ CD8 T 세포의 단순한 활성화는 전문 항원 제시 세포, 주로 성숙한 수지상 세포와의 상호작용을 필요로 한다.장기 기억 T세포를 생성하고 세포독성 T세포의 반복적인 자극을 허용하기 위해 수지상 세포는 활성화된+ CD4 도우미 T세포와 CD8+ T세포 [9][7]둘 다와 상호작용해야 한다.이+ 과정 동안, CD4 도우미 T 세포는 순진한+ CD8 T [10]세포에 강력한 활성화 신호를 주기 위해 수지상 세포에 "라이센스"를 부여합니다.
또+, CD8 T세포의 성숙은,[11] CD40 시그널링에 의해서 매개된다.순진한 CD8+ T 셀이 감염된 셀에 결합되면 감염된 셀이 CD40을 [11]방출하도록 트리거됩니다.이 CD40 릴리즈에서는 도우미 T세포의 도움을 받아 순진한 CD8+ T세포가 성숙된+ CD8 [11]T세포로 분화됩니다.
대부분의 경우 활성화는 항원의 TCR 인식에 의존하지만 활성화에 대한 대체 경로가 설명되었다.예를 들어 세포독성 T세포는 다른 CD8 T세포에 의해 표적화되면 활성화되어 [12]후자의 허용화를 유도하는 것으로 나타났다.
활성화되면 T세포는C T세포의 성장과 분화인자인 사이토카인 인터류킨2(IL-2)의 도움을 받아 클론 확장을 거친다.이것은 항원 양성 체세포를 찾아 몸 전체를 돌아다닐 수 있는 표적 항원에 특정한 세포의 수를 증가시킨다.
이펙터 기능
T세포는 감염C/기능하지 않는 체세포에 노출되면 세포독신 천공, 과립효소 및 과립리신을 방출한다.천공의 작용을 통해, 과립효소는 표적 세포의 세포질로 들어가고 그들의 세린 단백질 분해효소 기능은 결국 아포토시스(프로그램된 세포사망)로 이어지는 일련의 시스테인 단백질 분해효소인 카스파아제 캐스케이드를 유발한다.이것은 "치사적 타격"이라고 불리며 표적 [13]세포의 파동 같은 죽음을 관찰할 수 있게 해줍니다.T세포는C 혈장막 내에 존재하는 높은 지질순서와 음전하 포스파티딜세린으로 인해 천공 및 과립자임 세포독소의 영향에 [14]내성이 있다.
아포토시스를 유도하는 두 번째 방법은 T와C 감염된 세포 사이의 세포 표면 상호작용을 통해 이루어진다.T가C 활성화되면 표층 단백질 FAS 리간드(FasL)(Apo1L)(CD95L)를 발현하기 시작하며, 표층 단백질 FAS 리간드는 표적 세포에서 발현되는 Fas(Apo1)(CD95) 분자와 결합할 수 있다.그러나 이러한 Fas-Fas 리간드 상호작용은 T 이펙터 세포의C 세포 분해 활성보다 T 림프구의 발달 중 불필요한 T 림프구의 처리 또는 특정H T 세포의 용해 활성에 더 중요한 것으로 생각된다.FAS와 FasL을 함께 사용하면 사망 유도 신호 복합체(DISC)[15]를 채용할 수 있습니다.FAS 관련 사망 도메인(FADD)은 DISC와 함께 이동하므로 8단계와 [15]10단계를 모집할 수 있습니다.그런 다음 이러한 캐스파아제는 이펙터 캐스파아제 3, 6, 7을 활성화하여 라민 A, 라민 B1, 라민 B2, PARP(폴리 ADP 리보스 중합효소), DNA-PKs(DNA 활성화 단백질 키나제)와 같은 사망 기질을 분열시킨다.최종 결과는 Fas를 발현한 세포의 아포토시스입니다.
전사인자 Eomesodermin은 CD8+ T 세포 기능에서 중요한 역할을 하며 적응 면역 [16]반응에서 조절 유전자로 작용한다.기능 상실의 영향을 조사하는 연구는 이 전사 인자의 발현 감소가 CD8 T [16]세포에 의해+ 생성되는 천공의 양을 감소시키는 결과를 낳았다는 것을 발견했다.
질병 병인에 대한 역할
바이러스 감염과 세균 감염에 모두 효과적인 항체와 달리, 세포독성 T세포는 대부분 바이러스에 [17]효과적이다.
B형 간염 바이러스(HBV) 감염 중 세포독성 T세포는 감염된 세포를 죽이고 생존 가능한 간세포에서 HBV를 제거할 수 있는 항바이러스 사이토카인을 생성한다.그들은 또한 HBV [18]감염과 관련된 거의 모든 간 손상에 기여하면서 중요한 병원성 역할을 한다.혈소판은 감염된 간으로 바이러스 특이 세포독성 T세포의 [19]축적을 촉진하는 것으로 나타났다.마우스를 사용한 일부 연구에서 CXCR5+CD8+T 세포를 사용한 주입은 HBsAg의 유의한 감소를 보여준다.또한, CXCL13 수준의 증가는 간내 CXCR5+CD8+T 세포의 신병을 촉진하였고, 이러한 유형의 세포들은 만성 HVB [20]감염의 제어를 개선하는 데 도움이 될 수 있는 높은 수준의 HBV 특이적 간섭체(IFN)-γ 및 IL-21을 생성하였다.
세포독성 T세포는 관절염의 진행에 관여하고 있다.류마티스 관절염의 주요 관여는 관절의 관여이며 활막은 세포 매개 면역 반응의 주요 기관인 CD4+ T 림프구인 염증 세포의 과형성, 혈관 증가 및 침윤으로 특징지어진다.다른 연구에서 류마티스 관절염은 주요 조직적합성 복합체(MHC) 등급 II 항원과 강하게 연관되어 있다.인체에서 MHC 클래스 II 항원을 발현하는 유일한 세포는 구성 항원 제시 세포이다.이는 류마티스 관절염이 정체불명의 관절염 항원에 의해 발생한다는 것을 강하게 시사한다.항원은 바이러스 단백질이나 내인성 [21]단백질과 같은 외인성 항원이 될 수 있다.최근에는 인간연골당단백질39, 중쇄결합단백질 및 시트룰화단백질 등 여러 가지 가능한 내인성 항원이 확인되었다.활성화된 CD4+T림프구는 단구, 대식세포 및 활엽섬유아세포를 자극하여 사이토카인 인터류킨-1, 인터류킨-6 및 종양괴사인자 알파(TNFa)를 정교하게 하고 금속단백질가수분해효소를 분비한다.그 중 처음 세 가지는 류마티스 관절염의 염증을 일으키는 데 중요하다.이 활성화된 림프구는 또한 류마티스 [22]인자를 포함한 면역글로불린을 생성하기 위해 B세포를 자극한다.이들의 병원성 역할은 알려지지 않았지만 면역 복합체 형성을 통한 보체 활성화 때문일 수 있다.게다가, 몇몇 동물 연구들은 세포독성 T세포가 그 질병에서 주로 소염 작용을 할 수 있다는 것을 암시한다.또한 CD8+ 세포에 의한 사이토카인의 생성은 관절염 질환의 진행을 가속화할 수 있다는 연구도 있다.[23]
CD8+ T세포는 HIV 감염에 관여하는 것으로 밝혀졌다.HIV는 장기간에 걸쳐 숙주 세포 면역 체계를 회피하기 위한 많은 전략을 개발해 왔다.예를 들어, HIV는 CD8 T [24]세포에 의해+ 인식되지 않도록 하기 위해 매우 높은 돌연변이율을 채택했다.그들은 또한 CD8 T [24]세포에 의한+ 파괴를 더 피하기 위해 그들이 감염시킨 세포의 표면 MHC Class I 단백질의 발현을 하향 조정할 수 있다.CD8+ T세포가 감염된 세포를 발견, 인식, 결합하지 못하면 바이러스는 파괴되지 않고 계속 성장한다.
또한+ CD8 T세포는 제1형 [25]당뇨병에 관여할 수 있다.당뇨병 마우스 모델에 대한 연구는 CD4+ 세포가 단핵 백혈구가 췌장으로 대량 침투하는 원인이라는 것을 보여주었다.그러나 CD8+ 세포는 섬 베타 세포의 궁극적인 파괴에 책임이 있는 이펙터 역할을 하는 것으로 나타났다.그러나, 베타 2-마이크로글로불린(베타 2-mu) 궤적에서 늘 돌연변이를 운반하는 NOD 마우스에 대한 연구에서 주요 조직적합성 복합체 클래스 I 분자와 CD8+ T 세포가 결여된 NOD 마우스에서는 [26]당뇨병이 발병하지 않은 것으로 밝혀졌다.
CD8+ T세포는 화학요법 유도 말초신경증(CIPN)[27][28]을 해결하기 위해 필요할 수 있다.CD8 T세포가 없는+ 생쥐는 일반 생쥐에 비해 CIPN이 장기화되고 교육받은+ CD8 T세포를 주입하면 CIPN이 분해되거나 예방된다.
세포 독성 T-lymphocytes 다양한 질병과 장애의 개발, 이식 거부 반응(세포 독성 T-lymphocytes 외국인처럼 그것은 발견 후, HLA유형 다양화로 인해 사이에 새로운 기관을 공격하는 기부자이자 받는 사람)에 예를 들어 심하게 SARS-CoV-2 감염에 과도한 면역 물질인 시토카인의[29]( exaggera에 기인한 것으로 보인다.테드림프구 반응pro-inflammatory 생화학제는 큰 액수의 생성된다, 그 주제를 손상시킨다.;은 중추 신경계의 다발성 경화증 같은[30][31일]과 퇴행성 염증성 질환,(T세포 수초 같은 특정한 단백질에게의, 채용을 더 면역 세포는 건강한 세포를 파괴하지만, 병의 악화sensitised이 되).[32]
「 」를 참조해 주세요.
레퍼런스
- ^ Al-Shura AN (2020). "Lymphocytes". Advanced Hematology in Integrated Cardiovascular Chinese Medicine. Elsevier. pp. 41–46. doi:10.1016/b978-0-12-817572-9.00007-0. ISBN 978-0-12-817572-9. S2CID 241913878.
Helper T cells/CD4+ •express CD4 glycoproteins on their cell surface, which activate in the presence of peptide antigens on the surface of invading pathogens; •respond immediately to protect the immune system; •secrete different cytokine proteins according to the immune response.
- ^ Venturi S, Venturi M (September 2009). "Iodine, thymus, and immunity". Nutrition. 25 (9): 977–979. doi:10.1016/j.nut.2009.06.002. PMID 19647627.
- ^ Kabelitz D, Wesch D (2003). "Features and functions of gamma delta T lymphocytes: focus on chemokines and their receptors". Critical Reviews in Immunology. 23 (5–6): 339–370. doi:10.1615/CritRevImmunol.v23.i56.10. PMID 15030305.
- ^ Deseke M, Prinz I (September 2020). "Ligand recognition by the γδ TCR and discrimination between homeostasis and stress conditions". Cellular & Molecular Immunology. 17 (9): 914–924. doi:10.1038/s41423-020-0503-y. PMC 7608190. PMID 32709926.
- ^ Tuengel J, Ranchal S, Maslova A, Aulakh G, Papadopoulou M, Drissler S, et al. (October 2021). "Characterization of Adaptive-like γδ T Cells in Ugandan Infants during Primary Cytomegalovirus Infection". Viruses. 13 (10): 1987. doi:10.3390/v13101987. PMID 34696417.
- ^ Rojas-Espinosa O (2017). Inmunología (de memoria) (Cuarta edición ed.). Ciudad de México: Médica Panamericana. ISBN 968-7988-28-2. OCLC 1022564980.
- ^ a b Hoyer S, Prommersberger S, Pfeiffer IA, Schuler-Thurner B, Schuler G, Dörrie J, Schaft N (December 2014). "Concurrent interaction of DCs with CD4(+) and CD8(+) T cells improves secondary CTL expansion: It takes three to tango". European Journal of Immunology. 44 (12): 3543–3559. doi:10.1002/eji.201444477. PMID 25211552. S2CID 5655814.
- ^ Abbas AK, Lichtman AH, Pillai S (2018). Cellular and molecular immunology (Ninth ed.). Philadelphia, PA. ISBN 978-0-323-52323-3. OCLC 973917896.
- ^ Hivroz C, Chemin K, Tourret M, Bohineust A (2012). "Crosstalk between T lymphocytes and dendritic cells". Critical Reviews in Immunology. 32 (2): 139–155. doi:10.1615/CritRevImmunol.v32.i2.30. PMID 23216612.
- ^ Lanzavecchia A (June 1998). "Immunology. Licence to kill". Nature. 393 (6684): 413–414. Bibcode:1998Natur.393..413L. doi:10.1038/30845. PMID 9623994.
- ^ a b c Bennett SR, Carbone FR, Karamalis F, Flavell RA, Miller JF, Heath WR (June 1998). "Help for cytotoxic-T-cell responses is mediated by CD40 signalling". Nature. 393 (6684): 478–480. Bibcode:1998Natur.393..478B. doi:10.1038/30996. PMID 9624004. S2CID 4325396.
- ^ Milstein O, Hagin D, Lask A, Reich-Zeliger S, Shezen E, Ophir E, et al. (January 2011). "CTLs respond with activation and granule secretion when serving as targets for T-cell recognition". Blood. 117 (3): 1042–1052. doi:10.1182/blood-2010-05-283770. PMC 3035066. PMID 21045195.
- ^ Chang HF, Bzeih H, Chitirala P, Ravichandran K, Sleiman M, Krause E, et al. (February 2017). "Preparing the lethal hit: interplay between exo- and endocytic pathways in cytotoxic T lymphocytes". Cellular and Molecular Life Sciences. 74 (3): 399–408. doi:10.1007/s00018-016-2350-7. PMC 5241346. PMID 27585956.
- ^ Rudd-Schmidt JA, Hodel AW, Noori T, Lopez JA, Cho HJ, Verschoor S, et al. (November 2019). "Lipid order and charge protect killer T cells from accidental death". Nature Communications. 10 (1): 5396. Bibcode:2019NatCo..10.5396R. doi:10.1038/s41467-019-13385-x. PMC 6881447. PMID 31776337.
- ^ a b Bakshi RK, Cox MA, Zajac AJ (2014). "Cytotoxic T Lymphocytes". Encyclopedia of Medical Immunology. pp. 332–342. doi:10.1007/978-0-387-84828-0_36. ISBN 978-0-387-84827-3.
- ^ a b Pearce EL, Mullen AC, Martins GA, Krawczyk CM, Hutchins AS, Zediak VP, et al. (November 2003). "Control of effector CD8+ T cell function by the transcription factor Eomesodermin". Science. 302 (5647): 1041–1043. Bibcode:2003Sci...302.1041P. doi:10.1126/science.1090148. PMID 14605368. S2CID 43479181.
- ^ Kemball CC, Alirezaei M, Whitton JL (September 2010). "Type B coxsackieviruses and their interactions with the innate and adaptive immune systems". Future Microbiology. 5 (9): 1329–1347. doi:10.2217/fmb.10.101. PMC 3045535. PMID 20860480.
- ^ Iannacone M, Sitia G, Guidotti LG (2006). "Pathogenetic and antiviral immune responses against hepatitis B virus". Future Virology. 1 (2): 189–96. doi:10.2217/17460794.1.2.189.
- ^ Iannacone M, Sitia G, Isogawa M, Marchese P, Castro MG, Lowenstein PR, et al. (November 2005). "Platelets mediate cytotoxic T lymphocyte-induced liver damage". Nature Medicine. 11 (11): 1167–1169. doi:10.1038/nm1317. PMC 2908083. PMID 16258538.
- ^ Li Y, Tang L, Guo L, Chen C, Gu S, Zhou Y, et al. (March 2020). "CXCL13-mediated recruitment of intrahepatic CXCR5+CD8+ T cells favors viral control in chronic HBV infection". Journal of Hepatology. 72 (3): 420–430. doi:10.1016/j.jhep.2019.09.031. PMID 31610223.
- ^ Chang MH, Nigrovic PA (March 2019). "Antibody-dependent and -independent mechanisms of inflammatory arthritis". JCI Insight. 4 (5): e125278. doi:10.1172/jci.insight.125278. PMID 30843881.
- ^ Cope AP, Schulze-Koops H, Aringer M. "The central role of T cells in rheumatoid arthritis". Clinical and Experimental Rheumatology. 25 (5 Suppl 46): S4-11. PMID 17977483.
- ^ Carvalheiro H, da Silva JA, Souto-Carneiro MM (January 2013). "Potential roles for CD8(+) T cells in rheumatoid arthritis". Autoimmunity Reviews. 12 (3): 401–409. doi:10.1016/j.autrev.2012.07.011. PMID 22841983.
- ^ a b Gulzar N, Copeland KF (January 2004). "CD8+ T-cells: function and response to HIV infection". Current HIV Research. 2 (1): 23–37. doi:10.2174/1570162043485077. PMID 15053338.
- ^ Tsai S, Shameli A, Santamaria P (2008). "CD8+ T cells in type 1 diabetes". Advances in Immunology. 100: 79–124. doi:10.1016/S0065-2776(08)00804-3. PMID 19111164.
- ^ Wang B, Gonzalez A, Benoist C, Mathis D (August 1996). "The role of CD8+ T cells in the initiation of insulin-dependent diabetes mellitus". European Journal of Immunology. 26 (8): 1762–1769. doi:10.1002/eji.1830260815. PMID 8765018.
- ^ Laumet G, Edralin JD, Dantzer R, Heijnen CJ, Kavelaars A (June 2019). "Cisplatin educates CD8+ T cells to prevent and resolve chemotherapy-induced peripheral neuropathy in mice". Pain. 160 (6): 1459–1468. doi:10.1097/j.pain.0000000000001512. PMC 6527475. PMID 30720585.
- ^ Krukowski K, Eijkelkamp N, Laumet G, Hack CE, Li Y, Dougherty PM, et al. (October 2016). "CD8+ T Cells and Endogenous IL-10 Are Required for Resolution of Chemotherapy-Induced Neuropathic Pain". The Journal of Neuroscience. 36 (43): 11074–11083. doi:10.1523/JNEUROSCI.3708-15.2016. PMC 5098842. PMID 27798187.
- ^ Wiebe C, Nickerson PW (February 2020). "Human leukocyte antigen molecular mismatch to risk stratify kidney transplant recipients". Current Opinion in Organ Transplantation. 25 (1): 8–14. doi:10.1097/MOT.0000000000000714. PMID 31789952.
- ^ Channappanavar R, Perlman S (July 2017). "Pathogenic human coronavirus infections: causes and consequences of cytokine storm and immunopathology". Seminars in Immunopathology. 39 (5): 529–539. doi:10.1007/s00281-017-0629-x. PMC 7079893. PMID 28466096.
- ^ Sarzi-Puttini P, Giorgi V, Sirotti S, Marotto D, Ardizzone S, Rizzardini G, et al. "COVID-19, cytokines and immunosuppression: what can we learn from severe acute respiratory syndrome?". Clinical and Experimental Rheumatology. 38 (2): 337–342. PMID 32202240.
- ^ Neumann H, Medana IM, Bauer J, Lassmann H (June 2002). "Cytotoxic T lymphocytes in autoimmune and degenerative CNS diseases". Trends in Neurosciences. 25 (6): 313–319. doi:10.1016/S0166-2236(02)02154-9. PMID 12086750.
외부 링크
 Wikimedia Commons 세포독성 T세포 관련 매체
Wikimedia Commons 세포독성 T세포 관련 매체- T셀 그룹 - 카디프 대학교