카르티노이드
Carcinoid| 카르티노이드 | |
|---|---|
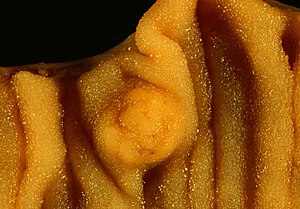 | |
| 소장(병리학 검체)의 내강을 침범하는 암 종양(영상 중앙)의 사진입니다.눈에 띄는 주름은 소장의 특징인 점액순환입니다. | |
| 전문 | 종양학 |
카르티노이드(carcinoid tumor)는 신경 내분비계의 세포에서 발생하는 천천히[1] 성장하는 신경 내분비 종양의 유형입니다.경우에 따라 전이가 발생할 수 있습니다.소장의 발암성 종양(제주넘, 회장, 맹장, 맹장)은 발암성 증후군과 관련이 있습니다.
때때로, 카르키노이드는 잘 분화된 [2][3]카르키노이드로부터 세로토닌과 다른 혈관 활성 물질의 배출을 포함하는 부신형성 증후군을 유발합니다.신경내분비 부신생물 증후군은 종양 조직과 정상 숙주 조직 사이의 기능적 펩타이드, 호르몬, 사이토카인, 성장 인자 및/또는 면역 교차 반응의 신생물 분비를 포함하며, 임상 징후 [4]및 증상의 증후군을 유발합니다.
발암성 종양은 맹장의 가장 흔한 악성 종양이지만 소장과 가장 흔하게 연관되어 있으며 직장과 위에서도 발견될 수 있습니다.그것들은 간에서 자라는 것으로 알려져 있지만, 이 발견은 보통 신체의 다른 곳에서 발생하는 일차 카르티노이드로 인한 전이성 질병의 징후입니다.그들은 대부분의 악성 종양에 비해 성장 속도가 매우 느립니다.모든 신경내분비 종양 환자의 진단 시 평균 연령은 63세입니다.
징후 및 증상
대부분의 카키노이드는 자연 생활을 통해 무증상이고 관련이 없는 이유(이른바 우연한 카키노이드)로 수술 후에만 발견되지만, 모든 카키노이드는 악성 잠재력을 가지고 있는 것으로 간주됩니다.
카르키노이드의 약 10%는 과도한 수준의 호르몬, 특히 세로토닌(5-하이드록시트립타민)을 분비하여 다음을 유발합니다.
- 플러싱(세로토닌 자체는 플러싱을 유발하지 않습니다.카르티노이드 증후군에서 홍조의 잠재적인 원인은 브래디키닌, 프로스타글란딘, 타키키닌, 물질 P 및/또는 히스타민, 설사 및 심장 문제를 포함합니다.심장 근육 세포에 대한 세로토닌의 성장 촉진 효과 때문에,[5] 세로토닌을 분비하는 카르티노이드 종양은 판막에 근세포가 증식하기 때문에 삼첨판 질환 증후군을 일으킬 수 있습니다.
- 설사.
- 씨근거리는 소리
- 복부 경련
- 말초부종
세로토닌의 유출은 트립토판의 고갈을 야기하여 나이아신 결핍을 초래할 수 있습니다.펠라그라로도 알려진 나이아신 결핍증은 피부염, 치매, 그리고 설사와 관련이 있습니다.
이러한 일련의 증상을 카르티노이드 증후군 또는 (급성인 경우) 카르티노이드 위기라고 합니다.때때로 출혈이나 종양 덩어리의 영향이 증상을 나타냅니다.발암물질의 가장 흔한 발생 부위는 소장, 특히 회장입니다; 발암물질 종양은 맹장의 가장 흔한 악성 종양입니다.발암성 종양은 난소나 [6]흉선에서 거의 발생하지 않을 수 있습니다.
그들은 가장 일반적으로 회장 수준의 중창 또는 맹장에서 발견됩니다.그 다음으로 가장 일반적으로 영향을 받는 영역은 호흡기이며, 전체 사례의 28%가 PAN-SEER 데이터(1973–1999)에 따라 다릅니다.직장은 또한 흔한 장소입니다.
위장
발암성 종양은 내장 전체에 있는 장염색소 세포에서 발생하는 종양입니다.발암성 종양의 3분의 2 이상이 [7]위장관에서 발견됩니다.
폐
발암성 종양은 폐에서도 발견됩니다.
기타 부위 및 전이
카르티노이드의 전이는 카르티노이드 증후군으로 이어질 수 있습니다.이것은 세로토닌을 포함한 많은 물질들이 과도하게 생산되기 때문인데, 이것들은 전신 순환으로 방출되고 피부 홍조, 설사, 기관지 수축, 그리고 오른쪽 심장 판막 질환의 증상을 초래할 수 있습니다.카르티노이드 증후군이 발생하는 환자는 6% 미만으로 추정되며, 이 중 50%는 심장 [8]질환이 있을 것으로 예상됩니다.
고블렛 세포 카르티노이드
이것은 맹장의 암호 세포에서 유래한 외분비 종양과 내분비 종양 사이의 잡종으로 간주됩니다.조직학적으로, 그것은 파네스 세포와 내분비 세포의 사소한 혼합물과 뮤신을 포함하는 고블렛 세포 클러스터를 형성합니다.성장 패턴은 독특합니다: 일반적으로 맹장의 축을 따라 확장되는 충수벽의 근육과 스트로마 사이에 산재한 종양 둥지의 동심원 밴드를 만듭니다.이로 인해 병변을 심각하게 의심하기 어렵고 측정하기가 어렵습니다.작은 종양 둥지는 근육이나 맹장 주변 지방으로 위장될 수 있습니다; 사이토케라틴 제제는 종양 세포를 가장 잘 보여줍니다; 뮤신 얼룩은 또한 그것들을 식별하는 데 도움이 됩니다.그들은 고전적인 맹장 카르키노이드보다 더 공격적인 방식으로 행동합니다.일반적으로 국소 림프절, 복막, 특히 난소에 퍼집니다.그들은 카르티노이드나 다른 내분비 증후군을 일으킬 만큼 충분한 호르몬 물질을 생산하지 않습니다.사실, 그들은 내분비 종양보다 외분비 종양을 더 많이 닮았습니다.'크립트 세포 암종'이라는 용어는 그들에게 사용되었고, 아마도 그들을 발암물질로 간주하는 것보다 더 정확할지 모르지만, 성공적인 경쟁자는 아니었습니다.
원인
카르티노이드 증후군은 남성 다섯 명 중 한 명에게 여러 개의 종양을 포함합니다.위 카르키노이드의 발생률은 염화수소, 하시모토 갑상선염, 악성 빈혈에서 증가합니다.
치료
가능하다면 수술이 유일한 치료법입니다.종양이 전이되어 (가장 일반적으로 간으로) 불치병으로 간주되는 경우, 방사성 표지 옥트레오타이드[9](예: 방사성 표지 옥트레오타이드)와 같은 유망한 치료 양식이 있습니다.종양의 성장을 억제하고 간 전이 환자의 생존을 연장하기 위한 루테튬(Lu) DOTA-octreotate)177 또는 방사성 의약품 131I-mIBG(메타이오도벤질구아니딘[9]).
화학 요법은 거의 효과가 없으며 일반적으로 표시되지 않습니다.옥트레오타이드 또는 란레오타이드(소마토스타틴 유사체)는 발암물질의 분비 활동을 감소시킬 수 있으며, 또한 증식 방지 효과를 가질 수 있습니다.인터페론 치료 또한 효과적이며, 보통 소마토스타틴 유사체와 결합됩니다.
우연성 카르티노이드의 전이 가능성은 아마도 낮으므로, 현재 권장되는 것은 3개월 후 CT 또는 MRI, 세로토닌과 같은 종양 마커에 대한 검사, 그리고 그 이후 연간 신체 검사와 함께 이력 및 신체 검사입니다.
역사
그들은 1907년 뮌헨 대학의 독일 병리학자 지그프리드 오버렌도퍼에 의해 처음 특징지어졌는데, 그는 미세하게 악성 종양을 가지고 있음에도 불구하고 양성 종양처럼 행동하는 독특한 특징을 설명하기 위해 카르지노이드 또는 "암종과 유사한"이라는 용어를 만들었습니다.그들의 내분비 관련 특성에 대한 인식은 후에 1914년에 고셋과 마손에 의해 기술되었고, 이 종양들은 현재 장의 장염색소 (EC)와 장염색소 유사 세포 (ECL)에서 발생하는 것으로 알려져 있습니다.일부 정보원들은 오토 루바르쉬가 이 [10]발견을 했다고 믿고 있습니다.
2000년, 세계보건기구는 "카르시노이드"를 재정의했지만, 이 새로운 정의가 모든 [11]개업의들에게 받아들여진 것은 아닙니다.이것은 문헌에서 카르티노이드와 다른 신경 내분비 종양을 구별하는 데 약간의 복잡성을 초래했습니다.미국 암 협회에 따르면, 2000년 WHO의 정의는 [11]다음과 같습니다.
WHO는 이제 이러한 성장을 신경내분비 종양과 신경내분비암으로 나눕니다.신경내분비 종양은 양성으로 보이지만 신체의 다른 부분으로 퍼질 수 있는 성장입니다.신경내분비암은 신체의 다른 부분으로 퍼질 수 있는 신경내분비세포의 비정상적인 성장입니다.
기타 생물
설치류 특유의 만성적인 위산 분비 감소는 발암성 발달을 [12]: 812 촉진합니다.
참고 항목
- 카르티노이드 증후군
- 북부 주립 대학 남자 농구팀의 명예 감독인 돈 마이어.마이어는 2009년 9월 자동차 사고 이후 발암성 암에 걸린 것으로 밝혀졌습니다.
- 교수이자 법학자인 데릭 벨은 2011년 10월 5일 발암물질 암으로 사망했습니다.
레퍼런스
- ^ Maroun J, Kocha W, Kvols L, et al. (April 2006). "Guidelines for the diagnosis and management of carcinoid tumors. Part 1: The gastrointestinal tract. A statement from a Canadian National Carcinoid Expert Group". Curr Oncol. 13 (2): 67–76. doi:10.3390/curroncol13020006. PMC 1891174. PMID 17576444.
- ^ Gade, Ajay K.; Olariu, Eva; Douthit, Nathan T.; Gade, Ajay K.; Olariu, Eva; Douthit, Nathan T. (2020-03-05). "Carcinoid Syndrome: A Review". Cureus. 12 (3): e7186. doi:10.7759/cureus.7186. ISSN 2168-8184. PMC 7124884. PMID 32257725.
- ^ Tsoli, Marina; Dimitriadis, Georgios K.; Androulakis, Ioannis I.; Kaltsas, Gregory; Grossman, Ashley (2000). Feingold, Kenneth R.; Anawalt, Bradley; Blackman, Marc R.; Boyce, Alison (eds.). Paraneoplastic Syndromes Related to Neuroendocrine Tumors. Endotext. South Dartmouth (MA): MDText.com, Inc. PMID 25905358. Retrieved 2023-02-19.
- ^ Guilmette, Julie; Nosé, Vânia (2019-07-01). "Paraneoplastic syndromes and other systemic disorders associated with neuroendocrine neoplasms". Seminars in Diagnostic Pathology. Paraneoplastic syndromes. 36 (4): 229–239. doi:10.1053/j.semdp.2019.03.002. ISSN 0740-2570. PMID 30910348. S2CID 85514650.
- ^ "Carcinoid Tumors and Syndrome". The Lecturio Medical Concept Library. Retrieved 5 July 2021.
- ^ Daffner KR, Sherman JC, Gilberto Gonzalez R, Hasserjian RP (2008). "Case 35-2008 — A 65-Year-Old Man with Confusion and Memory Loss". N Engl J Med. 359 (20): 2155–2164. doi:10.1056/NEJMcpc0804643. PMID 19005200.
- ^ Modlin IM, Lye KD, Kidd M (February 2003). "A 5-decade analysis of 13,715 carcinoid tumors". Cancer. 97 (4): 934–59. doi:10.1002/cncr.11105. PMID 12569593.
- ^ Fox DJ, Khattar RS (2004). "Carcinoid heart disease: presentation, diagnosis, and management". Heart. 90 (10): 1224–8. doi:10.1136/hrt.2004.040329. PMC 1768473. PMID 15367531.
- ^ a b "Medical Reviews".
- ^ Kulke MH, Mayer RJ (March 1999). "Carcinoid tumors". N. Engl. J. Med. 340 (11): 858–68. doi:10.1056/NEJM199903183401107. PMID 10080850.
- ^ a b "ACS :: What Is a Gastrointestinal Carcinoid Tumor?".
- ^ Haschek, Wanda; Rousseaux, Colin; Wallig, Matthew (2013). Haschek and Rousseaux's Handbook of Toxicologic Pathology. Academic Press. doi:10.1016/c2010-1-67850-9. ISBN 978-0-12-415759-0.
Cunningham JL, Janson ET (2011). "The Hallmarks of Ileal Carcinoids". Eur J Clin Invest. 41 (12): 1353–60. doi:10.1111/j.1365-2362.2011.02537.x. PMID 21605115. S2CID 31500259.



