베다킬린
Bedaquiline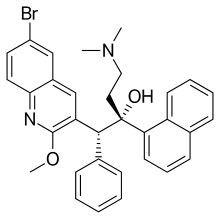 | |
| 임상자료 | |
|---|---|
| 상명 | 시투로 |
| 기타 이름 | 베다킬린 후마레이트,[1] TMC207,[2] R207910, AIDS222089 |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a613022 |
| 라이센스 데이터 | |
| 경로: 행정 | 입으로 |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 |
|
| 약동학 데이터 | |
| 단백질 결합 | >99.9% [3] |
| 신진대사 | 간, CYP3A4[4] 기준 |
| 제거 반감기 | 5.5개월 |
| 배설 | 똥을[4] 누다 |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 켐벨 | |
| CompTox 대시보드 (EPA) | |
| 화학 및 물리적 데이터 | |
| 공식 | C32H31BRN2O2 |
| 어금질량 | 555.516 g·190−1 |
| 3D 모델(JSmol) | |
| |
| |
시르투로라는 상표명으로 판매되는 베다킬린은 활동성 결핵 치료에 쓰이는 약이다.[1] 구체적으로는 다른 결핵약과 함께 다약 내성 결핵(MDR-TB) 치료에 쓰인다.[1][5][6] 그것은 입으로 사용된다.[7]
일반적인 부작용으로는 메스꺼움, 관절통, 두통, 가슴통증이 있다.[1] 심각한 부작용으로는 QT연장, 간기능장애, 사망위험 증가 등이 있다.[1] 임신 중의 해악은 발견되지 않았지만, 이 인구에서는 잘 연구되지 않았다.[8] 그것은 다이어릴퀴놀린 항균균박테리아 등급에 있다.[1] 아데노신 5'-삼인산(ATP)을 만드는 M. 결핵의 능력을 차단해 작용한다.[1]
베다킬린은 2012년 미국에서 의료용으로 승인되었다.[1] 그것은 세계보건기구의 필수 의약품 목록에 올라 있다.[9] 6개월 동안의 비용은 저소득 국가의 경우 약 900달러, 중간 소득 국가의 경우 3,000달러, 고소득 국가의 경우 3만 달러다.[7]
공공 부문은 베다킬린 개발에 미화 4억5500만 달러(7억4700만 달러)를 투자했다. 이는 소유주인 얀센바이오텍이 투자한 금액의 1.6배에서 5.1배(추정액 9000만~2억4000만 달러)로 추정된다. 자본화 및 위험 조정 시 이 비용은 각각 미화 647-120만 달러와 미화 2억922만7200만 달러가 된다.[10]
의학적 용법
Fast-Track 가속화 승인(Fast-Track)의 일환으로, 다제내성 결핵의 경우에만 사용되며, 보다 내성이 강한 광범위한 약물 내성 결핵을 위해 2012년 12월 미국 식품의약국(FDA)에 의해 사용이 승인되었다.[11]
2013년[update] 현재 세계보건기구(WHO)와 미국 질병관리본부(CDC)는 다른 권장 식이요법을 설계할 수 없을 때 다약 내성 결핵을 가진 사람들을 위해 베다킬린을 보존할 것을 잠정적으로 권고했다.[12][13]
임상시험
베다킬린은 현재 3단계 연구가 진행 중인 가운데 다약 내성 결핵 치료를 위한 2차 연구로 연구됐다.[14] 사망률 증가(더 나아가 부작용 섹션에 자세히 설명되어 있음)에 대한 우려에도 불구하고, 얼룩 양성 다제 내성 결핵의 치료율을 향상시키는 것으로 나타났다.[15]
작은 연구들은 또한 그것이 비투과성 세균박테리아 감염에 대한 구조요법으로 사용되는 것을 조사해왔다.[14]
실험 BPaMZ 조합 처리의 성분(베다큐일린 + 프레토마니드 + 뜸시플록사신 + 피라진아미드)[16][17]
NIX-TB 시험 결과, 광범위한 약물 내성(XDR) 또는 치료 불내성(MDR-TB) 또는 치료 불내성(MDR-TB)을 위해 6개월 동안 경구 투여한 베다킬린(일당 400mg, 주 3회 200mg), 프레토마니드(일당 200mg), 라인졸리드(일당 1200mg, 첫 달 이후 선량 수정 허용)가 나왔다. 치료 종료 시 90%의 바람직한 치료 결과를 얻었다. 이 베다킬린, 프레토만성, 라인졸리드(BPal) 체제는 24개월 후 사후 처리에서 88%의 바람직한 결과를 보여주었다. Nix-TB 실험의 후속으로 설계된 ZeNix 실험은 BPaL 섭생법에서 라인졸리드 투여량 감소나 지속시간을 뒷받침하는 추가 임상 증거를 제공했다.[18]
부작용
연구에서 베다킬린의 가장 흔한 부작용은 메스꺼움, 관절과 가슴 통증, 그리고 두통이었다. 이 약에는 hERG 채널을 차단해 QT 간격을 연장할 수 있어 사망 위험과 부정맥에 대한 블랙박스 경고 기능도 탑재됐다.[19] 베다킬린에 있는 모든 사람은 기준선과 반복 심전도 검사를 받아야 한다.[20] 만약 어떤 사람이 500 ms 이상의 QTcF를 가지고 있거나 상당한 심실 적혈증을 가지고 있다면, 베다킬린과 다른 QT 연장 약물은 중단되어야 한다.
현재까지 가장 큰 연구 중 하나가 위약을 받은 사람들이 베다킬린을 복용하는 그룹에서 사망자가 더 많았기 때문에 이 약에 대한 승인을 놓고 상당한 논란이 있다.[21] 79명 중 10명이 베다킬린 그룹에서 사망했고, 81명 중 2명이 위약 그룹에서 사망하였다.[15] 베다킬린 사망자 10명 중 1명은 자동차 사고였고, 5명은 기저 결핵 진행으로 판단됐으며 3명은 베다킬린 수취를 중단한 뒤였다.[21] 그러나, 베다킬린으로 치료받은 사람들의 사망률이 더 높다는 것에 대한 상당한 우려가 있어, 다른 방법으로는 4가지 약물 요법을 구성할 수 없는 상황, QT 간격을 연장하는 다른 의약품과의 사용을 제한하고, 눈에 띄는 블랙박스 경고의 배치를 권고한다.[21][14]
약물 상호작용
베다킬린은 약물의 산화 대사를 담당하는 간 효소인 CYP3A4의 강한 유도제나 억제제인 다른 약물과 함께 투여해서는 안 된다.[20] 강력한 CYP3A4 유도제인 리팜핀과 공동 투여하면 약물의 AUC가 52% 감소한다. 이것은 신체의 약물에 대한 노출을 줄이고 항균 효과를 감소시킨다. 강력한 CYP3A4 억제제인 케토코나졸과 공동 관리하면 AUC가 22% 증가하며 잠재적으로 부작용[20] 발생률이 증가할 수 있다.
베다킬린 또한 QT 간격을 연장할 수 있으므로 다른 QT 연장 약물의 사용은 피해야 한다.[12] QT 간격을 연장할 수 있는 다른 결핵약으로는 플루오로퀴놀론(특히 Moxifloxacin)과 클로파지민 등이 있다.[22]
작용기전
Bedaquiline은 mycobacteria의 ATP synthase를 위한 양성자 펌프를 차단한다.[23] 그것은 다이어릴퀴놀린이라고 불리는 새로운 종류의 약의 첫 번째 회원이다.[23] 베다킬린은 살균성이 있다.[23] ATP 생산은 세포 에너지 생산에 필요하며, 그 손실 납은 베다킬린 첨가 후 몇 시간 이내에 균박테리아 성장을 억제한다.[24] 베다킬린에 의한 미코박테리아 세포 사망의 시작은 치료 후 며칠이 지나도록 일어나지 않지만 그럼에도 불구하고 그 후 지속적으로 죽인다.[24]
저항
베다킬린에 의해 영향을 받는 ATP synthase의 특정 부분은 atpE 유전자에 의해 인코딩되는 subunit c이다. atpE의 돌연변이는 저항으로 이어질 수 있다. 약물 배출 펌프의 돌연변이는 저항과 관련이 있다.[25] Rv0678 돌연변이는 또 다른 두 번째 항TB 약물인 클로파지민에 대한 교차 저항과 관련이 있다.
진행 중인 연구
체외 실험 결과 베다킬린도 악성 포유류 세포의 미토콘드리아 ATP 싱타아제를 표적으로 하여 전이율을 낮출 수 있는 것으로 나타났다.[26]
역사
베다킬린은 2004년 항균제 및 항암화학요법에 관한 과학간 회의(ICAAC)에서 처음으로 이 약물이 7년 이상 개발되고 난 후 처음으로 설명되었다.[27] 얀센 파마세유티카의 코엔 안드리스가 이끄는 팀에 의해 발견되었다.[28]
베다킬린은 2012년 미국에서 의료용으로 승인되었다.[1]
존슨앤존슨(J&J)이 제조한 제품으로, 다른 실행 가능한 치료법이 부족한 질병에 대한 일시적인 승인 형식이다.[29] 방치된 질병을 치료하는 약물에 대한 승인을 얻음으로써, J&J는 미래의 약물에 대한 신속한 FDA 검토를 요청할 수 있게 되었다.[30]
2012년 12월 28일 FDA의 승인을 받았을 때 40여년 만에 처음으로 결핵 신약이었다.[31][32]
2016년 WHO는 이를 필수 의약품으로 추천해 비판을 받았다.[33]
세계보건기구(WHO) 결핵 프로그램 책임자는 얀센이 4년 동안 3000만 달러 상당의 베다킬린을 기증할 것이라고 지적했다.[34]
참조
- ^ a b c d e f g h i "Bedaquiline Fumarate". The American Society of Health-System Pharmacists. Archived from the original on 20 December 2016. Retrieved 8 December 2016.
- ^ Diacon AH, Pym A, Grobusch M, Patientia R, Rustomjee R, Page-Shipp L, et al. (June 2009). "The diarylquinoline TMC207 for multidrug-resistant tuberculosis". The New England Journal of Medicine. 360 (23): 2397–405. doi:10.1056/NEJMoa0808427. PMID 19494215.
- ^ "Sirturo: Clinical Pharmacology". Archived from the original on 28 February 2015. Retrieved 28 April 2014.
- ^ a b c "Bedaquiline". Archived from the original on 20 May 2013. Retrieved 28 April 2014.
- ^ "WHO Rapid Communication: Key changes to treatment of multidrug- and rifampicin-resistant tuberculosis (MDR/RR-TB)". WHO. Archived from the original on 20 August 2018. Retrieved 24 April 2019.
- ^ Ahmad N, Ahuja SD, Akkerman OW, Alffenaar JC, Anderson LF, Baghaei P, et al. (Collaborative Group for the Meta-Analysis of Individual Patient Data in MDR-TB treatment–2017) (September 2018). "Treatment correlates of successful outcomes in pulmonary multidrug-resistant tuberculosis: an individual patient data meta-analysis". Lancet. 392 (10150): 821–834. doi:10.1016/S0140-6736(18)31644-1. PMC 6463280. PMID 30215381.
- ^ a b World Health Organization (2015). The selection and use of essential medicines. Twentieth report of the WHO Expert Committee 2015 (including 19th WHO Model List of Essential Medicines and 5th WHO Model List of Essential Medicines for Children). Geneva: World Health Organization. pp. 26–30. hdl:10665/189763. ISBN 9789241209946. ISSN 0512-3054. WHO technical report series;994.
- ^ "Bedaquiline (Sirturo) Use During Pregnancy". www.drugs.com. Archived from the original on 20 December 2016. Retrieved 10 December 2016.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Gotham D, McKenna L, Frick M, Lessem E (18 September 2020). "Public investments in the clinical development of bedaquiline". PLOS ONE. 15 (9): e0239118. Bibcode:2020PLoSO..1539118G. doi:10.1371/journal.pone.0239118. PMC 7500616. PMID 32946474.
- ^ "Press Announcements - FDA approves first drug to treat multi-drug resistant tuberculosis". www.fda.gov. December 2012. Archived from the original on 19 December 2016.
- ^ a b Centers for Disease Control Prevention (October 2013). "Provisional CDC guidelines for the use and safety monitoring of bedaquiline fumarate (Sirturo) for the treatment of multidrug-resistant tuberculosis". MMWR. Recommendations and Reports. 62 (RR-09): 1–12. PMID 24157696.
- ^ WHO (2013). The use of bedaquiline in the treatment of multidrug-resistant tuberculosis: interim policy guidance. World Health Organization. Archived from the original on 10 September 2017.
- ^ a b c Field SK (July 2015). "Bedaquiline for the treatment of multidrug-resistant tuberculosis: great promise or disappointment?". Therapeutic Advances in Chronic Disease. 6 (4): 170–84. doi:10.1177/2040622315582325. PMC 4480545. PMID 26137207.
- ^ a b Diacon AH, Pym A, Grobusch MP, de los Rios JM, Gotuzzo E, Vasilyeva I, Leimane V, Andries K, Bakare N, De Marez T, Haxaire-Theeuwes M, Lounis N, Meyvisch P, De Paepe E, van Heeswijk RP, Dannemann B (August 2014). "Multidrug-resistant tuberculosis and culture conversion with bedaquiline". The New England Journal of Medicine. 371 (8): 723–32. doi:10.1056/NEJMoa1313865. PMID 25140958.
- ^ BPaMZ @TB Alliance 웨이백 머신에 2017-02-19 아카이브
- ^ 두 가지 신약 치료법이 모든 형태의 결핵을 치료할 수 있을 것이다. 2017년 2월 웨이백 기계에 2017-02-20 보관
- ^ Mishra, G (2021). "Nix-TB and ZeNix trials: Paving the way for shorter regimens for drug-resistant tuberculosis". Asian Pac J Trop Med. 14 (2): 431–432. doi:10.4103/1995-7645.329004.
- ^ Drugs.com: Wayback Machine에 2013-09-23 보관된 Sirturo 부작용
- ^ a b c "Prescribing Information for Bedaquiline" (PDF). Archived (PDF) from the original on 24 August 2013. Retrieved 28 April 2014.
- ^ a b c Cox E, Laessig K (August 2014). "FDA approval of bedaquiline--the benefit-risk balance for drug-resistant tuberculosis". The New England Journal of Medicine. 371 (8): 689–91. doi:10.1056/NEJMp1314385. PMID 25140952.
- ^ Hewison, Catherine; Guglielmetti, Lorenzo (2021). "Cardiac safety of multidrug-resistant tuberculosis treatment: moving towards individualised monitoring". The Lancet Infectious Diseases. 21 (7): 894–895. doi:10.1016/S1473-3099(20)30836-7. PMID 33587896.
- ^ a b c Worley MV, Estrada SJ (November 2014). "Bedaquiline: a novel antitubercular agent for the treatment of multidrug-resistant tuberculosis". Pharmacotherapy. 34 (11): 1187–97. doi:10.1002/phar.1482. PMC 5028565. PMID 25203970.
- ^ a b Koul A, Vranckx L, Dhar N, Göhlmann HW, Özdemir E, Neefs JM, Schulz M, Lu P, Mørtz E, McKinney JD, Andries K, Bald D (February 2014). "Delayed bactericidal response of Mycobacterium tuberculosis to bedaquiline involves remodelling of bacterial metabolism". Nature Communications. 5 (1): 3369. Bibcode:2014NatCo...5.3369K. doi:10.1038/ncomms4369. PMC 3948051. PMID 24569628.
- ^ Andries K, Villellas C, Coeck N, Thys K, Gevers T, Vranckx L, Lounis N, de Jong BC, Koul A (10 July 2014). "Acquired resistance of Mycobacterium tuberculosis to bedaquiline". PLOS ONE. 9 (7): e102135. Bibcode:2014PLoSO...9j2135A. doi:10.1371/journal.pone.0102135. PMC 4092087. PMID 25010492.
- ^ Fiorillo M, Scatena C, Naccarato AG, Sotgia F, Lisanti MP (May 2021). "Bedaquiline, an FDA-approved drug, inhibits mitochondrial ATP production and metastasis in vivo, by targeting the gamma subunit (ATP5F1C) of the ATP synthase" (PDF). Cell Death and Differentiation. 28 (9): 2797–2817. doi:10.1038/s41418-021-00788-x. PMC 8408289. PMID 33986463. S2CID 234496165.
- ^ Protopopova M, Bogatcheva E, Nikonenko B, Hundert S, Einck L, Nacy CA (May 2007). "In search of new cures for tuberculosis" (PDF). Medicinal Chemistry. 3 (3): 301–16. doi:10.2174/157340607780620626. PMID 17504204.[영구적 데드링크]
- ^ de Jonge MR, Koymans LH, Guillemont JE, Koul A, Andries K (June 2007). "A computational model of the inhibition of Mycobacterium tuberculosis ATPase by a new drug candidate R207910". Proteins. 67 (4): 971–80. doi:10.1002/prot.21376. PMID 17387738. S2CID 41795564.
- ^ Walker J, Tadena N (31 December 2012). "J&J Tuberculosis Drug Gets Fast-Track Clearance". Wall Street Journal. Archived from the original on 23 September 2015. Retrieved 1 January 2013.
- ^ Edney A (31 December 2012). "J&J&J Sirturo Wins FDA Approval to Treat Drug-Resistant TB". Bloomberg.com. Bloomberg. Archived from the original on 4 January 2013. Retrieved 1 January 2013.
- ^ "FDA Approves 1st New Tuberculosis Drug in 40 Years". ABC News. Archived from the original on 4 January 2013. Retrieved 31 December 2012.
- ^ Thomas K (31 December 2012). "F.D.A. Approves New Tuberculosis Drug". The New York Times. Archived from the original on 8 January 2013. Retrieved 31 December 2012.
- ^ Pinzler J, Mischke T (2016). "Die WHO - Im Griff der Lobbyisten?". Arte TV.
- ^ UNOPS (2015). "Stop TB Partnership, Global Drug Facility (GDF), The Bedaquiline Donation Program". www.stoptb.org. Retrieved 8 April 2020.
외부 링크
- "Bedaquiline". Drug Information Portal. U.S. National Library of Medicine.

