티우레아
Thiourea| | |||
| 이름 | |||
|---|---|---|---|
| 선호 IUPAC 이름 티우레아[1] | |||
| 기타 이름 티오카르바미드 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 605327 | |||
| 체비 | |||
| 켐벨 | |||
| 켐스파이더 | |||
| ECHA InfoCard | 100.000.494 | ||
| 1604 | |||
| 케그 | |||
펍켐 CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
| UN 번호 | 2811 | ||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| 첸스42 | |||
| 어금질량 | 76.12 g/190 | ||
| 외관 | 백색 고체 | ||
| 밀도 | 1.405 g/ml | ||
| 녹는점 | 182°C(360°F, 455K) | ||
| 142 g/l(25°C) | |||
자기 감수성(magnetic susibility) | -4.24×10cm−53/cm | ||
| 위험 | |||
| GHS 라벨 표시: | |||
   | |||
| 경고 | |||
| H302, H351, H361, H411 | |||
| P201, P202, P264, P270, P273, P281, P301+P312, P308+P313, P330, P391, P405, P501 | |||
| NFPA 704(화재 다이아몬드) | |||
| 관련 화합물 | |||
관련 화합물 | 요소 | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
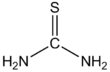
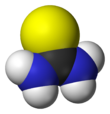
티우레아 (/ˌaɪo (jʊˈˈririː/)[2][3]는 SC(NH2)라는 공식을 가진 유기황 화합물이다.2 산소원자가 황 원자(황 원자)로 대체되는 것을 제외하고는 구조적으로 요소와 유사하지만 요소와 티우레아의 성질은 크게 다르다. 티우레아는 유기합성의 시약이다. "Thioureas"는 일반 구조(RRN12)(RRN34)C=S를 갖는 광범위한 화합물을 의미한다. 티우레아는 티오아미드(예: RC(S)NR2)와 관련이 있으며, 여기서 R은 메틸, 에틸 등이다.
구조 및 본딩
티우레아는 평면 분자다. C=S 결합 거리는 1.71 å이다. C-N 거리는 평균 1.33 å이다.[4] C-N pi-bonding에 의한 C-S 본드의 약화는 티오벤조페논의 짧은 C=S 본드로 나타내며, 1.63 å이다.
티우레아는 두 개의 태토메릭 형태로 발생하며, 그 중 티오네는 수용액에서 우세하다. 평형 상수는 K가eq 1.04×10으로−3 계산되었다.[5] 이소티우레아라고도 알려진 티올 형태는 이소티우로늄염과 같은 대체 화합물에서 만날 수 있다.
생산
티우레아의 전세계 연간 생산량은 약 10,000톤이다. 약 40%가 독일에서, 또 다른 40%는 중국에서, 20%는 일본에서 생산된다. 티우레아는 티오시아네이트 암모늄으로부터 생산될 수 있지만, 보다 일반적으로 이산화탄소가 존재하는 곳에서 황화수소와 시아나미드 칼슘의 반응에 의해 생산된다.[6]
적용들
티오크스 전구체
1인당 티우레아는 신청이 거의 없다. 주로 섬유 가공에서 흔한 환원제인 이산화 티우레아의 전구체로 소비된다.[6]
비료
최근 티우레아는 특히 환경 스트레스 조건에서 비료로서 여러 가지 바람직한 성질에 대해 조사되었다.[7] 종자 전처리(프리미어용), 엽분무 또는 중간 보충제 등 다양한 용량으로 적용할 수 있다.
기타 용도
다른 산업용으로는 난연 레진 및 경화 가속기의 생산이 있다.
티우레아는 디아조 종이, 빛에 민감한 복사 용지, 그리고 거의 모든 종류의 복사 용지에 보조제로 사용된다.
그것은 또한 은겔라틴 사진 지문의 톤을 맞추기 위해 사용된다.
티우레아는 클리프톤-필립스와 비버의 밝고 반밝은 전기 도금 공정에서 사용된다.[8] 주석()을 넣은 용액에도 쓰인다.II) 구리 인쇄 회로 기판용 무전기 주석 도금 용액으로서의 염화물.
반응
이 물질은 130 °C 이상의 가열 시 티오시아네이트 암모늄으로 변하는 특이한 성질을 가지고 있다. 식으면 암모늄 소금이 다시 티우레아로 바뀐다.[citation needed]
환원제
티우레아는 해당 디올에 대한 과산화물을 감소시킨다.[9] 반응의 중간은 불안정한 내복사이드다.
티우레아는 또한 카보닐 화합물을 주기 위한 오조놀리시스 환원 작업에도 사용된다.[10] 디메틸황화물은 이 반응에 효과적인 시약이기도 하지만 휘발성이 매우 높고(끓는 지점 37°C), 악취가 심한 반면 티우레아는 무취하고 편리한 비휘발성(극성을 반영)이다.
황화원
티우레아는 알킬 할로겐을 티올로 변환하는 것과 같은 황화물의 원료로 사용된다. 이 반응은 황 중심부의 높은 핵소독성과 중간 이소티오르늄 소금의 쉬운 가수분해를 이용한다.
- CS(NH2)2 + RX → RSC(NH
2)+
2X− - RSC(NH
2)+
2X−
+ 2 NaOH → RSNA + OC(NH2)2 + NaX + HO2 - RSNA + HCl → RSH + NaCl
이 예에서 에탄-1,2-디티올은 1,2-디브로모에탄으로부터 준비된다.[11]
- CHBr242 + 2 SC(NH2)2 → [CH24(SC)(NH2)]22BR2
- [CH24(SC)(NH2)]22Br2 + 2 KOH → CH24(SH)2 + 2 OC(NH2)2 + 2KBr
다른 티오아미드처럼 티우레아는 금속 이온과 반응할 때 황화물의 근원 역할을 할 수 있다. 예를 들어 수성 용액의 수은 소금이 티우레아로 처리될 때 황화 수은이 형성된다.
- Hg2+ + SC(NH2)2 + HO2 → HgS + OC(NH2)2 + 2H+
많은 금속 황화물의 합성에 적용된 이러한 황화 반응은 물과 일반적으로 약간의 난방을 필요로 한다.[12][13]
헤테로사이클의 전구체
티우레아는 피리미딘 파생상품의 블록을 만들고 있다. 따라서 티우레아는 β-디카르보닐 화합물로 응축된다.[14] 티우레아에 있는 아미노 그룹은 처음에는 카보닐로 응축되고, 이어서 사이클링과 토토머라이징이 된다. 탈황은 피리미딘을 전달한다.
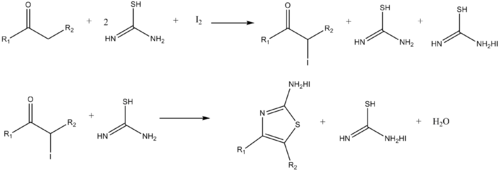
마찬가지로 아미노티아졸은 α-할로케톤과 티우레아의 반응에 의해 합성될 수 있다.[15]
티오바르비투르산과 술파시아졸은 티우레아를 이용하여 조제하고,[6] 4-아미노-3-히드라지노-5-메르카프토-1,2,4-트리아졸은 티우레아와 히드라진의 반응으로 조제한다.
실버 연마
소비자 제품 TarnX와[16] Silver Dip의 라벨에 따르면,[17] 액체 실버 세정 제품에는 티우레아가 캘리포니아의 발암물질 목록에 있는 화학 물질이라는 경고와 함께 티우레아가 들어 있다.[18] 시안화 사용과 제련 단계를 우회하여 선택적으로 산화시켜 금과 은의 침출물을 만들 수 있다.[19]
쿠르나코프 반응
티우레아는 특정 사각 평면 플래티넘 콤플렉스의 시스와 트랜스 이소머를 구별하는 데 사용되는 쿠르나코프 테스트의 필수 시약이다. 이 반응은 1893년 러시아의 화학자 니콜라이 쿠르나코프에 의해 발견되었으며, 여전히 이러한 유형의 화합물에 대한 분석으로 행해지고 있다.[20]
안전
티우레아의 LD는50 랫드의 경우 125mg/kg이다.[21]
만성 피폭에 대한 유전학적 효과(갑상선 확대)가 보고되었으며, 이는 티우레아의 요오드화합물 섭취 방해 능력을 반영한다.[6]
참고 항목
참조
- ^ Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: Royal Society of Chemistry. 2014. pp. 98, 864. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ "Thiourea". Oxford Dictionaries UK English Dictionary. Oxford University Press. n.d. Retrieved 2016-01-21.
- ^ "Thiourea". Merriam-Webster Dictionary. Retrieved 2016-01-21.
- ^ D. Mullen; E. Hellner (1978). "A Simple Refinement of Density Distributions of Bonding Electrons. IX. Bond Electron Density Distribution in Thiourea, CS(NH2)2, at 123K". Acta Crystallogr. B34 (9): 2789–2794. doi:10.1107/S0567740878009243.
- ^ Allegretti, P.E; Castro, E.A; Furlong, J.J.P (March 2000). "Tautomeric equilibrium of amides and related compounds: theoretical and spectral evidences". Journal of Molecular Structure: THEOCHEM. 499 (1–3): 121–126. doi:10.1016/S0166-1280(99)00294-8.
- ^ a b c d Bernd Mertschenk; Ferdinand Beck; Wolfgang Bauer (2002). "Thiourea and Thiourea Derivatives". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a26_803. ISBN 3527306730.
- ^ Wahid, Abdul (2017-08-01). "Thiourea: A Molecule with Immense Biological Significance for Plants" (PDF). International Journal of Agriculture and Biology. 19 (4): 911–920. doi:10.17957/ijab/15.0464. ISSN 1560-8530.
- ^ "81st Universal Metal Finishing Guidebook". Metal Finishing, Guidebook and Directory Issue. Metal Finishing Magazine: 285. Fall 2013. ISSN 0026-0576.
- ^ C. Kaneko; A. Sugimoro & S. Tanaka (1974). "A facile one-step synthesis of cis-2-cyclopentene and cis-2-cyclohexene-1,4-diols from the corresponding cyclodienes". Synthesis. 1974 (12): 876–877. doi:10.1055/s-1974-23462.
- ^ Gupta, D., Soman, G., and Dev, S. (1982). "Thiourea, a convenient reagent for the reductive cleavage of olefin ozonolysis products". Tetrahedron. 38 (20): 3013–3018. doi:10.1016/0040-4020(82)80187-7.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Speziale, A. J. (1963). "Ethanedithiol". Organic Syntheses.; Collective Volume, vol. 4, p. 401
- ^ Liang, Y.; et, al. (2016). "An efficient precursor to synthesize various FeS2 nanostructures via a simple hydrothermal synthesis method". CrystEngComm. 18 (33): 6262–6271. doi:10.1039/c6ce01203e.
- ^ Bao, N.; et al. (2007). "Facile Cd−Thiourea Complex Thermolysis Synthesis of Phase-Controlled CdS Nanocrystals for Photocatalytic Hydrogen Production under Visible Light". The Journal of Physical Chemistry C. 111 (47): 17527–17534. doi:10.1021/jp076566s.
- ^ Foster, H. M., and Snyder, H. R. (1963). "4-Methyl-6-hydroxypyrimidine". Organic Syntheses.
{{cite journal}}: CS1 maint : 복수이름 : 저자목록(링크); - ^ Dodson, R. M. & King, L. C. (1945). "The reaction of ketones with halogens and thiourea". J. Am. Chem. Soc. 67 (12): 2242–2243. doi:10.1021/ja01228a059. PMID 21005695.
- ^ https://cf1.bettymills.com/product/more_info/TX-4PRO.pdf
- ^ https://www.jlsmithco.com/wp-content/uploads/2020/05/hagerty-silver-dip-1-gal.jpg
- ^ https://oehha.ca.gov/chemicals/thiourea
- ^ 앤서니 에스포지토 "페놀스, UAM이 파일럿 티우레아 아우-아그 침출공장을 공개한다 - 멕시코" 비즈니스 뉴스 아메리카(2007년 7월 13일).
- ^ Kauffman, George B. (1983-01-01). "Nikolaĭ semenovich kurnakov, the reaction (1893) and the man (1860–1941) a ninety-year retrospective view". Polyhedron. 2 (9): 855–863. doi:10.1016/S0277-5387(00)81400-X. ISSN 0277-5387.
- ^ http://gis.dep.wv.gov/tri/cheminfo/msds1385.txt
추가 읽기
- Patai, S., ed. (1977). The Chemistry of double-bonded functional groups. New York, NY: John Wiley & Sons. pp. 1355–1496. ISBN 0-471-92493-8.