전자전달사슬
Electron transport chain
전자전달사슬(ETC[1])은 산화환원반응(환원 및 산화가 동시에 발생)을 통해 전자공여체에서 전자수용체로 전자를 전달하고 이 전자전달과 막을 통한 양성자(H이온+)의 전달을 결합하는 일련의 단백질 복합체 및 기타 분자이다.미토콘드리아 내막에 있는 일련의 단백질.NADH와 FADH2에서 ETC로 전달된 전자는 4개의 다중 서브유닛 대형 효소 복합체와 2개의 이동 전자 운반체를 포함한다.전자전달계의 많은 효소들은 막에 결합되어 있다.
전자전달계를 통과하는 전자의 흐름은 발기 과정이다.산화환원 반응의 에너지는 전기화학적 양성자 구배를 만들어 아데노신 삼인산(ATP)의 합성을 촉진한다.호기성 호흡에서 전자의 흐름은 최종 전자 수용체로서의 분자 산소와 함께 종료됩니다.혐기성 호흡에서는 황산염과 같은 다른 전자 수용체가 사용된다.
전자전달사슬에서 산화환원반응은 반응물질 및 생성물의 깁스 자유에너지 차이에 의해 구동된다.전자가 낮은 산화환원 전위에서 높은 산화환원 전위로 전달되는 동안 고에너지 전자공여체와 수용체가 저에너지 제품으로 전환될 때 방출되는 자유 에너지는 전자전달사슬의 복합체에 의해 이온의 전기화학적 구배를 생성하기 위해 사용된다.이 전기화학적 [2]구배는 ATP 합성효소와 산화적 인산화와의 결합을 통해 ATP의 합성을 촉진한다.
진핵생물에서 전자전달사슬과 산화적 인산화 부위는 미토콘드리아 내막에서 발견된다.시토크롬 c와 (간접적으로) NADH와 FADH와 같은 환원 화합물의 반응에 의해 방출되는 에너지는 전자전달계에 의해 사용되어 미토콘드리아 내막 위에 전기화학적 구배를 생성한다.광합성 진핵생물에서 전자수송사슬은 틸라코이드막에서 발견된다.여기서 빛 에너지는 양성자 펌프를 통한 전자 수송을 촉진하고 그 결과 양성자 구배는 후속 ATP의 합성을 일으킨다.박테리아에서, 전자 전달 사슬은 종마다 다를 수 있지만, 그것은 항상 ATP 합성효소를 [3]통한 전기 화학적 경사 생성과 산화적 인산화의 생성을 통한 ATP 합성과 결합된 산화 환원 반응 세트를 구성한다.
미토콘드리아 전자전달사슬
대부분의 진핵 세포는 산소와 구연산 순환, 지방산 대사, 그리고 아미노산 대사의 산물의 반응으로부터 ATP를 생산하는 미토콘드리아를 가지고 있다.미토콘드리아 내막에서 NADH와 FADH의2 전자는 전자전달망을 통해 산소로 전달되며,[4] 산소는 물로 환원되면서 과정을 이끄는 에너지를 제공한다.전자 전달 사슬은 일련의 효소 전자 공여체 및 수용체로 구성됩니다.각 전자 공여자는 산화 환원 전위가 더 높은 수용체에 전자를 전달하고, 이는 다시 이 전자를 다른 수용체에 기증합니다. 이 과정은 전자가 사슬의 말단 전자 수용체인 산소로 전달될 때까지 계속됩니다.고에너지 공여자와 수용자가 저에너지 제품으로 전환되기 때문에 각 반응은 에너지를 방출한다.전달된 전자를 통해, 이 에너지는 미토콘드리아 막을 가로지르는 양성자 구배를 생성하는데 사용되며, 양성자를 막간 공간에 "펌프"함으로써, 작동할 가능성이 있는 더 높은 자유 에너지 상태를 생성한다.ADP는 전자전달계의 산화환원 반응이 산소의 에너지 방출 반응에 의해 구동되는 전기화학적 구배를 사용하여 ATP로 인산화되기 때문에 이 전체 과정을 산화적 인산화라고 합니다.
미토콘드리아 산화환원담체
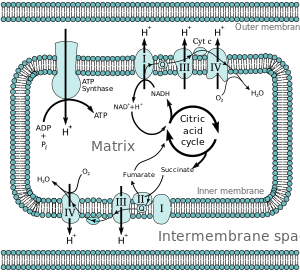
전자전달사슬에 전자가 전달되는 것과 관련된 에너지는 미토콘드리아 매트릭스에서 막간 공간으로 양성자를 펌핑하여 미토콘드리아 내막을 가로질러 전기화학적 양성자 구배(δpH)를 생성하는데 사용된다.이러한 양성자 구배는 주로 미토콘드리아 막 전위(δM)[5]에 전적으로 관여하지는 않는다.이것은 ATP 합성효소가 효소를 통해 기질로 되돌아오는 H의 흐름을+ 사용하여 아데노신 이인산염(ADP)과 무기 인산염으로부터 ATP를 생성하도록 한다.복합체 I(NADH 코엔자임 Q 환원효소, 라벨 I)은 크렙스 사이클 전자 캐리어 니코틴아미드 아데닌 디뉴클레오티드(NADH)로부터 전자를 받아들여 그것들을 코엔자임 Q(유비퀴논, 라벨 Q)로 전달하고, 또한 복합체 II(수산화수소효소, 라벨 II)로부터 전자를 받는다.Q는 전자를 복합체 III(시토크롬1 bc 복합체; 라벨 III)로 전달하고, 이는 그것들을 시토크롬 c(시토크롬 c)로 전달한다.세포 c는 복합 IV(시토크롬 c 산화효소, IV 라벨 부착)로 전자를 전달합니다.
미토콘드리아에서 4개의 막결합 복합체가 확인되었다.각각은 내막에 내장된 매우 복잡한 막 통과 구조입니다.그 중 3개는 양성자 펌프입니다.이들 구조는 지질 용해성 전자 운반체와 수용성 전자 운반체에 의해 전기적으로 연결됩니다.전체 전자 전달 사슬은 다음과 같이 요약할 수 있습니다.
NADH+H+ → 착체 I → Q ↑ 착체 II ↑ 숙신산염 → 착체 III → 시토크롬2 c → 착체 IV ↑ HO ↑ 착체 II ↑ 숙신산염
콤플렉스 I
복합 I(NADH 유비퀴논 산화환원효소, Type I NADH 탈수소효소 또는 미토콘드리아 복합체 I; EC 1.6.5.3)에서 2개의 전자가 NADH에서 제거되어 지질 가용성 캐리어 유비퀴논(Q)으로 이행된다.환원된 생성물인 유비퀴놀(QH2)은 막 내에서 자유롭게 확산되며, 복합 I은 막을 가로질러 4개의 양성자(H+)를 전위시켜 양성자 구배를 생성한다.복합체 I은 산소에 대한 조기 전자 누출이 발생하는 주요 부위 중 하나이며, 따라서 [6]슈퍼옥시드의 주요 생산 지점 중 하나이다.
전자의 경로는 다음과 같습니다.
NADH는 2전자 공정에서 플라빈 모노뉴클레오티드를 FMNH로2 환원시킴으로써 NAD로+ 산화된다.FMNH는2 세미퀴논 중간체를 통해 2개의 1전자 단계에서 산화된다.따라서 각 전자는 FMNH에서2 Fe-S 클러스터로, Fe-S 클러스터에서 유비퀴논(Q)으로 이동한다.제1전자의 이동은 프리라디칼(반퀴논) 형태의 Q를 낳고, 제2전자의 이동은 세미퀴논 형태를 유비퀴놀 형태인2 QH로 감소시킨다.이 과정에서 4개의 양성자가 미토콘드리아 매트릭스에서 막간 [7]공간으로 이동한다.전자가 복합체를 통과할 때 막 내에서 복합체의 180 앵스트롬 폭을 따라 전자 전류가 생성됩니다.이 전류는 NADH에서 [8]2개의 전자당 4개의 양성자가 막간 공간으로 능동적으로 전달되도록 합니다.
콤플렉스 II
복합 II(숙신산탈수소효소 또는 숙신산-CoQ 환원효소; EC 1.3.5.1)에서 추가 전자는 숙신산염에서 유래한 퀴논 풀(Q)로 전달되어 플라빈 아데닌 디뉴클레오티드(FAD)를 통해 Q로 전달된다.복합체 II는 숙신산탈수소효소(SDHA), 숙신산탈수소효소(ubiquinone) 철-황 서브유닛(SDHB), 숙신산탈수소효소 복합 서브유닛 C(SDHC) 및 숙신산탈수소효소 복합 서브유닛 D(SDHD)의 4가지 단백질 서브유닛으로 구성된다.다른 전자 공여체(예: 지방산 및 글리세롤 3-인산)도 전자를 (FAD를 통해) Q로 유도한다.복합체 II는 복합체 1에 대한 병렬 전자 전달 경로이지만 복합체 I과 달리 양성자는 이 경로의 막간 공간으로 전달되지 않는다.따라서 복합체 II를 통과하는 경로는 전체 전자전달 과정에 더 적은 에너지를 기여한다.
콤플렉스 III
복합 III(시토크롬1 bc 복합체 또는 CoQH-시토크롬2 c 환원효소; EC 1.10.2.2)에서 Q-사이클은 양성자의 비대칭 흡수/방출에 의해 양성자 구배에 기여한다.Q부위O QH에서2 2개의 전자가 제거되고, 이어서 막간 공간 내에 위치한 수용성 전자 운반체인 시토크롬 c의 2분자에 전달된다.다른 두 개의 전자는 순차적으로 단백질을 지나 유비퀴논의 퀴논 부분이 퀴놀로 환원되는 Q 부위로i 갑니다.양성자 구배는 Q 부위에서o 1개의 퀴놀(2 + -{ 산화에 의해 형성되어 Q 부위에서i 1개의 퀴논(2 -\을 형성한다.(총 4개의 양성자가 이동한다: 2개의 양성자가 퀴논을 퀴놀로 환원하고 2개의 양성자가 2개의 유비퀴놀 분자에서 방출된다.)
(높은 막 전위 또는 안티마이신 A와 같은 호흡 억제제에 의해) 전자 전달이 감소하면 복합체 III가 분자 산소로 전자를 누출하여 슈퍼옥시드가 형성될 수 있습니다.
이 복합체는 디메르카프롤(영국 안티리사이트, BAL), 냅토키논 및 안티마이신에 의해 억제된다.
콤플렉스 IV
때때로 시토크롬 AA3라고 불리는 복합 IV(시토크롬 c 산화효소; EC 1.9.3.1)에서, 4개의 전자가 시토크롬 c의 4개의 분자에서 제거되고 분자 산소(O2)와 4개의 양성자로 전달되어 2개의 분자의 물을 생성한다.복합체에는 배위된 구리 이온과 여러 개의 헴기가 포함되어 있습니다.동시에, 8개의 양성자가 미토콘드리아 매트릭스에서 제거되어(단 4개만이 막에 걸쳐 위치함) 양성자 구배에 기여한다.복합체 IV에서 양성자 펌핑의 정확한 세부 사항은 아직 [9]연구 중이다.시안화물은 복합체 IV의 억제제이다.
산화적 인산화와의 결합
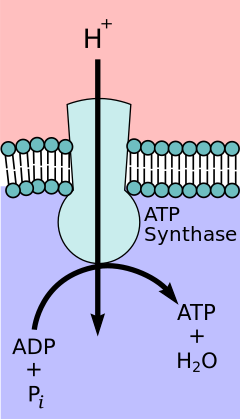
노벨 화학상 수상자인 피터 D가 제안한 화학 삼투압 결합 가설에 따르면. 미첼, 전자전달사슬과 산화적 인산화는 미토콘드리아 내막을 가로지르는 양성자 구배에 의해 결합된다.미토콘드리아 매트릭스에서 양성자가 유출되면 전기화학적 경사(프로톤 경사)가 발생한다.이 구배는 산화적 인산화를 통해 ATP를 만들기 위해 FFATPO1 합성효소 복합체에 의해 사용된다.ATP 합성효소는 때때로 전자전달계의 [10]복합체 V로 묘사된다.ATPO 합성효소의 F 성분은 미토콘드리아 매트릭스로의 양성자 플럭스를 제공하는 이온 채널로 작용한다.이것은 a, b 및 c 서브유닛으로 구성되어 있습니다.미토콘드리아의 막간 공간에 있는 양성자는 먼저 서브유닛 채널을 통해 ATP 합성효소 복합체로 들어간다.그러면 양성자가 c [11]서브유닛으로 이동합니다.c 서브유닛의 수는O F가 1회전하는 데 필요한 양성자의 수를 결정합니다.예를 들어, 인간에게는 8c의 서브유닛이 있기 때문에 8개의 양성자가 필요합니다.[12]c 서브유닛 후에, 양성자는 마침내 미토콘드리아 [11]매트릭스로 열리는 서브유닛 채널을 통해 매트릭스로 들어갑니다.이 환류는 산화 형태의 전자 캐리어(NAD 및 Q)가 생성되는 동안 생성된 자유 에너지를 O가 제공하는2 에너지로 방출합니다.자유 에너지는 [13]복합체의 F 성분에1 의해 촉매되는 ATP 합성을 촉진하는 데 사용됩니다.
산화적 인산화와의 결합은 ATP 생산의 핵심 단계이다.그러나 특정한 경우에는 두 프로세스를 분리하는 것이 생물학적으로 유용할 수 있습니다.갈색 지방 조직의 내부 미토콘드리아 막에 존재하는 분리 단백질인 서모게닌은 내부 미토콘드리아 매트릭스로 양성자의 대체 흐름을 제공한다.티록신 또한 천연 분리기입니다.이 대체 흐름은 ATP [14]생산보다는 열 발생을 초래한다.
역전자 흐름
역전자 흐름은 산화환원반응을 통해 전자전달계를 통해 전자가 전달되는 것이다.일반적으로 상당한 양의 에너지를 사용해야 하므로 전자 공여자의 산화 형태를 줄일 수 있습니다.예를 들어 NAD는 복합+ [15]I에 의해 NADH로 환원될 수 있다.역전자 흐름을 유도하는 몇 가지 요인이 있는 것으로 나타났습니다.그러나 이를 확인하기 위해서는 더 많은 작업이 필요하다.한 가지 예는 ATP 합성효소의 차단으로, 양성자가 축적되고 따라서 양성자 운동력이 높아져 역전자 [16]흐름을 유도하는 것이다.
세균전자전달사슬
진핵생물에서 NADH는 가장 중요한 전자공여체이다.관련된 전자전달사슬은 NADH → 복합 I → Q → 복합 III → 시토크롬 c → 복합 IV2 → O이며, 복합 I, III 및 IV는 양성자 펌프이고, Q 및 시토크롬 c는 이동 전자전달체이다.이 과정을 위한 전자수용체는 산소분자입니다.
원핵생물(박테리아와 고세균)에서는 여러 개의 다른 전자 공여체와 여러 개의 다른 전자 수용체가 있기 때문에 상황이 더 복잡하다.박테리아에서 일반화된 전자전달망은 다음과 같습니다.
공여체 ↓ ↓ 탈수소효소 → 퀴논 → bc1 → 시토크롬 ↓ ↓ 산화효소(옥시드락타아제) 산화효소(옥시드락타아제) ↓↓ Acceptor Acceptor
전자는 탈수소효소 레벨, 퀴논 풀 레벨 또는 이동식 시토크롬 전자 운반체 레벨의 세 가지 레벨로 사슬에 들어갈 수 있습니다.이러한 수준은 연속적으로 더 많은 양의 산화환원 전위 또는 말단 전자수용체에 대한 연속적인 전위차 감소에 해당합니다.다시 말해, 그것들은 전체 산화환원 반응에 대해 연속적으로 작은 깁스 자유 에너지 변화에 대응한다.
개별 박테리아는 종종 동시에 여러 전자전달계를 사용한다.박테리아는 많은 다른 전자 공여체, 많은 다른 탈수소효소, 많은 다른 산화효소 및 환원효소, 그리고 많은 다른 전자 수용체를 사용할 수 있습니다.예를 들어, 대장균은 (포도당과 산소를 에너지원으로 사용하여 곡예적으로 재배할 때) 두 개의 다른 NADH 탈수소 효소와 두 개의 다른 퀴놀 산화 효소를 사용하여 총 네 개의 다른 전자 전달 사슬을 동시에 작동시킵니다.
모든 전자전달 사슬의 공통적인 특징은 막 위에 전기화학적 구배를 만드는 양성자 펌프의 존재이다.박테리아 전자전달사슬은 미토콘드리아와 같은 3개의 양성자 펌프를 포함할 수도 있고, 2개 또는 적어도 1개를 포함할 수도 있다.
전자 공여체
현재의 생물권에서 가장 흔한 전자 공여자는 유기 분자입니다.유기 분자를 전자원으로 사용하는 유기체는 유기영양체라고 불린다.화학 유기영양생물(동물, 곰팡이, 원생동물)과 광석영양생물(식물 및 조류)은 친숙한 생명체의 대부분을 구성합니다.
어떤 원핵생물들은 무기물을 전자원으로 사용할 수 있다.그러한 유기체는 (화학)리토트로프("바위-이터")라고 불립니다.무기전자공여체에는 수소, 일산화탄소, 암모니아, 아질산염, 황, 황화물, 산화망간 및 철이 포함된다.암석영양은 지구 표면 수천 미터 아래에 있는 암석 지층에서 자라고 있는 것이 발견되었다.그들의 분포량 때문에, 우리 생물권의 유기영양과 광영양보다 암석영양이 더 많을 수 있습니다.
수소와 같은 무기 전자 공여체를 에너지원으로 사용하는 것은 진화 연구에서 특히 관심을 끈다.이러한 유형의 신진대사는 논리적으로 유기 분자와 산소를 에너지원으로 사용하기 전에 이루어졌을 것입니다.
콤플렉스 I 및 II
박테리아는 여러 다른 전자 공여체를 사용할 수 있다.유기물이 전자원일 때, 공여체는 NADH 또는 석신산염일 수 있으며, 이 경우 전자는 NADH 탈수소효소(미토콘드리아의 복합체 I과 유사) 또는 숙신산 탈수소효소(복합체 II와 유사)를 통해 전자전달망에 진입한다.다른 탈수소효소는 포름산탈수소효소, 젖산탈수소효소, 글리세린알데히드-3-인산탈수소효소2, H탈수소효소(수소효소), 전자전달사슬 등 다양한 에너지원을 처리하기 위해 사용될 수 있다.어떤 탈수소효소는 양성자 펌프이기도 하지만, 다른 것들은 전자를 퀴논 풀로 흘려보낸다.대부분의 탈수소효소는 세포가 성장하는 환경에 의해 유발되는 대사 요구에 반응하여 박테리아 세포에서 유도된 발현을 보여준다.대장균의 젖산탈수소효소의 경우, 효소는 곡예비용으로 다른 탈수소효소와 조합하여 사용된다.유도성이며 세포 내 DL-lactate 농도가 [citation needed]높을 때 발현된다.
퀴논 캐리어
퀴논은 세포막에 내장된 크고 비교적 움직이지 않는 고분자 복합체 사이에 전자(및 양성자)를 왕복하는 이동성 지질 용해성 운반체입니다.박테리아는 유비퀴논(Coenzyme Q, 미토콘드리아가 사용하는 것과 같은 퀴논)과 메나퀴논(Vitamin2 K)과 같은 관련 퀴논을 사용한다.술폴로부스속 고세균은 칼다리에엘라퀴논을 [17]사용한다.서로 다른 퀴논을 사용하는 것은 구조 변화로 인한 산화환원 전위의 약간의 변화 때문이다.이러한 퀴논의 산화환원 전위 변화는 전자수용체 변화 또는 박테리아 [18]복합체의 산화환원 전위 변화에 적합할 수 있다.
양성자 펌프
양성자 펌프는 막을 가로질러 양성자 구배를 만드는 과정입니다.양성자는 미토콘드리아 복합체 I과 IV에서 볼 수 있듯이 막을 가로질러 물리적으로 이동할 수 있다.전자를 반대 방향으로 이동시켜도 같은 효과를 낼 수 있다.그 결과 세포질에서 양성자가 사라지고 증배질에서 양성자가 나타난다.미토콘드리아 복합체 III는 퀴논에 의해 매개되는 두 번째 유형의 양성자 펌프를 사용한다.
몇몇 탈수소효소는 양성자 펌프이고 다른 것들은 그렇지 않다.대부분의 산화효소 및 환원효소는 양성자 펌프이지만, 일부는 그렇지 않습니다.시토크롬1 bc는 (대장균이 아닌) 많은 박테리아에서 발견되는 양성자 펌프입니다.이름에서 알 수 있듯이 박테리아1 bc는 미토콘드리아1 bc(복합체 III)와 유사하다.
시토크롬 전자 운반체
시토크롬은 철분을 함유한 단백질이다.그들은 매우 다른 두 가지 환경에서 발견됩니다.
일부 시토크롬은 세포막에 내장된 크고 움직이지 않는 고분자 구조에서 전자를 왕복하는 수용성 운반체이다.미토콘드리아에 있는 이동식 시토크롬 전자담체는 시토크롬 c이다.박테리아는 많은 다른 이동식 시토크롬 전자 운반체를 사용한다.
다른 시토크롬은 복합체 III 및 복합체 IV와 같은 고분자 내에서 발견된다.그것들은 전자 운반체 역할도 하지만 매우 다른 분자 내 고체 환경에서 작동합니다.
전자는 이동 시토크롬 또는 퀴논 운반체 수준에서 전자전달계에 들어갈 수 있다.예를 들어, 무기 전자 공여체(질산염, 철, 전자 전달 사슬)의 전자는 시토크롬 수준에서 전자 전달 체인으로 들어갑니다.전자가 NADH보다 더 큰 산화환원 수준에서 진입할 때, 전자전달계는 이 필요한 고에너지 분자를 생산하기 위해 역방향으로 작동해야 한다.
말단산화효소 및 환원효소
박테리아가 유산소 환경에서 자랄 때, 말단 전자 수용체는2 산화효소라고 불리는 효소에 의해 물로 환원된다.박테리아가 혐기성 환경에서 자랄 때, 말단 전자 수용체는 환원효소라고 불리는 효소에 의해 감소된다.미토콘드리아에서 말단막복합체(Complex IV)는 시토크롬산화효소이다.호기성 박테리아는 많은 다른 말단 산화효소를 사용한다.예를 들어 대장균(통성 혐기성)은 시토크롬산화효소나 bc복합체를1 가지고 있지 않다.에어로빅 조건에서는 산소를 물로 환원하기 위해 서로 다른 두 가지 말단 퀴놀 산화효소(양성자 펌프)를 사용합니다.
박테리아 복합체 IV는 분자가 말단 전자 수용체 역할을 하는 것에 따라 분류될 수 있다.클래스 I 산화효소는 시토크롬 산화효소이며 산소를 말단 전자수용체로 사용한다.클래스 II 산화효소는 퀴놀 산화효소이며 다양한 말단 전자수용체를 사용할 수 있다.이러한 클래스는 모두 포함된 redox-active 컴포넌트에 따라 카테고리로 세분화할 수 있습니다.예: Heme aa3 Class 1 말단 산화효소는 Class 2 말단[2] 산화효소보다 훨씬 효율적입니다.
산소를 말단 전자수용체로 사용하지 않는 혐기성 세균은 말단 수용체에 개별화된 말단 환원효소를 가진다.예를 들어 대장균은 환경에서의 수용체 가용성에 따라 푸마르산 환원효소, 질산 환원효소, 아질산 환원효소, DMSO 환원효소 또는 트리메틸아민-N-옥사이드 환원효소를 사용할 수 있다.
대부분의 말단 산화효소 및 환원효소는 유도된다.특정 환경 조건에 따라 필요에 따라 유기체에 의해 합성됩니다.
전자수용체
수많은 다른 전자 공여체(유기영양의 유기물, 암석영양의 무기물)가 있는 것처럼, 유기물과 무기물 모두 다양한 전자 수용체가 있습니다.산소를 사용할 수 있는 경우에는 호기성 세균 및 통성 혐기성균에서 말단 전자수용체로 가장 많이 사용된다.
대부분 혐기성 환경에서는 질산염, 아질산염, 철, 황산염, 이산화탄소 및 푸마르산염과 같은 작은 유기 분자를 포함한 다양한 전자 수용체가 사용됩니다.
광합성
산화인산화에서 전자는 NADH와 같은 전자공여체에서 전자전달계를 통해 O와 같은2 수용체로 전달되어 에너지를 방출한다.광인산화에서 햇빛의 에너지는 고에너지 전자공여체를 만드는데 사용되며, 고에너지 전자공여체는 산화성분을 감소시키고 전자전달계에 [9]의한 양성자 전이를 통해 ATP 합성과 결합할 수 있다.
광합성 전자전달 사슬은 미토콘드리아 사슬과 같이 박테리아 시스템의 특별한 경우로 간주될 수 있다.그들은 이동성, 지질 용해성 퀴논 운반체 (필로퀴논과 플라스토퀴논)와 이동성, 수용성 운반체 (시토크롬)를 사용한다.양성자 펌프도 포함되어 있습니다.모든 광합성 사슬의 양성자 펌프는 미토콘드리아 복합체 III와 유사하다.일반적으로 알려진 공생 이론은 두 기관 모두 박테리아로부터 유래했다고 주장한다.
「 」를 참조해 주세요.
레퍼런스
- ^ Lyall, Fiona (2010). "Biochemistry". Basic Science in Obstetrics and Gynaecology. pp. 143–171. doi:10.1016/B978-0-443-10281-3.00013-0. ISBN 978-0-443-10281-3.
- ^ a b Anraku Y (June 1988). "Bacterial electron transport chains". Annual Review of Biochemistry. 57 (1): 101–32. doi:10.1146/annurev.bi.57.070188.000533. PMID 3052268.
- ^ Kracke F, Vassilev I, Krömer JO (2015). "Microbial electron transport and energy conservation - the foundation for optimizing bioelectrochemical systems". Frontiers in Microbiology. 6: 575. doi:10.3389/fmicb.2015.00575. PMC 4463002. PMID 26124754.
- ^ Waldenström JG (2009-04-24). "Biochemistry. By Lubert Stryer". Acta Medica Scandinavica. 198 (1–6): 436. doi:10.1111/j.0954-6820.1975.tb19571.x. ISSN 0001-6101.
- ^ Zorova LD, Popkov VA, Plotnikov EY, Silachev DN, Pevzner IB, Jankauskas SS, et al. (July 2018). "Mitochondrial membrane potential". Analytical Biochemistry. 552: 50–59. doi:10.1016/j.ab.2017.07.009. PMC 5792320. PMID 28711444.
- ^ 로렌, 생화학, 존슨/콜, 2010, 페이지 598-611
- ^ Garrett & Grisham, 생화학, Brooks/Cole, 2010,
- ^ Garrett R, Grisham CM (2016). biochemistry. Boston: Cengage. p. 687. ISBN 978-1-305-57720-6.
- ^ a b Stryer. Biochemistry. toppan. OCLC 785100491.
- ^ Jonckheere AI, Smeitink JA, Rodenburg RJ (March 2012). "Mitochondrial ATP synthase: architecture, function and pathology". Journal of Inherited Metabolic Disease. 35 (2): 211–25. doi:10.1007/s10545-011-9382-9. PMC 3278611. PMID 21874297.
- ^ a b Garrett RH, Grisham CM (2012). Biochemistry (5th ed.). Cengage learning. p. 664. ISBN 978-1-133-10629-6.
- ^ Fillingame RH, Angevine CM, Dmitriev OY (November 2003). "Mechanics of coupling proton movements to c-ring rotation in ATP synthase". FEBS Letters. 555 (1): 29–34. doi:10.1016/S0014-5793(03)01101-3. PMID 14630314. S2CID 38896804.
- ^ Berg JM, Tymoczko JL, Stryer L (2002-01-01). "A Proton Gradient Powers the Synthesis of ATP".
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ Cannon B, Nedergaard J (January 2004). "Brown adipose tissue: function and physiological significance". Physiological Reviews. 84 (1): 277–359. doi:10.1152/physrev.00015.2003. PMID 14715917.
- ^ Kim BH, Gadd GM (2008). "Introduction to bacterial physiology and metabolism". Bacterial Physiology and Metabolism. Cambridge University Press. pp. 1–6. doi:10.1017/cbo9780511790461.002. ISBN 978-0-511-79046-1.
- ^ Mills EL, Kelly B, Logan A, Costa AS, Varma M, Bryant CE, et al. (October 2016). "Succinate Dehydrogenase Supports Metabolic Repurposing of Mitochondria to Drive Inflammatory Macrophages". Cell. 167 (2): 457–470.e13. doi:10.1016/j.cell.2016.08.064. PMC 5863951. PMID 27667687.
- ^ EC 1.3.5.1
- ^ Ingledew WJ, Poole RK (September 1984). "The respiratory chains of Escherichia coli". Microbiological Reviews. 48 (3): 222–71. doi:10.1128/mmbr.48.3.222-271.1984. PMC 373010. PMID 6387427.
추가 정보
- Fenchel T, King GM, Blackburn TH (September 2006). Bacterial Biogeochemistry: The Ecophysiology of Mineral Cycling (2nd ed.). Elsevier. ISBN 978-0-12-103455-9.
- Lengeler JW (January 1999). Drews G; Schlegel HG (eds.). Biology of the Prokaryotes. Blackwell Science. ISBN 978-0-632-05357-5.
- Nelson DL, Cox MM (April 2005). Lehninger Principles of Biochemistry (4th ed.). W. H. Freeman. ISBN 978-0-7167-4339-2.
- Nicholls DG, Ferguson SJ (July 2002). Bioenergetics 3. Academic Press. ISBN 978-0-12-518121-1.
- Stumm W; Morgan JJ (1996). Aquatic Chemistry (3rd ed.). John Wiley & Sons. ISBN 978-0-471-51185-4.
- Thauer RK, Jungermann K, Decker K (March 1977). "Energy conservation in chemotrophic anaerobic bacteria". Bacteriological Reviews. 41 (1): 100–80. doi:10.1128/MMBR.41.1.100-180.1977. PMC 413997. PMID 860983.
- White D (September 1999). The Physiology and Biochemistry of Prokaryotes (2nd ed.). Oxford University Press. ISBN 978-0-19-512579-5.
- Voet D, Voet JG (March 2004). Biochemistry. Biochemical Education. Vol. 28 (3rd ed.). John Wiley & Sons. pp. 124. doi:10.1016/s0307-4412(00)00032-7. ISBN 978-0-471-58651-7. PMID 10878303.
- Kim HS, Patel K, Muldoon-Jacobs K, Bisht KS, Aykin-Burns N, Pennington JD, et al. (January 2010). "SIRT3 is a mitochondria-localized tumor suppressor required for maintenance of mitochondrial integrity and metabolism during stress". Cancer Cell. 17 (1): 41–52. doi:10.1016/j.ccr.2009.11.023. PMC 3711519. PMID 20129246.
- Raimondi V, Ciccarese F, Ciminale V (January 2020). "Oncogenic pathways and the electron transport chain: a dangeROS liaison". Br J Cancer. 122 (2): 168–181. doi:10.1038/s41416-019-0651-y. PMC 7052168. PMID 31819197.
외부 링크
- 미국 국립의학도서관의 전자+수송+체인+복합체+단백질(MeSH)
- 칸 아카데미, 비디오 강의