유기석 시약
Organolithium reagent유기석 시약은 탄소-리튬 결합을 포함하는 유기금속 화합물이다.이러한 시약은 유기 합성에 중요하며, 친핵 첨가 또는 단순 [1]탈양성자를 통해 유기기 또는 리튬 원자를 합성 단계에서 기질에 전달하기 위해 자주 사용됩니다.유기석 시약은 다양한 엘라스토머를 생산하는 음이온 중합 개시제로 업계에서 사용됩니다.그것들은 또한 [2]제약업계에서 비대칭 합성에도 적용되어 왔다.탄소 원자와 리튬 원자의 전기 음성도 차이가 크기 때문에 C-Li 결합은 이온성이 높다.C-Li 결합의 극성으로 인해 유기석소 시약은 좋은 친핵체이며 강력한 염기이다.실험실 유기 합성을 위해 많은 유기석 시약이 시판되고 있습니다.이 시약들은 매우 반응성이 높으며 때로는 발열성이기도 합니다.
역사와 발전
유기석 시약의 연구는 1930년대에 시작되었고 Karl Ziegler, Georg Wittig, 그리고 Henry Gilman에 의해 개척되었습니다.그리냐드(마그네슘) 시약과 비교하여 유기석 시약은 금속화의 [3]경우와 같이 속도를 높이고 수율을 높여 동일한 반응을 수행할 수 있습니다.그 이후 유기석 시약이 그리냐르 시약을 일반적으로 [4]앞질렀다.
구조.
단순 알킬리튬 종은 종종 단량체 RLi로 나타나지만, 골재(올리고머) 또는 [5]폴리머로 존재한다.응집 정도는 유기 치환기와 다른 [6][7]배위자의 존재에 따라 달라집니다.이러한 구조는 다양한 방법, 특히 Li, Li 및 C NMR 스펙트럼 분석과 X선 회절 분석에 [1]의해 설명되었다.계산 화학은 이러한 [5]과제를 지원합니다.
탄소-리튬 결합의 성질
탄소와 리튬의 상대적인 전기음성도는 C-Li 결합이 극성을 [8][9][10]띠게 될 것임을 시사한다.그러나 특정 유기석 화합물은 문제를 복잡하게 만드는 비극성 용제의 용해성과 같은 특성을 가지고 있습니다.[8] 대부분의 데이터는 C-Li 결합이 본질적으로 이온성임을 시사하지만, C-Li [9][10]결합에 작은 공유자가 존재하는지 여부에 대해서는 논란이 있었다.한 추정치는 알킬리튬 화합물의 이온 특성 비율을 80~88%[11]로 추정한다.
알릴리튬화합물은 리튬카티온이 탄소γ결합면에 국소적인 카르바니온 중심 대신 δ방향으로3 좌표를 형성하기 때문에 알킬리튬보다 [6][12]아릴리튬의 응집도가 낮은 경우가 많다.아릴리튬 착화체에서는 리튬 양이온이 Li-Cγ형 [6][13]결합을 통해 단일 카르보니언 중심부로 좌표를 맞춘다.
솔리드 스테이트 구조
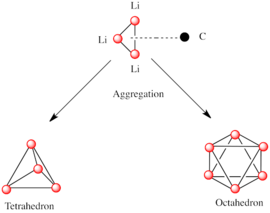
극지방의 아단위들로 구성된 다른 종들처럼 유기석소종들도 [7][14]집결합니다.골재 형성은 정전 상호작용, 리튬과 주변 용제 분자 또는 극성 첨가물 간의 조정 및 입체 효과에 [7]의해 영향을 받습니다.
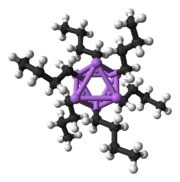
보다 복잡한 구조를 구축하기 위한 기본 구성 요소는 Li 삼각형과3 δ- [5]방식으로 상호작용하는 카르바니온 중심이다.단순 알킬리튬 시약에서는 이 삼각형들이 모여 4면체 또는 8면체 구조를 형성합니다.예를 들어, 메틸리튬, 에틸리튬 및 테르트-부틸리튬은 모두 사량체 [RLi]4에 존재합니다.메틸리튬은 4개의 리튬 중심이 4면체를 이루는 큐베인형 클러스터 내에 4면체로 존재한다.메틸리튬의 테트라머 중의 각 메탄화물은 인접한 테트라머의 [5][7]리튬 양이온과 무정부적 상호작용을 할 수 있다.반면 에틸리튬과 테르트-부틸리튬은 이러한 상호작용을 보이지 않기 때문에 비극성 탄화수소 용제에 용해된다.알킬리튬의 또 다른 클래스는 n-부틸리튬, 이소프로필리튬 및 사이클로헥사닐리튬과 [5]같은 육중미 구조를 채택합니다.
일반적인 리튬 아미드, 예를 들어 리튬 비스(트리메틸실릴) 아미드 및 리튬 디이소프로필아미드도 [15]응집 대상이다.리튬아미드는 고체상태에서 비배위성 용매에서 고분자-레이더형 구조를 채택하고 있으며, 일반적으로 에테르성 용매에서 이합체로 존재한다.강하게 공여되는 배위자의 존재 하에서 3중 또는 4중합체 리튬 중심이 형성된다.[16] 예를 들어, LDA는 주로 THF에서 [15]이합체로 존재합니다.LiDiisopropylamide(LDA) 및 LiHMDS(Liemethyldisilazide)와 같은 일반적인 리튬 아미드의 구조는 NMR [17]분광법을 사용하여 Colum과 동료들에 의해 광범위하게 연구되어 왔다.또 다른 중요한 종류의 시약은 시릴리튬으로 유기금속 복합체와 폴리실란 덴드리머의 [7][18]합성에 광범위하게 사용된다.고체 상태에서는 알킬리튬 시약과는 대조적으로 대부분의 시릴리튬은 THF와 같은 용제 분자와 배위된 단량체 구조를 형성하는 경향이 있으며, 소수의 시릴리튬만이 [7]고응집체로 특징지어졌다.이러한 차이는 실릴리튬의 조제 방법, 실리콘의 부피가 큰 알킬 치환기에 의해 야기되는 입체 장애, 그리고 Si-Li 결합의 편광성이 낮기 때문에 발생할 수 있다.TMEDA 및 (-)-sparteine과 같은 강하게 기증된 리간드의 첨가는 실릴리튬의 [7]배위 용제 분자를 대체할 수 있습니다.
솔루션 구조
결정구조에서 고체상태로 얻은 유기석 집합체의 구조정보에만 의존하는 것은 유기석 시약이 반응용액 [6]환경에서 다른 구조를 채택할 수 있기 때문에 일정한 한계가 있다.또 유기석소의 결정구조를 분리하기 어려운 경우도 있다.따라서 유기석소 시약의 구조와 리튬 함유 중간체의 용액 형태에 대한 연구는 이들 시약의 반응성을 이해하는 데 매우 유용하다.[19] NMR 분광학은 용액 내 유기 석영 응집체 연구를 위한 강력한 도구로 부상했다.알킬리튬종의 경우, C-Li J 커플링은 종종 카르바니온 중심과 상호작용하는 리튬의 수와 이러한 상호작용이 정적인지 [6]동적인지를 결정하기 위해 사용될 수 있다.또한 개별 NMR 신호에 따라 여러 집약체의 존재 여부를 공통의 단량체 [20]단위와 구별할 수 있습니다.
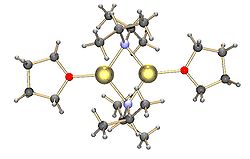
유기석소 화합물의 구조는 테트라히드로프랑(THF), 디에틸에테르(EtO2), 테트라메틸에틸렌디아민(TMEDA) 또는 헥사메틸포스포라마이드(HMPA)[5]와 같은 루이스 염기의 존재에 영향을 받는다.메틸리튬은 에테르 또는 극첨가물 HMPA에 의한 용매화가 고체 상태에서 [7]4중합체 구조를 탈응집하지 않는 특수한 경우이다.한편, THF는 6아메리카 부틸리튬을 탈응집시켜, 테트라머가 주종이며, 테트라머와 이합체와의 상호변환의 δG는 약 11kcal/[21]mol이다.TMEDA는 또한 n-부틸리튬의 리튬 양이온에 킬레이트하여 [(TMEDA) LiBu-n)]2[5][6]와 같은 용해 이합체를 형성할 수 있다.페닐리튬은 결정화된 에테르용액에서 일그러진 사량체로, 그리고 에테르용액에서 [6]이량체와 사량체의 혼합물로 존재하는 것으로 나타났다.
| 용제 | 구조. | |
|---|---|---|
| 메틸리튬 | THF | 사량체 |
| 메틸리튬 | 이더넷/HMPA | 사량체 |
| n-부틸리튬 | 펜탄 | 헥사머 |
| n-부틸리튬 | 에테르 | 사량체 |
| n-부틸리튬 | THF | 사량체 이합체 |
| 초부틸리튬 | 펜탄 | 헥사머 테트라머 |
| 이소프로필리튬 | 펜탄 | 헥사머 테트라머 |
| 테르트부틸리튬 | 펜탄 | 사량체 |
| 테르트부틸리튬 | THF | 단량체 |
| 페닐리튬 | 에테르 | 사량체 이합체 |
| 페닐리튬 | 이더넷/HMPA | 조광기 |
구조와 반응성
유기석소 시약의 구조는 화학적 환경에 따라 변화하므로 반응성과 [7][22]선택성도 변화한다.구조-반응성 관계를 둘러싼 한 가지 의문점은 유기석 시약의 응집 정도와 반응성 사이에 상관관계가 존재하는지 여부이다.원래 알킬리튬에서는 [23]모노머와 같은 낮은 골재가 더 반응하는 것으로 제안되었다.그러나 이합체 또는 다른 올리고머가 반응종인 반응경로도 발견되었으며,[24] LDA와 같은 리튬아미드의 경우 이합체 기반 반응이 일반적이다.[25]LDA 매개 반응에 대한 일련의 솔루션 역동학 연구에 따르면 에놀레이트의 골재가 작을수록 반드시 [17]반응성이 높아지는 것은 아닙니다.
또한 일부 루이스 염기는 유기석소 [26]화합물의 반응성을 증가시킨다.[27] 그러나 이러한 첨가물이 강한 킬레이트 배위자로 기능하는지 여부 및 이러한 첨가물에 의해 야기되는 골재의 구조적 변화와 반응성의 증가가 어떻게 관련되어 있는지 항상 [26][27]명확하지는 않다.예를 들어 TMEDA는 유기석소 [7]시약과 관련된 많은 반응에서 속도와 효율성을 높입니다.알킬리튬 시약에 대해 TMEDA는 공여 배위자 역할을 하며,[5] 응집 정도를 감소시키고, 이러한 [28]종의 구핵성을 증가시킨다.그러나 TMEDA가 리튬 양이온에 대한 공여 배위자 역할을 항상 하는 것은 아니며, 특히 음이온 산소와 질소 중심이 존재하는 경우에는 더욱 그렇습니다.예를 들어, LDA 및 LiHMDS와 경합하는 공여 [29]리간드가 없는 탄화수소 용제에서도 약하게 상호작용합니다.이민석화에서 THF는 LiHMDS에 대한 강한 기증 리간드 역할을 하지만, THMEDA는 LiHMDS로부터 쉽게 분리되어 보다 반응성이 높은 종인 LiHMDS 이합체를 형성한다.따라서 LiHMDS의 경우 TMEDA는 응집 [30]상태를 감소시켜 반응성을 증가시키지 않습니다.또한 THF 용액에서 [6][31]TMEDA는 단순 알킬리튬 화합물과 달리 리티오-아세토페놀레이트를 탈응집하지 않는다.LiHMDS 및 LDA와 같은 리튬 아미드에 HMPA를 추가하면 종종 THF에 이합체/단량체 집합체가 혼합됩니다.단, HMPA의 농도가 높아져도 이합체/단량체종의 비율은 변하지 않으므로 반응도 증가가 관찰된 것은 탈아그리게이션의 결과가 아니다.이러한 첨가물이 반응성을 높이는 메커니즘은 아직 [22]연구되고 있다.
반응성 및 응용 프로그램
유기석소 시약의 C-Li 결합은 극성이 높습니다.그 결과 탄소는 결합 내 전자 밀도의 대부분을 끌어당기고 카르보니온과 유사하다.따라서 유기석소 시약은 염기성이 강하고 친핵성이 강하다.합성 시 유기석소 시약의 가장 일반적인 용도에는 친핵체, 탈양성자의 강력한 염기, 중합 개시제 및 기타 유기금속 화합물의 제조를 위한 시작 물질이 포함된다.
친핵체로서
탄화 반응
친핵체로서 유기석소 시약은 탄소-탄소 이중 또는 삼중 결합에 탄소-리튬 결합이 추가되어 새로운 유기석소 [32]종을 형성한다.이 반응은 유기석소 화합물의 가장 널리 사용되는 반응이다.음이온 중합공정에서 탄화석화가 중요하며, n-부틸리튬을 촉매로 사용하여 스티렌, 부타디엔, 이소프렌 또는 이들의 [33][34]혼합물의 중합을 개시한다.
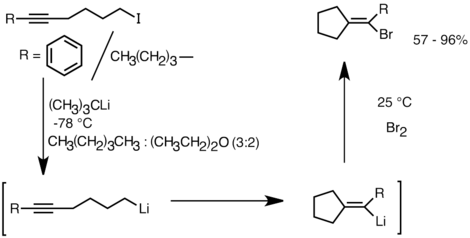
이 반응성을 이용하는 또 다른 응용 분야는 분자 내 [32]탄화합물에 의한 탄소환 화합물 및 복소환 화합물의 형성이다.음이온환화의 한 형태로서 분자 내 탄화 반응은 래디칼환화보다 몇 가지 이점을 제공한다.첫째, 제품 고리형 유기석종은 전자 친필과 반응할 수 있지만, 대응하는 구조의 라디칼 중간체를 포착하는 것은 어려운 경우가 많다.둘째, 음이온환화는 래디칼환화보다 레지오 및 입체환화(특히 5헥세닐리튬의 경우)가 더 특이적이다.분자내 탄화합물은 알킬-, 비닐리튬을 삼중결합 및 모노알킬 치환 이중결합에 첨가할 수 있게 한다.아릴리튬은 또한 5원환을 형성하면 첨가될 수 있다.분자 내 탄화수소의 한계는 중간 고리형 유기석소가 종종 고리개방을 [32]겪는 경향이 있기 때문에 3원 또는 4원 고리형성의 어려움을 포함한다.분자내 탄화반응의 예를 다음에 제시하겠습니다.리튬-할로겐 교환에서 파생된 리튬 종은 5-exo-trig 고리 폐쇄를 통해 비닐리튬을 형성하기 위해 순환되었다.비닐리튬 종은 전자 친필과 더욱 반응하여 기능화된 시클로펜틸리덴 [35]화합물을 생성한다.
카르보닐 화합물 첨가
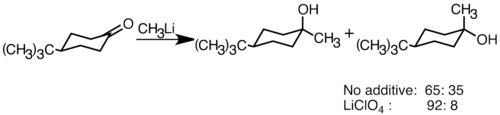
친핵성 유기석 시약은 친전자성 카르보닐 이중 결합에 탄소-탄소 결합을 형성할 수 있다.알데히드나 케톤과 반응하여 알코올을 만들 수 있습니다.첨가 과정은 주로 극성 첨가를 통해 진행되는데, 극성 첨가는 적도 방향에서 친핵성 유기석소를 공격하여 축방향 [36]알코올을 생성한다.LiClO4 등의 리튬염을 첨가하면 [37]반응의 입체선택성을 향상시킬 수 있다.
케톤이 입체적으로 저해될 경우,[36] Gridnard 시약을 사용하면 첨가 대신 카르보닐기가 환원되는 경우가 많습니다.그러나 알킬리튬 시약은 케톤을 감소시킬 가능성이 낮으며 대체 알코올을 [38]합성하는 데 사용될 수 있습니다.다음은 3차 알코올을 생성하기 위해 아다만톤에 [39]에틸리튬을 첨가한 예입니다.
유기석 시약은 또한 카르본산과 반응하여 [36]케톤을 형성하는 능력에서 그리냐드 시약보다 우수합니다.이 반응은 유기석 시약 첨가량을 신중하게 조절하거나 염화트리메틸실릴을 사용하여 과잉 리튬 시약을 [40]담금질함으로써 최적화될 수 있습니다.케톤을 합성하는 보다 일반적인 방법은 와인렙 아미드(N-메톡시-N-메틸 아미드)에 유기석소 시약을 추가하는 것입니다.이 반응은 N-메톡시 산소와 카르보닐 산소 사이의 리튬 이온 킬레이트 때문에 유기석 시약이 과도하게 사용될 때 케톤을 제공하는데, 이는 산성으로 [41]인해 붕괴되는 사면체 중간체를 형성한다.
유기석소 시약은 또한 작업 후 이산화탄소와 반응하여 카르본산을 [42]형성합니다.
친핵첨가가 2개소 가능한 에논기판의 경우(카르보닐카본에 1,2개소 또는 β카본에 1,4개소 첨가), 대부분의 고반응성 유기석소종은 1,2개소를 선호하지만 유기석소 시약이 공역첨가를 받도록 촉진하는 방법은 여러 가지가 있다.첫째, 1,4 부가물은 열역학적으로 더 유리한 종일 가능성이 높기 때문에 균등화(두 제품의 이성화)를 통해 켤레 첨가를 달성할 수 있으며, 특히 리튬 친핵체가 약하고 1.2 부가 가역성이 있는 경우에는 더욱 그러하다.둘째, 이 반응에 공여 리간드를 첨가함으로써 1,4개의 켤레 첨가를 선호하는 헤테로 원자 안정화 리튬종을 형성한다.하나의 예에서 용매에 저준위 HMPA를 첨가하는 것이 1,4 첨가제를 선호한다.공여배위자가 없는 경우 리튬 양이온은 산소 원자에 밀접하게 배위되지만, 리튬 양이온이 HMPA에 의해 용해되면 카르보닐 산소와 리튬 이온의 배위성이 약해진다.이 방법은 일반적으로 알킬 및 아릴리튬 [43][44]시약의 위치선택성에 영향을 미칠 수 없다.
유기석 시약은 또한 종종 키랄 배위자의 존재 하에서 카르보닐 및 그 유도체에 에난티오 선택적 구핵성 첨가를 수행할 수 있다.이 반응성은 제약 화합물의 산업 합성물에 광범위하게 적용된다.예를 들어 HIV 역전사효소 억제제인 에파비렌즈의 Merck와 Dupont 합성이다.프로키랄케톤에 아세틸화리튬을 첨가하여 키랄알코올생성물을 얻는다.활성반응 중간체의 구조는 용액 상태의 NMR 스펙트럼 분석 연구와 고체 상태의 X선 결정학으로 입방체 2:2 4량자로 [45]결정되었다.
S2형N 반응
유기석소 시약은 친핵체 역할을 하며 알킬 또는 [46]할로겐화알릴과 S2형N 반응을 할 수 있다.알킬화에서 그리냐르 시약보다 반응성이 높은 것으로 간주되지만 래디칼 반응 또는 금속-할로겐 교환과 같은 경쟁적인 부작용으로 인해 여전히 사용이 제한적이다.알킬레이션에 사용되는 대부분의 유기석소 시약은 헤테로 원자 안정화,[6] 아릴 또는 아릴리튬 시약과 같이 안정성이 높고 염기성이 낮으며 응집력이 낮다.HMPA는 반응 속도와 제품 수율을 증가시키는 것으로 나타났으며, 아릴리튬 시약의 반응성은 종종 칼륨 [36]알콕시드를 첨가함으로써 향상된다.유기석소 시약은 에폭시드로 친핵성 공격을 하여 알코올을 형성할 수도 있다.
베이스로서
유기석 시약은 광범위한 염기성을 제공합니다.3개의 약한 전자 공여 알킬기를 가진 tert-부틸리튬은 상업적으로 이용 가능한 가장 강력한 염기이다(pKa = 53).그 결과 -OH, -NH 및 -SH의 산성 양성자는 유기석소 시약의 존재 하에서 보호되는 경우가 많다.일반적으로 사용되는 리튬 염기는 n-부틸리튬과 리튬 디알킬아미드(LiNR)2와 같은 알킬리튬 종입니다.리튬디이소프로필아미드(LDA) 및 리튬비스(트리메틸실릴)아미드(LiHMDS)와 같이 부피가 큰 R기를 가진 시약들은 종종 친핵성 첨가를 위해 입체적으로 저해되며, 따라서 탈양성자에 대해 더 선택적이다.리튬디알킬아미드(LiNR)2는 에놀레이트 형성 및 알돌 [47]반응에 널리 사용된다.이러한 염기의 반응성과 선택성은 용제 및 기타 대향 이온의 영향을 받습니다.
금속화
암석화 또는 리튬-수소 교환이라고도 알려진 유기석소 시약과의 금속화는 유기석소 시약, 가장 일반적으로 알킬리튬이 양성자를 추출하여 새로운 유기석소 종을 형성할 때 달성됩니다.
-
(1)
일반적인 금속화 시약은 낙티움입니다.tert-부틸리튬과 sec-부틸리튬은 일반적으로 n-부틸리튬보다 반응성이 높고 선택성이 더 우수하지만,[47] 그것들은 또한 더 비싸고 다루기 어렵다.금속화는 다용도 유기석 시약을 준비하는 일반적인 방법입니다.금속화의 위치는 대부분 C-H 결합의 산도에 의해 제어된다.음이온의 전자밀도를 안정시키는 데 뛰어나기 때문에 전자수집단에 대한 위치α에서 암석화가 발생하는 경우가 많다.방향족 화합물 및 헤테로사이클에 대한 방향족 그룹은 위치선택적인 금속화 부위를 제공합니다. 방향족 오르토 금속화는 금속화 반응의 중요한 종류입니다.금속화 술폰, 아실기 및 α 금속화 아미드는 화학 합성의 중요한 중간체이다.알릴에테르와 알킬리튬 또는 LDA의 금속화에 의해 산소에 음이온α가 형성되어 2,3-Wittig 전위까지 진행할 수 있다.TMEDA 및 HMPA와 같은 공여 리간드를 첨가하면 금속화 속도를 높이고 기판 [48]범위를 넓힐 수 있다.키랄 유기석 시약은 비대칭 금속화를 [49]통해 접근할 수 있습니다.
방향성 오르토 금속화는 위치 특이적 치환 방향족 화합물의 합성에 중요한 도구이다.전자 친필을 사용한 중간 리튬 종의 석화와 후속 담금질에 대한 이러한 접근법은 위치 결정성이 높기 때문에 전자 친성 방향족 치환보다 더 나은 경우가 많다.이 반응은 α 위치에 있는 유기석소 시약에 의한 탈양성자를 통해 방향족 고리의 직접 금속화 그룹(DMG)으로 진행됩니다.DMG는 종종 루이스 염기성 헤테로 원자를 포함하고 루이스-산성 리튬 양이온과 배위할 수 있는 기능성 기이다.이것은 복합 유도 근접 효과를 발생시켜 α 위치에서 탈양성자를 유도하여 전자 친필과 더욱 반응할 수 있는 아릴리튬 종을 형성한다.가장 효과적인 DMG는 아미드, 카르바메이트, 술폰 및 술폰아미드입니다.그것들은 방향족 고리에 있는 알파-프로톤들의 산도를 증가시키는 강한 전자 인출 그룹입니다.2개의 DMG가 존재하는 경우 금속화는 종종 보다 강한 지시 그룹에 대해 직교적으로 발생하지만 혼합 생성물도 관찰됩니다.산성 양성자를 포함하는 다수의 헤테로사이클 또한 오르토메탈화를 겪을 수 있다.단, 알킬리튬이 탈양성자가 아닌 전자부족 헤테로사이클에 첨가하는 것이 관찰되었기 때문에 전자부족 헤테로사이클의 경우에는 LDA와 같은 리튬아미드염기가 일반적으로 사용된다.페로센과 같은 특정 전이 금속-아렌 복합체에서는 전이 금속이 아렌으로부터 전자 밀도를 끌어당겨 방향족 양성자를 더욱 산성으로 만들고, 오르소 금속화를 [50]할 준비가 되어 있다.
슈퍼파아제
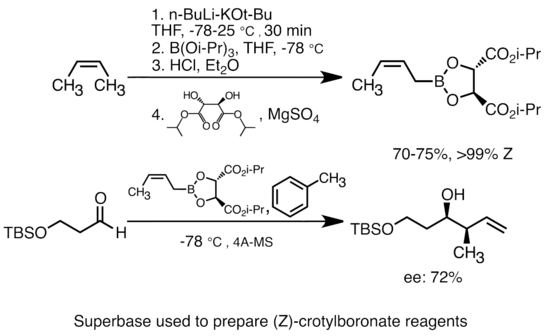
알킬리튬에 알콕시드칼륨을 첨가하면 유기석소종의 [51]염기성이 크게 높아진다.가장 일반적인 "슈퍼베이스"는 "LiCKOR" 시약으로 약칭되는 낙틸리튬에 KOtBu를 첨가하여 형성될 수 있습니다.이러한 "슈퍼베이스"는 반응성이 매우 높고 종종 입체선택성 시약입니다.아래 예에서 LiCKOR 염기는 금속화와 그에 따른 리튬-금속 [52]교환을 통해 입체특이적 크로틸보론산염을 생성한다.
비대칭 금속화
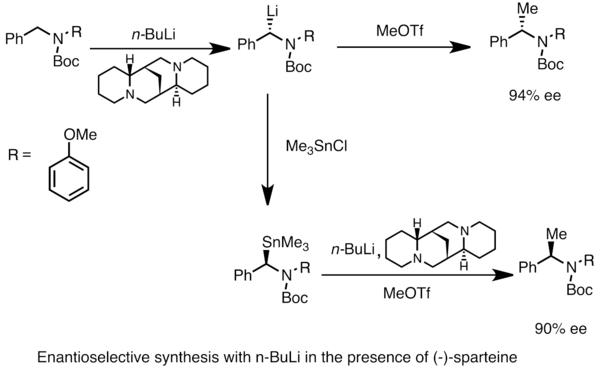
프로키랄 기질의 비대칭 금속화에 의해 에난티오렌실리튬종을 얻을 수 있다.비대칭 유도를 위해서는 (-)-스파르테인과 [49]같은 키랄 배위자가 있어야 한다.키랄 리튬 종의 에난티오머 비율은 종종 탈양성자 비율의 차이에 의해 영향을 받는다.아래 예에서 N-Boc-N-벤질아민을 (-)-스파르테인의 존재 하에서 n-부틸리튬으로 처리하면 높은 에난티오머 과잉의 1개의 에난티오머를 얻을 수 있다.트리메틸염화물을 사용한 트랜스메탈레이션은 반대되는 [53]에난티오머를 제공합니다.
에놀레이트 형성
카르보닐기에 대한 C-H결합α의 탈양성자에 의해 유기석소에 의해 에놀레이트 리튬이 형성된다.에놀산리튬은 알돌 축합 및 알킬화와 같은 탄소-탄소 결합 형성 반응에서 친핵체로 널리 사용된다.그들은 또한 실릴에놀에테르 형성에 있어 중요한 중간체이다.
리튬 에놀라트 형성은 카르보닐기에 대한 상대적으로 산성인 양성자 α(DMSO에서 pK = 20-28)가 유기 리시움 염기와 반응하는 산염기 반응으로 일반화될 수 있다.일반적으로 강력한 비핵염기, 특히 LDA, LiHMDS 및 LiTMP와 같은 리튬아미드가 사용된다.THF와 DMSO는 리튬 에놀라트 [54]반응의 일반적인 용제입니다.
에놀레이트 형성의 입체화학과 메커니즘은 화학계에서 많은 관심을 얻고 있다.스테릭 효과, 용매, 극성 첨가제 및 유기석기 염기의 종류와 같은 많은 요인들이 에놀라트 입체 화학의 결과에 영향을 미칩니다.에놀레이트 리튬의 입체화학의 선택성을 설명하고 예측하는 데 사용되는 많은 모델 중 하나가 아일랜드 [55]모델이다.
이 가정에서는 단량체 LDA가 카르보닐 기질과 반응하여 고리형 짐머만-트랙슬러형 전이 상태를 형성한다.(E)-에놀라트는 (Z)-에놀라트 전이 [54]상태에서 바람직하지 않은 신-펜탄 상호작용 때문에 바람직하다.
HMPA나 DMPU 등의 극성 첨가물을 첨가하면 (Z)에놀레이트의 형성에 유리하다.아일랜드 모델은 이러한 기증자 배위자가 리튬 양이온에 따라 조정되고, 그 결과 카르보닐 산소와 리튬의 상호작용이 감소하며, 전환 상태는 6원짜리 의자만큼 단단하게 결합되지 않는다고 주장한다.(Z) 에놀레이트의 비율은 LiHMDS 등의 부피가 큰 사이드 체인(side chain)을 가진 리튬 염기가 [54]사용되는 경우에도 증가합니다.그러나 이러한 첨가물이 어떻게 입체선택성을 역행하는지에 대한 메커니즘은 여전히 논의되고 있다.
아일랜드 모델은 리튬종을 전이 상태의 단량체로 묘사하기 때문에 몇 가지 문제가 있었다.실제로 다양한 리튬 응집체가 리튬 에놀레이트 용액에서 종종 관찰되며, 특정 기질, 용매 및 반응 조건에 따라 어떤 응집체가 [54]용액에서 실제로 반응하는 종인지를 판단하기가 어려울 수 있다.
리튬-할로겐 교환
리튬-할로겐 교환은 유기할라이드와 유기석소종 사이의 헤테로 원자 교환을 포함한다.
-
(2)
리튬-할로겐 교환은 새로운 유기석 시약을 준비하는 데 매우 유용합니다.리튬-할로겐 교환의 적용은 Parham 사이클라이제이션에 [56]의해 설명된다.
금속 변환
유기석 시약은 종종 다른 유기금속 화합물을 금속으로 변환하여 제조하는 데 사용됩니다.오르가노코퍼, 오르가노틴, 오르가노실리콘, 오르가노보론, 오르가노인, 오르가노세륨 및 오르가노황 화합물을 적절한 전자화일과 반응시켜 제조하는 경우가 많다.
-
(3)
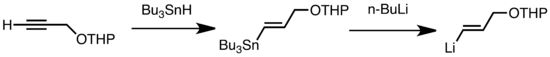
일반적인 금속 변환 유형으로는 저온에서 [47]빠른 Li/Sn, Li/Hg 및 Li/Te 교환이 있습니다.Li/Sn 교환의 장점은 생성된 n-BuSn3 부산물이 알킬리튬 [47]시약에 반응하지 않기 때문에 트리알킬스탄 전구체가 거의 부작용을 겪지 않는다는 것이다.다음 예에서는 말단 알킨의 하이드로스탠화에 의해 얻어지는 비닐스탄은 [57]n-BuLi와의 트랜스메탈화를 통해 비닐리튬을 형성한다.
유기석소는 [58]아연염과의 금속 교환을 통해 유기질 화합물을 제조하는 데도 사용될 수 있다.
알킬리튬종을 할로겐화구리(I)와 반응시킴으로써 리튬디오르가노쿠프레트를 형성할 수 있다.생성된 유기 업레이트는 일반적으로 유기 리슘 시약이나 그리냐드 [59]시약보다 알데히드 및 케톤에 대한 반응성이 낮습니다.
준비
대부분의 단순 알킬리튬 시약과 일반적인 리튬 아미드는 다양한 용제 및 농도로 시판됩니다.실험실에서 유기석 시약을 준비할 수도 있습니다.다음은 유기석 시약을 준비하는 몇 가지 일반적인 방법입니다.
리튬 금속과의 반응
금속 리튬을 사용한 할로겐화 알킬 환원은 단순한 알킬 및 아릴 유기석 [36]시약을 제공할 수 있습니다.
-
(4)
유기석 시약의 산업용 준비는 염화알킬을 나트륨 0.5~2% 함유 금속 리튬으로 처리함으로써 달성된다.변환은 발열성이 매우 높습니다.나트륨은 라디칼 경로를 시작하고 속도를 [60]증가시킨다.환원은 급진적인 경로를 통해 진행됩니다.아래는 리튬 [61]금속을 사용한 환원을 이용한 기능화 리튬 시약의 제조 예입니다.때로는 나프탈렌이나 4,4'-di-t-부틸비페닐(DTBB)과 같은 특정 촉매와의 반응에 미세한 분말 형태의 리튬 금속이 사용되기도 한다.리튬 금속으로 환원시켜 알킬리튬 시약을 생성할 수 있는 또 다른 기질은 황화물입니다.황화물의 환원은 α-리시오 에테르, 황화물 및 [62]실란과 같은 기능성 유기석소 시약의 형성에 유용하다.
금속화
유기석 시약을 조제하는 두 번째 방법은 금속화(리튬 수소 교환)이다.수소 원자의 상대적인 산도는 석화의 위치를 조절한다.
이것은 알킬리튬 시약을 조제하는 가장 일반적인 방법인데, 이는 sp 카본에 결합된 말단 수소가 매우 산성이고 쉽게 [36]탈양성자가 되기 때문이다.방향족 화합물에 대해서도 치환기의 [63]지향성 효과에 의해 석화의 위치가 결정된다.가장 효과적인 지시 치환기 중 일부는 알콕시, 아미도, 술폭시드, 술포닐이다.금속화는 종종 이러한 치환기에 직교하는 위치에서 발생합니다.헤테로아로마 화합물에서 금속화는 보통 헤테로아토믹과 [36][63]직교하는 위치에서 발생합니다.
리튬-할로겐 교환
리튬-할로겐 교환 참조(반응성 및 응용 프로그램)
유기석 시약을 조제하는 세 번째 방법은 리튬 할로겐 교환이다.
tert-butylithium 또는 n-butylithium은 리튬 할로겐 교환을 통해 새로운 유기석소를 생성하는 데 가장 일반적으로 사용되는 시약이다.리튬-할로겐 교환은 주로 요오드화 아릴과 요오드화 알케닐, 그리고 sp2 탄소를 가진 브롬화물을 대응하는 유기 리시움 화합물로 변환하는 데 사용된다.반응은 매우 빠르며 종종 -60 ~ -120 °[48]C에서 진행됩니다.
금속 변환
네 번째 유기석 시약 제조 방법은 금속 변환이다.이 방법은 비닐리튬을 조제할 때 사용할 수 있다.
샤피로 반응
샤피로 반응에서 강력한 알킬리튬 염기의 두 당량이 p-tosylhydrazone 화합물과 반응하여 올레핀 생성물을 생성한다.
처리
유기석소 화합물은 반응성이 매우 높은 종으로 특별한 취급 기술이 필요합니다.부식성, 인화성, 때로는 발화성(공기 또는 [64]습기에 노출되면 즉시 점화됨)이 있는 경우가 많습니다.알킬리튬 시약은 열분해되어 대응하는 알킬종과 [65]수소화리튬을 형성할 수도 있다.유기석소 시약은 일반적으로 10°C 미만으로 보관됩니다.반응은 에어프리 [64]기술을 사용하여 수행됩니다.알킬리튬 시약의 농도는 종종 [66][67][68]적정법에 의해 결정된다.
유기석소 시약은 에테르와 천천히 반응하지만 에테르와 반응하는 경우가 많습니다. [69]그럼에도 불구하고 에테르는 용매로 자주 사용됩니다.
| 용제 | 온도 | n-BuLi | s-BuLi | t-BuLi | MeLi | CH2=C(OET)-Li | CH2=C(SiMe3)-Li |
|---|---|---|---|---|---|---|---|
| THF | −40 °C | 338분 | |||||
| THF | −20 °C | 42분 | |||||
| THF | 0°C | 17시간 | |||||
| THF | 20 °C | 107분 | 15시간 이상 | 17시간 | |||
| THF | 35 °C | 10분 | |||||
| THF/TMEDA | −20 °C | 55시간 | |||||
| THF/TMEDA | 0°C | 340분 | |||||
| THF/TMEDA | 20 °C | 40분 | |||||
| 에테르 | −20 °C | 480분 | |||||
| 에테르 | 0°C | 61분 | |||||
| 에테르 | 20 °C | 153시간 | 30분 미만 | 17 d | |||
| 에테르 | 35 °C | 31시간 | |||||
| Ether/TMEDA | 20 °C | 603분 | |||||
| DME | −70 °C | 120분 | 11분 | ||||
| DME | −20 °C | 110분 | 2분 | 22분 | |||
| DME | 0°C | 6분 소요 |
「 」를 참조해 주세요.
레퍼런스
- ^ a b Zabicky, Jacob (2009). "Analytical aspects of organolithium compounds". PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. doi:10.1002/9780470682531.pat0304. ISBN 9780470682531.
- ^ Wu, G.; Huang, M. (2006). "Organolithium Reagents in Pharmaceutical Asymmetric Processes". Chem. Rev. 106 (7): 2596–2616. doi:10.1021/cr040694k. PMID 16836294.
- ^ Eisch, John J. (2002). "Henry Gilman: American Pioneer in the Rise of Organometallic Chemistry in Modern Science and Technology†". Organometallics. 21 (25): 5439–5463. doi:10.1021/om0109408. ISSN 0276-7333.
- ^ Rappoport, Z.; Marek, I., eds. (2004). The Chemistry of Organolithium Compounds (2 parts). John Wiley & Sons, Ltd. ISBN 978-0-470-84339-0.
- ^ a b c d e f g h i Stey, Thomas; Stalke, Dietmar (2009). "Lead structures in lithium organic chemistry". PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. doi:10.1002/9780470682531.pat0298. ISBN 9780470682531.
- ^ a b c d e f g h i j Reich, Hans J. (2013). "Role of Organolithium Aggregates and Mixed Aggregates in Organolithium Mechanisms". Chemical Reviews. 113 (9): 7130–7178. doi:10.1021/cr400187u. PMID 23941648.
- ^ a b c d e f g h i j Strohmann, C; et al. (2009). "Structure Formation Principles and Reactivity of Organolithium Compounds" (PDF). Chem. Eur. J. 15 (14): 3320–3334. doi:10.1002/chem.200900041. PMID 19260001.
- ^ a b Jemmis, E.D.; Gopakumar, G. (2009). "Theoretical studies in organolithium chemistry". PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. doi:10.1002/9780470682531.pat0297. ISBN 9780470682531.
- ^ a b Streiwieser, A. (2009). "Perspectives on Computational Organic Chemistry". J. Org. Chem. 74 (12): 4433–4446. doi:10.1021/jo900497s. PMC 2728082. PMID 19518150.
- ^ a b Bickelhaupt, F. M.; et al. (2006). "Covalency in Highly Polar Bonds. Structure and Bonding of Methylalkalimetal Oligomers (CH3M)n (M = Li−Rb; n = 1, 4)". J. Chem. Theory Comput. 2 (4): 965–980. doi:10.1021/ct050333s. PMID 26633056.
- ^ Weiss, Erwin (November 1993). "Structures of Organo Alkali Metal Complexes and Related Compounds". Angewandte Chemie International Edition in English. 32 (11): 1501–1523. doi:10.1002/anie.199315013. ISSN 0570-0833.
- ^ Fraenkel, G.; Qiu, Fayang (1996). "Observation of a Partially Delocalized Allylic Lithium and the Dynamics of Its 1,3 Lithium Sigmatropic Shift". J. Am. Chem. Soc. 118 (24): 5828–5829. doi:10.1021/ja960440j.
- ^ Fraenkel. G; et al. (1995). "The carbon-lithium bond in monomeric arllithium: Dynamics of exchange, relaxation and rotation". J. Am. Chem. Soc. 117 (23): 6300–6307. doi:10.1021/ja00128a020.
- ^ Power, P.P; Hope H. (1983). "Isolation and crystal structures of the halide-free and halide-rich phenyllithium etherate complexes [(PhLi.Et2O)4] and [(PhLi.Et2O)3.LiBr]". JACS. 105 (16): 5320–5324. doi:10.1021/ja00354a022.
- ^ a b Williard, P. G.; Salvino, J. M. (1993). "Synthesis, isolation, and structure of an LDA-THF complex". Journal of Organic Chemistry. 58 (1): 1–3. doi:10.1021/jo00053a001.
- ^ Hilmersson, Goran; Granander, Johan (2009). "Structure and dynamics of chiral lithium amides". PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. doi:10.1002/9780470682531.pat0342. ISBN 9780470682531.
- ^ a b Collum, D.B.; et al. (2007). "Lithium Diisopropylamide: Solution Kinetics and Implications for Organic Synthesis". Angew. Chem. Int. Ed. 49 (17): 3002–3017. doi:10.1002/anie.200603038. PMID 17387670.
- ^ Sekiguchi, Akira.; et al. (2000). "Lithiosilanes and their application to the synthesis of polysilane dendrimers". Coord. Chem. Rev. 210: 11–45. doi:10.1016/S0010-8545(00)00315-5.
- ^ Collum, D. B.; et al. (2008). "Solution Structures of Lithium Enolates, Phenolates, Carboxylates, and Alkoxides in the Presence of N,N,N′,N′-Tetramethylethylenediamine: A Prevalence of Cyclic Dimers". J. Org. Chem. 73 (19): 7743–7747. doi:10.1021/jo801532d. PMC 2636848. PMID 18781812.
- ^ Reich, H. J.; et al. (1998). "Aggregation and reactivity of phenyllithium solutions". J. Am. Chem. Soc. 120 (29): 7201–7210. doi:10.1021/ja980684z.
- ^ McGarrity, J. F.; Ogle, C.A. (1985). "High-field proton NMR study of the aggregation and complexation of n-butyllithium in tetrahydrofuran". J. Am. Chem. Soc. 107 (7): 1805–1810. doi:10.1021/ja00293a001.
- ^ a b Reich, H. J. (2012). "What's going on with these lithium reagents". J. Org. Chem. 77 (13): 5471–5491. doi:10.1021/jo3005155. PMID 22594379.
- ^ Wardell, J.L. (1982). "Chapter 2". In Wilinson, G.; Stone, F. G. A.; Abel, E. W. (eds.). Comprehensive Organometallic Chemistry, Vol. 1 (1st ed.). New York: Pergamon. ISBN 978-0080406084.
- ^ Strohmann, C.; Gessner, V.H. (2008). "Crystal Structures of n-BuLi Adducts with (R,R)-TMCDA and the Consequences for the Deprotonation of Benzene". J. Am. Chem. Soc. 130 (35): 11719–11725. doi:10.1021/ja8017187. PMID 18686951.
- ^ Collum, D. B.; et al. (2007). "Lithium Diisopropylamide: Solution Kinetics and Implications for Organic Synthesis". Angew. Chem. Int. Ed. 46 (17): 3002–3017. doi:10.1002/anie.200603038. PMID 17387670.
- ^ a b Chalk, A.J; Hoogeboom, T.J (1968). "Ring metalation of toluene by butyllithium in the presence of N,N,N′,N′-tetramethylethylenediamine". J. Organomet. Chem. 11: 615–618. doi:10.1016/0022-328x(68)80091-9.
- ^ a b Reich, H.J; Green, D.P (1989). "Spectroscopic and Reactivity Studies of Lithium Reagent - HMPA Complexes". JACS. 111 (23): 8729–8731. doi:10.1021/ja00205a030.
- ^ Williard, P.G; Nichols, M.A (1993). "Solid-state structures of n-butyllithium-TMEDA, -THF, and -DME complexes". JACS. 115 (4): 1568–1572. doi:10.1021/ja00057a050.
- ^ Collum, D.B. (1992). "Is N,N,N,N-Tetramethylethylenediamine a Good Ligand for Lithium?". Acc. Chem. Res. 25 (10): 448–454. doi:10.1021/ar00022a003.
- ^ Bernstein, M.P.; Collum, D.B. (1993). "Solvent- and substrate-dependent rates of imine metalations by lithium diisopropylamide: understanding the mechanisms underlying krel". J. Am. Chem. Soc. 115 (18): 8008–8010. doi:10.1021/ja00071a011.
- ^ Seebach, D (1988). "Structure and Reactivity of Lithium Enolates. From Pinacolone to Selective C-Alkylations of Peptides. Difficulties and Opportunities Afforded by Complex Structures" (PDF). Angew. Chem. Int. Ed. 27 (12): 1624–1654. doi:10.1002/anie.198816241.
- ^ a b c Fananas, Francisco; Sanz, Roberto (2009). "Intramolecular carbolithiation reactions". PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. doi:10.1002/9780470682531.pat0341. ISBN 9780470682531.
- ^ Heinz-Dieter Brandt, Wolfgang Nentwig1, Nicola Rooney, Ronald T. LaFlair, Ute U. Wolf, John Duffy, Judit E.Ulmann's Encyclopedia of Industrial Chemistry, 2011, Wiley-VCH, Mark Drewitt, Stephan Glander "고무, 5. Solution Rubbers" (고무, 5. 솔루션 고무)doi: 10.1002/14356007.o23_o02
- ^ Baskaran, D.; Müller, A.H. (2010). "Anionic Vinyl Polymerization". Controlled and living polymerizations: From mechanisms to applications. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. doi:10.1002/9783527629091.ch1. ISBN 9783527629091.
- ^ Bailey, W.F.; et al. (1989). "Preparation and facile cyclization of 5-alkyn-1-yllithiums". Tetrahedron Lett. 30 (30): 3901–3904. doi:10.1016/S0040-4039(00)99279-7.
- ^ a b c d e f g Carey, Francis A. (2007). "Organometallic compounds of Group I and II metals". Advanced Organic Chemistry: Reaction and Synthesis Pt. B (Kindle ed.). Springer. ISBN 978-0-387-44899-2.
- ^ Ashby, E.C.; Noding, S.R. (1979). "The effects of added salts on the stereoselectivity and rate of organometallic compound addition to ketones". J. Org. Chem. 44 (24): 4371–4377. doi:10.1021/jo01338a026.
- ^ Yamataka, Hiroshi (2009). "Addition of organolithium reagents to double bonds". PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. doi:10.1002/9780470682531.pat0310. ISBN 9780470682531.
- ^ Landa, S.; et al. (1967). "Über adamantan und dessen derivate IX. In 2-stellung substituierte derivate". Collection of Czechoslovak Chemical Communications. 72 (2): 570–575. doi:10.1135/cccc19670570.
- ^ Rubottom, G.M.; Kim, C (1983). "Preparation of methyl ketones by the sequential treatment of carboxylic acids with methyllithium and chlorotrimethylsilane". J. Org. Chem. 48 (9): 1550–1552. doi:10.1021/jo00157a038.
- ^ Zadel, G.; Breitmaier, E. (1992). "A One-Pot Synthesis of Ketones and Aldehydes from Carbon Dioxide and Organolithium Compounds". Angew. Chem. Int. Ed. 31 (8): 1035–1036. doi:10.1002/anie.199210351.
- ^ Ronald, R.C. (1975). "Methoxymethyl ethers. An activating group for rapid and regioselective metalation". Tetrahedron Lett. 16 (46): 3973–3974. doi:10.1016/S0040-4039(00)91212-7.
- ^ Hunt, D.A. (1989). "Michael addition of organolithium compounds. A Review". Org. Prep. Proc. Int. 21 (6): 705–749. doi:10.1080/00304948909356219.
- ^ Reich, H. J.; Sikorski, W. H. (1999). "Regioselectivity of Addition of Organolithium Reagents to Enones: The Role of HMPA". J. Org. Chem. 64 (1): 14–15. doi:10.1021/jo981765g. PMID 11674078.
- ^ Collum, D.B.; et al. (2001). "NMR Spectroscopic Investigations of Mixed Aggregates Underlying Highly Enantioselective 1,2-Additions of Lithium Cyclopropylacetylide to Quinazolinones". J. Am. Chem. Soc. 123 (37): 9135–9143. doi:10.1021/ja0105616. PMID 11552822.
- ^ Sommmer, L.H.; Korte, W. D. (1970). "Stereospecific coupling reactions between organolithium reagents and secondary halides". J. Org. Chem. 35: 22–25. doi:10.1021/jo00826a006.
- ^ a b c d 유기석 시약 라이히, H.J. 2002 https://organicchemistrydata.org/hansreich/resources/organolithium/organolithium_data/orgli-primer.pdf
- ^ a b 유기석소 시약 및 중간물 Leroux.F, Schlosser의 준비.M., Zohar.E., 마렉.I., Wiley, New York.2004. ISBN 978-0-470-84339-0
- ^ a b Hoppe, Dieter; Christoph, Guido (2009). "Asymmetric deprotonation with alkyllithium– (−)-sparteine". PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. doi:10.1002/9780470682531.pat0313. ISBN 9780470682531.
- ^ Clayden, Jonathan (2009). "Directed metallization of aromatic compounds". PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. doi:10.1002/9780470682531.pat0306. ISBN 9780470682531.
- ^ Schlosser, M (1988). "Superbases for organic synthesis". Pure Appl. Chem. 60 (11): 1627–1634. doi:10.1351/pac198860111627.
- ^ Roush, W.R.; et al. (1988). "Enantioselective synthesis using diisopropyl tartrate modified (E)- and (Z)-crotylboronates: Reactions with achiral aldehydes". Tetrahedron Lett. 29 (44): 5579–5582. doi:10.1016/S0040-4039(00)80816-3.
- ^ Park, Y.S.; et al. (1996). "(−)-Sparteine-Mediated α-Lithiation of N-Boc-N-(p-methoxyphenyl)benzylamine: Enantioselective Syntheses of (S) and (R) Mono- and Disubstituted N-Boc-benzylamines". J. Am. Chem. Soc. 118 (15): 3757–3758. doi:10.1021/ja9538804.
- ^ a b c d Valnot, Jean-Yves; Maddaluno, Jacques (2009). "Aspects of the synthesis, structure and reactivity of lithium enolates". PATAI'S Chemistry of Functional Groups. John Wiley & Sons, Ltd. doi:10.1002/9780470682531.pat0345. ISBN 9780470682531.
- ^ Ireland. R. E.; et al. (1976). "The ester enolate Claisen rearrangement. Stereochemical control through stereoselective enolate formation". J. Am. Chem. Soc. 98 (10): 2868–2877. doi:10.1021/ja00426a033.
- ^ Parham, W.P.; Bradsher, C.K. (1982). "Aromatic organolithium reagents bearing electrophilic groups. Preparation by halogen-lithium exchange". Acc. Chem. Res. 15 (10): 300–305. doi:10.1021/ar00082a001.
- ^ Corey, E.J.; Wollenberg, R.H. (1975). "Useful new organometallic reagents for the synthesis of allylic alcohols by nucleophilic vinylation". J. Org. Chem. 40 (15): 2265–2266. doi:10.1021/jo00903a037.
- ^ Reeder, M.R.; et al. (2003). "An Improved Method for the Palladium Cross-Coupling Reaction of Oxazol-2-ylzinc Derivatives with Aryl Bromides". Org. Process Res. Dev. 7 (5): 696–699. doi:10.1021/op034059c.
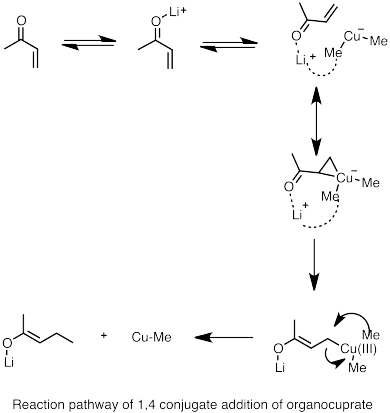
- ^ Nakamura, E.; et al. (1997). "Reaction Pathway of the Conjugate Addition of Lithium Organocuprate Clusters to Acrolein". J. Am. Chem. Soc. 119 (21): 4900–4910. doi:10.1021/ja964209h.
- ^ "Organometics in Organic Synthesis", Schloser, M., Ed, Wiley: New York, 1994.ISBN 0-471-93637-5
- ^ Si-Fodil, M.; et al. (1998). "Obtention of 2,2-(diethoxy) vinyl lithium and 2-methyl-4-ethoxy butadienyl lithium by arene-catalysed lithiation of the corresponding chloro derivatives. Synthetic applications". Tetrahedron Lett. 39 (49): 8975–8978. doi:10.1016/S0040-4039(98)02031-0.
- ^ Cohen, T; Bhupathy. M (1989). "Organoalkali compounds by radical anion induced reductive metalation of phenyl thioethers". Acc. Chem. Res. 22 (4): 152–161. doi:10.1021/ar00160a006.
- ^ a b Snieckus, V (1990). "Directed ortho metalation. Tertiary amide and O-carbamate directors in synthetic strategies for polysubstituted aromatics". Chem. Rev. 90 (6): 879–933. doi:10.1021/cr00104a001.
- ^ a b Schwindeman, James A.; Woltermann, Chris J.; Letchford, Robert J. (2002). "Safe handling of organolithium compounds in the laboratory". Chemical Health and Safety. 9 (3): 6–11. doi:10.1016/S1074-9098(02)00295-2. ISSN 1074-9098.
- ^ Gellert, H; Ziegler, K. (1950). "Organoalkali compounds. XVI. The thermal stability of lithium alkyls". Liebigs Ann. Chem. 567: 179–185. doi:10.1002/jlac.19505670110.
- ^ Juaristi, E.; Martínez-Richa, A.; García-Rivera, A.; Cruz-Sánchez, J. S. (1983). "Use of 4-Biphenylmethanol, 4-Biphenylacetic Acid and 4-Biphenylcarboxylic Acid/Triphenylmethane as Indicators in the Titration of Lithium Alkyls. Study of the Dianion of 4-Biphenylmethanol". The Journal of Organic Chemistry. 48 (15): 2603–2606. doi:10.1021/jo00163a038.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ "Titrating Soluble RM, R2NM and ROM Reagents" (PDF). Retrieved 2014-06-04.
- ^ "Methods for Standardizing Alkyllithium Reagents (literature through 2006)" (PDF). Retrieved 2014-06-04.
- ^ Stanetty, P.; Koller, H.; Mihovilovic, M. (1992). "Directed Ortho-Lithiation of Phenylcarbamic Acid 1,l-Dimethylethyl Ester (N-Boc-aniline). Revision and Improvements". J. Org. Chem. 57 (25): 6833–6837. doi:10.1021/jo00051a030.