금속 할로겐 교환
Metal–halogen exchange유기 금속 화학에서 금속-할로겐 교환은 유기 할로겐을 유기 금속 생성물로 변환하는 기본 반응이다.이 반응은 일반적으로 전기양극성 금속(Li, Na, Mg)과 유기염화물, 브롬화물 및 요오드화물의 사용을 포함한다.특히 유기석 화합물 제조에 금속-할로겐 교환을 사용하는 것이 잘 개발되었습니다.
리튬-할로겐 교환
리튬-할로겐 교환에는 유기석소 화합물과 관련된 반응과 리튬 금속과 관련된 반응의 두 종류가 고려될 수 있습니다.상업용 유기석소 화합물은 리튬과 유기 브롬화물 및 염화물의 이종(슬러리) 반응에 의해 생산됩니다.
- 2 Li + R-X → LiX + R-Li
종종 할로겐화리튬은 용해성 제품 안에 남습니다.
이 기사의 대부분은 프리폼된 유기 리시움 화합물의 균질한(단상) 반응에 관한 것이다.
- R-Li + R-X → R-X + R-Li
낙틸리튬은 일반적으로 사용된다.길만과 위티그는 1930년대 [1]후반에 독립적으로 이 방법을 발견했다.소금이 생성되지 않기 때문에 소금 메타제스 반응이 아닙니다.
리튬-할로겐 교환은 비닐, 아릴 및 1차 알킬리튬 시약을 준비하는 데 자주 사용됩니다.할로겐화비닐은 보통 이중결합의 [2]입체화학을 유지한 상태에서 리튬-할로겐 교환을 거친다.알콕실기나 관련된 킬레이트 기의 존재는 리튬-할로겐 [3]교환을 가속화한다.리튬 할로겐 교환은 일반적으로 빠른 반응입니다.이것은 보통 친핵성 첨가보다 빠르고 때때로 양성자 [4]전달 속도를 초과할 수 있다.
환율은 보통 I > Br > Cl 추세를 따릅니다.알킬 및 아릴플루오르화물은 일반적으로 유기석소 시약에 대해 반응하지 않는다.리튬-할로겐 교환은 동태적으로 제어되며, 교환 속도는 주로 유기석소 [5][3]시약의 카르바니온 중간체(sp2 > sp3 > sp)의 안정성에 의해 영향을 받는다.
메커니즘 및 범위
리튬-할로겐 [6]교환을 위한 두 가지 메커니즘이 제안되었다.제안된 경로 중 하나는 가역적인 "산염 복합체" 중간체를 생성하는 친핵성 메커니즘을 포함한다.판햄과 칼라브레즈는 TMEDA와 복합된 요오드화 [7]리튬비스(펜타플루오로페닐)를 결정화했다."아테이트 복합체"는 전자 친필과 반응하여 펜타플루오로페닐 요오드화물과 CHLi를65 [7]제공합니다.리튬종의 카르보니온이 [8]아릴할라이드상의 할로겐 원자를 공격하는 친핵성 경로를 뒷받침하는 많은 역학 연구도 있다.또 다른 제안된 메커니즘은 라디칼 생성에 따른 단일 전자 전달을 포함한다.2차 [9][6]및 3차 알킬리튬과 할로겐화 알킬의 반응에서 EPR 분광법에 의해 라디칼종이 검출되었다.리튬-할로겐 교환의 역학적 연구는 유기석소종의 집합체의 형성에 의해 복잡해진다.
기타 금속
- 마그네슘-할로겐 교환
그리냐드 시약은 미리 형성된 그리냐드 시약을 유기 할로겐화물로 처리하여 제조할 수 있습니다.이 방법은 Mg 전송이 많은 기능 그룹을 허용한다는 장점을 제공합니다.대표적인 반응에는 염화 이소프로필마그네슘과 브롬화 아릴 또는 [10]요오드화물이 포함됩니다.
- i-PrMgCl + ArCl → i-PrCl + ArMgCl
- ArBr + Li [ MgBu3 ]→ ArMgBu2 + BuBr
- 아연-할로겐 교환
아연-할로겐 교환:[12]
- LiBuZn3 + R-I → Li[R-ZnBu2] + BuI
적용들
유기 [13]합성에서 몇 가지 예를 찾을 수 있다.
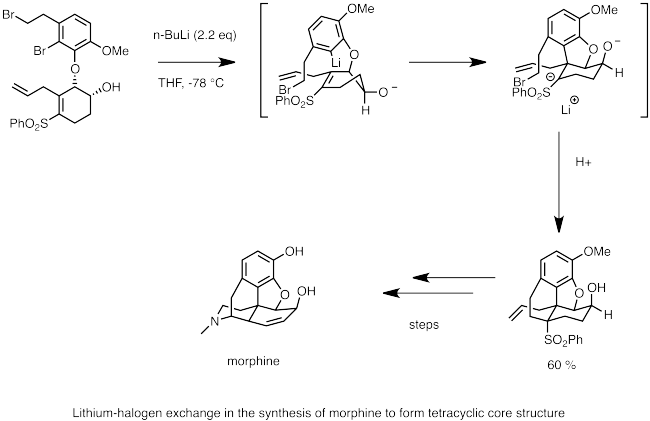
리튬-할로겐 교환 아래는 모르핀 합성의 단계이다.여기서 n-부틸리튬은 브롬화물과의 리튬-할로겐 교환에 사용된다.친핵성 카르보니온 중심은 인접한 술폰기에 의해 안정화 된 음이온을 생성하면서 이중 결합에 대한 탄산화 과정을 빠르게 거친다.음이온에 의한 분자내 S2N 반응은 [14]모르핀의 고리뼈를 형성한다.
리튬-할로겐 교환은 파르함 [15]환화의 중요한 부분입니다.이 반응에서 할로겐화 아릴(일반적으로 요오드화물 또는 브롬화물)은 유기석소와 교환하여 석화된 아렌 종을 형성합니다.아렌이 전기친균성 부분을 가진 측쇄를 가지고 있으면 리튬에 부착된 카르보니언은 분자 내 친핵성 공격을 하고 순환한다.이 반응은 헤테로사이클 [16]형성에 유용한 전략이다.아래 예에서는 이소시아네이트의 환화에 Parham cyclization을 사용하여 이소인돌리논을 형성한 후 니트로네이트로 변환하였다.니트론 종은 라디칼과 더 반응하며 생물학적 라디칼 [17]과정을 연구하기 위한 "스핀 트랩"으로 사용될 수 있습니다.
레퍼런스
- ^ Gilman, Henry; Langham, Wright; Jacoby, Arthur L. (1939). "Metalation as a Side Reaction in the Preparation of Organolithium Compounds". Journal of the American Chemical Society. 61 (1): 106–109. doi:10.1021/ja01870a036. ISSN 0002-7863.
- ^ Seebach, D.; Neumann H. (1976). "Stereospecific preparation of terminal vinyllithium derivatives by Br/Li-exchange with t-butyllithium". Tetrahedron Lett. 17 (52): 4839–4842. doi:10.1016/s0040-4039(00)78926-x.
- ^ a b Leroux F., Schlosser M., Zohar E., Marek I. (2004). The Preparation of Organolithium Reagents and Intermediates. New York: Wiley. ISBN 978-0-470-84339-0.
{{cite book}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Bailey, W. F.; et al. (1986). "Metal—halogen interchange between t-butyllithium and 1-iodo-5-hexenes provides no evidence for single-electron transfer". Tetrahedron Lett. 27 (17): 1861–1864. doi:10.1016/s0040-4039(00)84395-6.
- ^ Carey, Francis A. (2007). "Organometallic compounds of Group I and II metals". Advanced Organic Chemistry: Reaction and Synthesis Pt. B (Kindle ed.). Springer. ISBN 978-0-387-44899-2.
- ^ a b Bailey, W. F.; Patricia, J. F. (1988). "The mechanism of the lithium–halogen Interchange reaction: a review of the literature". J. Organomet. Chem. 352 (1–2): 1–46. doi:10.1016/0022-328X(88)83017-1.
- ^ a b Farnham, W. B.; Calabrese, J. C. (1986). "Novel hypervalent (10-I-2) iodine structures". J. Am. Chem. Soc. 108 (9): 2449–2451. doi:10.1021/ja00269a055. PMID 22175602.
- ^ Rogers, H. R.; Houk, J. (1982). "Preliminary studies of the mechanism of metal-halogen exchange. The kinetics of reaction of n-butyllithium with substituted bromobenzenes in hexane solution". J. Am. Chem. Soc. 104 (2): 522–525. doi:10.1021/ja00366a024.
- ^ Fischer, H. (1969). "Electron spin resonance of transient alkyl radicals during alkyllithium-alkyl halide reactions". J. Phys. Chem. 73 (11): 3834–3838. doi:10.1021/j100845a044.
- ^ Knochel, P.; Dohle, W.; Gommermann, N.; Kneisel, F. F.; Kopp, F.; Korn, T.; Sapountzis, I.; Vu, V. A. (2003). "Highly Functionalized Organomagnesium Reagents Prepared through Halogen–Metal Exchange". Angewandte Chemie International Edition. 42 (36): 4302–4320. doi:10.1002/anie.200300579. PMID 14502700.
- ^ Arredondo, Juan D.; Li, Hongmei; Balsells, Jaume (2012). "Preparation of t-Butyl-3-Bromo-5-Formylbenzoate Through Selective Metal-Halogen Exchange Reactions". Organic Syntheses. 89: 460. doi:10.15227/orgsyn.089.0460.
- ^ Balkenhohl, Moritz; Knochel, Paul (2020). "Recent Advances of the Halogen–Zinc Exchange Reaction". Chemistry – A European Journal. 26 (17): 3688–3697. doi:10.1002/chem.201904794. PMC 7155102. PMID 31742792.
- ^ Adam P. Smith, Scott A. Savage, J. Christopher Love, Cassandra L. Fraser (2002). "Synthesis of 4-, 5-, and 6-methyl-2,2'-bipyridine by a Negishi Cross-coupling Strategy: 5-methyl-2,2'-bipyridine". Org. Synth. 78: 51. doi:10.15227/orgsyn.078.0051.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Toth, J. E.; Hamann, P. R.; Fuchs, P. L. (1988). "Studies culminating in the total synthesis of (dl)-morphine". J. Org. Chem. 53 (20): 4694–4708. doi:10.1021/jo00255a008.
- ^ Parham, W. P.; Bradsher, C. K. (1982). "Aromatic organolithium reagents bearing electrophilic groups. Preparation by halogen–lithium exchange". Acc. Chem. Res. 15 (10): 300–305. doi:10.1021/ar00082a001.
- ^ Sotomayor, N.; Lete, E. (2003). "Aryl and Heteroaryllithium Compounds by Metal–Halogen Exchange. Synthesis of Carbocyclic and Heterocyclic Systems". Curr. Org. Chem. 7 (3): 275–300. doi:10.2174/1385272033372987.
- ^ Quin, C.; et al. (2009). "Synthesis of a mitochondria-targeted spin trap using a novel Parham-type cyclization". Tetrahedron. 65 (39): 8154–8160. doi:10.1016/j.tet.2009.07.081. PMC 2767131. PMID 19888470.