헥사메틸인스포라미드
Hexamethylphosphoramide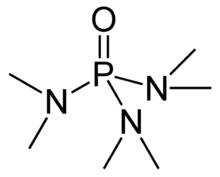 | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 헥사메틸인산삼합체[1] | |
| 기타 이름 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐벨 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.010.595 |
| 케그 | |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C6H18N3OP | |
| 어금질량 | 179.20 g/190 |
| 외관 | 투명 무색의 액체[2] |
| 냄새 | 향기롭고 순한 아민[2] 같은 |
| 밀도 | 1.03 g/cm3 |
| 녹는점 | 7.20°C(44.96°F, 280.35K) |
| 비등점 | 232.5°C(450.5°F, 505.6K) CRC[3] |
| 그릇된[2] | |
| 증기압 | 20°C에서[2] 0.03mmHg(4.0Pa) |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | 의심 발암[2] 물질 |
| GHS 라벨 표시: | |
 | |
| 위험 | |
| H340, H350 | |
| P201, P202, P281, P308+P313, P405, P501 | |
| 플래시 포인트 | 104.4°C(219.9°F, 377.5K) |
| NIOSH(미국 건강 노출 제한): | |
PEL(허용) | 없는[2] |
REL(권장) | CA[2] |
IDLH(즉시 위험) | Ca [N.D.][2] |
| 안전 데이터 시트(SDS) | 옥스퍼드 MSDS |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
헥사메틸인스포라미드는 흔히 HMPA라고 약칭하며 [(CH3)2N]3PO라는 공식을 가진 인포라마이드(인산 아미드)이다. 이 무색의 액체는 유기합성에 유용한 시약이다.
구조 및 반응도
HMPA는 고도로 기초적인 3차 인산염 헥사메틸인산삼화(HMPT), P(NMe2)의 산화물이다.3 다른 인산 산화물(트리페닐인산화물 등)과 마찬가지로 분자는 4면체 코어와 극성이 높은 P=O 결합을 가지며, 산소 원자에 상당한 음전하가 존재한다.
질소-인산 결합을 포함하는 화합물은 일반적으로 염산에 의해 분해되어 양성자 아민과 인산염을 형성한다.
그것은 몇 시간 동안 안정성이 있는 푸른 용액을 형성하는 알칼리 금속을 용해한다.[4] 이러한 푸른 용액에는 용융 전자가 존재한다.[5]
적용들
HMPA는 중합체, 가스, 유기농 화합물용 특수 용매다. 부틸리튬 등 리튬기반의 과점자를 분해해 석회반응의 선택성을 향상시킨다. HMPA는 선택적으로 양이온을 용해하기 때문에, 그렇지 않으면 더 많은 음이온을 발생시킴으로써 S2N 반응을 더 느리게 가속화한다. HMPA의 기본 질소 중심은 Li와+ 강하게 조응한다.[6]
HMPA는 과산화물 몰리브데넘 콤플렉스에 기초한 유용한 시약에 들어 있는 리간드로, 예를 들어 MoO(O2)(2HMPA)(HO2)는 유기합성에서 산화제로 사용된다.[7]
대체 시약
황산화 디메틸은 코솔벤트로 HMPA 대신 종종 사용될 수 있다. 둘 다 강력한 수소 결합 수용기로, 그들의 산소 원자는 금속을 결합한다. HMPA의 다른 대안으로는 N,N′-테트라알킬루레아 DMPU(디메틸프로필렌유레아)[8][9] 또는 DMI(1,3-디메틸-2-이미다졸리돈)가 있다.[10] 트리피롤리딘인산삼화(TPPA)는 사마륨 디오다이오드[11](diiodide)로 환원되는 HMPA의 좋은 대체 시약이며 사마륨 케틸스와 관련된 많은 반응에 대한 루이스 베이스 첨가제라고 보고되었다.[12]
독성
HMPA는 가벼운 독성일 뿐 쥐에게 암을 유발하는 것으로 밝혀졌다.[6] HMPA는 염산의 작용에 의해 분해될 수 있다.
참조
- ^ a b "Front Matter". Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. pp. P001–P004. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ a b c d e f g h NIOSH Pocket Guide to Chemical Hazards. "#0321". National Institute for Occupational Safety and Health (NIOSH).
- ^ Haynes, William M. (2010). Handbook of Chemistry and Physics (91 ed.). Boca Raton, Florida, USA: CRC Press. p. 3-280. ISBN 978-1-43982077-3.
- ^ Luehrs, Dean C.; Kohut, John P. (1974). "Hexamethylphosphoramide solvates of alkali metal salts". Journal of Inorganic and Nuclear Chemistry. 36 (7): 1459–1460. doi:10.1016/0022-1902(74)80605-6.
- ^ Gremmo, Norberto; Randles, John E. B. (1974). "Solvated electrons in hexamethylphosphoramide. Part 1.—Conductivity of solutions of alkali metals". Journal of the Chemical Society, Faraday Transactions 1: Physical Chemistry in Condensed Phases. 70: 1480–1487. doi:10.1039/F19747001480.
- ^ a b Dykstra, R. R. (2001). "Hexamethylphosphoric Triamide". Hexamethylphosphoric Triamide. Encyclopedia of Reagents for Organic Synthesis. New York, NY: John Wiley & Sons. doi:10.1002/047084289X.rh020. ISBN 978-0471936237.
- ^ Dickman, Michael H.; Pope, Michael T. (1994). "Peroxo and Superoxo Complexes of Chromium, Molybdenum, and Tungsten". Chemical Reviews. 94 (3): 569–584. doi:10.1021/cr00027a002.
- ^ Mukhopadhyay, T.; Seebach, D. (1982). "Substitution of HMPT by the Cyclic Urea DMPU as a Cosolvent for highly Reactive Nucleophiles and Bases". Helvetica Chimica Acta. 65 (1): 385–391. doi:10.1002/hlca.19820650141.
- ^ Beck, A. K.; Seebach, D. (2001). "N,N′-Dimethylpropyleneurea". N,N′-Dimethylpropyleneurea. Encyclopedia of Reagents for Organic Synthesis. New York: John Wiley & Sons. doi:10.1002/047084289X.rd366. ISBN 978-0471936237.
- ^ Lo, Chi-Chu; Chao, Pei-Min (1990). "Replacement of carcinogenic solvent HMPA by DMI in insect sex pheromone synthesis". Journal of Chemical Ecology. 16 (12): 3245–3253. doi:10.1007/BF00982095. PMID 24263426. S2CID 9859086.
- ^ McDonald, Chriss E.; Ramsey, Jeremy D.; Sampsell, David G.; Butler, Julie A.; Cecchini, Michael R. (2010). "Tripyrrolidinophosphoric Acid Triamide as an Activator in Samarium Diiodide Reductions". Organic Letters. 12 (22): 5178–5181. doi:10.1021/ol102040s. PMID 20979412.
- ^ Berndt, Mathias; Hölemann, Alexandra; Niermann, André; Bentz, Christoph; Zimmer, Reinhold; Reissig, Hans-Ulrich (2012). "Replacement of HMPA in Samarium Diiodide Promoted Cyclizations and Reactions of Organolithium Compounds". European Journal of Organic Chemistry. 2012 (7): 1299–1302. doi:10.1002/ejoc.201101830. ISSN 1099-0690.
Tripyrrolidinophosphoric acid triamide (TPPA) can replace carcinogenic HMPA as a Lewis basic additive in many reactions involving samarium ketyls. In most cases, yields and selectivities of cyclizations of (het)aryl, alkenyl, and alkynyl ketones are similar.
외부 링크
- "Hexamethylphosphoramide CAS No. 680-31-9" (PDF). Report on Carcinogens (12th ed.). National Toxicology Program, Department of Health and Human Services. 2011.
- "Hexamethyl phosphoramide". NIOSH Pocket Guide to Chemical Hazards. Centers for Disease Control and Prevention, Department of Health and Human Services. 2011.
- Merck Index. Vol. 4761 (12th ed.).


