풀레렌
Fullerene| 에 관한 일련의 기사의 일부 |
| 나노 물질 |
|---|
 |
| 탄소 나노튜브 |
| 풀레렌즈 |
| 기타 나노 입자 |
| 나노구조재료 |
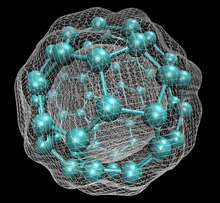
플라렌은 탄소 원자가 단일 결합과 이중 결합으로 연결된 분자로 이루어진 탄소 동소체로 5~7개의 원자의 융합 고리를 가진 폐쇄 또는 부분적으로 닫힌 망사를 형성한다.그 분자는 속이 빈 구체, 타원체, 튜브, 또는 많은 다른 모양과 크기일 수 있다.그래핀은 정육각형 고리로 이루어진 평평한 그물망으로, 이 과의 극단적인 구성원으로 볼 수 있다.
닫힌 망사 토폴로지를 가진 풀레렌은 비공식적으로 경험식n C(흔히 Cn으로 표기된다. 여기서 n은 탄소 원자의 수이다.단, n의 값에 따라서는 복수의 이성질체가 존재할 수 있습니다.
이 과의 이름은 가장 유명한 멤버인 벅민스터 풀러렌(C60)의 이름을 따 지어졌으며, 다시 벅민스터 풀러의 이름을 따왔다.닫힌 풀레렌(특히60 C)은 축구의 표준 공('축구')과 비슷하기 때문에 비공식적으로 버키볼(buckyball)이라고도 불린다.중첩된 닫힌 풀레렌은 버키 양파라고 명명되었습니다.원통형 플라렌은 카본 나노튜브 [1]또는 버키튜브라고도 불립니다.순수하거나 혼합된 플라렌의 부피가 큰 고체 형태를 [2]풀라이트라고 합니다.
풀레렌은 한동안 예견됐지만 1985년 우연히 합성된 후에야 자연과[3][4] [5][6]우주에서 검출됐다.플라렌의 발견은 이전에는 흑연, 다이아몬드, 그을음, 숯과 같은 비정질 탄소로 제한되었던 탄소의 알려진 동소체의 수를 크게 증가시켰다.그들은 화학 및 기술, 특히 재료 과학, 전자 및 나노 [7]기술 분야에서 집중적인 연구의 대상이 되어 왔습니다.
역사
예측 및 제한된 관측치
20면체
60
60 CH 케이지가 가능한 토폴로지 [8]구조로서 1965년에 언급되었다.오사와 에이지씨는 1970년에 [9]C의 존재를
60 예언했다.> 그는 코란눌렌 분자의 구조가 축구공 모양의 부분집합이라는 것을 알아채고, 완전한 공 모양도 존재할 수 있다는 가설을 세웠다.[10]일본 과학 저널은 그의 생각을 보도했지만, 유럽이나 미주에는 그 어떤 번역본도 도착하지 않았다.
또한 1970년에 R. W. 헨슨(당시 영국 원자력 연구 기관의)이 C 구조를
60 제안하고 모델을 만들었다.불행하게도, 그 새로운 형태의 탄소에 대한 증거는 그 당시에 매우 약했기 때문에, 그 제안은 회의적인 반응을 보였고, 결코 발표되지 않았다.그것은 [11][12]1999년에야 인정되었다.
1973년, 헨슨과는 독립적으로, 구소련의 과학자 그룹이 C의
60 안정성에 대한 양자 화학 분석을 하고 그것의 전자 구조를 계산했다.이 [13]논문은 1973년에 발표되었지만, 과학계는 이 이론적인 예측을 크게 중요시하지 않았다.
1980년경, 이지마 스미오는 카본 블랙의 전자 현미경 이미지로부터 C의 분자를
60 확인하였고, 거기서 C는 "버키 양파"[14] 구조의 입자의 핵을 형성하였다.
C의 검출
60
1985년, 서섹스 대학의 해롤드 크로토(Harold Kroto)가 제임스 R.와 함께 일했습니다. 라이스 대학의 히스, 숀 오브라이언, 로버트 컬, 리처드 스말리는 헬륨 대기에서 탄소를 증발시켜 만든 수티 잔류물에서 플라렌을 발견했다.제품의 질량 스펙트럼에서 이산 피크는 탄소 원자 60개 이상의 정확한 질량을 가진 분자와 일치하는 것으로 나타났다. 즉
60, C와 C
70.그 팀은 그들의 구조를 이제는 친숙한 "버키볼"[15]이라고 밝혔다.
"buckminsterfulleene"이라는 이름은 결국 발견자들이 미국인 건축가 Buckminster Fuller에 대한 경의를 표하기 위해 C를 위해
60 선택되었는데, 그가 대중화한 측지학적 돔과 구조가 모호하게 유사하기 때문입니다; 만약 그들이 완전한 구체로 확장된다면, 또한 20면체 대칭군을 [16]가질 것입니다."ene"의 끝은 탄소가 불포화되었고, 일반적인 네 개의 원자가 아닌 세 개의 다른 원자와만 연결되어 있다는 것을 나타내기 위해 선택되었습니다."fulerene"이라는 줄임말이 결국 온 가족에게 적용되게 되었다.
크로토, 컬, 스몰리는 이런 종류의 분자를 발견한 공로로 1996년 노벨 화학상을[17] 받았다.
추가 개발
크로토와 라이스 팀은 이미 [15]C 외에 다른60 플라렌을 발견했고, 그 후 몇 년 동안 그 목록은 훨씬 더 확대되었다.탄소 나노튜브는 1991년에 [18][19]처음 발견되어 합성되었다.
그들이 발견된 후, 극미량의 플라렌이 질퍽한 [20]불꽃과 [4]대기 중의 번개 방출에 의해 생성되는 것으로 밝혀졌다.1992년, 풀레렌은 러시아 [3]카렐리아에 있는 슝아이트라고 알려진 미네랄로이드 과에서 발견되었다.
제작 기술은 도널드 허프만, 볼프강 크래치머, 로웰 D를 포함한 많은 과학자들에 의해 개선되었다. 양, 그리고 콘스탄티노스 포스티로풀로스.[21]그들의 노력 덕분에 1990년에는 그램 크기의 플라렌 분말을 비교적 쉽게 생산할 수 있었다.플라렌 정화는 여전히 화학자들에게 어려운 과제이며, 플라렌 가격을 결정하는 것이 대부분이다.
2010년, 6500광년 떨어진 [5]별 주위를 둘러싼 우주 먼지 구름 속에서 NASA의 스피처 적외선 망원경에 의해 C와70 C의 스펙트럼60 신호가 관측되었다.크로토는 이렇게 말했다: "이 가장 흥미로운 돌파구는, 내가 오랫동안 의심했던 것처럼, 버키볼이 우리 [6]은하의 어두운 구석에서 태고적부터 존재해왔다는 설득력 있는 증거를 제공한다."천문학자 레티지아 스탕겔리니에 따르면, "외계에서 온 버키볼이 [22]지구상의 생명체에 씨앗을 제공했을 가능성이 있다."2019년 허블우주망원경을 통해 이들 [23][24]별 사이의 공간에서 이온화된60 C 분자가 검출되었다.
종류들
플라렌에는 닫힌 버키볼과 열린 원통형 [25]카본 나노튜브라는 두 가지 주요 종류가 있습니다.그러나 카본 나노버드와 같은 두 등급 사이에 혼성 구조가 존재한다. 즉, 반구형 메쉬로 덮인 나노튜브 또는 더 큰 "버키버드"로 덮인 나노튜브이다.
버키볼
벅민스터풀레렌
벅민스터풀레렌은 두 펜타곤이 모서리를 공유하지 않는 오각형과 육각형 고리를 포함하는 가장 작은 플라렌 분자입니다(펜타렌에서처럼 불안정할 수 있습니다).그을음에서 발견되는 경우가 많기 때문에 자연발생적인 측면에서도 가장 흔하다.
벅민스터풀레렌의 경험적 공식은
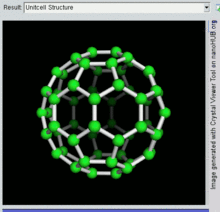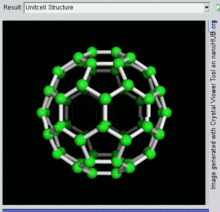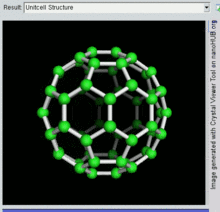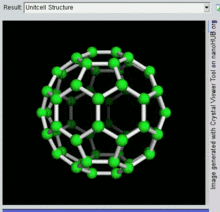
60 C이고 그 구조는 잘린 20개의 6각형과 12개의 5각형으로 만들어진 형태의 축구공과 유사하며, 각 다각형 정점에 탄소 원자가 있고 각 다각형 가장자리를 따라 결합한다.
벅민스터풀레렌 분자의 반데르발스 지름은 약 1.1나노미터(nm)[26]이다.벅민스터풀레렌 분자의 핵에서 핵 직경은 약 0.71 nm이다.
벅민스터풀레렌 분자는 두 개의 결합 길이를 가지고 있다.6:6 링 결합(2개의 육각형 사이)은 "이중 결합"으로 간주될 수 있으며 6:5 결합(6각형과 오각형 사이)보다 짧습니다.평균 결합 길이는 1.4Ω입니다.
기타 플라렌
또 다른 꽤 일반적인 플라렌은 실험식
70 [27]C를 가지고 있지만, 72, 76, 84의 플라렌과 심지어 100개의 탄소 원자를 가진 플라렌이 일반적으로 얻어진다.
가능한 가장 작은 플라렌은 12면체
20 C이다.22개의 [28]정점이 있는 풀레렌은 없습니다.서로 다른 플라렌2n C의 수는 대략 n에9 비례하여 n = 12, 13, 14, ...의 증가에 따라 증가한다(OEIS의 시퀀스 A007894).예를 들어 1812개의 비동형 플라렌
60 C가 있다.C의 유일한
60 형태인 벅민스터풀레렌에는 인접한 펜타곤 쌍이 없습니다(이러한 가장 작은 플라렌).성장을 더 잘 설명하기 위해 214,127,713개의 비동형 플라렌
200 C가 있으며, 이 중 15,655,672개는 인접한 펜타곤이 없다.많은 플라렌 이성질체의 최적화된 구조가 [29]웹에 공개되고 나열됩니다.
헤테로풀레렌은 케이지 또는 튜브 형태의 구조 내에 탄소 치환 헤테로아톰을 가지고 있다.그것들은 1993년에[30] 발견되었고 전반적인 플라렌계 화합물 종류를 크게 확장시키고 그들의 표면에 매달린 결합을 가질 수 있다.주목할 만한 예로는 붕소, 질소(아자풀레렌), 산소 및 인 유도체가 있습니다.
탄소 나노튜브
탄소 나노튜브는 원통형 플라렌이다.이 탄소 튜브들은 보통 폭이 몇 나노미터에 불과하지만, 마이크로미터 미만에서 몇 밀리미터 길이까지 다양합니다.대부분의 경우 클로즈 엔드가 있지만 오픈 엔드가 될 수도 있습니다.튜브가 닫히기 전에 지름이 줄어드는 경우도 있습니다.그들의 독특한 분자 구조는 높은 인장 강도, 높은 전기 전도율, 높은 연성, 높은 열 전도율, 그리고 상대적인 화학 불활성을 포함한 놀라운 거시적 특성을 낳습니다(원통형이고 "평면"이기 때문에 쉽게 변위할 수 있는 "노출된" 원자가 없습니다).카본 나노튜브의 사용법 중 하나는 2007년 렌셀라 폴리테크닉 [31]연구소에 의해 개발된 종이 배터리에 관한 것이다.우주 기술 분야에서의 또 다른 매우 투기적인 사용은 우주 엘리베이터에 필요한 고강도 탄소 케이블을 생산하는 것이다.
파생상품
버키볼과 카본나노튜브는 다음과[25] 같은 다양한 파생 모델과 대형 구조의 구성 요소로 사용되어 왔습니다.
- 윤활유를 [33]위해 제안된 중첩 버키볼("탄소 나노온" 또는 "버키온")[32]
- 네스트 카본 나노튜브('탄소 메가튜브')[34]
- 연결된 "볼 앤 체인" 이합체(탄소 [35]체인으로 연결된 두 개의 버키볼)
- 버키볼 링이 [36]서로 연결되어 있습니다.
헤테로풀레렌 및 비탄소 플라렌
C60의 발견 이후, 많은 플라렌이 합성되어 왔고 (또는 이론적으로 분자 모델링 방법에 의해 연구되었다) 탄소 원자의 일부 또는 전부가 다른 원소로 대체되었다.특히 무기 나노튜브는 많은 관심을 끌었다.
붕소
일반적인 탄소 대신 붕소 원자를 사용하는 버키볼의 종류는 2007년에 예측되고 기술되었다.각 원자가 5개 또는 6개의 결합을 형성하는 B 구조는
80 C
60 [37]버키볼보다 더 안정적일 것으로 예측되었습니다.그러나 후속 분석 결과 예측된h I 대칭 구조가 진동적으로 불안정하고 결과적으로 발생하는 케이지가 자발적인 대칭을 파괴하여 드문 Th 대칭(배구 [38]대칭)을 가진 퍼칭 케이지가 생성된다.이 분자의 6원 고리 수는 20개이고 5원 고리 수는 12개입니다.각 6개 멤버 링의 중앙에는 원자가 하나 더 있으며, 원자를 둘러싼 각 원자에 결합되어 있습니다.체계적인 글로벌 검색 알고리즘을 채택함으로써 이전에 제안한 플라렌은 80원자 붕소 클러스터의 글로벌 최대값이 아니므로 자연에서 찾을 수 없으며 가장 안정적인 구성은 [39]복잡하다는 것이 나중에 밝혀졌다.같은 논문은 붕소의 에너지 지형이 다른 것과 달리 많은 무질서한 저에너지 구조를 가지고 있기 때문에 순수 붕소 플라렌이 [39]자연에 존재할 가능성은 낮다고 결론지었다.
그러나 2014년에 보로스페렌이라는 불규칙한
40 B 복합체가 준비되었다.이 복합체는 48개의 삼각형 네트워크로2d [40]교차된 D 대칭을 가진 두 개의 육각형 면과 네 개의 육각형 면을 가지고 있습니다.
기타 요소
무기(탄소가 없는) 플라렌형 구조물은 몰리브덴(Molybdenum)을 사용하여 제작되었습니다.IV) 황화물(MoS2), 오랫동안 흑연상 윤활제로 사용되는 텅스텐(WS2), 티타늄(TiS2) 및 니오브(NbS2).이 재료들은 최소 350톤/cm2(34.3GPA)[41]까지 안정적인 것으로 확인되었습니다.
게르마늄, 주석 및 납을 위해 20면체 또는 왜곡된 이면체 플라렌 유사 복합체도 준비되었습니다. 이러한 복합체 중 일부는 대부분의 전이 금속 [42][43]원자를 수용할 수 있을 만큼 충분히 넓습니다.
메인 플라렌
아래 표는 지금까지 합성되어 특징지어진 주요 폐쇄 탄소 플라렌의 표이며,[44] 그 CAS 번호가 알려져 있는 경우이다.탄소 원자가 60개 미만인 풀레렌은 "하위 풀레렌"[45]이라고 불리며, 원자가 70개 이상인 풀레렌은 "하위 풀레렌"[46]이라고 불린다.
| 공식 | 숫자 Isom. [1] | 몰. 음. | 크리스팅. 음. | 스페이스 그룹 | 아니요. | 피어슨 기호. | a(nm) | b(nm) | c(nm) | β° | Z | ρ (cm/g3) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| C 20. | 1 | 나h | ||||||||||
| C 60. | 1 | 나h | ||||||||||
| C 70. | 1 | D5h. | ||||||||||
| C 72. | 1 | D6h. | ||||||||||
| C 74. | 1 | D3h. | ||||||||||
| C 76. | 2 | D2* | 단사정계 | P21 | 4 | mP2 | 1.102 | 1.108 | 1.768 | 108.10 | 2 | 1.48 |
| 큐빅 | FM3m | 225 | cF4 | 1.5475 | 1.5475 | 1.5475 | 90 | 4 | 1.64 | |||
| C 78. | 5 | D2v. | ||||||||||
| C 80. | 7 | |||||||||||
| C 82. | 9 | C 2, C2v, C3v | 단사정계 | P21 | 4 | mP2 | 1.141 | 1.1355 | 1.8355 | 108.07 | 2 | |
| C 84. | 24 | D2*, D2d | 큐빅 | FM3m | 1.5817[47] | 1.5817 | 1.5817 | 90 | ||||
| C 86. | 19 | |||||||||||
| C 88. | 35 | |||||||||||
| C 90. | 46 | |||||||||||
| C 3996. |
테이블에서, "Num.Isom."은 플라렌의 두 펜타곤이 [48][49]모서리를 공유해서는 안 된다는 "분리된 오각형 규칙" 내에서 가능한 이성질체 수입니다."Mol.Symm"은 [49][50]분자의 대칭인데 반해 "Cryst"는 분자의 대칭이다.Symmm"은 고체 상태의 결정 골격이다.둘 다 실험적으로 가장 풍부한 형태로 규정된다.별표 *는 둘 이상의 카이랄 형식을 가진 대칭을 표시합니다.
C
76 또는 C
82 결정이 톨루엔 용액에서 성장하면 단사정형의 대칭을 가진다.결정구조는 플라렌의 구 사이에 채워진 톨루엔 분자를 포함하고 있다.그러나 C로부터의
76 용제의 증발에 의해 면중심 입방체 형태로 [51]변환된다.단사정계상 및 면중심입방정계(fcc)상 모두 C 및 C
70 플라렌의 특성이
60 더 좋은 것으로 알려져 있습니다.
특성.
토폴로지
슐레겔 다이어그램은 클로즈드 쉘 플라렌의 3D 구조를 명확히 하기 위해 자주 사용됩니다. 2D 투영법은 이러한 [52]점에서 이상적이지 않은 경우가 많기 때문입니다.
수학적인 용어로, 단순한 구와 같은 평균 표면(방향성, 0속)을 가진 닫힌 껍질 플라렌의 조합 위상(즉, 그들의 위치와 거리를 무시한 탄소 원자와 그들 사이의 결합)은 볼록한 다면체로 표현될 수 있다; 더 정확히는 그것의 수직면으로 구성된 그것의 1차원 골격이다.es 및 엣지.Schlegel 다이어그램은 골격을 다면체의 면 중 하나에 투영하는 것입니다. 그 면 바로 바깥에 있는 점을 통해 다른 모든 정점이 그 면 안에 투영됩니다.
- 일부 플라렌의 슐레겔 도표
닫힌 플라렌의 Schlegel 다이어그램은 평면적이고 3-규칙적인 그래프이다(또는 "입방체"; 모든 정점이 3도를 갖는다는 의미).
구체와 같은 껍질이 있는 닫힌 플라렌은 적어도 펜타곤 또는 헵타곤인 사이클을 가져야 한다.보다 정확하게는, 모든 면이 5개 또는 6개의 변을 가지고 있다면, 오일러의 다면체 공식인 V-E+F=2(여기서 V, E, F는 정점, 모서리, 면의 수)에서 V는 짝수여야 하며 정확히 12개의 펜타곤과 V/2-10개의 육각형이어야 한다.플라렌의 사이클이 [53]7원자인 경우에도 유사한 제약이 존재합니다.
탄소 나노튜브와 그래핀과 같은 개방형 플라렌은 전적으로 육각형 고리로 구성될 수 있습니다.이론적으로, 끝이 닫힌 토러스 모양의 시트를 형성하기 위해 결합된 긴 나노튜브는 또한 완전히 육각형으로 구성될 수 있습니다.
본딩
각 탄소 원자는 일반적인 4개의 결합 대신 3개의 이웃에만 연결되기 때문에, 이러한 결합을 단일 및 이중 공유 결합의 혼합이라고 설명하는 것이 관례입니다.C에서60 탄소의 교배는 [54]sp로 보고되었다2.01.결합 상태는 라만 분광법, IR 분광법,[54][55] X선 광전자 분광법으로 분석할 수 있다.
캡슐화
추가적인 원자, 이온, 클러스터, 또는 작은 분자들은 내면체 플라렌으로 알려진 포함 화합물을 형성하기 위해 플라렌 안에 갇힐 수 있습니다.특이한 예로는 분리된 오각형 [56]규칙을 위반하는 달걀 모양의 플라렌3 TbN@C가
84 있다.페름기 말기의 운석 충돌에 대한 증거는 [57]플라렌에 갇힘으로써 보존된 귀한 가스를 분석함으로써 발견되었다.
조사.
2000년대 초, 플라렌의 화학적, 물리적 특성은 연구 개발 분야에서 뜨거운 주제였다.Popular Science는 [58]갑옷에 플라펜을 사용할 수 있는 가능성에 대해 논의했다.
나노 기술 분야에서, 내열성과 초전도성은 가장 많이 연구되는 특성 중 하나이다.
풀레렌에 적용된 ab-initio 양자법을 사용하여 많은 계산이 수행되었습니다.DFT 및 TD-DFT 방법에 의해 IR, Raman 및 UV 스펙트럼을 얻을 수 있다.이러한 계산 결과를 실험 결과와 비교할 수 있습니다.
풀레렌은 1993년에 발견된 빙겔 반응과 같은 많은 유기 반응에서 특이한 반응 물질이다.
방향성
연구자들은 플라렌의 표면에 활성 그룹을 부착함으로써 플라렌의 반응성을 높일 수 있었다.벅민스터풀레렌은 "초방향성"을 나타내지 않는다: 즉, 육각형 고리의 전자는 분자 전체에 걸쳐 비국재화되지 않는다.
n개의 탄소 원자로 이루어진 구형 플라렌은 n개의 pi 결합 전자를 가지며, 자유로이 비국재화된다.이것들은 전체 분자에 대해 탈국소화를 시도해야 한다.이러한 배열의 양자역학은 n = 2, 8, 18, 32, 50, 72, 98, 128 등에 대해 안정적인 채워진 껍데기를 가진 단일 원자의 잘 알려진 양자역학 구조의 껍데기 하나와 같아야 하지만, 이 시리즈는 60을 포함하지 않는다.구면 방향족도에 대한 이 2(N + 21) 법칙은 휘켈 법칙의 3차원 유사체이다.10+ 양이온은 이 규칙을 충족하며 방향족이어야 합니다.이는 양이온에 [59]강한 반자성 구면 전류가 존재하는 것을 보여주는 양자 화학 모델링을 사용한 경우로 나타났다.
그 결과, 물
60 속의 C는 두 개의 전자를 더 집어 음이온이 되는 경향이 있다.아래에 설명된 nC는
60 C가 느슨한 금속 결합을 형성하려고 시도한
60 결과일 수 있습니다.
반응
중합
높은 압력과 온도에서 버키볼은 붕괴되어 다양한 1차원, 2차원 또는 3차원 탄소 골격을 형성합니다.단일 스트랜드 폴리머는 ATRAP([60]Atom Transfer Radical Addition Polymeration) 경로를 사용하여 형성됩니다.
'초경질 풀라이트'는 풀라이트의 고압고온(HPHT) 가공에 의해 생성되는 물질을 나타내는 데 자주 사용되는 신조어입니다.이러한 처리는 풀라이트를 나노결정 형태의 다이아몬드로 변환하는데, 이 다이아몬드는 놀라운 기계적 [61]특성을 보이는 것으로 보고되고 있다.
화학
풀레렌은 안정적이지만 완전히 반응하지 않는 것은 아니다.sp-하이브리드2 탄소 원자는 평판 흑연에서 에너지 최소값이 되며, 닫힌 구체 또는 튜브를 형성하기 위해 구부려야 하며, 각도가 변형됩니다.플라렌의 특징적인 반응은 6,6-이중결합에서 친전자성 첨가이며, sp-하이브리드2 탄소를 sp-하이브리드3 탄소로 변화시킴으로써 각도 왜곡을 감소시킨다.혼성 궤도의 변화는 결합 각도가 sp2 오비탈의 약 120°에서3 sp 오비탈의 약 109.5°로 감소하게 한다.이러한 결합각의 감소는 구나 튜브를 닫을 때 결합이 덜 휘게 하고, 따라서 분자가 더 안정되게 됩니다.
용해성
풀레렌은 톨루엔, 클로로벤젠 및 1,2,3-트리클로로프로판과 같은 많은 유기용제에 용해된다.용해도는 일반적으로 이황화탄소 중 C가60 8 g/L로 비교적 낮다.여전히, 플라렌은 상온에서 [62][63][64][65][66]일반적인 용매에 용해될 수 있는 유일한 탄소 동소체이다.가장 좋은 용제로는 C 51g/L를 용해하는60 1-클로로나프탈렌이 있다.
순수한 벅민스터풀레렌 용액은 짙은 보라색이다.C의
70 용액은 적갈색이다.높은 플라렌
76 C부터
84 C까지의 색상은 다양합니다.
벤젠 용액에서 순수 및 용해된 C와
70 C의
60 밀리미터 크기의 결정을 배양할 수 있습니다.벤젠 용액에서 C를
60 결정화하면(용해가 최대일 때) 트리클린 고체용매
60 C·4CH가
6
6 생성되며, 30°C 이상에서는 무용매 FCC
60 [67][68]C가 얻어진다.
양자역학
1999년 비엔나 대학의 연구원들은 파동 입자 이중성이 플라렌과 [69]같은 분자에 적용된다는 것을 증명했다.
초전도
풀레렌은 보통 전기 절연체이지만, 알칼리 금속으로 결정화되면, 생성된 화합물이 전도되거나 [70]초전도될 수 있습니다.
키라리티
일부 플라렌(예
76: C, C
78, C
80 및 C
84)은 D-대칭이고2 성공적으로 분해되었기 때문에 본질적으로 키랄이다.에난티오머를 위한 특정 센서를 개발하기 위한 연구가 진행 중입니다.
안정성.
플라렌을 만드는 분자 메커니즘을 설명하기 위해 두 가지 이론이 제안되었다.더 오래된, "상향식" 이론은 그것들이 원자별로 만들어졌다고 제안합니다.대체적인 "하향식" 접근법은 훨씬 더 큰 구조물이 구성 부품으로 [71]부서질 때 풀레렌이 형성된다고 주장한다.
2013년 연구자들은 더 큰 구조에서 형성된 비대칭 풀레렌이 안정적인 풀레렌으로 정착한다는 것을 발견했다.합성된 물질은 84개의 탄소 원자와 케이지 안에 있는 2개의 탄소 원자와 2개의 이트륨 원자로 구성된 특정한 금속성 풀레렌이었다.이 과정에서 약 100마이크로그램이 [71]생성되었습니다.
하지만, 그들은 비대칭 분자가 이론적으로 붕괴되어 알려진 거의 모든 플라렌과 메탈로풀레렌을 형성할 수 있다는 것을 발견했다.몇 개의 분자 결합이 깨지는 것과 관련된 사소한 동요는 케이지가 매우 대칭적이고 안정되게 만듭니다.이 통찰력은 적절한 분자 결합이 [71][72]끊어졌을 때 그래핀에서 풀레렌이 형성될 수 있다는 이론을 뒷받침한다.
체계적인 명명
IUPAC에 따르면 플라렌 이름을 붙이기 위해서는 플라렌을 구성하는 고리의 부재 원자의 수, 쇤파리 표기에서의 대칭점군, 원자의 총수를 인용해야 한다.예를 들어 벅민스터풀레렌C는 계통적으로60 (C-I
60h)[5,6]풀레렌으로 명명된다.점군의 이름은 해당 플라렌의 유도체에 의해 대칭성이 상실되더라도 유지되어야 한다.
대체 또는 부착된 원소의 위치를 나타내기 위해 플라렌 원자는 보통 나선형 경로로 번호가 매겨지며, 보통 주축 중 하나의 링에서 시작합니다.플라렌의 구조가 이러한 번호를 부여하지 않는 경우, 여전히 나선 경로 시퀀스를 달성하기 위해 다른 시작 원자를 선택했습니다.
후자는 C의 경우입니다70.이것은 IUPAC 표기로 (C-D
705h(6))[5,6]풀레렌입니다대칭5h(6) D는 C축이5 펜타곤이 [52]아닌 육각형으로 둘러싸인 오각형을 통과하는 이성질체임을 의미합니다.
IUPAC의 명명법에서는 풀라렌의 완전 포화 유사체를 풀라네라고 합니다.메쉬에 1개 이상의 탄소를 치환한 다른 원소가 있는 경우, 이 화합물을 헤테로풀렌이라고 한다.이중 결합을 메틸렌 브릿지로 대체한 경우 -CH-2 결과물은 호모풀레렌입니다.원자가 완전히 삭제되고 수소 원자에 포화된 원자가 누락되면 노르풀레렌이다.결합이 제거되면(시그마와 파이 모두), 화합물은 세코풀레렌이 된다. 새로운 결합이 몇 가지 특이한 순서로 첨가되면 시클로풀레렌이다.[52]
생산.
플라렌 생산은 일반적으로 플라렌이 풍부한 그을음을 생산하는 것으로 시작된다.원래(그리고 여전히 전류) 방법은 불활성 대기에서 근처의 두 흑연 전극 사이에 큰 전류를 보내는 것이었습니다.결과적으로 발생하는 전기 아크는 탄소를 기화시켜 플라즈마로 만들고, 그 후 냉각시켜 수티 [15]잔류물로 만듭니다.또는 흑연의 레이저 어블레이션 또는 방향족 [73][citation needed]탄화수소의 열분해로 그을음을 발생시킨다.벤젠 연소는 [74][75]MIT에서 개발된 가장 효율적인 과정입니다.
이 과정들은 다양한 플라렌과 다른 형태의 탄소의 혼합물을 생산한다.그런 다음 적절한 유기 용제를 사용하여 그을음에서 플라렌을 추출하고 크로마토그래피로 [76]: p.369 분리합니다.원자가 80개 이상인 플라렌은 밀리그램의 양을 얻을 수 있다.C76, C78, C는84 시판되고 있습니다.
적용들
풀레렌은 고성능 MRI 조영제, X선 영상 조영제, 광역학적 치료 및 약물 및 유전자 전달을 포함한 여러 생물의학 응용 분야에 광범위하게 사용되어 왔으며, 몇 가지 포괄적인 [77]리뷰에 요약되어 있다.
종양 연구
과거의 암 연구는 방사선 치료를 포함했지만, 종양 세포 치료의 획기적인 발전은 다른 조건을 가진 환자들에게 더 많은 선택권을 줄 것이기 때문에 광역학적 치료는 연구하는데 중요하다.최근 암 연구에서 Hela 세포를 사용한 실험은 암세포에 흡수되어 세포사멸을 촉발하는 능력을 높이는 새로운 광감작제 개발을 포함한다.또한 원치 않는 세포 [78]손상을 방지하기 위해 새로운 광감작제가 체내에 오래 머무르지 않는 것이 중요합니다.
풀레렌은 Hela 세포에 흡수될 수 있다.C유도체는
60 L-페닐알라닌, 엽산,[79] L-arginine 등의 관능기를 이용하여 세포에 전달될 수 있다.
플라렌을 기능화하는 것은 암세포에 의한 분자의 용해도를 높이는 것을 목표로 한다.암세포는 암세포의 전달물질의 상향조절 때문에 이러한 분자들을 증가하는 속도로 흡수하는데, 이 경우 아미노산 전달물질은 플라렌의 [80]L-arginine과 L-페닐알라닌 기능군을 가져올 것이다.
세포에 흡수되면 C 유도체는
60 분자 산소를 활성 산소로 변화시켜 플라렌 분자를 흡수할 수 있는 Hela 세포와 다른 암 세포에서 세포자멸을 유발함으로써 빛 방사선에 반응합니다.이 연구는 반응성 물질이 암세포를 표적으로 삼은 후 빛 방사선에 의해 유발될 수 있다는 것을 보여주며,[81] 치료를 받는 동안 주변 조직의 손상을 최소화할 수 있다는 것을 보여준다.
암세포에 의해 흡수되고 빛 방사선에 노출될 때, 반응성 산소를 만드는 반응은 암세포를 구성하는 DNA, 단백질, 그리고 지질을 손상시킨다.이 세포 손상은 암세포가 세포사멸을 겪게 하고, 이것은 종양의 크기를 감소시킬 수 있다.광선 치료가 완료되면 플라렌이 활성산소를 재흡수하여 다른 [82]조직의 손상을 방지합니다.이 치료법은 암세포에 중점을 두기 때문에 암세포가 빛 방사선에 닿는 곳에 있는 환자에게 좋은 선택이다.이 연구가 계속됨에 따라 치료법은 몸속 깊이 침투하여 암세포에 의해 보다 효과적으로 [78]흡수될 수 있을 것이다.
안전성 및 독성
2013년, 1990년대 초부터 시작된 플라렌의 독성에 대한 포괄적인 검토가 발표되었고 플라렌이 발견된 이후 수집된 증거는 거의 C가 [77]독성이라는
60 결론을 내렸다.이러한 탄소 나노 입자의 독성은 용량과 시간에 의존할 뿐만 아니라 다음과 같은 다른 여러 요인에 따라 달라진다.
- type (예: C
60, C
70, M@C
60, M@C
82) - 이러한 나노 입자를 수용성화하는 데 사용되는 기능성 기(예:오, COOH)
- 투여방법(예를 들어 정맥주사, 복강내)
모든 신규 플라렌 또는 메탈로풀레렌 기반 복합체의 약리학적 특성을 다른 화합물로 개별적으로 평가할 것을 권고했다.
대중문화
플라렌의 예는 대중문화에서 자주 나타난다.풀레네스는 과학자들이 그들에게 심각한 관심을 갖기 훨씬 전에 소설에 등장했습니다.1966년 뉴사이언티스트 칼럼에서 데이비드 존스는 불순물 [83]원자의 추가와 함께 평면 육각형 그물을 왜곡함으로써 거대한 중공 탄소 분자를 만들 수 있는 가능성을 제시했다.
「 」를 참조해 주세요.
레퍼런스
- ^ "Definition of BUCKYTUBE". www.merriam-webster.com.
- ^ "fullerite". Archived from the original on 23 October 2015.
- ^ a b Buseck, P.R.; Tsipursky, S.J.; Hettich, R. (1992). "Fullerenes from the Geological Environment". Science. 257 (5067): 215–7. Bibcode:1992Sci...257..215B. doi:10.1126/science.257.5067.215. PMID 17794751. S2CID 4956299.
- ^ a b "The allotropes of carbon". Interactive Nano-Visualization in Science & Engineering Education. Archived from the original on 18 June 2010. Retrieved 29 August 2010.
- ^ a b Cami, J; Bernard-Salas, J.; Peeters, E.; Malek, S. E. (2 September 2010). "Detection of C
60 and C
70 in a Young Planetary Nebula". doi:10.1126/science.1192035. S2CID 33588270.{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ a b 2010년 7월 22일 BBC, 스타들은 탄소 '우주공'을 공개한다.
- ^ Belkin, A.; et., al. (2015). "Self-Assembled Wiggling Nano-Structures and the Principle of Maximum Entropy Production". Sci. Rep. 5: 8323. Bibcode:2015NatSR...5E8323B. doi:10.1038/srep08323. PMC 4321171. PMID 25662746.
- ^ Schultz, H.P. (1965). "Topological Organic Chemistry. Polyhedranes and Prismanes". Journal of Organic Chemistry. 30 (5): 1361–1364. doi:10.1021/jo01016a005.
- ^ Osawa, E. (1970). "Superaromaticity". Kagaku. 25: 854–863.
- ^ Halford, B. (9 October 2006). "The World According to Rick". Chemical & Engineering News. 84 (41): 13–19. doi:10.1021/cen-v084n041.p013.
- ^ Thrower, P.A. (1999). "Editorial". Carbon. 37 (11): 1677–1678. doi:10.1016/S0008-6223(99)00191-8.
- ^ Henson, R.W. "The History of Carbon 60 or Buckminsterfullerene". Archived from the original on 15 June 2013.
- ^ Bochvar, D.A.; Galpern, E.G. (1973). "О гипотетических системах: карбододекаэдре, s-икосаэдре и карбо-s-икосаэдре" [On hypothetical systems: carbon dodecahedron, S-icosahedron and carbon-S-icosahedron]. Dokl. Akad. Nauk SSSR. 209: 610.
- ^ Iijima, S (1980). "Direct observation of the tetrahedral bonding in graphitized carbon black by high resolution electron microscopy". Journal of Crystal Growth. 50 (3): 675–683. Bibcode:1980JCrGr..50..675I. doi:10.1016/0022-0248(80)90013-5.
- ^ a b c Kroto, H.W.; Heath, J. R.; Obrien, S. C.; et al. (1985). "C
60: Buckminsterfullerene". Nature. 318 (6042): 162–163. Bibcode:1985Natur.318..162K. doi:10.1038/318162a0. S2CID 4314237. - ^ 벅민스터풀레렌, C
60서섹스 풀러렌 그룹(chm.bris.ac.uk - ^ "The Nobel Prize in Chemistry 1996". Retrieved 7 February 2014.
- ^ Mraz, S.J. (14 April 2005). "A new buckyball bounces into town". Machine Design. Archived from the original on 13 October 2008.
- ^ Iijima, Sumio (1991). "Helical microtubules of graphitic carbon". Nature. 354 (6348): 56–58. Bibcode:1991Natur.354...56I. doi:10.1038/354056a0. S2CID 4302490.
- ^ Reilly, P. T. A.; Gieray, R. A.; Whitten, W. B.; Ramsey, J. M. (2000). "Fullerene Evolution in Flame-Generated Soot". Journal of the American Chemical Society. 122 (47): 11596–11601. doi:10.1021/ja003521v. ISSN 0002-7863.
- ^ Krätschmer, W.; Lamb, Lowell D.; Fostiropoulos, K.; Huffman, Donald R. (1990). "Solid C60: a new form of carbon". Nature. 347 (6291): 354–358. Bibcode:1990Natur.347..354K. doi:10.1038/347354a0. ISSN 0028-0836. S2CID 4359360.
- ^ Atkinson, Nancy (27 October 2010). "Buckyballs Could Be Plentiful in the Universe". Universe Today. Retrieved 28 October 2010.
- ^ Starr, Michelle (29 April 2019). "The Hubble Space Telescope Has Just Found Solid Evidence of Interstellar Buckyballs". ScienceAlert.com. Retrieved 29 April 2019.
- ^ Cordiner, M.A.; et al. (22 April 2019). "Confirming Interstellar C60 + Using the Hubble Space Telescope". The Astrophysical Journal Letters. 875 (2): L28. arXiv:1904.08821. Bibcode:2019ApJ...875L..28C. doi:10.3847/2041-8213/ab14e5. S2CID 121292704.
- ^ a b Miessler, G.L.; Tarr, D.A. (2004). Inorganic Chemistry (3rd ed.). Pearson Education. ISBN 978-0-13-120198-9.
- ^ Qiao, Rui; Roberts, Aaron P.; Mount, Andrew S.; et al. (2007). "Translocation of C
60 and Its Derivatives Across a Lipid Bilayer". Nano Letters. 7 (3): 614–9. Bibcode:2007NanoL...7..614Q. CiteSeerX 10.1.1.725.7141. doi:10.1021/nl062515f. PMID 17316055. - ^ Locke, W. (13 October 1996). "Buckminsterfullerene: Molecule of the Month". Imperial College. Retrieved 4 July 2010.
- ^ Meija, Juris (2006). "Goldberg Variations Challenge" (PDF). Analytical and Bioanalytical Chemistry. 385 (1): 6–7. doi:10.1007/s00216-006-0358-9. PMID 16598460. S2CID 95413107.
- ^ 파울러, P. W.와 마놀로풀로스, D. E. C
n 풀레네.nanotube.msu.edu - ^ Harris, D.J. "Nitroballs의 발견: 풀러렌 화학 연구" http://www.usc.edu/CSSF/History/1993/CatWin_S05.html 2015년 11월 29일 웨이백 머신에 보관
- ^ Pushparaj, V.L.; Shaijumon, Manikoth M.; Kumar, A.; et al. (2007). "Flexible energy storage devices based on nanocomposite paper". Proceedings of the National Academy of Sciences. 104 (34): 13574–7. Bibcode:2007PNAS..10413574P. doi:10.1073/pnas.0706508104. PMC 1959422. PMID 17699622.
- ^ Ugarte, D. (1992). "Curling and closure of graphitic networks under electron-beam irradiation". Nature. 359 (6397): 707–709. Bibcode:1992Natur.359..707U. doi:10.1038/359707a0. PMID 11536508. S2CID 2695746.
- ^ Sano, N.; Wang, H.; Chhowalla, M.; et al. (2001). "Synthesis of carbon 'onions' in water". Nature. 414 (6863): 506–7. Bibcode:2001Natur.414..506S. doi:10.1038/35107141. PMID 11734841. S2CID 4431690.
- ^ Mitchel, D.R.; Brown, R. Malcolm Jr. (2001). "The Synthesis of Megatubes: New Dimensions in Carbon Materials". Inorganic Chemistry. 40 (12): 2751–5. doi:10.1021/ic000551q. PMID 11375691.
- ^ Shvartsburg, A.A.; Hudgins, R. R.; Gutierrez, Rafael; et al. (1999). "Ball-and-Chain Dimers from a Hot Fullerene Plasma" (PDF). Journal of Physical Chemistry A. 103 (27): 5275–5284. Bibcode:1999JPCA..103.5275S. doi:10.1021/jp9906379.
- ^ Li, Y.; Huang, Y.; Du, Shixuan; Liu, Ruozhuang (2001). "Structures and stabilities of C
60-rings". Chemical Physics Letters. 335 (5–6): 524–532. Bibcode:2001CPL...335..524L. doi:10.1016/S0009-2614(01)00064-1. - ^ Gonzalez Szwacki, N.; Sadrzadeh, A.; Yakobson, B. (2007). "B
80 Fullerene: An Ab Initio Prediction of Geometry, Stability, and Electronic Structure". Physical Review Letters. 98 (16): 166804. Bibcode:2007PhRvL..98p6804G. doi:10.1103/PhysRevLett.98.166804. PMID 17501448. - ^ Gopakumar, G.; Nguyen, M.T.; Ceulemans, A. (2008). "The boron buckyball has an unexpected Th symmetry". Chemical Physics Letters. 450 (4–6): 175–177. arXiv:0708.2331. Bibcode:2008CPL...450..175G. doi:10.1016/j.cplett.2007.11.030. S2CID 97264790.
- ^ a b De, S.; Willand, A.; Amsler, M.; et al. (2011). "Energy Landscape of Fullerene Materials: A Comparison of Boron to Boron Nitride and Carbon". Physical Review Letters. 106 (22): 225502. arXiv:1012.3076. Bibcode:2011PhRvL.106v5502D. doi:10.1103/PhysRevLett.106.225502. PMID 21702613. S2CID 16414023.
- ^ Zhai, Hua-Jin; Ya-Fan Zhao; Wei-Li Li; et al. (13 July 2014). "Observation of an all-boron fullerene". Nature Chemistry. 6 (8): 727–731. Bibcode:2014NatCh...6..727Z. doi:10.1038/nchem.1999. ISSN 1755-4349. PMID 25054944.
- ^ Genuth, Iddo; Yaffe, Tomer (15 February 2006). "Protecting the soldiers of tomorrow". IsraCast. Archived from the original on 26 March 2008.
- ^ Cui, Li-Feng; Xin Huang; Lei-Ming Wang; et al. (1 July 2006). "Sn122-: Stannaspherene". Journal of the American Chemical Society. 128 (26): 8390–8391. doi:10.1021/ja062052f. ISSN 0002-7863. PMID 16802791.
- ^ Cui, Li-Feng; Xin Huang; Lei-Ming Wang; et al. (1 August 2006). "Pb122-: Plumbaspherene". The Journal of Physical Chemistry A. 110 (34): 10169–10172. Bibcode:2006JPCA..11010169C. doi:10.1021/jp063617x. ISSN 1089-5639. PMID 16928103.
- ^ W. L. F. Armarego; Christina Li Lin Chai (11 May 2009). Purification of laboratory chemicals. Butterworth-Heinemann. pp. 214–. ISBN 978-1-85617-567-8. Retrieved 26 December 2011.
- ^ Sun, Marc C. Nicklaus; Rui-hua, Xie (2005). "Structure, Stability, and NMR Properties of Lower Fullerenes C38−C50 and Azafullerene C44N6". J. Phys. Chem. 109 (20): 4617–4622. doi:10.1021/jp0450181.
- ^ Thilgen, Carlo; Herrmann, Andreas; Diederich, François (14 November 1997). "The Covalent Chemistry of Higher Fullerenes: C70 and Beyond". Angewandte Chemie International Edition in English. 36 (21): 2268–2280. doi:10.1002/anie.199722681.
- ^ Margadonna, Serena; Brown, Craig M.; Dennis, T. John S.; et al. (July 1998). "Crystal Structure of the Higher Fullerene C". Chemistry of Materials. 10 (7): 1742–1744. doi:10.1021/cm980183c.
- ^ Manolopoulos, David E.; Fowler, Patrick W. (1991). "Structural proposals for endohedral metal-fullerene complexes". Chemical Physics Letters. 187 (1–2): 1–7. Bibcode:1991CPL...187....1M. doi:10.1016/0009-2614(91)90475-O.
- ^ a b Diederich, Francois; Whetten, Robert L. (1992). "Beyond C60: The higher fullerenes". Accounts of Chemical Research. 25 (3): 119. doi:10.1021/ar00015a004.
- ^ K Veera Reddy (1 January 1998). Symmetry And Spectroscopy Of Molecules. New Age International. pp. 126–. ISBN 978-81-224-1142-3. Retrieved 26 December 2011.
- ^ Kawada, H.; Fujii, Y.; Nakao, H.; et al. (1995). "Structural aspects of C
82 and C
76 crystals studied by x-ray diffraction". Physical Review B. 51 (14): 8723–8730. doi:10.1103/PhysRevB.51.8723. PMID 9977506. - ^ a b c Powell, W. H.; Cozzi, F.; Moss, G. P.; et al. (2002). "Nomenclature for the C60-Ih and C70-D5h(6) Fullerenes (IUPAC Recommendations 2002)" (PDF). Pure and Applied Chemistry. 74 (4): 629–695. doi:10.1351/pac200274040629. S2CID 93423610.
- ^ '풀레렌', 브리태니커 백과사전 온라인
- ^ a b Diana, Nooramalina; Yamada, Yasuhiro; Gohda, Syun; et al. (1 February 2021). "Carbon materials with high pentagon density". Journal of Materials Science. 56 (4): 2912–2943. Bibcode:2021JMatS..56.2912D. doi:10.1007/s10853-020-05392-x. ISSN 1573-4803. S2CID 224784081.
- ^ Kim, Jungpil; Yamada, Yasuhiro; Kawai, Miki; et al. (1 October 2015). "Spectral change of simulated X-ray photoelectron spectroscopy from graphene to fullerene". Journal of Materials Science. 50 (20): 6739–6747. Bibcode:2015JMatS..50.6739K. doi:10.1007/s10853-015-9229-0. ISSN 1573-4803. S2CID 93478144.
- ^ Beavers, C.M.; Zuo, T. (2006). "Tb3N@C
84: An improbable, egg-shaped endohedral fullerene that violates the isolated pentagon rule". Journal of the American Chemical Society. 128 (35): 11352–3. doi:10.1021/ja063636k. PMID 16939248. - ^ Luann, B.; Poreda, Robert J.; Hunt, Andrew G.; et al. (2007). "Impact Event at the Permian-Triassic Boundary: Evidence from Extraterrestrial Noble Gases in Fullerenes". Science. 291 (5508): 1530–3. Bibcode:2001Sci...291.1530B. doi:10.1126/science.1057243. PMID 11222855. S2CID 45230096.
- ^ Erik Sofge (12 February 2014). "How Real Is 'RoboCop'?". Popular Science.
- ^ Johansson, M.P.; Jusélius, J.; Sundholm, D. (2005). "Sphere Currents of Buckminsterfullerene". Angewandte Chemie International Edition. 44 (12): 1843–6. doi:10.1002/anie.200462348. PMID 15706578.
- ^ Hiorns, R.C.; Cloutet, Eric; Ibarboure, Emmanuel; et al. (2010). "Synthesis of Donor-Acceptor Multiblock Copolymers Incorporating Fullerene Backbone Repeat Units". Macromolecules. 14. 43 (14): 6033–6044. Bibcode:2010MaMol..43.6033H. doi:10.1021/ma100694y.
- ^ Blank, V.; Popov, M.; Pivovarov, G.; et al. (1998). "Ultrahard and superhard phases of fullerite C
60: Comparison with diamond on hardness and wear". Diamond and Related Materials. 7 (2–5): 427–431. Bibcode:1998DRM.....7..427B. CiteSeerX 10.1.1.520.7265. doi:10.1016/S0925-9635(97)00232-X. - ^ Beck, Mihály T.; Mándi, Géza (1997). "Solubility of C
60". Fullerenes, Nanotubes and Carbon Nanostructures. 5 (2): 291–310. doi:10.1080/15363839708011993. - ^ Bezmel'nitsyn, V.N.; Eletskii, A.V.; Okun', M.V. (1998). "Fullerenes in solutions". Physics-Uspekhi. 41 (11): 1091–1114. Bibcode:1998PhyU...41.1091B. doi:10.1070/PU1998v041n11ABEH000502.
- ^ Ruoff, R.S.; Tse, Doris S.; Malhotra, Ripudaman; Lorents, Donald C. (1993). "Solubility of fullerene (C
60) in a variety of solvents" (PDF). Journal of Physical Chemistry. 97 (13): 3379–3383. doi:10.1021/j100115a049. Archived from the original (PDF) on 8 May 2012. Retrieved 24 February 2015. - ^ Sivaraman, N.; Dhamodaran, R.; Kaliappan, I.; et al. (1994). "Solubility of C
70 in Organic Solvents". Fullerene Science and Technology. 2 (3): 233–246. doi:10.1080/15363839408009549. - ^ Semenov, K. N.; Charykov, N. A.; Keskinov, V. A.; et al. (2010). "Solubility of Light Fullerenes in Organic Solvents". Journal of Chemical & Engineering Data. 55: 13–36. doi:10.1021/je900296s.
- ^ Talyzin, A.V. (1997). "Phase Transition C
60−C
60*4C
6H6 in Liquid Benzene".{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ Talyzin, A.V.; Engström, I. (1998). "C
70 in Benzene, Hexane, and Toluene Solutions". Journal of Physical Chemistry B. 102 (34): 6477–6481. doi:10.1021/jp9815255. - ^ Arndt, M.; Nairz, Olaf; Vos-Andreae, Julian; et al. (1999). "Wave-particle duality of C
60" (PDF). Nature. 401 (6754): 680–2. Bibcode:1999Natur.401..680A. doi:10.1038/44348. PMID 18494170. S2CID 4424892. - ^ Katz, E. A. (2006). "Fullerene Thin Films as Photovoltaic Material". In Sōga, Tetsuo (ed.). Nanostructured materials for solar energy conversion. Elsevier. pp. 372, 381. ISBN 978-0-444-52844-5.
- ^ a b c '버키볼'이 어떻게 형성되는지에 대한 하향식 이론을 뒷받침한다.kurzweilai.net. 2013년 9월 24일
- ^ Zhang, J.; Bowles, F. L.; Bearden, D. W.; et al. (2013). "A missing link in the transformation from asymmetric to symmetric metallofullerene cages implies a top-down fullerene formation mechanism". Nature Chemistry. 5 (10): 880–885. Bibcode:2013NatCh...5..880Z. doi:10.1038/nchem.1748. PMID 24056346.
- ^ Bobrowsky, Maciej (1 October 2019). "Nanostructures and computer simulations in material science" (PDF). Retrieved 3 February 2020.
- ^ Osawa, Eiji (2002). Perspectives of Fullerene Nanotechnology. Springer Science & Business Media. p. 29. ISBN 978-0-7923-7174-8.
- ^ Arikawa, Mineyuki (2006). "Fullerenes—an attractive nano carbon material and its production technology". Nanotechnology Perceptions. 2 (3): 121–128. ISSN 1660-6795.
- ^ Katz, E. A. (2006). "Fullerene Thin Films as Photovoltaic Material". In Sōga, Tetsuo (ed.). Nanostructured materials for solar energy conversion. Elsevier. pp. 361–443. doi:10.1016/B978-044452844-5/50014-7. ISBN 978-0-444-52844-5.
- ^ a b G. 랄와니와 B.시타라만, 다기능 플라렌 및 메탈로풀레렌 기반 나노바이오물질, NanoLIFE 2013년 8월 8일, 3:1342003.DOI: 10.1142/S1793984413420038 전문 PDF
- ^ a b Brown, S.B.; Brown, E.A.; Walker, I. (2004). "The present and future role of photodynamic therapy in cancer treatment". Lancet Oncology. 5 (8): 497–508. doi:10.1016/S1470-2045(04)01529-3. PMID 15288239.
- ^ Mroz, Pawel; Pawlak, Anna; Satti, Minahil; et al. (2007). "Functionalized fullerenes mediate photodynamic killing of cancer cells: type I versus typee II photochemical mechanism". Free Radical Biology & Medicine. 43 (5): 711–719. doi:10.1016/j.freeradbiomed.2007.05.005. PMC 1995806. PMID 17664135.
- ^ Ganapathy, Vadivel; Thanaraju, Muthusamy; Prasad, Puttur D. (2009). "Nutrient transporters in cancer: Relevance to Warburg hypothesis and beyond". Pharmacology & Therapeutics. 121 (1): 29–40. doi:10.1016/j.pharmthera.2008.09.005. PMID 18992769.
- ^ Hu, Zhen; Zhang, Chunhua; Huang, Yudong; et al. (2012). "Photodynamic anticancer activities of water-soluble C
60 derivatives and their biological consequences in a HeLa cell line". Chemico-Biological Interactions. 195 (1): 86–94. doi:10.1016/j.cbi.2011.11.003. PMID 22108244. - ^ Markovic, Zoran; Trajkovic, Vladimir (2008). "Biomedical potential of the reactive oxygen species generation and quenching by fullerenes". Biomaterials. 29 (26): 3561–3573. doi:10.1016/j.biomaterials.2008.05.005. PMID 18534675.
- ^ Jones, D. (1966). "Note in Ariadne column". New Scientist. 32: 245.
외부 링크
- 나노카본: 그래핀에서 버키볼 사이 사이클로헥산, 벤젠, 그래핀, 흑연, 키랄 및 비키랄 나노튜브 및 C60 버키볼의 인터랙티브 3D 모델 - WeCanFigureThisOut.org 를 참조해 주세요.
- C 플라렌의 특성
60 - 리처드 스몰리의 노벨상 자서전인식하다
- 해리 크로토 경의 웹 페이지
- 풀레렌의 심플 모델
- 풀라이트 소개
- 버키 볼, 베가 사이언스 트러스트가 C의 구조를
60 설명하는 짧은 비디오 - 자이언트 풀레렌즈, 자이언트 풀레렌즈를 보는 짧은 비디오
- 그래핀, 2010년 9월 15일, BBC 라디오 프로그램 디스커버리










![(C 60-Ih)[5,6]fullerene Carbon numbering.](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c8/Buckminsterfullerene-2D-skeletal_numbered.svg/200px-Buckminsterfullerene-2D-skeletal_numbered.svg.png)
![(C 70-D5h(6))[5,6]fullerene Carbon numbering.](http://upload.wikimedia.org/wikipedia/commons/thumb/2/2c/C70fullerene-2D-skeletal_numbered.svg/187px-C70fullerene-2D-skeletal_numbered.svg.png)
![(C 70-D5h(6))[5,6]fullerene Non-equivalent bonds shown by different colours.](http://upload.wikimedia.org/wikipedia/commons/thumb/9/99/C70fullerene-2D-skeletal_numbered_isobonds.svg/187px-C70fullerene-2D-skeletal_numbered_isobonds.svg.png)
)[5,6]fullerene.](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d7/Cyclopropa12_C70fullerene-2D-skeletal_renumbered.svg/198px-Cyclopropa12_C70fullerene-2D-skeletal_renumbered.svg.png)
)[5,6]fullerene.](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c3/Cyclopropa212_C70fullerene-2D-skeletal_renumbered.svg/198px-Cyclopropa212_C70fullerene-2D-skeletal_renumbered.svg.png)
![C 71-PCBM, [1,2]-isomer. IUPAC name is methyl 4-(3’-phenyl-3’H-cyclopropa[1,2](C 70-D5h(6))[5,6]fullerene-3’-yl)butyrate.](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d3/PC71BM.svg/200px-PC71BM.svg.png)


