콜로이드 골드
Colloidal gold| 에 관한 일련의 기사의 일부 |
| 나노 물질 |
|---|
 |
| 탄소 나노튜브 |
| 풀레렌즈 |
| 기타 나노 입자 |
| 나노구조재료 |
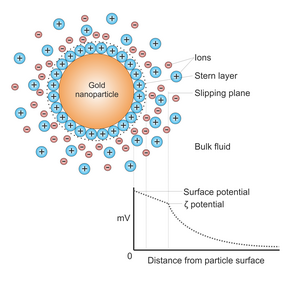
콜로이드 골드는 보통 [1]물인 액체 속의 금 나노 입자의 솔 또는 콜로이드 현탁액입니다.콜로이드는 보통 와인 레드 컬러(100nm 미만의 구형 입자의 경우) 또는 파란색/보라색(큰 구형 입자 또는 나노로드의 [2]경우)입니다.금 나노 입자는 광학,[3] 전자 및 분자 인식 특성으로 인해 전자 현미경,[4] 전자, 나노 기술, [5]재료 과학 및 [6][7][8][9]생물의학을 포함한 광범위한 분야에서 많은 잠재적 또는 유망한 응용 분야를 가진 실질적인 연구의 대상입니다.
콜로이드 금 나노 입자의 특성과 그 잠재적 용도는 크기와 [10]모양에 따라 크게 좌우됩니다.예를 들어 막대 모양의 입자는 가로 흡수 피크와 세로 흡수 피크를 모두 가지며, 형상의 이방성은 [11]그 자기집합에 영향을 준다.
역사

광원의 [12][13]위치에 따라 색이 변하는 4세기 리쿠르구스컵에서 고대부터 유리 콜로이드 금을 염색하는 방법으로 사용되었다.
중세 시대에, 금 소금을 포함한 용액인 가용성 금은 다양한 질병에 대한 치료 특성으로 명성을 떨쳤다.1618년, 철학자이자 의학계의 일원인 프란시스 앤서니는 파나세아 아우레아라는[14] 책을 출판했습니다.이 책은 콜로이드 금의 형성과 그 의학적 용도에 대한 정보를 소개하고 있다.약 반세기 후, 영국의 식물학자 니콜라스 컬페퍼는 1656년에 콜로이드 금의 의학적 사용만을 논한 "오룸 포타빌레 [15]논문"이라는 책을 출판했다.
1676년, 독일의 화학자인 요한 쿤켈은 스테인드글라스의 제조에 관한 책을 출판했다.쿤켈은 그의 책 "고정염과 휘발성염에 관한 귀중한 관찰 또는 발언-오로와 아르젠토 포타빌레, 스피릿우 문디 등"[16]에서 아우럼 포타빌레의 분홍색은 인간의 눈에는 보이지 않는 금속 입자에서 나온 것이라고 추정했다.1842년, 존 허셜은 사진을 종이에 기록하기 위해 콜로이드 금을 사용하는 크리소타이프라고 불리는 사진 공정을 발명했다.
콜로이드 금에 대한 현대의 과학적 평가는 1850년대에 [17][18]마이클 패러데이의 연구가 시작될 때까지 시작되지 않았다.1856년 영국 왕립연구소의 지하 연구실에서 패러데이는 현미경 [19]슬라이드에 금박 조각을 장착하던 중 우연히 루비 레드 용액을 만들었다.그는 이미 빛과 물질의 성질에 관심이 있었기 때문에 패러데이는 콜로이드 금의 광학적 성질을 더 조사했다.그는 1857년에 콜로이드 금의 첫 번째 순수한 샘플을 준비했는데, 이것을 그는 '활성금'이라고 불렀다.그는 염화금 용액을 줄이기 위해 인을 사용했다.패러데이가 150년 전에 만든 콜로이드 금은 여전히 광학적으로 활성 상태입니다.오랫동안, '루비' 금의 구성은 불분명했다.몇몇 화학자들은 그것의 [20][21]준비로 인해 그것이 금 주석 화합물이라고 의심했다.패러데이는 그 색깔이 사실은 금 입자의 작은 크기 때문이라는 것을 알아챘다.그는 현재 패러데이-타인달 [18]효과라고 불리는 부유 금 미립자의 빛 산란 특성에 주목했다.
1898년, 리차드 아돌프 지그몬디는 희석된 [22]용액에 최초의 콜로이드 금을 준비했다.지그몬디 외에도 초원심응집법을 발명한 테오도르 스베드베르크와 구면 입자에 의한 산란과 흡수 이론을 제공한 구스타프 미에도 콜로이드 [11][23]금의 합성과 성질에 관심이 있었다.
20세기 들어 다양한 분석 기술이 발전하면서 금 나노입자에 대한 연구가 가속화되고 있다.나노입자 연구에 가장 많이 기여한 것은 원자력 현미경, 전자 현미경 등 첨단 현미경 기술이다.비교적 쉬운 합성과 높은 안정성 때문에 다양한 금 입자가 실용성을 위해 연구되어 왔다.다른 종류의 금 나노 입자가 전자제품과 같은 많은 산업에서 이미 사용되고 있다.
물리 속성
옵티컬

콜로이드 금은 나노 입자와 가시광선의 상호작용 때문에 수 세기 동안 예술가들에 의해 사용되어 왔다.금나노입자는 빛을 흡수하여 산란시켜[24] 입자의 크기, 모양, 국소 굴절률 및 응집 상태에 따라 선명한 빨간색(작은 입자)에서 푸른색(검은색)까지, 그리고 마지막으로 투명하고 무색(큰 입자)으로 변합니다.이 색깔들은 나노입자 표면의 전도 전자가 입사광과 공명하면서 진동하는 국소적 표면 플라즈몬 공명(LSPR)이라고 불리는 현상 때문이다.
사이즈의 효과
일반적으로 흡수되는 빛의 파장은 나노 [25]입경이 커지는 함수로 증가한다.예를 들어 직경이 30nm 이하인 의사 구면 금 나노입자는 최대 530nm의 [25][clarification needed]LSPR 흡수를 가진다.
국소굴절률의 영향
금 나노 입자 용액의 명백한 색의 변화는 금 콜로이드 금 나노 입자의 광학적 성질 suspended[26][27] 있는 환경에 의해 야기될 수 있는 나노 입자 표면 근처의 굴절률, 따라서 둘 다 있는 분자들을 직접적으로 나노 입자 표면에(즉 나노 입자 부착된 화면에 달려 있다.ligands) 및/또는 나노입자 용매는 모두 관찰된 [26]광학 특성에 영향을 미칠 수 있습니다.금 표면 근처의 굴절률이 증가함에 따라, NP LSPR은 더[27] 긴 파장으로 전환됩니다. 용매 환경 외에도, 나노 입자에 실리카, 바이오 분자 또는 [28]산화 알루미늄과 같은 비전도성 껍질을 코팅함으로써 소멸 피크를 조정할 수 있습니다.
집약 효과
금 나노 입자가 모이면 유효 입자의 크기, 모양, 유전체 환경이 모두 [29]바뀌기 때문에 입자의 광학 특성이 변한다.
의학 연구
전자 현미경 검사
콜로이드 금과 다양한 유도체는 생물학적 전자 현미경 [30][31][32][33][34]검사에서 가장 널리 사용되는 항원의 라벨 중 하나이다.콜로이드 금 입자는 항체, 렉틴, 슈퍼 안티겐, 글리칸, 핵산,[35] 수용체와 같은 많은 전통적인 생물학적 프로브에 부착될 수 있습니다.크기가 다른 입자는 전자 현미경에서 쉽게 구별할 수 있으므로 동시에 여러 개의 라벨을 붙이는 실험을 [36]할 수 있습니다.
금 나노입자는 생물학적 프로브 외에 운모, 단결정 실리콘, 원자 편평한 금(II) 등의 다양한 광물 기판에 전사되어 원자력 현미경법(AFM)[37]으로 관찰된다.
약물 전달 시스템
금 나노 입자는 약물 [38][39]전달을 개선하고 목표로 하기 위해 질병이 있는 장기, 조직 또는 세포에 대한 약물의 생물 분포를 최적화하기 위해 사용될 수 있다.나노입자 매개 약물 전달은 약물 배포가 부적절할 경우에만 가능하다.이러한 사례에는 불안정한 약물(단백질, siRNA, DNA), 어려운 부위로의 전달(뇌, 망막, 종양, 세포내 장기) 및 심각한 부작용이 있는 약물(예: 항암제)이 포함된다.나노 입자의 성능은 입자의 크기와 표면 기능에 따라 달라집니다.또한 약물 방출 및 입자 분해는 시스템에 따라 달라질 수 있습니다(예를 들어 pH에 민감한 생분해성 고분자).최적의 나노드러그 전달 시스템은 활성 약물이 올바른 시간 및 지속 시간 동안 작용 현장에서 사용 가능한 것을 보장하며, 그 농도는 최소 유효 농도(MEC) 이상 최소 독성 농도([40]MTC) 미만이어야 한다.
금 나노 입자는 파클리탁셀과 [41]같은 약물의 운반체로 조사되고 있다.소수성 약물의 투여에는 분자 캡슐화가 필요하며 나노 크기의 입자가 망상 내피계를 피하는 데 특히 효과적이라는 것이 밝혀졌다.
종양 검출
암 연구에서 콜로이드 골드는 종양을 목표로 하고 생체 내 SERs(표면 강화 라만 분광법)를 사용하여 검출을 제공하기 위해 사용될 수 있다.이들 금 나노입자는 양자점보다 200배 이상 밝은 빛을 내는 라만 리포터로 둘러싸여 있다.라만 리포터들은 나노 입자를 티올 변형 폴리에틸렌 글리콜 코팅으로 봉입했을 때 안정화된 것으로 밝혀졌다.이를 통해 생체 내 호환성과 순환이 가능합니다.특히 종양세포를 목표로 하기 위해 폴리에틸렌길화된 금 입자는 항체(또는 scFv와 같은 항체 단편)와 결합되며, 표피 성장인자 수용체는 때때로 특정 암 유형의 세포에서 과도하게 발현된다.SERS를 사용하여, 이 페길화된 금 나노 입자는 [42]종양의 위치를 탐지할 수 있습니다.
금나노입자는 종양 혈관의 누출로 종양에 축적되어 마우스 모델에서 피부암 검출용 단펄스 레이저를 이용한 시간 분해능 광학 단층 촬영 시스템에서 조영제로 사용할 수 있다.정맥에 투여된 구형 금 나노입자는 반사광신호의 시간 프로파일을 넓히고 주변 정상 조직과 [43]종양 사이의 대조도를 높인 것으로 밝혀졌다.
유전자 치료
금 나노 입자는 치료 효과가 최대인 siRNA 올리고뉴클레오티드의 세포내 전달 매개체로서의 가능성을 보여 왔다.
금나노입자는 세포내 핵산가수분해효소에 대한 보호와 선택적 [44]표적화를 용이하게 함으로써 안티센스 올리고뉴클레오티드(단가닥 및 이중가닥 DNA)의 세포내 전달 매개체로서의 가능성을 보여준다.
광열제
금 나노로드는 생체 내 응용에 광열제로 조사되고 있습니다.금 나노로드는 가시 파장에서 근적외선 파장으로 표면 플라즈몬 공명(SPR) 대역을 석면비가 조정하는 막대 모양의 금 나노 입자입니다.SPR의 총 소광은 흡수 및 산란으로 구성됩니다.축지름이 작은 나노로드(~10 nm)의 경우 흡수가 지배적인 반면 축지름이 큰 나노로드(>35 nm)의 경우 산란이 지배적이다.그 결과 생체 내 연구에서는 흡수 단면이 [45]높아 근적외광의 광열변환기로 소경 금나노로드가 활용되고 있다.근적외선은 사람의 피부와 조직을 통해 쉽게 전달되기 때문에 나노로드는 암 등의 절제 성분으로 사용될 수 있다.고분자로 코팅되면 금나노로드는 반감기가 6시간 이상이고 체내 체류시간이 72시간 정도이며 [46]간을 제외한 내부 장기는 거의 또는 전혀 흡수되지 않는 것으로 관찰되었다.
금 나노로드는 임상 전 연구에서 광열제로써 의심할 여지 없이 성공했지만, 크기가 신장 배설 역치를 [47][48]초과하기 때문에 임상 사용 승인을 받지 못했다.2019년에는 (i)고온증 치료에 적합한 광열 변환, (ii)다중 광열 치료의 가능성 및 (ii) 치료 작용 [49]후 빌딩 블록의 신장 배설의 가능성을 포함한 최초의 NIR 흡수 플라스몬 초소형 올인 나노 아키텍처가 보고되었다.
방사선 치료량 증가제
종양에 [50]전달되는 선량을 높이기 위해 금 및 기타 중원자 함유 나노 입자의 사용에 상당한 관심이 보여졌습니다.금나노입자는 가까운 건강한 조직보다 종양에 더 많이 흡수되기 때문에 선량이 선택적으로 증가한다.이 치료법의 생물학적 효과는 [51]나노입자 근처에 방사선량이 국소적으로 축적되기 때문인 것으로 보인다.이 메커니즘은 중이온 치료에서 발생하는 것과 동일합니다.
유독가스 검출
연구진이 금나노입자(AuNPs)의 응집방지에 기초해 공기 중에 존재하는 황화수소
2 HS를 현장 검출하기 위한 단순하고 저렴한 방법을 개발했다.HS를 약한 알칼리성 완충액에 용해시키면
2 HS-가 형성되어 AuNP를 안정시키고 HS의 [52]독성
2 수준을 시각적으로 검출할 수 있도록 붉은색을 유지할 수 있다.
금 나노 입자 기반 바이오 센서
금 나노입자가 바이오센서에 포함되어 안정성, 감도, 선택성을 [53]향상시킵니다.작은 크기, 높은 표면 대 체적비, 높은 표면 에너지와 같은 나노 입자 특성은 광범위한 생체 분자의 고정화를 가능하게 한다.특히 금 나노 입자는 전자를 운반하는 "전자선" 역할을 할 수 있으며 전자광에 대한 증폭 효과를 통해 [54][55]신호 증폭기 역할을 할 수 있다.금 나노입자 기반 바이오센서는 광학, 전기화학 바이오센서 등이 대표적이다.
옵티컬 바이오센서

금 나노입자는 국소 굴절률 변화에 반응하여 광학 센서의 감도를 향상시킨다.광파와 금속 전도 전자 사이의 상호작용인 표면 플라스몬 공명에 대한 입사광의 각도는 다른 물질이 [56][57]금속 표면에 결합될 때 변화합니다.금은 주변의 유전율에 [58][59]매우 민감하기 때문에, 분석 물질의 결합은 금 나노 입자의 SPR을 크게 이동시켜 더 민감한 검출을 가능하게 할 것이다.금 나노 입자는 또한 SPR 신호를 [60]증폭시킬 수 있다.플라즈몬파가 금 나노 입자를 통과할 때, 파동의 전하 밀도와 금의 전자 I이 상호작용하여 전자 [53]결합이라고 불리는 더 높은 에너지 반응을 초래했습니다.분석물질과 생체수용체가 금에 결합하기 때문에 분석물질의 겉보기 질량을 증가시켜 신호를 [53]증폭시킨다.이러한 특성은 Au [61]NP가 없는 경우보다 1000배 민감한 DNA 센서를 구축하는 데 사용되었습니다.습도 센서도 습도 변화에 따라 분자 간의 원자 간 간격을 변경하여 제작되었으며, 이 간격의 변화로 인해 Au NP의 [62]LSPR도 변경됩니다.
전기화학 바이오센서
전기화학 센서는 생체 정보를 감지 가능한 전기 신호로 변환합니다.Au NP의 전도성과 생체적합성으로 인해 "전자선"[53] 역할을 할 수 있습니다.그것은 전극과 [63]효소의 활성 부위 사이에서 전자를 전달합니다.Au NP를 효소 또는 전극에 부착하는 두 가지 방법으로 수행할 수 있습니다.GNP-포도당 산화효소 단분자 전극은 이 두 [64]가지 방법으로 구성되었다.Au NP는 효소의 배향에 있어 보다 자유롭고, 따라서 보다 민감하고 안정적인 검출을 가능하게 했다.Au NP는 또한 효소의 고정화 플랫폼 역할을 한다.대부분의 생체 분자는 [53]전극과 상호작용할 때 변성되거나 활성을 잃습니다.Au는 생체적합성과 높은 표면 에너지로 활성 변화 없이 많은 양의 단백질과 결합할 수 있어 보다 민감한 [65][66]센서가 됩니다.또한 Au NP는 생물학적 [67][68]반응을 촉매한다.2nm 미만의 금 나노 입자는 스티렌의 [69]산화에 촉매 활성을 보였다.
면역 바이오센서
금 나노입자는 면역학적 검출방법에 [70]사용하기 위해 펩타이드와 글리칸으로 코팅되어 있다.ELISA에서 글리코나노 입자를 사용할 가능성은 예상하지 못했지만, 이 방법은 높은 감도를 가진 것으로 보여 환자 혈청 내 항체 식별을 위한 특정 분석법의 개발 가능성을 제공한다.
박막
알칸티오르 분자와 같은 유기 리간드로 덮인 금 나노 입자는 큰 단분자층(cm2)으로 자가 할 수 있습니다(cm2}})입자는 클로로포름이나 톨루엔과 같은 유기 용매에서 먼저 준비되고 액체 표면 또는 고체 기판 위에 단분자로 확산됩니다.이러한 나노입자의 계면 박막은 계면활성제로 만들어진 랑뮤르-블로젯 단분자와 밀접한 관계가 있다.
나노 입자 단분자의 기계적 특성은 광범위하게 연구되어 왔다.도데카네티오르로 덮인 5nm 구체의 경우 단층 영률은 GPa [72]수준이다.막의 역학은 인접한 [73]입자의 리간드 셸 사이의 강한 상호작용에 의해 유도된다.파단 시에는 11± \ 2.6 MPa의 파단응력에서 변형방향과 수직으로 균열이 발생하며, 이는 가교 폴리머 [74]필름과 같다.독립형 나노입자막은 입자 회전자유도의 [75]비국소 결합 등 비국소 미세구조적 제약조건으로 인해 동일한 두께의 연속체 판에 대해 이론적으로 예측된 것보다 높은 5({ 스타일 ^5의 굽힘강성을 보인다.한편 공기/수면에서 지지되는 나노입자 단분자층에서는 습윤환경에서의 [76]리간드 상호작용 스크리닝에 의해 굽힘에 대한 내성이 현저하게 저하되는 것을 알 수 있다.
표면화학
다양한 유형의 콜로이드 금 합성에서 나노 입자의 계면은 자기조립 단분자와 유사한 계면에서 반복 패턴이 [77]없는 무질서한 경계까지 매우 다른 특성을 나타낼 수 있습니다.Au-Ligand 계면을 넘어, 다양한 기능 부분(작은 유기 분자, 폴리머, DNA, RNA)과 계면 리간드의 결합은 광범위한 기능성의 상당 부분을 콜로이드 금으로 제공한다.
리간드 교환/기능화
초기 나노입자 합성 후 콜로이드 금 리간드는 종종 특정 용도에 맞게 설계된 새로운 리간드와 교환된다.예를 들어 Turkevich식([78]또는 Citrate Reduction)법으로 생성된 Au NP는 카르복실기와 NP의 표면과의 결합이 비교적 약하기 때문에 리간드 교환 반응을 통해 쉽게 반응한다.이 배위자 교환은 생체적합성과 기능성을 높이기 위해 DNA에서 RNA, 단백질에서 중합체(PEG와 같은)에 이르는 많은 생체 분자와의 결합을 생성할 수 있습니다.예를 들어, 리간드는 특정 산소화 [79]반응을 위해 흡착액과 활성 금 표면 사이의 상호작용을 매개하여 촉매 활성을 높이는 것으로 나타났다.리간드 교환은 콜로이드 [77]입자의 상전달을 촉진하기 위해서도 사용할 수 있다.배위자 [80][81]이탈 속도를 촉진하기 위해서는 더 높은 온도가 필요하지만, Brust형 합성법에서 생성된 알칸티올-아레스트 NPs와 리간드 교환도 가능하다.리간드와 다른 분자의 결합을 통해 추가적인 기능화를 위한 대체 방법을 얻을 수 있지만, 이 방법은 Au NPs의 콜로이드 안정성을 [82]파괴할 수 있다.
배위자 제거
많은 경우 Au의 다양한 고온 촉매 적용과 마찬가지로 캡 리간드의 제거는 보다 바람직한 물리화학적 [83]특성을 생성한다.Au NP당 Au 원자의 수를 비교적 일정하게 유지하면서 콜로이드 금에서 리간드를 제거하는 것은 이러한 맨 클러스터가 집적되는 경향 때문에 어려울 수 있다.리간드의 제거는 모든 과도한 캡핑 리간드를 간단히 씻어냄으로써 부분적으로 달성될 수 있지만, 이 방법은 모든 캡핑 리간드를 제거하는 데는 효과적이지 않다.고온 또는 가벼운 절제 상태에서 세척 후 리간드 제거가 이루어지는 경우가 많습니다.또는 전기화학적으로 리간드를 [84]식각할 수 있다.
표면구조 및 화학적 환경
콜로이드 금 NP 표면에 있는 리간드의 정확한 구조는 콜로이드 금 입자의 특성에 영향을 미친다.콜로이드 금 NP의 표면에서 캡핑 리간드의 결합 형태 및 표면 패킹은 나노 입자 [77]표면에서 관찰되는 높은 곡률 때문에 벌크 표면 모델 흡착과는 크게 다른 경향이 있다.나노스케일의 티올레이트-금 계면은 잘 연구되었으며 티올레이트 배위자는 티올레이트-Au(0) 특성이 [85][86]유의한 "스태플" 모티브를 위해 입자의 표면에서 Au 원자를 끌어내는 것으로 관찰되었습니다.반면 구연산염-금 표면은 곡면 금 표면에 대한 구연산염의 결합 구조가 매우 많기 때문에 상대적으로 덜 연구됩니다.2014년에 수행된 연구에 따르면 구연산염의 가장 선호하는 결합은 2개의 카르본산과 구연산염의 수산기가 3개의 표면 금속 [87]원자와 결합하는 것으로 확인되었다.
건강과 안전
금나노입자(AuNPs)가 인체 표적 약물 전달을 위해 추가로 조사됨에 따라 이들의 독성을 고려할 필요가 있다.대부분의 경우 AuNP는 [citation needed]생체적합성이지만 독성이 되는 농도는 측정해야 하며, 그 농도가 사용된 농도의 범위 내에 있는지 확인해야 한다.독성은 체외 및 체외에서 시험할 수 있다.시험관내 독성 결과는 단백질 조성이 다른 세포 성장 배지의 종류, 세포 독성(세포 건강, 세포 스트레스, 세포 내 세포 수)을 결정하는 방법 및 용액 내 [88]캡핑 리간드에 따라 달라질 수 있다.생체내 평가는 조직 고유의 독성학(신장, 간, 혈액), 염증 및 산화 [88]반응뿐만 아니라 유기체의 일반적인 건강(이상 행동, 체중 감소, 평균 수명)을 결정할 수 있다.체외 실험은 체내 [88]실험보다 수행하기가 더 간단하기 때문에 체외 실험은 체내 실험보다 더 인기가 있다.
합성 시 독성 및 위험
AuNPs 자체는 [citation needed]독성이 낮거나 무시할 수 있는 것으로 보이며, 문헌에 따르면 독성은 입자 자체보다는 리간드와 훨씬 더 관련이 있는 것으로 나타나지만, 이들의 합성은 위험한 화학물질을 포함한다.금 이온을 금 금속으로 환원하기 위해, 가혹한 시약인 붕화수소나트륨이 사용됩니다.[89]금 이온은 보통 강력한 [90]산인 클로로아우르산으로부터 나온다.AuNP를 합성하는 데 사용되는 시약의 높은 독성과 위험 때문에, 더 많은 "친환경" 합성 방법이 필요하게 되었다.
캡 리간드로 인한 독성
AuNPs와 관련된 캡핑 리간드 중 일부는 독성이 있을 수 있고 다른 일부는 독성이 없을 수 있습니다.금나노로드(AuNRs)에서는 저농도의 CTAB 안정화 AuNRs와 강한 세포독성이 관련되어 있는 것으로 나타났으나, 유리 CTAB가 [90][91]독성의 원인으로 생각되고 있다.이러한 AuNR을 오버로드하는 변형은 CTAB 분자가 AuNR에서 [90]용액으로 탈착되는 것을 방지함으로써 인간 대장암 세포(HT-29)의 독성을 감소시킵니다.리간드 독성은 AuNPs에서도 나타난다.동일한 농도에서 HAuCl4의 90% 독성과 비교하여 카르복실산염 터미니를 가진 AuNPs는 [92]무독성으로 나타났다.비오틴, 시스테인, 구연산염, 포도당과 결합된 큰 AuNP는 인간 백혈병 세포(K56)에서 최대 0.25M의 [93]농도로 독성이 없었다. 또한 구연산 캡 금나노스피어(AuNS)는 사람의 혈액과 양립할 수 있으며 혈소판 응집이나 면역 [94]반응을 일으키지 않았다.그러나 837nm 크기의 구연산 금 나노입자는 생쥐에게 치명적인 독성이 있어 수명 단축, 심각한 질병, 식욕 및 체중 감소, 머리카락 변색, 간, 비장, 폐 손상을 유발한다. 즉 면역체계의 [95]한 부분을 이동한 후 비장과 간에 축적된 금 나노입자.폴리에틸렌 글리콜(PEG) 수식 AuNP에는 여러 가지 견해가 있습니다.이러한 AuNPs는 주입에 의해 마우스 간에서 독성이 발견되어 세포사망과 경미한 [96]염증을 유발하였다.그러나 PEG 공중합체와 결합된 AuNPs는 인간 대장 세포에 대해 무시해도 될 정도의 독성을 보였다(Caco-2).[97]AuNP 독성 또한 리간드의 전체 전하량에 따라 달라집니다.AuNS가 음전하 세포막과 상호작용하기 때문에 특정 용량에서 양전하 리간드를 가진 AuNS는 원숭이 신장 세포(Cos-1), 인간 적혈구 및 대장균에서 독성이 있다. 음전하 리간드를 가진 AuNS는 [92]이들 종에서 독성이 없는 것으로 밝혀졌다.앞서 언급한 체내 및 체외 실험 외에 다른 유사한 실험이 수행되었다.트리메틸암모늄 리간드 터미니를 가진 알킬티올레이트-AuNPs는 체외에서 포유류 세포막을 가로지르는 DNA의 전이를 높은 수준으로 매개하며, 이는 이들 [98]세포에 해롭다.토끼의 각막 아지랑이는 상처치유를 촉진하고 각막섬유화를 [99]억제하는 유전자에 의해 트랜스감염된 폴리에틸렌미닌 뚜껑의 금 나노입자를 사용하여 생체 내에서 치유되었다.
나노입자 크기에 따른 독성
특정 시스템의 독성은 나노 입자의 크기에 따라 달라질 수 있습니다.1.4nm 크기의 AuNS는 인간 피부암 세포(SK-Mel-28), 인간 자궁경부암 세포(HeLa), 마우스 섬유아세포 세포(L929), 마우스 대식세포(J774A.1)에서 독성이 발견된 반면, 0.8, 1.2, 1.8nm 크기의 AuNS는 독성이 15nm 정도 낮았다.생체내 연구 주입 후 AuNP 축적이 있다는 증거가 있지만, 이는 크기에 따라 매우 다르다. 1.8nm AuNPs는 [100]쥐의 폐에 거의 완전히 갇힌 것으로 밝혀졌다.혈액,[101][102] 뇌,[101] 위,[101] [101]췌장, 신장,[101] 간,[101][102] [101][102]비장에 서로 다른 크기의 AuNP가 축적되는 것으로 확인되었다.
생분해성 초강력 나노 아키텍처에 대한 생물안전성과 생물역동학 연구는 금 나노 입자가 신장 [103][104]경로를 통해 탈출함으로써 유기체 내 금속 축적을 피할 수 있다는 것을 증명했다.
합성
일반적으로 금나노입자는 클로로아우르산(H
4[AuCl])의 환원에 의해 액체('액체 화학법')에서 생성된다.입자가 응집되는 것을 방지하기 위해 안정화제를 첨가한다.구연산염은 환원제와 콜로이드 안정제 역할을 모두 한다.
다양한 유기 리간드로 기능화할 수 있어 고도의 [17]기능을 가진 유기-유기 하이브리드를 만들 수 있습니다.
투르케비치법
이 간단한 방법은 J에 의해 개척되었다.1951년[105][106] Turkevich et al.에 의해 정제되고 G에 의해 정제되었다.1970년대 [107][108]프렌즈.직경 약 10~20nm의 약간 단분산된 구형 금 나노 입자를 생성한다.더 큰 입자를 만들 수 있지만 단분산성과 형태를 희생합니다.뜨거운 클로로아우르산을 구연산나트륨 용액으로 처리하여 콜로이드 금을 제조한다.투르케비치 반응은 일시적인 금 나노와이어의 형성을 통해 진행된다.이 금 나노와이어들은 반응 용액이 루비-레드로 [109]변하기 전에 어두운 모습을 보이는 원인이 됩니다.
캡 에이전트
나노입자 합성 시 입자 성장 및 집적을 저해하기 위해 캡핑제를 사용한다.이 화학 물질은 입자 주변에서의 반응성을 차단하거나 감소시킵니다. 좋은 캡형제는 새로운 [110]핵에 대한 높은 친화력을 가집니다.구연산 이온 또는 타닌산은 환원제와 캡제로서 [111][112]기능한다.구연산나트륨이 적으면 입자가 커진다.
브루스트 쉬프린법
이 방법은 1990년대 [113]초 브루스트와 쉬프린에 의해 발견되었으며 일반적으로 물과 혼합되지 않는 유기 액체(톨루엔 등)에서 금 나노 입자를 생성하는 데 사용될 수 있다.클로로우르산 용액과 톨루엔의 테트라옥틸암모늄 브롬화물(TOAB) 용액과 항응고제 및 환원제로서의 붕소수소나트륨의 반응을 포함한다.
여기서 금나노입자는 5~6nm [114]정도로 NaBH는 환원제, TOAB는 상전달 촉매이자 안정화제이다.
TOAB는 금 나노입자에 특별히 강하게 결합하지 않기 때문에 약 2주 동안 용액이 서서히 응집됩니다.이를 방지하기 위해 티올(특히 알칸티올)과 같은 더 강한 결합제를 첨가하면 금에 결합해 영속적인 [115][116]용액을 만들 수 있다.알칸티오르 보호 금 나노 입자를 침전시킨 후 다시 녹일 수 있다.티올은 두 물질이 서로 [117]반응할 때 형성되는 금-황 결합에 강한 친화력이 있기 때문에 더 좋은 결합제입니다.테트라-도데칸티올은 작은 [118]입자를 합성하기 위해 일반적으로 사용되는 강한 결합제이다.상전달제 중 일부는 정제된 나노입자에 결합되어 있을 수 있으며, 이는 용해성과 같은 물리적 특성에 영향을 미칠 수 있다.이 물질을 가능한 한 많이 제거하기 위해서는 나노 입자를 삭슬렛 추출에 의해 더욱 정제해야 한다.
퍼로법
2009년 [119]Perrault와 Chan에 의해 발견된 이 접근법은 15nm의 금 나노입자 씨앗을 포함하는 수용액에서 HauCl을4 감소시키기 위해 하이드로퀴논을 사용한다.이 종자 기반 합성 방법은 사진 필름 현상 시 사용되는 방법과 유사하며, 필름 내의 은 입자가 표면에 환원된 은을 첨가하여 성장합니다.마찬가지로, 금 나노 입자는 하이드로퀴논과 함께 작용하여 표면에 이온성 금의 축소를 촉매할 수 있습니다.구연산염과 같은 안정제의 존재는 금 원자의 입자에 대한 퇴적과 성장을 제어한다.전형적으로 구연산염법을 이용하여 나노입자 종자를 생산한다.하이드로퀴논 방법은 제조할 수 있는 단분산 구형 입자의 범위를 확장하기 때문에 Frens의 [107][108]방법을 보완합니다.Frens 방법은 12~20nm의 입자에 이상적이지만 하이드로퀴논 방법은 최소 30~300nm의 입자를 생성할 수 있다.
마틴법
마틴과 [120]Eah가 2010년에 발견한 이 간단한 방법은 물 속에서 거의 단분산된 금 나노 입자를 생성한다.가열과 함께 "sweet zone" 내에서 HauCl-HCl4 이온에 대한 NaBH-NaOH 이온의 비율을 조정하여 환원 화학량계를 정밀하게 제어함으로써 3~6 nm의 재현 가능한 직경 조정이 가능하다.수용성 입자는 용액의 과도한 이온으로 인해 높은 전하를 띠기 때문에 콜로이드적으로 안정적입니다.이러한 입자는 다양한 친수성 기능으로 코팅되거나 비극성 용제에 적용하기 위해 소수성 리간드와 혼합될 수 있습니다.무극성 용매에서는 나노 입자가 높은 하전 상태를 유지하고 액체 방울 위에서 자가 조립하여 단분산 나노 입자의 2D 단분자막을 형성합니다.
나노테크 연구
리세니폼균은 10~100나노미터 [121]크기의 금나노튜브 합성에 사용할 수 있다.금 나노 입자는 보통 유기 용제나 독성 시약을 사용하여 고온에서 합성됩니다.박테리아는 훨씬 더 온화한 조건에서 그것들을 생산한다.
30 nm보다 큰 입자의 경우 구형 금 나노 입자의 다분산성이 낮은 입자의 크기를 제어하는 것은 여전히 어려운 일이다.NP 구조를 최대한 제어하기 위해 Navarro와 동료들은 환원제로 아세틸아세톤산나트륨, 안정제로 [122]구연산나트륨을 사용하는 변형된 Turkevitch-Frens 절차를 사용했습니다.
소놀리스
금 입자를 실험적으로 생성하는 또 다른 방법은 소놀리시스이다.이런 유형의 첫 번째 방법은 Baigent와 Muller에 [123]의해 발명되었다.이 연구는 관련된 과정에 에너지를 제공하기 위해 초음파의 사용을 개척했고 직경 10nm 미만의 금 입자를 만들 수 있었다.또 다른 방법은 초음파, 사용함에 있어서 HAuCl4의 수용액의 glucose,[124]을 줄이는 요원들 중 수산화 급진파와 설탕 열 분해 급진 주의자들은 반응(는 계면 영역에 붕괴 파문이 충치나 벌크 물 사이에 형성되는 극심)과 형태를 폭 30–50 nm과 severa의 길이와 nanoribbons다.나는 mic로미터이 리본은 매우 유연하고 90° 이상의 각도로 구부릴 수 있습니다.포도당이 시클로덱스트린(글루코오스 올리고머)으로 대체되면 구형 금 입자만 얻어지는데, 이는 포도당이 리본으로 형태학을 유도하는 데 필수적이라는 것을 암시한다.
블록공중합체 매개법
블록공중합체를 이용한 금 나노입자의 경제적이고 환경 친화적이며 빠른 합성 방법론이 Sakai [125]등에 의해 개발되었습니다.본 합성방법론에서 블록공중합체는 환원제 및 안정화제의 이중역할을 한다.금나노입자의 형성은 3가지 주요 단계로 구성된다: 금괴의 용액과 형성에서의 블록공중합체에 의한 금염 이온의 감소, 금괴에서의 블록공중합체의 흡착, 금괴의 성장을 위한 이들 금괴의 표면에서의 금염 이온의 추가 감소, 그리고 마지막으로 그 찌그러짐.블록 공중합체에 의한 일화.그러나 이 방법은 보통 한정된 수율(나노입자 농도)을 가지며, 이는 금염 농도의 증가에 따라 증가하지 않는다.Ray [126]등은 주변 온도에서 나노 입자 수율을 여러 배 향상시킴으로써 이 합성 방법을 개선했다.
적용들
항생제 복합 나노 입자 합성
항생제 기능화 금속 나노입자는 다제내성 세균주를 치료하기 위한 방법으로 널리 연구되어 왔다.예를 들어, 카나마이신 캡 금나노입자(Kan-AuPs)는 카나마이신 [127]단독과 비교하여 그램 양성 및 그램 음성 세균주 양쪽에 대해 넓은 스펙트럼 용량 의존 항균 활성을 보였다.
「 」를 참조해 주세요.
레퍼런스
- ^ Voliani, Valerio (2020-04-20). Gold Nanoparticles: An Introduction to Synthesis, Properties and Applications. De Gruyter. doi:10.1515/9781501511455. ISBN 978-1-5015-1145-5. S2CID 219789607.
- ^ Sapsford KE, Algar WR, Berti L, Gemmill KB, Casey BJ, Oh E, Stewart MH, Medintz IL (March 2013). "Functionalizing nanoparticles with biological molecules: developing chemistries that facilitate nanotechnology". Chemical Reviews. 113 (3): 1904–2074. doi:10.1021/cr300143v. PMID 23432378. S2CID 206896854.
- ^ Sreekumar, S.; Shah, N.; Mondol, J.; Hewitt, N.; Chakrabarti, S. (February 2022). "Broadband absorbing mono, blended and hybrid nanofluids for direct absorption solar collector: A comprehensive review" (PDF). Nano Futures. 103: 504–515. doi:10.1088/2399-1984/ac57f7. S2CID 247095942.
- ^ Gorji, Saleh; Cheong, Kuan Yew (2015). "Au nanoparticles embedded at the interface of Al/4H-SiC Schottky contacts for current density enhancement". Applied Physics A. 118: 315–325. doi:10.1007/s00339-014-8733-4. S2CID 96824985.
- ^ Torres-Torres, D.; Trejo-Valdez, M.; Castañeda, L.; Torres-Torres, C.; Tamayo-Rivera, L.; Fernández-Hernández, R. C.; Reyes-Esqueda, J. A.; Muñoz-Saldaña, J.; Rangel-Rojo, R.; Oliver, A. (2010-08-02). "Inhibition of the two-photon absorption response exhibited by a bilayer TiO2 film with embedded Au nanoparticles". Optics Express. 18 (16): 16406–16417. doi:10.1364/OE.18.016406. ISSN 1094-4087. PMID 20721027.
- ^ Yang X, Yang M, Pang B, Vara M, Xia Y (October 2015). "Gold Nanomaterials at Work in Biomedicine". Chemical Reviews. 115 (19): 10410–88. doi:10.1021/acs.chemrev.5b00193. PMID 26293344.
- ^ Mulvaney P (2003). The beauty and elegance of Nanocrystals: How invisibly small particles will colour and shape our future (Report). University of Melbourne. Archived from the original on 2004-10-28.
- ^ Rao CN, Kulkarni GU, Thomas PJ, Edwards PP (2000). "Metal nanoparticles and their assemblies". Chemical Society Reviews. 29 (1): 27–35. doi:10.1039/A904518J. S2CID 59025862.
- ^ Dreaden EC, Alkilany AM, Huang X, Murphy CJ, El-Sayed MA (April 2012). "The golden age: gold nanoparticles for biomedicine". Chemical Society Reviews. 41 (7): 2740–79. doi:10.1039/c1cs15237h. PMC 5876014. PMID 22109657.
- ^ Zeng S, Yong KT, Roy I, Dinh XQ, Yu X, Luan F (2011). "A review on functionalized gold nanoparticles for biosensing applications" (PDF). Plasmonics. 6 (3): 491–506. doi:10.1007/s11468-011-9228-1. S2CID 34796473.
- ^ a b Sharma V, Park K, Srinivasarao M (2009). "Colloidal dispersion of gold nanorods: Historical background, optical properties, seed-mediated synthesis, shape separation and self-assembly". Materials Science and Engineering: R: Reports. 65 (1–3): 1–38. doi:10.1016/j.mser.2009.02.002.
- ^ "The Lycurgus Cup". British Museum. Retrieved 2015-12-04.
- ^ Freestone I, Meeks N, Sax M, Higgitt C (2007). "The Lycurgus Cup — A Roman nanotechnology". Gold Bulletin. 40 (4): 270–277. doi:10.1007/BF03215599.
- ^ Antonii F (1618). Panacea aurea sive Tractatus duo de ipsius auro potabili. Ex Bibliopolio Frobeniano.
- ^ Culpeper N (1657). Mr. Culpepper's Treatise of aurum potabile Being a description of the three-fold world, viz. elementary celestial intellectual containing the knowledge necessary to the study of hermetick philosophy. Faithfully written by him in his life-time, and since his death, published by his wife. London.
- ^ Kunckel von Löwenstern J (1678). Utiles observationes sive animadversiones de salibus fixis et volatilibus, auro et argento potabili (etc.). Austria: Wilson.
- ^ a b Reddy VR (July 2006). "Gold nanoparticles: synthesis and applications". Synlett. 2006 (11): 1791–2. doi:10.1055/s-2006-944219.
- ^ a b Faraday M (January 1857). "The Bakerian Lecture: Experimental Relations of Gold (and Other Metals) to Light". Philosophical Transactions of the Royal Society of London. 147: 145–181. Bibcode:1857RSPT..147..145F. doi:10.1098/rstl.1857.0011.
- ^ "Michael Faraday's gold colloids The Royal Institution: Science Lives Here". www.rigb.org. Retrieved 2015-12-04.
- ^ Gay-Lussac (1832). "Ueber den Cassius'schen Goldpurpur". Annalen der Physik. 101 (8): 629–630. Bibcode:1832AnP...101..629G. doi:10.1002/andp.18321010809.
- ^ Berzelius JJ (1831). "Ueber den Cassius' schen Goldpurpur". Annalen der Physik. 98 (6): 306–308. Bibcode:1831AnP....98..306B. doi:10.1002/andp.18310980613.
- ^ Zsigmondy R (December 11, 1926). "Properties of colloids" (PDF). Nobel Foundation. Retrieved 2009-01-23.
- ^ Zeng S, Yu X, Law W, Zhang Y, Hu R, Dinh X, H o H, Yong K (2013). "Size dependence of Au NP-enhanced surface plasmon resonance based on differential phase measurement". Sensors and Actuators B: Chemical. 176: 1128–1133. doi:10.1016/j.snb.2012.09.073.
- ^ Anderson ML, Morris CA, Stroud RM, Merzbacher CI, Rolison DR (1999-02-01). "Colloidal Gold Aerogels: Preparation, Properties, and Characterization". Langmuir. 15 (3): 674–681. doi:10.1021/la980784i.
- ^ a b Link S, El-Sayed MA (1999-05-01). "Size and Temperature Dependence of the Plasmon Absorption of Colloidal Gold Nanoparticles". The Journal of Physical Chemistry B. 103 (21): 4212–4217. CiteSeerX 10.1.1.596.6328. doi:10.1021/jp984796o.
- ^ a b Ghosh SK, Nath S, Kundu S, Esumi K, Pal T (2004-09-01). "Solvent and Ligand Effects on the Localized Surface Plasmon Resonance (LSPR) of Gold Colloids". The Journal of Physical Chemistry B. 108 (37): 13963–13971. doi:10.1021/jp047021q.
- ^ a b Underwood S, Mulvaney P (1994-10-01). "Effect of the Solution Refractive Index on the Color of Gold Colloids". Langmuir. 10 (10): 3427–3430. doi:10.1021/la00022a011.
- ^ Xing S, Tan LH, Yang M, Pan M, Lv Y, Tang Q, Yang Y, Chen H (2009-05-12). "Highly controlled core/shell structures: tunable conductive polymer shells on gold nanoparticles and nanochains". Journal of Materials Chemistry. 19 (20): 3286. doi:10.1039/b900993k. S2CID 96293198.
- ^ Ghosh SK, Pal T (November 2007). "Interparticle coupling effect on the surface plasmon resonance of gold nanoparticles: from theory to applications". Chemical Reviews. 107 (11): 4797–862. doi:10.1021/cr0680282. PMID 17999554. S2CID 46326525.
- ^ Horisberger M, Rosset J (April 1977). "Colloidal gold, a useful marker for transmission and scanning electron microscopy". The Journal of Histochemistry and Cytochemistry. 25 (4): 295–305. doi:10.1177/25.4.323352. PMID 323352.
- ^ Electron microscopy: principles and techniques for biologists (2nd ed.). Jones and Bartlett. October 1998. ISBN 978-0-7637-0192-5.
- ^ Hunter EE (September 1993). Practical electron microscopy : a beginner's illustrated guide (2nd ed.). Cambridge University Press. ISBN 978-0-521-38539-8.
- ^ Electron microscopy: methods and protocols. Methods in Molecular Biology (2nd ed.). Humana Press. February 2007. ISBN 978-1-58829-573-6.
- ^ Romano EL, Romano M (1977). "Staphylococcal protein a bound to colloidal gold: A useful reagent to label antigen-antibody sites in electron microscopy". Immunochemistry. 14 (9–10): 711–715. doi:10.1016/0019-2791(77)90146-X.
- ^ Fetni R, Drouin R, Lemieux N, Messier PE, Richer CL (December 1991). "Simultaneous visualization of chromosome bands and hybridization signal using colloidal-gold labeling in electron microscopy". Proceedings of the National Academy of Sciences of the United States of America. 88 (23): 10916–20. Bibcode:1991PNAS...8810916F. doi:10.1073/pnas.88.23.10916. PMC 53043. PMID 1961763.
- ^ Kasamatsu H, Lin W, Edens J, Revel JP (July 1983). "Visualization of antigens attached to cytoskeletal framework in animal cells: colocalization of simian virus 40 Vp1 polypeptide and actin in TC7 cells". Proceedings of the National Academy of Sciences of the United States of America. 80 (14): 4339–43. Bibcode:1983PNAS...80.4339K. doi:10.1073/pnas.80.14.4339. PMC 384033. PMID 6308616.
Double labeling with colloidal gold particles of different sizes
- ^ Grobelny J, DelRio FW, Pradeep N, Kim DI, Hackley VA, Cook RF (2011). "Size measurement of nanoparticles using atomic force microscopy". In McNeil SE (ed.). Characterization of nanoparticles intended for drug delivery. Humana Press. pp. 71–82. ISBN 978-1-60327-198-1.
- ^ Han G, Ghosh P, Rotello VM (February 2007). "Functionalized gold nanoparticles for drug delivery". Nanomedicine. 2 (1): 113–23. doi:10.2217/17435889.2.1.113. PMID 17716197.
- ^ Han G, Ghosh P, Rotello VM (2007). "Multi-functional gold nanoparticles for drug delivery". Bio-Applications of Nanoparticles. Advances in Experimental Medicine and Biology. Vol. 620. pp. 48–56. doi:10.1007/978-0-387-76713-0_4. ISBN 978-0-387-76712-3. PMID 18217334.
- ^ Langer R (February 2000). "Biomaterials in drug delivery and tissue engineering: one laboratory's experience". Accounts of Chemical Research. 33 (2): 94–101. doi:10.1021/ar9800993. PMID 10673317.
- ^ Gibson JD, Khanal BP, Zubarev ER (September 2007). "Paclitaxel-functionalized gold nanoparticles". Journal of the American Chemical Society. 129 (37): 11653–61. doi:10.1021/ja075181k. PMID 17718495. S2CID 12034022.
- ^ Qian X, Peng XH, Ansari DO, Yin-Goen Q, Chen GZ, Shin DM, Yang L, Young AN, Wang MD, Nie S (January 2008). "In vivo tumor targeting and spectroscopic detection with surface-enhanced Raman nanoparticle tags". Nature Biotechnology. 26 (1): 83–90. doi:10.1038/nbt1377. PMID 18157119. S2CID 15309464.
- ^ Sajjadi AY, Suratkar AA, Mitra KK, Grace MS (2012). "Short-Pulse Laser-Based System for Detection of Tumors: Administration of Gold Nanoparticles Enhances Contrast". Journal of Nanotechnology in Engineering and Medicine. 3 (2): 021002. doi:10.1115/1.4007245.
- ^ Giljohann DA, Seferos DS, Prigodich AE, Patel PC, 미르킨 CA.다가의 siRNA-나노입자 결합에 의한 유전자 조절.Jam Chem Soc 2009; 131:2072–2073.
- ^ Mackey MA, Ali MR, Austin LA, Near RD, El-Sayed MA (February 2014). "The most effective gold nanorod size for plasmonic photothermal therapy: theory and in vitro experiments". The Journal of Physical Chemistry B. 118 (5): 1319–26. doi:10.1021/jp409298f. PMC 3983380. PMID 24433049.
- ^ Niidome T, Yamagata M, Okamoto Y, Akiyama Y, Takahashi H, Kawano T, Katayama Y, Niidome Y (September 2006). "PEG-modified gold nanorods with a stealth character for in vivo applications". Journal of Controlled Release. 114 (3): 343–7. doi:10.1016/j.jconrel.2006.06.017. PMID 16876898.
- ^ Cassano, Domenico; Pocoví-Martínez, Salvador; Voliani, Valerio (2018-01-17). "Ultrasmall-in-Nano Approach: Enabling the Translation of Metal Nanomaterials to Clinics". Bioconjugate Chemistry. 29 (1): 4–16. doi:10.1021/acs.bioconjchem.7b00664. ISSN 1043-1802. PMID 29186662.
- ^ Vlamidis, Ylea; Voliani, Valerio (2018-10-08). "Bringing Again Noble Metal Nanoparticles to the Forefront of Cancer Therapy". Frontiers in Bioengineering and Biotechnology. 6: 143. doi:10.3389/fbioe.2018.00143. ISSN 2296-4185. PMC 6186777. PMID 30349817.
- ^ Cassano, Domenico; Santi, Melissa; D’Autilia, Francesca; Mapanao, Ana Katrina; Luin, Stefano; Voliani, Valerio (2019). "Photothermal effect by NIR-responsive excretable ultrasmall-in-nano architectures". Materials Horizons. 6 (3): 531–537. doi:10.1039/C9MH00096H. ISSN 2051-6347.
- ^ Hainfeld JF, Slatkin DN, Smilowitz HM (September 2004). "The use of gold nanoparticles to enhance radiotherapy in mice". Physics in Medicine and Biology. 49 (18): N309–15. doi:10.1088/0031-9155/49/18/N03. PMID 15509078. S2CID 28457097.
- ^ McMahon SJ, Hyland WB, Muir MF, Coulter JA, Jain S, Butterworth KT, Schettino G, Dickson GR, Hounsell AR, O'Sullivan JM, Prise KM, Hirst DG, Currell FJ (2011). "Biological consequences of nanoscale energy deposition near irradiated heavy atom nanoparticles". Scientific Reports. 1: 18. Bibcode:2011NatSR...1E..18M. doi:10.1038/srep00018. PMC 3216506. PMID 22355537.
- ^ Zhang Z, Chen Z, Wang S, Qu C, Chen L (May 2014). "On-site visual detection of hydrogen sulfide in air based on enhancing the stability of gold nanoparticles". ACS Applied Materials & Interfaces. 6 (9): 6300–7. doi:10.1021/am500564w. PMID 24754960.
- ^ a b c d e Xu S (2010). "Gold nanoparticle-based biosensors". Gold Bulletin. 43: 29–41. doi:10.1007/BF03214964.
- ^ Wang J, Polsky R, Xu D (2001). "Silver-Enhanced Colloidal Gold Electrochemical Stripping Detection of DNA Hybridization". Langmuir. 17 (19): 5739. doi:10.1021/la011002f.
- ^ Wang J, Xu D, Polsky R (April 2002). "Magnetically-induced solid-state electrochemical detection of DNA hybridization". Journal of the American Chemical Society. 124 (16): 4208–9. doi:10.1021/ja0255709. PMID 11960439.
- ^ Daniel MC, Astruc D (January 2004). "Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology". Chemical Reviews. 104 (1): 293–346. doi:10.1021/cr030698+. PMID 14719978. S2CID 29293663.
- ^ Hu M, Chen J, Li ZY, Au L, Hartland GV, Li X, Marquez M, Xia Y (November 2006). "Gold nanostructures: engineering their plasmonic properties for biomedical applications". Chemical Society Reviews. 35 (11): 1084–94. doi:10.1039/b517615h. PMID 17057837. S2CID 2259806.
- ^ Link S, El-Sayed MA (1996). "Spectral Properties and Relaxation Dynamics of Surface Plasmon Electronic Oscillations in Gold and Silver Nanodots and Nanorods". J. Phys. Chem. B. 103 (40): 8410. doi:10.1021/jp9917648. S2CID 40012876.
- ^ Mulvaney, P. (1996). "Surface Plasmon Spectroscopy of Nanosized Metal Particles". Langmuir. 12 (3): 788. doi:10.1021/la9502711.
- ^ Lin HY, Chen CT, Chen YC (October 2006). "Detection of phosphopeptides by localized surface plasma resonance of titania-coated gold nanoparticles immobilized on glass substrates". Analytical Chemistry. 78 (19): 6873–8. doi:10.1021/ac060833t. PMID 17007509. S2CID 13373307.
- ^ He L, Musick MD, Nicewarner SR, Salinas FG (2000). "Colloidal Au-Enhanced Surface Plasmon Resonance for Ultrasensitive Detection of DNA Hybridization". Journal of the American Chemical Society. 122 (38): 9071. doi:10.1021/ja001215b.
- ^ Okamoto T, Yamaguchi I, Kobayashi T (2000). "Local plasmon sensor with gold colloid monolayers deposited upon glass substrates". Opt Lett. 25 (6): 372–4. Bibcode:2000OptL...25..372O. doi:10.1364/OL.25.000372. PMID 18059883.
- ^ Brown KR, Fox P, Natan MJ (1996). "Morphology-Dependent Electrochemistry of Cytochromecat Au Colloid-Modified SnO2Electrodes". Journal of the American Chemical Society. 118 (5): 1154. doi:10.1021/ja952951w.
- ^ Xiao Y, Patolsky F, Katz E, Hainfeld JF, Willner I (March 2003). ""Plugging into Enzymes": nanowiring of redox enzymes by a gold nanoparticle". Science. 299 (5614): 1877–81. Bibcode:2003Sci...299.1877X. doi:10.1126/science.1080664. PMID 12649477. S2CID 40388898.
- ^ Gole A, Dash C, Ramakrishnan V, Sainkar SR, Mandale AB, Rao M, Sastry M (2001). "Pepsin−Gold Colloid Conjugates: Preparation, Characterization, and Enzymatic Activity". Langmuir. 17 (5): 1674. doi:10.1021/la001164w.
- ^ Gole A, Vyas S, Phadtare S, Lachke A, Sastry M (2002). "Studies on the formation of bioconjugates of Endoglucanase with colloidal gold". Colloids and Surfaces B: Biointerfaces. 25 (2): 129. doi:10.1016/s0927-7765(01)00301-0.
- ^ Valden M, Lai X, Goodman DW (September 1998). "Onset of catalytic activity of gold clusters on titania with the appearance of nonmetallic properties". Science. 281 (5383): 1647–50. Bibcode:1998Sci...281.1647V. doi:10.1126/science.281.5383.1647. PMID 9733505. S2CID 21287894.
- ^ Lou Y, Maye MM, Han L, Zhong CJ (2001). "Gold–platinum alloy nanoparticle assembly as catalyst for methanol electrooxidation". Chemical Communications. 2001 (5): 473. doi:10.1039/b008669j.
- ^ Turner M, Golovko VB, Vaughan OP, Abdulkin P, Berenguer-Murcia A, Tikhov MS, Johnson BF, Lambert RM (August 2008). "Selective oxidation with dioxygen by gold nanoparticle catalysts derived from 55-atom clusters". Nature. 454 (7207): 981–3. Bibcode:2008Natur.454..981T. doi:10.1038/nature07194. PMID 18719586. S2CID 4355469.
- ^ Marradi M, Chiodo F, García I, Penadés S (2013). "Glyconanoparticles as multifunctional and multimodal carbohydrate systems". Chem. Soc. Rev. 42 (11): 4728–45. doi:10.1039/C2CS35420A. PMID 23288339.
- ^ Chiodo F, Marradi M, Tefsen B, Snippe H, van Die I, Penadés S (2013). "High sensitive detection of carbohydrate binding proteins in an ELISA-solid phase assay based on multivalent glyconanoparticles". PLOS ONE. 8 (8): e73027. Bibcode:2013PLoSO...873027C. doi:10.1371/journal.pone.0073027. PMC 3754922. PMID 24014084.
- ^ Mueggenburg KE, Lin XM, Goldsmith RH, Jaeger HM (September 2007). "Elastic membranes of close-packed nanoparticle arrays". Nature Materials. 6 (9): 656–60. Bibcode:2007NatMa...6..656M. doi:10.1038/nmat1965. PMID 17643104. S2CID 444592.
- ^ He J, Kanjanaboos P, Frazer NL, Weis A, Lin XM, Jaeger HM (July 2010). "Fabrication and mechanical properties of large-scale freestanding nanoparticle membranes". Small. 6 (13): 1449–56. doi:10.1002/smll.201000114. PMID 20521265. S2CID 206491859.
- ^ Wang Y, Kanjanaboos P, Barry E, McBride S, Lin XM, Jaeger HM (February 2014). "Fracture and failure of nanoparticle monolayers and multilayers". Nano Letters. 14 (2): 826–30. Bibcode:2014NanoL..14..826W. doi:10.1021/nl404185b. PMID 24467462. S2CID 207673690.
- ^ Wang Y, Liao J, McBride SP, Efrati E, Lin XM, Jaeger HM (October 2015). "Strong Resistance to Bending Observed for Nanoparticle Membranes". Nano Letters. 15 (10): 6732–7. Bibcode:2015NanoL..15.6732W. doi:10.1021/acs.nanolett.5b02587. PMID 26313627. S2CID 29849022.
- ^ Griesemer SD, You SS, Kanjanaboos P, Calabro M, Jaeger HM, Rice SA, Lin B (May 2017). "The role of ligands in the mechanical properties of Langmuir nanoparticle films". Soft Matter. 13 (17): 3125–3133. Bibcode:2017SMat...13.3125G. doi:10.1039/c7sm00319f. PMID 28397901.
- ^ a b c Sperling RA, Parak WJ (March 2010). "Surface modification, functionalization and bioconjugation of colloidal inorganic nanoparticles". Philosophical Transactions. Series A, Mathematical, Physical, and Engineering Sciences. 368 (1915): 1333–83. Bibcode:2010RSPTA.368.1333S. doi:10.1098/rsta.2009.0273. PMID 20156828.
- ^ Tauran Y, Brioude A, Coleman AW, Rhimi M, Kim B (August 2013). "Molecular recognition by gold, silver and copper nanoparticles". World Journal of Biological Chemistry. 4 (3): 35–63. doi:10.4331/wjbc.v4.i3.35. PMC 3746278. PMID 23977421.
- ^ Taguchi T, Isozaki K, Miki K (December 2012). "Enhanced catalytic activity of self-assembled-monolayer-capped gold nanoparticles". Advanced Materials. 24 (48): 6462–7. doi:10.1002/adma.201202979. PMID 22968900. S2CID 205247206.
- ^ Heinecke CL, Ni TW, Malola S, Mäkinen V, Wong OA, Häkkinen H, Ackerson CJ (August 2012). "Structural and theoretical basis for ligand exchange on thiolate monolayer protected gold nanoclusters". Journal of the American Chemical Society. 134 (32): 13316–22. doi:10.1021/ja3032339. PMC 4624284. PMID 22816317.
- ^ Perumal S, Hofmann A, Scholz N, Rühl E, Graf C (April 2011). "Kinetics study of the binding of multivalent ligands on size-selected gold nanoparticles". Langmuir. 27 (8): 4456–64. doi:10.1021/la105134m. PMID 21413796.
- ^ McMahon JM, Emory SR (January 2007). "Phase transfer of large gold nanoparticles to organic solvents with increased stability". Langmuir. 23 (3): 1414–8. doi:10.1021/la0617560. PMID 17241067.
- ^ Tyo EC, Vajda S (July 2015). "Catalysis by clusters with precise numbers of atoms". Nature Nanotechnology. 10 (7): 577–88. Bibcode:2015NatNa..10..577T. doi:10.1038/nnano.2015.140. PMID 26139144.
- ^ Niu Z, Li Y (2014-01-14). "Removal and Utilization of Capping Agents in Nanocatalysis". Chemistry of Materials. 26 (1): 72–83. doi:10.1021/cm4022479.
- ^ Häkkinen H, Walter M, Grönbeck H (May 2006). "Divide and protect: capping gold nanoclusters with molecular gold-thiolate rings". The Journal of Physical Chemistry B. 110 (20): 9927–31. doi:10.1021/jp0619787. PMID 16706449.
- ^ Reimers JR, Ford MJ, Halder A, Ulstrup J, Hush NS (March 2016). "Gold surfaces and nanoparticles are protected by Au(0)-thiyl species and are destroyed when Au(I)-thiolates form". Proceedings of the National Academy of Sciences of the United States of America. 113 (11): E1424–33. Bibcode:2016PNAS..113E1424R. doi:10.1073/pnas.1600472113. PMC 4801306. PMID 26929334.
- ^ Park JW, Shumaker-Parry JS (February 2014). "Structural study of citrate layers on gold nanoparticles: role of intermolecular interactions in stabilizing nanoparticles". Journal of the American Chemical Society. 136 (5): 1907–21. doi:10.1021/ja4097384. PMID 24422457.
- ^ a b c Alkilany AM, Murphy CJ (September 2010). "Toxicity and cellular uptake of gold nanoparticles: what we have learned so far?". Journal of Nanoparticle Research. 12 (7): 2313–2333. Bibcode:2010JNR....12.2313A. doi:10.1007/s11051-010-9911-8. PMC 2988217. PMID 21170131.
- ^ Perala SR, Kumar S (August 2013). "On the mechanism of metal nanoparticle synthesis in the Brust-Schiffrin method". Langmuir. 29 (31): 9863–73. doi:10.1021/la401604q. PMID 23848382.
- ^ a b c Alkilany AM, Nagaria PK, Hexel CR, Shaw TJ, Murphy CJ, Wyatt MD (March 2009). "Cellular uptake and cytotoxicity of gold nanorods: molecular origin of cytotoxicity and surface effects". Small. 5 (6): 701–8. doi:10.1002/smll.200801546. PMID 19226599.
- ^ Takahashi H, Niidome Y, Niidome T, Kaneko K, Kawasaki H, Yamada S (January 2006). "Modification of gold nanorods using phosphatidylcholine to reduce cytotoxicity". Langmuir. 22 (1): 2–5. doi:10.1021/la0520029. PMID 16378388.
- ^ a b c Goodman CM, McCusker CD, Yilmaz T, Rotello VM (June 2004). "Toxicity of gold nanoparticles functionalized with cationic and anionic side chains". Bioconjugate Chemistry. 15 (4): 897–900. doi:10.1021/bc049951i. PMID 15264879.
- ^ Connor EE, Mwamuka J, Gole A, Murphy CJ, Wyatt MD (March 2005). "Gold nanoparticles are taken up by human cells but do not cause acute cytotoxicity". Small. 1 (3): 325–7. doi:10.1002/smll.200400093. PMID 17193451.
- ^ Dobrovolskaia MA, Patri AK, Zheng J, Clogston JD, Ayub N, Aggarwal P, Neun BW, Hall JB, McNeil SE (June 2009). "Interaction of colloidal gold nanoparticles with human blood: effects on particle size and analysis of plasma protein binding profiles". Nanomedicine. 5 (2): 106–17. doi:10.1016/j.nano.2008.08.001. PMC 3683956. PMID 19071065.
- ^ Chen YS, Hung YC, Liau I, Huang GS (May 2009). "Assessment of the In Vivo Toxicity of Gold Nanoparticles". Nanoscale Research Letters. 4 (8): 858–864. Bibcode:2009NRL.....4..858C. doi:10.1007/s11671-009-9334-6. PMC 2894102. PMID 20596373.
- ^ Cho WS, Cho M, Jeong J, Choi M, Cho HY, Han BS, Kim SH, Kim HO, Lim YT, Chung BH, Jeong J (April 2009). "Acute toxicity and pharmacokinetics of 13 nm-sized PEG-coated gold nanoparticles". Toxicology and Applied Pharmacology. 236 (1): 16–24. doi:10.1016/j.taap.2008.12.023. PMID 19162059.
- ^ Gref R, Couvreur P, Barratt G, Mysiakine E (November 2003). "Surface-engineered nanoparticles for multiple ligand coupling". Biomaterials. 24 (24): 4529–37. doi:10.1016/s0142-9612(03)00348-x. PMID 12922162.
- ^ Boisselier E, Astruc D (June 2009). "Gold nanoparticles in nanomedicine: preparations, imaging, diagnostics, therapies and toxicity". Chemical Society Reviews. 38 (6): 1759–82. doi:10.1039/b806051g. PMID 19587967.
- ^ Tandon A, Sharma A, Rodier JT, Klibanov AM, Rieger FG, Mohan RR (June 2013). "BMP7 gene transfer via gold nanoparticles into stroma inhibits corneal fibrosis in vivo". PLOS ONE. 8 (6): e66434. Bibcode:2013PLoSO...866434T. doi:10.1371/journal.pone.0066434. PMC 3682981. PMID 23799103.
- ^ Gratton SE, Pohlhaus PD, Lee J, Guo J, Cho MJ, Desimone JM (August 2007). "Nanofabricated particles for engineered drug therapies: a preliminary biodistribution study of PRINT nanoparticles". Journal of Controlled Release. 121 (1–2): 10–8. doi:10.1016/j.jconrel.2007.05.027. PMC 1994820. PMID 17643544.
- ^ a b c De Jong WH, Hagens WI, Krystek P, Burger MC, Sips AJ, Geertsma RE (April 2008). "Particle size-dependent organ distribution of gold nanoparticles after intravenous administration". Biomaterials. 29 (12): 1912–9. doi:10.1016/j.biomaterials.2007.12.037. PMID 18242692.
- ^ Cassano, Domenico; Mapanao, Ana-Katrina; Summa, Maria; Vlamidis, Ylea; Giannone, Giulia; Santi, Melissa; Guzzolino, Elena; Pitto, Letizia; Poliseno, Laura; Bertorelli, Rosalia; Voliani, Valerio (2019-10-21). "Biosafety and Biokinetics of Noble Metals: The Impact of Their Chemical Nature". ACS Applied Bio Materials. 2 (10): 4464–4470. doi:10.1021/acsabm.9b00630. ISSN 2576-6422. PMID 35021406. S2CID 204266885.
- ^ Cassano, Domenico; Summa, Maria; Pocoví-Martínez, Salvador; Mapanao, Ana-Katrina; Catelani, Tiziano; Bertorelli, Rosalia; Voliani, Valerio (February 2019). "Biodegradable Ultrasmall-in-Nano Gold Architectures: Mid-Period In Vivo Distribution and Excretion Assessment". Particle & Particle Systems Characterization. 36 (2): 1800464. doi:10.1002/ppsc.201800464. S2CID 104434042.
- ^ Turkevich J, Stevenson PC, Hillier J (1951). "A study of the nucleation and growth processes in the synthesis of colloidal gold". Discuss. Faraday Soc. 11: 55–75. doi:10.1039/df9511100055. S2CID 97664009.
- ^ Kimling J, Maier M, Okenve B, Kotaidis V, Ballot H, Plech A (August 2006). "Turkevich method for gold nanoparticle synthesis revisited". The Journal of Physical Chemistry B. 110 (32): 15700–7. doi:10.1021/jp061667w. PMID 16898714. S2CID 11729630.
- ^ a b Frens, G. (1972). "Particle size and sol stability in metal colloids". Colloid & Polymer Science. 250 (7): 736–741. doi:10.1007/bf01498565. S2CID 92726968.
- ^ a b Frens, G. (1973). "Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions". Nature. 241 (105): 20–22. Bibcode:1973NPhS..241...20F. doi:10.1038/physci241020a0.
- ^ Pong BK, Elim HI, Chong JX, Trout BL, Lee JY (2007). "New Insights on the Nanoparticle Growth Mechanism in the Citrate Reduction of Gold(III) Salt: Formation of the Au Nanowire Intermediate and Its Nonlinear Optical Properties". J. Phys. Chem. C. 111 (17): 6281–6287. doi:10.1021/jp068666o.
- ^ Niu Z, Li Y (2014). "Removal and Utilization of Capping Agents in Nanocatalysis". Chemistry of Materials. 26: 72–83. doi:10.1021/cm4022479.
- ^ Fang Y, Tan J, Lan T, Foo SG, Pyun DG, Lim S, Kim D (2018). "Universal one‐pot, one‐step synthesis of core–shell nanocomposites with self‐assembled tannic acid shell and their antibacterial and catalytic activities". Journal of Applied Polymer Science. 135 (6): 45829. doi:10.1002/app.45829.
- ^ Fang Y, Tan J, Choi H, Lim S, Kim D (2018). "Highly sensitive naked eye detection of Iron (III) and H2O2 using poly-(tannic acid) (PTA) coated Au nanocomposite". Sensors and Actuators B: Chemical. 259: 155–161. doi:10.1016/j.snb.2017.12.031.
- ^ Brust M, Walker M, Bethell D, Schiffrin DJ, Whyman R (1994). "Synthesis of Thiol-derivatised Gold Nanoparticles in a Two-phase Liquid-Liquid System". Chem. Commun. (7): 801–802. doi:10.1039/C39940000801.
- ^ Manna A, Chen P, Akiyama H, Wei T, Tamada K, Knoll W (2003). "Optimized Photoisomerization on Gold Nanoparticles Capped by Unsymmetrical Azobenzene Disulfides". Chemistry of Materials. 15 (1): 20–28. doi:10.1021/cm0207696.
- ^ Gao J, Huang X, Liu H, Zan F, Ren J (March 2012). "Colloidal stability of gold nanoparticles modified with thiol compounds: bioconjugation and application in cancer cell imaging". Langmuir. 28 (9): 4464–71. doi:10.1021/la204289k. PMID 22276658.
- ^ 베칼레, 로랑, 사드 바라주크, 수랏 하찬다니."마그네슘 테트라페닐포르피린 광보호제로서의 금 나노입자의 유익한 역할"SpringerReference (n.d.) : n.pag.웹. 2016년 11월 14일
- ^ Templeton AC, Wuelfing WP, Murray RW (January 2000). "Monolayer-protected cluster molecules". Accounts of Chemical Research. 33 (1): 27–36. CiteSeerX 10.1.1.501.2383. doi:10.1021/ar9602664. PMID 10639073.
- ^ Louis C (2017). "Chemical preparation of gold nanoparticles on surfaces". In Louis C, Pluchery O (eds.). Gold nanoparticles for physics, chemistry and biology (Second ed.). Hackensack (N.J.); London: World Scientific. p. 155. ISBN 978-1-78634-124-2.
- ^ Perrault SD, Chan WC (December 2009). "Synthesis and surface modification of highly monodispersed, spherical gold nanoparticles of 50-200 nm". Journal of the American Chemical Society. 131 (47): 17042–3. doi:10.1021/ja907069u. PMID 19891442.
- ^ Martin MN, Basham JI, Chando P, Eah SK (May 2010). "Charged gold nanoparticles in non-polar solvents: 10-min synthesis and 2D self-assembly". Langmuir. 26 (10): 7410–7. doi:10.1021/la100591h. PMID 20392108. Martin 합성법에 대한 3분짜리 데모 비디오는 YouTube에서 볼 수 있습니다.
- ^ Kalishwaralal K, Deepak V, Ram Kumar Pandian S, Gurunathan S (November 2009). "Biological synthesis of gold nanocubes from Bacillus licheniformis". Bioresource Technology. 100 (21): 5356–8. doi:10.1016/j.biortech.2009.05.051. PMID 19574037.
- ^ Navarro JR, Lerouge F, Cepraga C, Micouin G, Favier A, Chateau D, Charreyre MT, Lanoë PH, Monnereau C, Chaput F, Marotte S, Leverrier Y, Marvel J, Kamada K, Andraud C, Baldeck PL, Parola S (November 2013). "Nanocarriers with ultrahigh chromophore loading for fluorescence bio-imaging and photodynamic therapy". Biomaterials. 34 (33): 8344–51. doi:10.1016/j.biomaterials.2013.07.032. PMID 23915950.
- ^ Baigent CL, Müller G (1980). "A colloidal gold prepared using ultrasonics". Experientia. 36 (4): 472–473. doi:10.1007/BF01975154. S2CID 32998274.
- ^ Zhang J, Du J, Han B, Liu Z, Jiang T, Zhang Z (February 2006). "Sonochemical formation of single-crystalline gold nanobelts". Angewandte Chemie. 45 (7): 1116–9. doi:10.1002/ange.200503762. PMID 16389606.
- ^ Sakai T, Alexandridis P (April 2005). "Mechanism of gold metal ion reduction, nanoparticle growth and size control in aqueous amphiphilic block copolymer solutions at ambient conditions". The Journal of Physical Chemistry B. 109 (16): 7766–77. doi:10.1021/jp046221z. PMID 16851902.
- ^ Ray D, Aswal VK, Kohlbrecher J (March 2011). "Synthesis and Characterization of High Concentration Block Copolymer-Mediated Gold Nanoparticles". Langmuir. 27 (7): 4048–56. doi:10.1021/la2001706. PMID 21366279.
- ^ Payne NJ, Waghwani HK, Connor MG, Hamilton W, Tockstein S, Moolani H, Chavda F, Badwaik VD, Lawrenz MB, Dakshinamurthy R (May 2016). "Novel Synthesis of Kanamycin Conjugated Gold Nanoparticles with Potent Antibacterial Activity". Frontiers in Microbiology. 7. 607. doi:10.3389/fmicb.2016.00607. PMC 4908860. PMID 27330535.
추가 정보
- Boisselier E, Astruc D (June 2009). "Gold nanoparticles in nanomedicine: preparations, imaging, diagnostics, therapies and toxicity". Chemical Society Reviews. 38 (6): 1759–82. doi:10.1039/b806051g. PMID 19587967.
외부 링크
- Moriarty, Philip. "Au – Gold Nanoparticle". Sixty Symbols. Brady Haran for the University of Nottingham.
- 금 나노 입자의 구연산염 합성 및 하이드로퀴논 합성을 위한 포인트 바이 포인트 방법을 이용할 수 있다.





 굽힘강성을 보인다.한편 공기/수면에서 지지되는 나노입자 단분자층에서는 습윤환경에서의
굽힘강성을 보인다.한편 공기/수면에서 지지되는 나노입자 단분자층에서는 습윤환경에서의