헥사메타인산나트륨
Sodium hexametaphosphate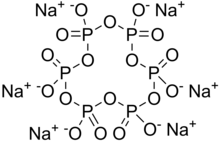 | |
| 이름 | |
|---|---|
| IUPAC 이름 시클로인산나트륨 | |
| 기타 이름 칼곤 S 유리 나트륨 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.030.299 |
| EC 번호 |
|
| 메쉬 | 나트륨+폴리메타인산염 |
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| Na 6P 6O 18 | |
| 몰 질량 | 611.7704 g mol−1 |
| 외모 | 백색 결정 |
| 냄새 | 무취의 |
| 밀도 | 2.484 g/cm3 |
| 녹는점 | 628 °C (1,162 °F, 901 K) |
| 비등점 | 1,500 °C (2,730 °F, 1,770 K) |
| 용해성의 | |
| 용해성 | 유기 용제에 녹지 않는 |
굴절률(nD) | 1.482 |
| 위험 요소 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 요소 | 자극성 |
| GHS [2]라벨링: | |
 | |
| 경고 | |
| H319 | |
| 치사량 또는 농도(LD, LC): | |
LD50(중간선량) | 3.053 g kg−1 |
| 안전 데이터 시트(SDS) | hazard.com |
| 관련 화합물 | |
기타 음이온 | 인산삼나트륨 피로인산테트라소듐 삼인산펜타소듐 |
관련 화합물 | 삼인산나트륨 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
헥사메타인산나트륨(SHMP)은 Na[(PO3)]6[3]의6 소금이다.상업용 헥사메타인산나트륨은 전형적으로 메타인산염(emioric formula: NaPO3)의 혼합물이며, 그 중 헥사메타인산나트륨은 일반적으로 이 이름으로 지칭되는 화합물이다.이러한 혼합물을 더 정확하게는 폴리메타인산나트륨이라고 부른다.그것들은 물에 녹는 하얀 고체입니다.
사용하다
SHMP는 격리제로 사용되며 E 번호 E452i로 사용되는 식품 첨가물로 사용되는 등 다양한 산업에서 사용되고 있습니다.탄산나트륨을 SHMP에 첨가하여 pH를 8.0–8.6으로 올리기도 하며, 이는 물의 연화 및 세제에 사용되는 많은 SHMP 제품을 생산한다.
헥사메타인산나트륨의 중요한 용도는 점토계 세라믹 [4][5][6][7]입자의 제조에 있어서의 디플로콜란트이다.또한 토양 텍스처 [8]평가를 위해 점토 및 기타 토양 종류를 분해하는 분산제로도 사용됩니다.
치약의 유효성분으로 오염방지 및 치석방지 [9]성분으로 사용됩니다.
에너지 드링크 NOS에는 헥사메타인산나트륨이 함유되어 있습니다.
식품첨가물
식품첨가물로서 유화제로서 SHMP를 사용한다.인조 메이플 시럽, 통조림 우유, 치즈 분말 및 딥, 모조 치즈, 휘핑 토핑, 포장 달걀 흰자, 로스트 비프, 생선 살코기, 과일 젤리, 냉동 디저트, 샐러드 드레싱, 청어, 아침 시리얼, 아이스크림, 맥주 및 병음료는 SHMP를 [10][11][12]함유할 수 있다.
물유연제염
SHMP는 다이아몬드 크리스탈 브랜드 Bright & Soft Salt Pellets에서 0.03% 농도의 물 연화제로 사용됩니다.염화나트륨을 제외한 유일한 첨가물이다.
준비
SHMP는 오르토인산나트륨을 가열하여 피로인산나트륨을 생성한다.
- 224 NaHPO → NaHPO2227 + HO2
이어서 피로인산을 가열하여 해당하는 헥사메타인산나트륨을 얻는다.
- 32227 NaHPO → (NaPO3)6 + 32 HO
빠른 냉각이 뒤따릅니다.
반응
SHMP는 수용액, 특히 산성 조건에서 트리메타인산나트륨과 [13]오르토인산나트륨으로 가수분해된다.
역사
헥사메타인산은 1849년 독일의 화학자 테오도르 플라이트에 의해 [14][15]명명되었다.1956년까지 그레이엄 소금(폴리인산나트륨)의 가수분해물의 크로마토그래피 분석 결과, [16]4개 이상의 인산기가 포함된 고리형 음이온이 존재하는 것으로 나타났다.[17] 이러한 발견은 1961년에 확인되었다.1963년 독일 화학자 에리히 틸로와 울리히 슐케는 [18]무수 트리메타인산나트륨을 가열하여 헥사메타인산나트륨을 만드는 데 성공했다.
안전.
인산나트륨은 급성 경구 독성이 낮은 것으로 알려져 있다.EFSA와 USFDA는 10,000mg/l 또는 mg/kg을 초과하지 않는 SHMP 농도를 보호수준으로 간주하고 있으며, 이 염분의 극단적 농도는 "불규칙적인 맥박, 서맥, 저칼슘혈증"과 같은 혈청 농도의 나트륨으로 인해 급성 부작용을 일으킬 수 있다."[19]
참조
- ^ Merck Index, 제12판, 폴리메타인산나트륨, 8814
- ^ "C&L Inventory". echa.europa.eu.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 530. ISBN 978-0-08-037941-8.
- ^ Kaolinite와 KaolinF의 용해 과정에서의 Sodium Hexametaphosphate의 역할Andreola; E.카스텔리니;T만프레디니; M.로마놀리유럽도자기학회지 제24권 제7호, 2004년 6월
- ^ 분산제가 알루미나 스피넬 자기유동성 내화성 주물의 기계적 강도발달에 미치는 영향사산 오트로지, 모하마드 레자 닐포루샨, 아라시 다고이, 레자 마즈반세라믹스 – Silikatty 54 (3) 284–289 (2010)
- ^ 헥사메타인산나트륨 액상화제가 인산칼슘 시멘트의 기본 특성에 미치는 영향S. Hesaraki; A. Zamanian; F.모자데생물의학재료연구저널 제1권 제88A호, 2009년 제2호
- ^ 실험설계를 이용한 세라믹 현탁액의 유동학적 거동에 대한 점토의 광물학적 영향에 관한 연구Afef Jmal Ayadi; 줄리앙 소로; 아멜 카문; 사미르 바클루티.국제 최근 연구 및 응용 연구 저널 14(2)2013년 2월
- ^ ASTM D422 – 63(2007) 토양 입자 크기 분석을 위한 표준 시험 방법.
- ^ Crest Pro-Health에 관한 FAQ
- ^ "Ingredient Results - Sodium Hexametaphosphate".
- ^ "Food Additives & Ingredients - Food Additive Status List". Food and Drug Administration. 26 August 2021.
- ^ "CFR - Code of Federal Regulations Title 21".
- ^ Van Wazer, John (1958). Phosphorus and its Compounds. New York: Interscience Publishers. Retrieved 7 April 2015.
- ^ Fleitmann, 여.(1849년)."Ueber derselben Verbindungsproportion verschiedenen Metaphosphorsäuren und zwei neue Säuren 죽"[ 같은 화합물 비율의 다양한 또는 산과, 두가지의 새로운 산에].Annalen Physik 운트 Chemie 해부학자.2시리즈(독일어로).78:233–260, 338–366.페이지의 주 249일, Fleitmann은 이름 Hexametaphosphorsäure(헥사 메타 인산)것입니다.
- ^ Griffith, E.J.; Buxton, R.L. (1965). "The preparation and properties of the twelve-membered ring hexametaphosphate anion". Inorganic Chemistry. 4 (4): 549–551. doi:10.1021/ic50026a023. 페이지 549 참조.
- ^ Van Wazer, J. R.; Kroupa, E. Karl (1956). "Existence of ring phosphates higher than tetrametaphosphate". Journal of the American Chemical Society. 78 (8): 1772. doi:10.1021/ja01589a086.
- ^ (Thilo & Schülke, 1963a), 페이지 1175.
- ^ 참조:
- Thilo, E.; Schülke, U. (1963a). "Darstellung des echten Natrium-hexametaphosphates Na6[P6O18]" [Preparation of true sodium hexametaphosphate Na6[P6O18]]. Angewandte Chemie (in German). 75 (23): 1175–1176. Bibcode:1963AngCh..75.1175T. doi:10.1002/ange.19630752305.
- Thilo, E.; Schülke, U. (1963b). "Preparation of true sodium hexametaphosphate Na6[P6O18]". Angewandte Chemie International Edition. 2 (12): 742. doi:10.1002/anie.196307421.
- ^ Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). "Phosphoric Acid and Phosphates". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_465.pub3.


