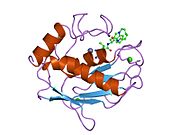
MMP7
MMP7| MMP7 | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||
| 에일리어스 | MMP7, MMP-7, MPSL1, PUMP-1, 매트릭스 메탈롭티드가수분해효소7 | ||||||||||||||||||||||||
| 외부 ID | OMIM: 178990 MGI: 103189 HomoloGene: 37619 GeneCard: MMP7 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 맞춤법 | |||||||||||||||||||||||||
| 종. | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레즈 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 장소(UCSC) | Chr 11: 102.52 ~102.53 Mb | Chr 9: 7.69 ~7.7 Mb | |||||||||||||||||||||||
| PubMed 검색 | [3] | [4] | |||||||||||||||||||||||
| 위키데이터 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 마틸리신 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| EC 번호 | 3.4.24.23 | ||||||||
| CAS 번호 | 141256-52-2 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| |||||||||
마틸리신은 매트릭스 메탈로프로테이나아제 7(MMP-7), 펌프 1단백질가수분해효소(PUMP-1), 자궁 메탈로프로테이나아제라고도 알려져 있으며 MMP7 [5]유전자에 의해 암호화되어 있는 인간의 효소이다.효소(EC 3.4.24.23)는 매트린, 추정(또는 중단) 금속단백질가수분해효소-1, 매트릭스 금속단백질가수분해효소-1, PUMP-1 단백질분해효소-1, 추정 금속단백질가수분해효소, [6][7][8][9]MMP로도 알려져 있다.인간의 MMP-7은 분자량이 약 30kDa이다.[10]
마틸리신은 1988년 [11]셀러스와 워즈너에 의해 쥐의 자궁에서 발견되었다.인간 MMP7의 상보적 DNA(cDNA)는 1988년 뮬러 [12]등에 의해 분리되었다.MMP7은 구조관련 아연의존성 엔도펩티드가수분해효소로 이루어진 매트릭스메탈로프로테아제(MMP) 계열의 구성원이다.분해/활성화된 MMP7의 주요 역할은 카제인, 타입 I, II, IV 및 V겔라틴, 피브로넥틴, 프로테오글리칸을 [12][13]포함한 고분자를 분해하여 세포외 기질을 분해하는 것이다.
유전자, 조절 및 발현
인간의 MMP7은 11번 염색체 q22.3에 위치하고 있으며, MMP 유전자는 마티리신, 콜라게나아제-1, 스트로멜라스타아제1, 스트로멜라스타아제-2, 메탈로엘라스타아제 유전자를 포함한 11번 염색체의 q 영역에 군집되어 있다.그것은 267개의 아미노산으로 구성되어 있습니다.MMP7의 cDNA는 스트로멜리신-1과 [12]49% 상동한다.MMP 패밀리의 다른 멤버와 비교하여 MMP7에는 C 말단 단백질 [14]도메인이 없습니다.
인간 MMP7의 프로모터는 TATA 박스, 활성단백질 1(AP-1) 부위 및 2개의 역폴리오마바이러스 증강제 A결합단백질 2(PEA-3)를 포함한다.AP-1/PEA-3 결합 모티브는 MMP7이 성장인자, 종양유전자 및 포볼에스테르에 반응하기 위해 필수적이며 필수적입니다.또한 Matelysin/C에는 PEA와 AP-1이 필요합니다.AT리포터는 종양촉진제 12-O-테트라데카놀포르볼-13-아세테이트(TPA) 및 표피성장인자(EGF)에 의해 유도된다.또한 AP-1의 고레벨 발현과 그 결합단백질은 Ras 활성화 세포에서 마틸리신의 고레벨 발현은 AP-1에 [12]의존한다는 돌연변이 Ki-Ras와 관련이 있는 것으로 밝혀졌다.
MMP7의 발현은 Wnt/β 카테닌 신호전달경로에 의해 조절되고 변환성장인자β(TGF-β)에 의해 매개된다.TGF-β는 ECM을 자극하여 MMP7, 스트로멜린 mRNA 및 자이모겐 분비를 억제한다.TGF-β의 아이소폼은 프로게스테론 매개 경로를 통해 인간 자궁내막에서 MMP7 mRNA와 단백질을 억제한다.그러나 변형 세포들 사이에서 MMP7에 대한 TGF-β의 역효과가 관찰되었다.인간교종세포주 및 인간편평상세포암세포주 II-4에서 TGF-β는 MMP7 mRNA 및 단백질의 발현을 자극하여 세포의 [15]침습적 거동을 촉진한다.
인간 MMP7 유전자의 프로모터 영역은 MMP7이 IL-1 및 IL-6에 결합할 수 있음을 나타내는 NR-IL6 결합 배열과 상동하는 2개 이상의 부위를 포함한다.또한 MMP7 mRNA의 수치는 인간 메산지얼 [12]세포에서 종양괴사인자α(TNF-α) 및 IL-1 β의 처리 후에 상승한다.
MMP7은 피부, 침샘, 췌장, 장 및 생식기관, 간 및 유방 외분비선의 덕트상피를 포함한 상피세포에서 흔히 발현된다.또한 MMP7은 인간 대장암에서 [13]이형성샘의 내강표면에서 고도로 발현된다.
구조.
MMP7 단백질은 촉매 아연 이온, 구조 아연 이온 및 2개의 칼슘 이온을 포함한 4개의 금속 이온에 의해 결합된다.촉매 아연 이온은 HEXGHXGXH 영역의 3개의 His 잔기에 4배위 방식으로 결합합니다.칼슘 이온 결합은 2차 구조를 안정시키는 데 중요한 역할을 한다.MMP7은 얕은 소수성 기판 결합 포켓을 가지고 있다.힌지가 가장 긴 MMP9에 비해 MMP7은 헤모펙신이 부족하고 힌지가 없다.대신 MMP7은 가변 C-말단 헤모펙신 유사 도메인을 함유하여 기질특이성을 [15]촉진한다.MMP7의 단백질은 자이모겐으로 분비된다.MMP7의 프로도아민은 시스테인 잔류물을 포함하는 C 말단 근처에 약 9kD의 고도로 보존된 "시스테인 스위치" PRCGXPD 시퀀스를 포함합니다.시스테인 잔류물은 단백질 잠복 상태를 유지하며 촉매 아연에 결합한다.시스테인 –아연 배위의 해리는 프로도메인의 최초 30개 아미노산의 분열로부터 시작되며, 이는 배좌 변화로 이어지고, 나아가 글루-타이어 부위에서 프로도메인 전체의 분열로 이어진다.Woessner et al.에 따르면 MMP7의 Mr은 잠복형식은 28,000, 프로도메인 [12]분할 후 활성형은 19,000Mr이다.
상호 작용
프로마트리신(Pro-MMP7)은 엔도단백질가수분해효소 및 플라스민에 의해 잠복형에서 활성형으로 변환된다.트립신이 인식할 수 있는 부위의 플라스민 균열은 가장 가능성이 높은 생리활성제로 간주된다.시험관내 플라스민은 전체 활성의 50%에서 프로 MMP7을 활성화할 수 있다.또한 MMP7의 체외 단백질 분해 활성을 조사하기 위해 활성 재조합 pro-MMP7과 정제 기질을 이용한 결과, MMP7은 ECM 성분, proMMPs 및 비매트릭스 단백질을 주로 포함한 많은 단백질 기질을 절단하는 것으로 나타났다.MMP7은 라미닌과 콜라겐 IV를 연결하는 당단백질 엔탁틴을 콜라게나아제-1보다 약 100~600배 빠른 속도로 분해한다.또한 MMP7은 다른 MMP를 활성화할 수 있습니다.활성화된 MMP7 및 APMA는 콜라게나아제-1의 활성을 증가시킬 수 있으며, MMP7은 잠복해 있는 프로겔라티나아제 A를 활성 [12]형태로 변환할 수도 있다.
기능.
매트릭스 메탈로프로테이나아제(MMP) 패밀리의 단백질은 관절염이나 전이 등의 질병 과정뿐만 아니라 배아 발달, 생식, 조직 리모델링 등의 정상적인 생리 과정에서도 세포외 매트릭스의 분해에 관여한다.대부분의 MMP는 세포외 단백질 분해 효소에 의해 분해될 때 활성화되는 비활성 프로단백질로 분비된다.이 유전자에 의해 코드된 효소는 프로테오글리칸, 피브로넥틴, 엘라스틴 및 카세인을 분해하고 보존된 C 말단 단백질 도메인이 없다는 점에서 대부분의 MMP 패밀리 멤버와 다르다.이 효소는 상처 치유에 관여하며, 생쥐를 대상으로 한 연구에 따르면 장 [16]점막에 있는 디펜신의 활동을 조절하는 것으로 나타났습니다.
MMP7은 처음에 Woessner 등에 의해 특징지어졌다.세포외 기질 성분을 소화시키고 젤라틴의 α2(I) 사슬을 보다 빠르게 절단하며 Ala-Leu14 및 Tyr-Leu에서16 인슐린의 B 사슬을 소화하며 콜라겐 타입 I, II, IV, V에는 작용하지 않는다.MMP7의 최적 pH는 7이고 pI는 5.9이며, MMP4는 α 2-마크로글로불린과 [11]TIMP에 의해 억제된다. MMP7 활성의 억제는 일반적으로 EDTA와 1,10-페난트로린, 특히 아연 킬레이션을 포함한 금속 탈모제에 의존한다.따라서 MMP7 억제의 선택성은 MMPs 패밀리의 거의 모든 구성원이 아연 결합 부위를 가진 촉매 도메인을 포함하고 있기 때문에 어렵다.TIMP-1 및 2는 MMP7 활성을 저해하는 촉매 부위에서 활성 MMP7에 비공유적으로 결합된다.활성화된 MMP7은 또한 종양 [17]침투를 용이하게 하기 위해 proMMP2 및 proMMP9의 프로페타이드를 절단할 수 있다.
정상적인 조직 발달
Quondamatteo et al. 면역조직화학적으로 착색된 MMP7 및 초기 인간 간 발달에 국소화된 MMP7.이들은 임신 6주차에 일부 간세포와 내피세포에서 MMP7이 나타났으며,[18] 그 이후에는 조혈세포만 남아 있다고 보고했다.
조직 리모델링
MMP가 TIMP 억제를 벗어나기 위해 상피유발막 관련 성장인자 처리의 혈장막에 활성 MMP7을 모집하여 상피수복 및 증식을 실시한다.인간의 자궁내막에서 MMP7 mRNA의 발현은 월경 시 증가하며 증식기에는 높은 상태를 유지한다.또, MMP-7은 콜레스테롤이 풍부한 도메인을 포함한 상피의 혈장막에 결합한다.경계 MMP7은 활성화되어 TIMP 억제에 내성이 있습니다.상피 혈장막 및 E-카데린, β4-integrin, TNF-alpha, RAS, 헤파린 결합 EGF, IGF 결합 단백질 및 플라스미노겐을 포함한 관련 기질의 활성을 촉진한다.또한 이 과정은 상피세포의 이동, 증식 및 아포토시스를 촉진한다.월경의 경우,[15] 월경 후 자궁 내막 재생을 촉진합니다.Huang et al.은 MMP7의 단백질 분해 활성은 담도폐쇄증 관련 간 [19]섬유증에서 조직 리모델링에 중요한 역할을 한다고 보고했다.
임상적 의의
MMP7은 콜라겐 III/IV/V/IX/X/XI 및 프로테오글리칸을 절단하여 MMP 억제제가 조직 열화 억제, 리모델링, 혈관 [13][17]형성 방지 및 종양 침입 저지에 관여하는 치료에 잠재적으로 사용될 수 있음을 나타낸다.
암에서의 역할
MMP7은 잠재적으로 종양 전이 및 염증 [17]과정에 관여하는 것으로 밝혀졌다.MMP7의 상향조절은 식도, 위, 대장, 간, 췌장, 신장세포암을 포함한 많은 악성종양과 관련이 있다.높은 MMP7 발현은 세포외 매트릭스 고분자와 결합조직을 분해함으로써 암의 침입과 혈관신생을 촉진한다.이러한 분해는 태생, 산후 자궁 형성, 조직 복구, 혈관 형성, 뼈 리모델링, 관절염, 욕창, 종양 전이/침윤을 포함한 많은 메커니즘과 관련이 있습니다.활성화된 MMP7은 MMP2 및 MMP9의 지모겐을 활성화하고 종양괴사인자 및 우로키나아제 플라스미노겐 활성제의 [13]전구체의 단백질 분해 과정을 매개한다.
대장암과 MMP7 발현
MMP7은 세포 표면 단백질을 분해하고 암세포의 유착을 촉진하며 종양 전이 가능성을 높인다.히가시 외 연구진은 세포 표면의 콜레스테롤 황산염에 대한 MMP7의 결합이 세포막 관련 단백질 분해 작용에 중요한 역할을 한다고 보고했다.또한 콜레스테롤 황산염 결합에는 MMP7의 촉매부위 반대쪽에 위치한 MMP7 C말단의 내부 Ile 29, Arg33, Arg51, Trp 55 및 171~173의 잔류물이 필요하다.야생형 MMP7은 피브로넥틴을 소화할 수 있지만 돌연변이 MMP7은 대장암 세포의 [20]집적을 유도하지 못한다.또한, 카심 외 연구진은 MMP7이 심각한 이형성을 가진 진보된 대장선종성 폴리에서 높게 발현된다고 보고했다.또한 MMP7은 대장선종을 악성 상태로 전환하여 성장을 [21]촉진하는 데 관여한다.
레퍼런스
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG00000137673 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000018623 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Knox JD, Boreham DR, Walker JA, Morrison DP, Matrisian LM, Nagle RB, Bowden GT (Jan 1997). "Mapping of the metalloproteinase gene matrilysin (MMP7) to human chromosome 11q21-->q22". Cytogenet Cell Genet. 72 (2–3): 179–82. doi:10.1159/000134181. PMID 8978768.
- ^ Muller D, Quantin B, Gesnel MC, Millon-Collard R, Abecassis J, Breathnach R (July 1988). "The collagenase gene family in humans consists of at least four members". The Biochemical Journal. 253 (1): 187–92. doi:10.1042/bj2530187. PMC 1149273. PMID 2844164.
- ^ Woessner JF, Taplin CJ (November 1988). "Purification and properties of a small latent matrix metalloproteinase of the rat uterus". The Journal of Biological Chemistry. 263 (32): 16918–25. doi:10.1016/S0021-9258(18)37479-9. PMID 3182822.
- ^ Quantin B, Murphy G, Breathnach R (June 1989). "Pump-1 cDNA codes for a protein with characteristics similar to those of classical collagenase family members". Biochemistry. 28 (13): 5327–34. doi:10.1021/bi00439a004. PMID 2550050.
- ^ Miyazaki K, Hattori Y, Umenishi F, Yasumitsu H, Umeda M (December 1990). "Purification and characterization of extracellular matrix-degrading metalloproteinase, matrin (pump-1), secreted from human rectal carcinoma cell line". Cancer Research. 50 (24): 7758–64. PMID 2253219.
- ^ "MMP7 (human)". www.phosphosite.org. Retrieved 2021-10-05.
- ^ a b Woessner JF, Taplin CJ (November 1988). "Purification and properties of a small latent matrix metalloproteinase of the rat uterus". J. Biol. Chem. 263 (32): 16918–25. doi:10.1016/S0021-9258(18)37479-9. PMID 3182822.
- ^ a b c d e f g Parks WC, Mecham RP (1988). "Matrix Metalloproteinases". 263. San Diego: Academic.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ a b c d Yokoyama Y, Grünebach F, Schmidt SM, Heine A, Häntschel M, Stevanovic S, Rammensee HG, Brossart P (2008). "Matrilysin (MMP-7) is a novel broadly expressed tumor antigen recognized by antigen-specific T cells". Clin. Cancer Res. 14 (17): 5503–11. doi:10.1158/1078-0432.CCR-07-4041. PMID 18765542.
- ^ "Genes and Mapped Phenotypes". National Center for Biotechnology Information.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ a b c Gaide Chevronnay HP, Selvais C, Emonard H, Galant C, Marbaix E, Henriet P (2012). "Regulation of matrix metalloproteinases activity studied in human endometrium as a paradigm of cyclic tissue breakdown and regeneration". Biochim. Biophys. Acta. 1824 (1): 146–56. doi:10.1016/j.bbapap.2011.09.003. PMID 21982799.
- ^ "Entrez Gene: MMP7 matrix metallopeptidase 7 (matrilysin, uterine)".
- ^ a b c Edman K, Furber M, Hemsley P, Johansson C, Pairaudeau G, Petersen J, Stocks M, Tervo A, Ward A, Wells E, Wissler L (2011). "The discovery of MMP7 inhibitors exploiting a novel selectivity trigger". ChemMedChem. 6 (5): 769–73. doi:10.1002/cmdc.201000550. PMID 21520417. S2CID 32715622.
- ^ Quondamatteo F, Knittel T, Mehde M, Ramadori G, Herken R (1999). "Matrix metalloproteinases in early human liver development". Histochem. Cell Biol. 112 (4): 277–82. doi:10.1007/s004180050448. PMID 10550612. S2CID 711819.
- ^ Huang CC, Chuang JH, Chou MH, Wu CL, Chen CM, Wang CC, Chen YS, Chen CL, Tai MH (2005). "Matrilysin (MMP-7) is a major matrix metalloproteinase upregulated in biliary atresia-associated liver fibrosis". Mod. Pathol. 18 (7): 941–50. doi:10.1038/modpathol.3800374. PMID 15696117.
- ^ Higashi S, Oeda M, Yamamoto K, Miyazaki K (2008). "Identification of amino acid residues of matrix metalloproteinase-7 essential for binding to cholesterol sulfate". J. Biol. Chem. 283 (51): 35735–44. doi:10.1074/jbc.M806285200. PMID 18955490.
- ^ Qasim BJ, Ali HH, Hussein AG (2013). "Immunohistochemical expression of matrix metalloproteinase-7 in human colorectal adenomas using specified automated cellular image analysis system: a clinicopathological study". Saudi J Gastroenterol. 19 (1): 23–7. doi:10.4103/1319-3767.105916. PMC 3603485. PMID 23319034.
추가 정보
- Massova I, Kotra LP, Fridman R, Mobashery S (1998). "Matrix metalloproteinases: structures, evolution, and diversification". FASEB J. 12 (25n26): 1075–95. CiteSeerX 10.1.1.31.3959. doi:10.1142/S0217984998001256. PMID 9737711.
- Nagase H, Woessner JF (1999). "Matrix metalloproteinases". J. Biol. Chem. 274 (31): 21491–4. doi:10.1074/jbc.274.31.21491. PMID 10419448.