MMP9
MMP992kDa 타입 IV 콜라겐화효소, 92kDa 젤라틴화효소 또는 젤라틴화효소 B(GELB)로도 알려진 매트릭스 메탈로펩티드가수분해효소9(MMP-9)는 세포외 매트릭스의 분해에 관여하는 아연-메탈로프로테아제 계열에 속하는 효소이다.인간에서 MMP9[5] 유전자는 시그널 펩타이드, 프로페타이드, 피브로넥틴 타입 II 도메인을 3회 삽입한 촉매 도메인을 코드하고 이어서 C 말단 헤모펙신 유사 [6]도메인을 코드한다.
기능.
매트릭스메탈로프로테이나아제(MMP) 계열의 단백질은 관절염, 뇌내출혈과 같은 병리학적 과정뿐만 아니라 배아발달, 생식, 혈관신생, 뼈발달, 상처치유, 세포이동, 학습 및 기억과 같은 정상적인 생리과정에서의 세포외 매트릭스 파괴에 관여한다.나이와 [7][8]전이입니다.대부분의 MMP는 세포외 단백질 분해 효소에 의해 분해될 때 활성화되는 비활성 프로단백질로 분비된다.이 유전자에 의해 코드된 효소는 IV형, V형 콜라겐과 다른 세포외 기질 단백질을 [9]분해한다.붉은털원숭이 연구는 이 효소가 골수에서 조혈 전구세포의 IL-8 유도 이동에 관여하는 것을 시사하며, 쥐 연구는 종양 관련 조직 리모델링에 [5]대한 역할을 시사한다.
추간판 단백질인 트롬보스폰딘은 ECM [10]리모델링의 주요 효과인 매트릭스 메탈로프로테아제(MMP) 2 및 9와의 상호작용을 조절합니다.
호중구 작용
MMP9은 엘라스타제와 함께 기저막을 [11]통한 호중구 이동의 조절 인자로 보인다.
MMP9는 호중구 작용 내에서 세포외 매트릭스의 분해, IL-1β의 활성화, 여러 케모카인의 [12]분열과 같은 몇 가지 중요한 기능을 한다.마우스 모델에서는 MMP9 결핍이 엔도톡신 쇼크에 대한 내성을 초래하여 패혈증에서 [13]MMP9가 중요하다는 것을 시사한다.
혈관신생성
MMP9는 혈관신생과 혈관신생에 중요한 역할을 할 수 있다.예를 들어 MMP9는 악성 교종 신생 [14]혈관과 관련된 리모델링에 관여하는 것으로 보인다.또한 성장판 혈관신생과 비대성 연골세포 생성 모두 성장판 형성의 핵심 조절제이다.MMP9의 녹아웃 모델은 비후성 연골세포의 [15]아포토시스, 혈관화 및 골화를 지연시킨다.마지막으로, 혈관신생의 중요한 구성요소인 내피줄기세포의 신장에 젤라틴화효소 B가 필요하다는 중요한 증거가 있다.
상처 복구
MMP9은 인간의 호흡기 상피 [17]치료 중에 크게 상향 조절된다.MMP9 결핍 마우스 모델을 사용하여 MMP9가 상피상피복구를 조정하고 결핍 마우스도 상처치유 [18]중 피브리노겐 매트릭스를 제거할 수 없는 것으로 나타났다.또한 TGF-δ1과 상호작용할 때 젤라틴화효소 B는 콜라겐 수축을 촉진하여 상처 [19]폐쇄를 돕는다.
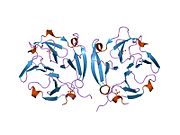
구조.
MMP9는 19개의 아미노산 시그널 펩타이드를 포함한 707개의 아미노산 잔기로 이루어진 프리프로엔자임으로 합성되어 불활성 프로 MMP로 분비되며, 인간 MMP9 프로엔자임은 5개의 도메인으로 구성되어 있다.아미노 말단 프로페타이드, 아연 결합 촉매 도메인 및 카르복실 말단 헤모펙신 유사 도메인이 보존된다.주요 구조는 몇 가지 도메인 모티브로 구성됩니다.프로펩티드 도메인은 보존된 PRCGVPD 배열로 특징지어진다.이 시퀀스 내의 Cys를 "시스테인 스위치"라고 합니다.그것은 효소를 비활성 [6]상태로 유지하기 위해 촉매 아연을 결합시킨다.

플라즈민과 스트로멜리신 1(MMP-3)을 포함한 상호작용 단백질 분해효소 캐스케이드를 통해 활성화된다.플라스민은 자이모겐에서 활성 MMP-3를 생성합니다.활성 MMP-3는 92-kDa pro-MMP-9로부터 프로펩타이드를 분해하여 82-kDa 효소 활성 [21]효소를 생성한다.활성효소에서는 기질 또는 불소활성 프로브가 분해되는 효소 활성부위에서 프로페티드를 치환한다.[20]촉매 도메인에는 2개의 아연 원자와 3개의 칼슘 원자가 포함되어 있습니다.촉매 아연은 보존된 HEXXHXGXXH 결합 모티브의 세 개의 히스티딘에 의해 조정됩니다.다른 아연 원자와 세 개의 칼슘 원자는 구조적이다.독특한 "Met-turn" 구조를 형성하는 보존된 메티오닌은 MMP9를 메츠시킨으로 분류합니다.[22]억제제와 복합된 MMP9의 대부분의 결정학적 구조에서는 이러한 도메인이 생략되지만, 세 가지 타입 II 피브로넥틴 반복이 촉매 도메인에 삽입된다.MMP9의 활성 형태에는 C 말단 헤모펙신 유사 도메인도 포함되어 있습니다.이 도메인은 4개의 β-프로펠러 블레이드와 1개의 α-나선으로 형성된 타원체이다.각 블레이드는 2개의 칼슘과 2개의 염화 [23]이온을 포함하는 깔때기 모양의 터널 주위에 배치된 4개의 역평행 β-스트랜드로 구성됩니다.헤모펙신 도메인은 삼중 나선형 간질성 콜라겐의 분열을 촉진하는 데 중요합니다.
임상적 의의
MMP9은 암, 태반 말라리아, 면역학 및 심혈관 질환을 포함한 수많은 병리학적 과정과 관련이 있는 것으로 밝혀졌다.
관절염
류마티스[24] 관절염과 국소 뇌허혈의 [25]경우 MMP9 수치가 상승할 수 있습니다.
암
MMP9의 가장 널리 연관된 병리 중 하나는 세포외 매트릭스 리모델링과 혈관신생에서 그것의 역할 때문에 암과의 관계이다.예를 들어 전이성 유방암 세포주에서는 [26]발현 증가가 관찰되었다.젤라틴화효소 B는 혈관신생에서 간질 리모델링, 그리고 궁극적으로 전이에 [27]이르는 종양 진행에서 중심적인 역할을 한다.그러나 그 생리학적 기능 때문에 젤라틴화효소 B 억제를 암 치료 방식에 활용하는 것은 어려울 수 있다.단, 종양 전이 진단에서 젤라틴화효소 B가 조사되었습니다. - 젤라틴화효소 B/조직 복합체는 위장암 및 부인과 악성종양에서 증가되는 것으로 보입니다.
MMP9와 같은 MMP는 기저막과 세포외 매트릭스의 콜라겐 IV의 열화가 침입, 전이, 성장 및 혈관신생을 [29]포함한 종양 진행을 촉진하기 때문에 여러 인간 악성종양의 발생에 관여할 수 있다.
심혈관의
MMP9 수치는 특발성 심방세동이 [30]진행됨에 따라 증가한다.
MMP9은 대동맥류 [31]발생과 관련이 있는 것으로 밝혀졌으며, 대동맥류 [32]발생을 막는 것은 그 중단이다.독시사이클린은 MMP9의 억제를 통해 사람의 [33]대동맥 염증을 감소시킴으로써 동물모델의 대동맥류 성장을 억제한다.
임신 관련 말라리아(자반성 말라리아)
가나 인구에 대한 연구는 MMP-9 단일 뉴클레오티드 다형성 1562 C > T(rs3918242)가 [34]태반 말라리아에 대한 보호 효과가 있었으며, 이는 말라리아에 대한 감수성에서의 MMP-9의 가능한 역할을 시사한다.
안구건조증
특히 마이봄샘 기능 장애가 있는 안구건조증 환자는 MMP-9 [35]수치가 더 높습니다.
레퍼런스
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG00000100985 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000017737 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b "Matrix metallopeptidase 9 (gelatinase B, 92kDa gelatinase, 92kDa type IV collagenase)".
- ^ a b Nagase H, Woessner JF (July 1999). "Matrix metalloproteinases". The Journal of Biological Chemistry. 274 (31): 21491–4. doi:10.1074/jbc.274.31.21491. PMID 10419448.
- ^ Wang J, Tsirka SE (July 2005). "Neuroprotection by inhibition of matrix metalloproteinases in a mouse model of intracerebral haemorrhage". Brain. 128 (Pt 7): 1622–33. doi:10.1093/brain/awh489. PMID 15800021.
- ^ Vandooren J, Van den Steen PE, Opdenakker G (2013). "Biochemistry and molecular biology of gelatinase B or matrix metalloproteinase-9 (MMP-9): the next decade". Critical Reviews in Biochemistry and Molecular Biology. 48 (3): 222–72. doi:10.3109/10409238.2013.770819. PMID 23547785. S2CID 33781725.
- ^ Van den Steen PE, Dubois B, Nelissen I, Rudd PM, Dwek RA, Opdenakker G (December 2002). "Biochemistry and molecular biology of gelatinase B or matrix metalloproteinase-9 (MMP-9)". Critical Reviews in Biochemistry and Molecular Biology. 37 (6): 375–536. doi:10.1080/10409230290771546. PMID 12540195. S2CID 35833950.
- ^ Hirose Y, Chiba K, Karasugi T, Nakajima M, Kawaguchi Y, Mikami Y, Furuichi T, Mio F, Miyake A, Miyamoto T, Ozaki K, Takahashi A, Mizuta H, Kubo T, Kimura T, Tanaka T, Toyama Y, Ikegawa S (May 2008). "A functional polymorphism in THBS2 that affects alternative splicing and MMP binding is associated with lumbar-disc herniation". American Journal of Human Genetics. 82 (5): 1122–9. doi:10.1016/j.ajhg.2008.03.013. PMC 2427305. PMID 18455130.
- ^ Delclaux C, Delacourt C, D'Ortho MP, Boyer V, Lafuma C, Harf A (March 1996). "Role of gelatinase B and elastase in human polymorphonuclear neutrophil migration across basement membrane". American Journal of Respiratory Cell and Molecular Biology. 14 (3): 288–95. doi:10.1165/ajrcmb.14.3.8845180. PMID 8845180.
- ^ Opdenakker G, Van den Steen PE, Dubois B, Nelissen I, Van Coillie E, Masure S, Proost P, Van Damme J (June 2001). "Gelatinase B functions as regulator and effector in leukocyte biology". Journal of Leukocyte Biology. 69 (6): 851–9. PMID 11404367.
- ^ Dubois B, Starckx S, Pagenstecher A, Oord Jv, Arnold B, Opdenakker G (August 2002). "Gelatinase B deficiency protects against endotoxin shock". European Journal of Immunology. 32 (8): 2163–71. doi:10.1002/1521-4141(200208)32:8<2163::AID-IMMU2163>3.0.CO;2-Q. PMID 12209628.
- ^ Forsyth PA, Wong H, Laing TD, Rewcastle NB, Morris DG, Muzik H, Leco KJ, Johnston RN, Brasher PM, Sutherland G, Edwards DR (April 1999). "Gelatinase-A (MMP-2), gelatinase-B (MMP-9) and membrane type matrix metalloproteinase-1 (MT1-MMP) are involved in different aspects of the pathophysiology of malignant gliomas". British Journal of Cancer. 79 (11–12): 1828–35. doi:10.1038/sj.bjc.6690291. PMC 2362801. PMID 10206300.
- ^ Vu TH, Shipley JM, Bergers G, Berger JE, Helms JA, Hanahan D, Shapiro SD, Senior RM, Werb Z (May 1998). "MMP-9/gelatinase B is a key regulator of growth plate angiogenesis and apoptosis of hypertrophic chondrocytes". Cell. 93 (3): 411–22. doi:10.1016/s0092-8674(00)81169-1. PMC 2839071. PMID 9590175.
- ^ Heissig B, Hattori K, Dias S, Friedrich M, Ferris B, Hackett NR, Crystal RG, Besmer P, Lyden D, Moore MA, Werb Z, Rafii S (May 2002). "Recruitment of stem and progenitor cells from the bone marrow niche requires MMP-9 mediated release of kit-ligand". Cell. 109 (5): 625–37. doi:10.1016/s0092-8674(02)00754-7. PMC 2826110. PMID 12062105.
- ^ Buisson AC, Zahm JM, Polette M, Pierrot D, Bellon G, Puchelle E, Birembaut P, Tournier JM (February 1996). "Gelatinase B is involved in the in vitro wound repair of human respiratory epithelium". Journal of Cellular Physiology. 166 (2): 413–26. doi:10.1002/(sici)1097-4652(199602)166:2<413::aid-jcp20>3.0.co;2-a. PMID 8592002.
- ^ Mohan R, Chintala SK, Jung JC, Villar WV, McCabe F, Russo LA, Lee Y, McCarthy BE, Wollenberg KR, Jester JV, Wang M, Welgus HG, Shipley JM, Senior RM, Fini ME (January 2002). "Matrix metalloproteinase gelatinase B (MMP-9) coordinates and effects epithelial regeneration". The Journal of Biological Chemistry. 277 (3): 2065–72. doi:10.1074/jbc.m107611200. PMID 11689563.
- ^ Kobayashi T, Kim H, Liu X, Sugiura H, Kohyama T, Fang Q, Wen FQ, Abe S, Wang X, Atkinson JJ, Shipley JM, Senior RM, Rennard SI (June 2014). "Matrix metalloproteinase-9 activates TGF-β and stimulates fibroblast contraction of collagen gels". American Journal of Physiology. Lung Cellular and Molecular Physiology. 306 (11): L1006-15. doi:10.1152/ajplung.00015.2014. PMC 4042193. PMID 24705725.
- ^ a b Tranchant I, Vera L, Czarny B, Amoura M, Cassar E, Beau F, Stura EA, Dive V (March 2014). "Halogen bonding controls selectivity of FRET substrate probes for MMP-9". Chemistry & Biology. 21 (3): 408–13. doi:10.1016/j.chembiol.2014.01.008. PMID 24583051.
- ^ Ramos-DeSimone N, Hahn-Dantona E, Sipley J, Nagase H, French DL, Quigley JP (May 1999). "Activation of matrix metalloproteinase-9 (MMP-9) via a converging plasmin/stromelysin-1 cascade enhances tumor cell invasion". The Journal of Biological Chemistry. 274 (19): 13066–76. doi:10.1074/jbc.274.19.13066. PMID 10224058.
- ^ Bode W, Gomis-Rüth FX, Stöckler W (September 1993). "Astacins, serralysins, snake venom and matrix metalloproteinases exhibit identical zinc-binding environments (HEXXHXXGXXH and Met-turn) and topologies and should be grouped into a common family, the 'metzincins'". FEBS Letters. 331 (1–2): 134–40. doi:10.1016/0014-5793(93)80312-I. PMID 8405391. S2CID 27244239.
- ^ Gomis-Rüth FX, Gohlke U, Betz M, Knäuper V, Murphy G, López-Otín C, Bode W (December 1996). "The helping hand of collagenase-3 (MMP-13): 2.7 A crystal structure of its C-terminal haemopexin-like domain". Journal of Molecular Biology. 264 (3): 556–66. doi:10.1006/jmbi.1996.0661. PMID 8969305.
- ^ Gruber BL, Sorbi D, French DL, Marchese MJ, Nuovo GJ, Kew RR, Arbeit LA (February 1996). "Markedly elevated serum MMP-9 (gelatinase B) levels in rheumatoid arthritis: a potentially useful laboratory marker". Clinical Immunology and Immunopathology. 78 (2): 161–71. doi:10.1006/clin.1996.0025. PMID 8625558.
- ^ Clark AW, Krekoski CA, Bou SS, Chapman KR, Edwards DR (November 1997). "Increased gelatinase A (MMP-2) and gelatinase B (MMP-9) activities in human brain after focal ischemia". Neuroscience Letters. 238 (1–2): 53–6. doi:10.1016/s0304-3940(97)00859-8. PMID 9464653. S2CID 916260.
- ^ Morini M, Mottolese M, Ferrari N, Ghiorzo F, Buglioni S, Mortarini R, Noonan DM, Natali PG, Albini A (August 2000). "The alpha 3 beta 1 integrin is associated with mammary carcinoma cell metastasis, invasion, and gelatinase B (MMP-9) activity". International Journal of Cancer. 87 (3): 336–42. doi:10.1002/1097-0215(20000801)87:3<336::aid-ijc5>3.3.co;2-v. PMID 10897037.
- ^ Farina AR, Mackay AR (January 2014). "Gelatinase B/MMP-9 in Tumour Pathogenesis and Progression". Cancers. 6 (1): 240–96. doi:10.3390/cancers6010240. PMC 3980597. PMID 24473089.
- ^ Zucker S, Lysik RM, DiMassimo BI, Zarrabi HM, Moll UM, Grimson R, Tickle SP, Docherty AJ (August 1995). "Plasma assay of gelatinase B: tissue inhibitor of metalloproteinase complexes in cancer". Cancer. 76 (4): 700–8. doi:10.1002/1097-0142(19950815)76:4<700::aid-cncr2820760426>3.0.co;2-5. PMID 8625169.
- ^ Groblewska M, Siewko M, Mroczko B, Szmitkowski M (April 2012). "The role of matrix metalloproteinases (MMPs) and their inhibitors (TIMPs) in the development of esophageal cancer". Folia Histochemica et Cytobiologica. 50 (1): 12–9. doi:10.5603/fhc.2012.0002. PMID 22532131.
- ^ Li M, Yang G, Xie B, Babu K, Huang C (February 2014). "Changes in matrix metalloproteinase-9 levels during progression of atrial fibrillation". The Journal of International Medical Research. 42 (1): 224–30. doi:10.1177/0300060513488514. PMID 24345823.
- ^ Newman KM, Ogata Y, Malon AM, Irizarry E, Gandhi RH, Nagase H, Tilson MD (August 1994). "Identification of matrix metalloproteinases 3 (stromelysin-1) and 9 (gelatinase B) in abdominal aortic aneurysm". Arteriosclerosis and Thrombosis. 14 (8): 1315–20. doi:10.1161/01.atv.14.8.1315. PMID 8049193.
- ^ Pyo R, Lee JK, Shipley JM, Curci JA, Mao D, Ziporin SJ, Ennis TL, Shapiro SD, Senior RM, Thompson RW (June 2000). "Targeted gene disruption of matrix metalloproteinase-9 (gelatinase B) suppresses development of experimental abdominal aortic aneurysms". The Journal of Clinical Investigation. 105 (11): 1641–9. doi:10.1172/jci8931. PMC 300851. PMID 10841523.
- ^ Lindeman JH, Abdul-Hussien H, van Bockel JH, Wolterbeek R, Kleemann R (April 2009). "Clinical trial of doxycycline for matrix metalloproteinase-9 inhibition in patients with an abdominal aneurysm: doxycycline selectively depletes aortic wall neutrophils and cytotoxic T cells". Circulation. 119 (16): 2209–16. doi:10.1161/CIRCULATIONAHA.108.806505. PMID 19364980.
- ^ Apoorv TS, Babu PP, Meese S, Gai PP, Bedu-Addo G, Mockenhaupt FP (July 2015). "Matrix metalloproteinase-9 polymorphism 1562 C > T (rs3918242) associated with protection against placental malaria". The American Journal of Tropical Medicine and Hygiene. 93 (1): 186–8. doi:10.4269/ajtmh.14-0816. PMC 4497894. PMID 26013370.
- ^ Messmer, Elisabeth M.; von Lindenfels, Victoria; Garbe, Alexandra; Kampik, Anselm (November 2016). "Matrix Metalloproteinase 9 Testing in Dry Eye Disease Using a Commercially Available Point-of-Care Immunoassay". Ophthalmology. 123 (11): 2300–2308. doi:10.1016/j.ophtha.2016.07.028. PMID 27665213.
추가 정보
- Nagase H, Woessner JF (July 1999). "Matrix metalloproteinases". The Journal of Biological Chemistry. 274 (31): 21491–4. doi:10.1074/jbc.274.31.21491. PMID 10419448.
- Zhao X, Wu T, Chang CF, Wu H, Han X, Li Q, Gao Y, Li Q, Hou Z, Maruyama T, Zhang J, Wang J (May 2015). "Toxic role of prostaglandin E2 receptor EP1 after intracerebral hemorrhage in mice". Brain, Behavior, and Immunity. 46: 293–310. doi:10.1016/j.bbi.2015.02.011. PMC 4422065. PMID 25697396.
- Starckx S, Van den Steen PE, Wuyts A, Van Damme J, Opdenakker G (February 2002). "Neutrophil gelatinase B and chemokines in leukocytosis and stem cell mobilization". Leukemia & Lymphoma. 43 (2): 233–41. doi:10.1080/10428190290005982. PMID 11999552. S2CID 940921.
- Wu H, Zhang Z, Li Y, Zhao R, Li H, Song Y, Qi J, Wang J (October 2010). "Time course of upregulation of inflammatory mediators in the hemorrhagic brain in rats: correlation with brain edema". Neurochemistry International. 57 (3): 248–53. doi:10.1016/j.neuint.2010.06.002. PMC 2910823. PMID 20541575.
- Bischof P, Meisser A, Campana A (2002). "Control of MMP-9 expression at the maternal-fetal interface". Journal of Reproductive Immunology. 55 (1–2): 3–10. doi:10.1016/S0165-0378(01)00142-5. PMID 12062817.
- St-Pierre Y, Van Themsche C, Estève PO (September 2003). "Emerging features in the regulation of MMP-9 gene expression for the development of novel molecular targets and therapeutic strategies". Current Drug Targets. Inflammation and Allergy. 2 (3): 206–15. doi:10.2174/1568010033484133. PMID 14561155. S2CID 453825.
- Wu H, Wu T, Hua W, Dong X, Gao Y, Zhao X, Chen W, Cao W, Yang Q, Qi J, Zhou J, Wang J (March 2015). "PGE2 receptor agonist misoprostol protects brain against intracerebral hemorrhage in mice". Neurobiology of Aging. 36 (3): 1439–50. doi:10.1016/j.neurobiolaging.2014.12.029. PMC 4417504. PMID 25623334.
- Lee JM, Yin K, Hsin I, Chen S, Fryer JD, Holtzman DM, Hsu CY, Xu J (March 2005). "Matrix metalloproteinase-9 in cerebral-amyloid-angiopathy-related hemorrhage". Journal of the Neurological Sciences. 229–230: 249–54. doi:10.1016/j.jns.2004.11.041. PMID 15760647. S2CID 21791281.
- Nair RR, Boyd DD (November 2005). "Expression cloning of novel regulators of 92 kDa type IV collagenase expression". Biochemical Society Transactions. 33 (Pt 5): 1135–6. doi:10.1042/BST20051135. PMID 16246065.
- Wu H, Zhang Z, Hu X, Zhao R, Song Y, Ban X, Qi J, Wang J (June 2010). "Dynamic changes of inflammatory markers in brain after hemorrhagic stroke in humans: a postmortem study". Brain Research. 1342: 111–7. doi:10.1016/j.brainres.2010.04.033. PMC 2885522. PMID 20420814.
- Wu H, Wu T, Han X, Wan J, Jiang C, Chen W, Lu H, Yang Q, Wang J (January 2017). "Cerebroprotection by the neuronal PGE2 receptor EP2 after intracerebral hemorrhage in middle-aged mice". Journal of Cerebral Blood Flow and Metabolism. 37 (1): 39–51. doi:10.1177/0271678X15625351. PMC 5363749. PMID 26746866.
- Ram M, Sherer Y, Shoenfeld Y (July 2006). "Matrix metalloproteinase-9 and autoimmune diseases". Journal of Clinical Immunology. 26 (4): 299–307. doi:10.1007/s10875-006-9022-6. PMID 16652230. S2CID 19619963.