난모세포
Oocyte| 난모세포 | |
|---|---|
| 식별자 | |
| 메쉬 | D009865 |
| FMA | 18644 |
| 해부학 용어 | |
난모세포(영국: /ooəsatt/, 미국: /oooo-o--/), 난모세포는 번식에 관여하는 암컷 생식세포 또는 생식세포이다.다른 말로 하면, 이것은 미성숙한 난자, 즉 난세포이다.난소 내 여성 태아에서 난모세포가 생성된다.암컷 생식 세포는 원시 생식 세포(PGC)를 생성하며, 이 세포는 유사분열 과정을 거치며 구고니아를 형성한다.난모증은 난모세포가 된다.난모세포는 저온 보존을 위해 수집될 수 있는 유전 물질의 한 형태이다.
형성
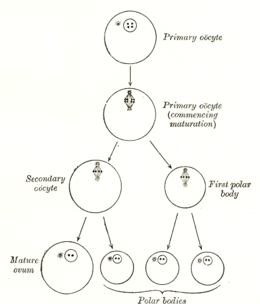
난모세포의 형성은 난모세포형성이라고 불리며 난모세포형성의 [1]한 부분이다.난모세포는 태아기 동안 2차 난모세포가 형성되고 배란의 일부로 2차 난모세포가 형성된다.
| 셀 타입 | 배수성/배수체 | 염색분체 | 과정 | 완료 시기 |
| 우고늄 | 이중배체/46(2N) | 2C | 난모세포형성(유도증) | 임신 3개월째 |
| 일차 난모세포 | 이중배체/46(2N) | 4C | 난형성(Meiosis I)(난형성) | 1단계에서 최대 50년간 기술 |
| 이차 난모세포 | 반수체/23(1N) | 2C | 난형성(meiosis II) | 수정될 때까지 중기 II에서 중단됨 |
| 우티드 | 반수체/23(1N) | 1C | 난형성(meiosis II) | 수정 후 분 |
| 난형 | 반수체/23(1N) | 1C |
특성.
세포질
난모세포는 세포질이 풍부하며, 세포는 발달 초기에 영양을 공급하기 위해 노른자 과립을 포함하고 있다.
핵
난모세포 생성의 1차 단계 동안, 핵은 [2]배낭이라고 불린다.
인간 2차 난모세포의 유일한 정상적인 유형은 23,X(여성을 결정하는) 염색체를 가지고 있는 반면, 정자는 23,X(여성을 결정하는) 또는 23,Y(남성을 결정하는) 염색체를 가질 수 있다.
둥지
난자나 미성숙 난자 내의 공간이 세포 [3]둥지입니다.
적란-외구 복합체
적혈구-구 복합체는 그라피안 모낭의 난모세포를 둘러싸고 있는 촘촘하게 채워진 적혈구 층을 포함합니다.난모세포는 감수분열II에서 중기II 단계에서 정지되며 2차 난모세포로 간주된다.배란 전에 적란 복합체는 적란 팽창으로 알려진 구조적 변화를 겪습니다.과립상세포는 단단하게 압축된 상태에서 확장된 점액질 매트릭스로 변환됩니다.적란 복합체는 난모세포가 발달하는 난포 환경과 직접적으로 소통하기 때문에 적란구 확장이 난모세포의 성숙에 매우 중요하다는 것을 많은 연구들이 보여준다.메커니즘이 완전히 알려져 있지 않고 특정 [4][5][6]종에 따라 다르지만 수정에도 중요한 역할을 합니다.
모성기여금
난모세포의 운명은 수정이 되고 궁극적으로 완전한 기능을 하는 유기체로 성장하는 것이기 때문에, 여러 세포와 발달 과정을 조절할 준비가 되어 있어야 한다.크고 복잡한 세포인 난모세포는 배아의 성장을 지시하고 세포 활동을 조절하는 수많은 분자를 공급받아야 한다.난모세포는 여성 배우자 형성의 산물이기 때문에 난모세포에 대한 모성 기여가 크고, 결과적으로 새로 수정된 난자에 대한 모성 기여가 크다.난모세포에 공급되는 많은 종류의 분자가 있으며, 이는 성장하는 접합자 내에서 다양한 활동을 지시할 것입니다.
생식선 DNA 손상 방지
세포의 DNA는 세포대사의 부산물로 생성된 산화적 유리기의 해로운 영향에 취약하다.난모세포에서 발생하는 DNA 손상은 복구되지 않으면 치명적일 수 있으며, 번식력 감소와 잠재적 자손의 손실을 초래할 수 있다.난모세포는 평균 체세포보다 상당히 크기 때문에 난모세포의 공급을 위해 상당한 대사활동이 필요하다.만약 이 대사활동이 난모세포의 대사기계에 의해 수행된다면, 난모세포 게놈은 생성된 반응성 산화 부산물에 노출될 것이다.따라서 생식선 DNA의 이러한 취약성을 피하기 위해 프로세스가 진화한 것으로 보인다.난모세포의 DNA 게놈 손상을 방지하기 위해, 난모세포 구성 요소 중 많은 부분의 합성에 기여하는 대사를 다른 모세포로 이동시킨 후 난모세포로 [7][8]이동시키는 것이 제안되었다.따라서, 많은 유기체의 난모세포는 산화 DNA 손상으로부터 보호되며, 초기 배아 성장에서 접합자를 배양하기 위해 많은 물질 덩어리를 저장한다.
mRNA 및 단백질
난모세포가 성장하는 동안 모세포에 의해 다양한 모체 전사 전달 RNA, 즉 mRNA가 공급된다.이러한 mRNA는 mRNP(메시지 리보핵단백질) 복합체에 저장되고 특정 시점에 번역될 수 있으며, 세포질의 특정 영역 내에서 국소화될 수 있으며, 전체 난모세포의 [9]세포질 내에서 균일하게 분산될 수 있다.물질적으로 장전된 단백질은 또한 세포질 전체에 걸쳐 국소화되거나 유비쿼터스 될 수 있다.mRNA와 장전된 단백질의 번역 산물은 세포 주기 진행과 세포 대사 같은 세포 "하우스키핑"의 조절에서부터 수정, 접합체 전사 활성화, 신체 [9]축 형성과 같은 발달 과정의 조절까지 다양한 기능을 가지고 있다.아래는 아프리카발톱개구리의 난모세포에서 발견된 모계 유전 mRNA와 단백질의 몇 가지 예입니다.
| 이름. | 모체 분자 유형 | 현지화 | 기능. |
|---|---|---|---|
| 베지티[10] | mRNA | 식물 반구 | 전사율 |
| Vg1[11] | mRNA | 식물 반구 | 전사율 |
| XXBP-1[12] | mRNA | 알 수 | 전사율 |
| 크레브[13] | 단백질 | 유비쿼터스 | 전사율 |
| FoxH1[14] | mRNA | 유비쿼터스 | 전사율 |
| p53[15] | 단백질 | 유비쿼터스 | 문자 변환 계수 |
| Lef/TCF[16] | mRNA | 유비쿼터스 | 전사율 |
| FGF2[17] | 단백질 | 핵 | 알 수 |
| FGF2, 4, 9 FGFR1[16] | mRNA | 알 수 | FGF 시그널링 |
| 엑토데르민[18] | 단백질 | 동물의 반구 | 유비퀴틴리가아제 |
| 페이스[19] 4 | mRNA | 식물 반구 | 프로단백질변환효소 |
| 코코[20] | 단백질 | 알 수 | BMP억제제 |
| 비뚤어진 위배[16] | 단백질 | 알 수 | BMP/코딘결합단백질 |
| 플로피[21] | mRNA | 식물 반구 | 생식세포 형성 및 피질회전 |
미토콘드리아
난모세포는 모세포로부터 미토콘드리아를 공급받아 배아대사와 아포토시스 현상을 조절하게 [9]된다.미토콘드리아의 분할은 난모세포 전체에 미토콘드리아를 위치시킬 미세관 시스템에 의해 수행된다.포유류와 같은 특정 유기체에서는 정자에 의해 난모세포로 가져온 부성 미토콘드리아는 유비퀴티드 단백질의 부착에 의해 분해된다.부성 미토콘드리아의 파괴는 미토콘드리아와 미토콘드리아 DNA 또는 mtDNA의 [9]엄밀한 모성유전을 보장한다.
뉴클레오루스
포유동물에서 난모세포의 [22]핵은 모세포에서만 유래한다.핵에서 발견되는 구조인 핵은 rRNA가 전사되어 리보솜으로 조립되는 위치이다.핵이 성숙한 난모세포에서 조밀하고 비활성화된 반면,[22] 그것은 배아의 적절한 발달을 위해 필요하다.
리보솜
모체 세포는 또한 접합체 게놈이 활성화되기 전에 단백질의 번역에 필요한 리보솜의 저장을 합성하고 기여한다.포유류의 난모세포에서는 모체유래 리보솜과 일부 mRNA가 세포질 격자라고 불리는 구조에 저장된다.섬유소, 단백질, RNA의 네트워크인 이러한 세포질 격자는 성장하는 [23]난모세포 내에서 리보솜의 수가 감소함에 따라 밀도가 증가하는 것으로 관찰되었습니다.
제1상 체포
암컷 포유동물과 조류는 미래의 배란에 필요한 모든 난모세포를 가지고 태어나며, 이러한 난모세포는 감수 [24]분열의 전 단계 I에서 멈춘다.예를 들어 인간의 경우 난모세포는 태아의 임신 3개월에서 4개월 사이에 형성되어 출생 시에 존재한다.이 전단계에서 나는 몇 년 동안 지속될 수 있는 단계(dictyate)를 정지시켰다.유전체 복사본은 난모세포에 4개 있다.4개의 게놈 복사 단계에서 octeyes의 체포는 생식선 [24]DNA의 손상을 복구하는 데 필요한 정보 중복을 제공하는 것으로 보인다.사용된 수리 과정에는 상동 재조합 [24][25][26]수리가 포함될 수 있습니다.전상결핍 난모세포는 DNA [25]손상을 효율적으로 복구할 수 있는 높은 능력을 가지고 있다.DNA 복구 능력은 암컷 배아 라인의 핵심 품질 관리 메커니즘이자 [25]불임성의 중요한 결정 요인인 것으로 보인다.
아버지의 기부금
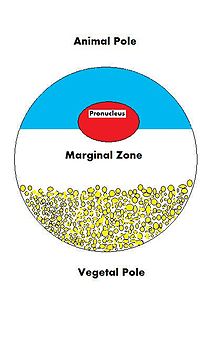
난모세포를 수정시키는 정자는 접합체 게놈의 나머지 절반인 프로뉴클러스(pronucleus)에 기여할 것이다.몇몇 종에서, 정자는 또한 첫 번째 분열을 위해 필요한 접합자 중심체를 구성하는 데 도움을 주는 중심체를 만들 것입니다.그러나 생쥐와 같은 일부 종에서는 중심체 전체가 [27]모성적으로 획득된다.현재 조사되고 있는 것은 정자에 의한 배아에 대한 다른 세포질 기여 가능성이다.
수정 중에 정자는 ① 대사적으로 휴면 중인 난모세포를 활성화시키는 신호 또는 활성화인자 ② 반수체 부성 게놈 ③ 미소관계를 유지하는 역할을 하는 중심체 등 세 가지 중요한 부분을 제공한다.정자 해부도 참조
이상
- 비접합—감수분열 I에서 적절한 상동 분리가 실패하거나 감수분열 II에서 자매 염색체 분리가 실패하면 난모세포가 잘못된 수의 염색체를 갖는 배수가 발생할 수 있다(예: 22,X 또는 24,X).이것은 다운증후군이나 에드워즈 증후군과 같은 인간 질환의 원인이다.그것은 산모의 나이가 많을수록 더 가능성이 높다.
- 일부 난모세포는 다핵을 가지고 있지만 결코 성숙하지 않을 것으로 생각된다.
「 」를 참조해 주세요.
레퍼런스
- ^ answers.com
- ^ "Germinal vesicle". Biology Articles, Tutorials & Dictionary Online. 2019-10-07. Retrieved 2022-04-09.
- ^ Grier HJ, Uribe MC, Parenti LR (April 2007). "Germinal epithelium, folliculogenesis, and postovulatory follicles in ovaries of rainbow trout, Oncorhynchus mykiss (Walbaum, 1792) (Teleostei, protacanthopterygii, salmoniformes)". Journal of Morphology. 268 (4): 293–310. doi:10.1002/jmor.10518. PMID 17309079. S2CID 23482731.
- ^ Yokoo M, Sato E (2004). "Cumulus-oocyte complex interactions during oocyte maturation". International Review of Cytology. 235: 251–91. doi:10.1016/S0074-7696(04)35006-0. ISBN 978-0-12-364639-2. PMID 15219785.
- ^ Tanghe S, Van Soom A, Nauwynck H, Coryn M, de Kruif A (March 2002). "Minireview: Functions of the cumulus oophorus during oocyte maturation, ovulation, and fertilization". Molecular Reproduction and Development. 61 (3): 414–24. doi:10.1002/mrd.10102. PMID 11835587. S2CID 5728551.
- ^ Huang Z, Wells D (October 2010). "The human oocyte and cumulus cells relationship: new insights from the cumulus cell transcriptome". Molecular Human Reproduction. 16 (10): 715–25. doi:10.1093/molehr/gaq031. PMID 20435609.
- ^ Bernstein C (1993). "Sex as a response to oxidative DNA damage. Chapter 10". In Halliwell B, Aruoma OI (eds.). DNA and Free Radicals. Great Britain: Ellis Horwood Limited. pp. 204–205. ISBN 978-0-13-222035-4.
- ^ Bernstein C (1998). "Sex as a response to oxidative DNA damage. Chapter 4". In Aruoma OI, Halliwell B (eds.). DNA and Free Radicals: Techniques, Mechanisms & Applications. Saint Lucia and London: OICA International. pp. 112–113. ISBN 976-8056169.
- ^ a b c d Mtango NR, Potireddy S, Latham KE (2008). "Oocyte quality and maternal control of development". International Review of Cell and Molecular Biology. 268: 223–90. doi:10.1016/S1937-6448(08)00807-1. PMID 18703408.
- ^ Zhang J, King ML (December 1996). "Xenopus VegT RNA is localized to the vegetal cortex during oogenesis and encodes a novel T-box transcription factor involved in mesodermal patterning". Development. 122 (12): 4119–29. doi:10.1242/dev.122.12.4119. PMID 9012531.
- ^ Heasman J, Wessely O, Langland R, Craig EJ, Kessler DS (December 2001). "Vegetal localization of maternal mRNAs is disrupted by VegT depletion". Developmental Biology. 240 (2): 377–86. doi:10.1006/dbio.2001.0495. PMID 11784070.
- ^ Zhao H, Cao Y, Grunz H (May 2003). "Xenopus X-box binding protein 1, a leucine zipper transcription factor, is involved in the BMP signaling pathway". Developmental Biology. 257 (2): 278–91. doi:10.1016/s0012-1606(03)00069-1. PMID 12729558.
- ^ Sundaram N, Tao Q, Wylie C, Heasman J (September 2003). "The role of maternal CREB in early embryogenesis of Xenopus laevis". Developmental Biology. 261 (2): 337–52. doi:10.1016/s0012-1606(03)00303-8. PMID 14499645.
- ^ Kofron M, Puck H, Standley H, Wylie C, Old R, Whitman M, Heasman J (October 2004). "New roles for FoxH1 in patterning the early embryo". Development. 131 (20): 5065–78. doi:10.1242/dev.01396. PMID 15459100.
- ^ Takebayashi-Suzuki K, Funami J, Tokumori D, Saito A, Watabe T, Miyazono K, et al. (September 2003). "Interplay between the tumor suppressor p53 and TGF beta signaling shapes embryonic body axes in Xenopus". Development. 130 (17): 3929–39. doi:10.1242/dev.00615. PMID 12874116.
- ^ a b c Heasman J (February 2006). "Maternal determinants of embryonic cell fate". Seminars in Cell & Developmental Biology. 17 (1): 93–8. doi:10.1016/j.semcdb.2005.11.005. PMID 16426874.
- ^ Song J, Slack JM (December 1994). "Spatial and temporal expression of basic fibroblast growth factor (FGF-2) mRNA and protein in early Xenopus development". Mechanisms of Development. 48 (3): 141–51. doi:10.1016/0925-4773(94)90055-8. PMID 7893598. S2CID 20281053.
- ^ Dupont S, Zacchigna L, Cordenonsi M, Soligo S, Adorno M, Rugge M, Piccolo S (April 2005). "Germ-layer specification and control of cell growth by Ectodermin, a Smad4 ubiquitin ligase". Cell. 121 (1): 87–99. doi:10.1016/j.cell.2005.01.033. PMID 15820681. S2CID 16628152.
- ^ Birsoy B, Berg L, Williams PH, Smith JC, Wylie CC, Christian JL, Heasman J (February 2005). "XPACE4 is a localized pro-protein convertase required for mesoderm induction and the cleavage of specific TGFbeta proteins in Xenopus development". Development. 132 (3): 591–602. doi:10.1242/dev.01599. PMID 15634697.
- ^ Bell E, Muñoz-Sanjuán I, Altmann CR, Vonica A, Brivanlou AH (April 2003). "Cell fate specification and competence by Coco, a maternal BMP, TGFbeta and Wnt inhibitor". Development. 130 (7): 1381–9. doi:10.1242/dev.00344. PMID 12588853.
- ^ Chan AP, Kloc M, Larabell CA, LeGros M, Etkin LD (May 2007). "The maternally localized RNA fatvg is required for cortical rotation and germ cell formation". Mechanisms of Development. 124 (5): 350–63. doi:10.1016/j.mod.2007.02.001. PMC 2435194. PMID 17376659.
- ^ a b Ogushi S, Palmieri C, Fulka H, Saitou M, Miyano T, Fulka J (February 2008). "The maternal nucleolus is essential for early embryonic development in mammals". Science. 319 (5863): 613–6. doi:10.1126/science.1151276. PMID 18239124. S2CID 7799743.
- ^ Yurttas P, Vitale AM, Fitzhenry RJ, Cohen-Gould L, Wu W, Gossen JA, Coonrod SA (August 2008). "Role for PADI6 and the cytoplasmic lattices in ribosomal storage in oocytes and translational control in the early mouse embryo". Development. 135 (15): 2627–36. doi:10.1242/dev.016329. PMC 2708103. PMID 18599511.
- ^ a b c Mira A (September 1998). "Why is meiosis arrested?". Journal of Theoretical Biology. 194 (2): 275–87. Bibcode:1998JThBi.194..275M. doi:10.1006/jtbi.1998.0761. PMID 9778439.
- ^ a b c Stringer JM, Winship A, Zerafa N, Wakefield M, Hutt K (May 2020). "Oocytes can efficiently repair DNA double-strand breaks to restore genetic integrity and protect offspring health". Proceedings of the National Academy of Sciences of the United States of America. 117 (21): 11513–11522. doi:10.1073/pnas.2001124117. PMC 7260990. PMID 32381741.
- ^ He, Da-Jian; Wang, Lin; Zhang, Zhi-Bi; Guo, Kun; Li, Jing-Zheng; He, Xie-Chao; Cui, Qing-Hua; Zheng, Ping (2018-11-18). "Maternal gene Ooep may participate in homologous recombination-mediated DNA double-strand break repair in mouse oocytes". Zoological Research. 39 (6): 387–395. doi:10.24272/j.issn.2095-8137.2018.067. PMC 6085769. PMID 29955025.
- ^ Sutovsky P, Schatten G (2000). "Paternal contributions to the mammalian zygote: fertilization after sperm-egg fusion". International Review of Cytology. 195: 1–65. doi:10.1016/s0074-7696(08)62703-5. ISBN 978-0-12-364599-9. PMID 10603574.
원천
- Purves WK, Orians GH, Sadava D, Heller HC (2004). Life: The Science of Biology (7th ed.). Freeman, W. H. & Company. pp. 823–824. ISBN 978-0-7167-9856-9.