케톤체
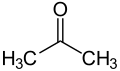
Ketone bodies케톤체는 간에 의해 지방산으로부터 생성된 케톤기를 포함하는 수용성 분자입니다.[1]케톤체는 간 외부 조직으로 쉽게 운반되어 아세틸-CoA(아세틸-Coenzyme A)로 변환되고, 아세틸-CoA는 구연산 회로(Krebs 회로)로 들어가 에너지를 [2]위해 산화된다.[3] 이러한 간 유래 케톤 그룹은 아세토아세트산(아세테이트), 베타-히드록시부틸레이트 및 아세토아세테이트의 자연 분해 생성물인 아세톤을 포함한다(그림 참조).
케톤체는 다양한 시나리오의 칼로리 제한 기간 동안 간에서 생산된다: 낮은 음식 섭취(단식), 탄수화물 제한 식단, 기아, 장기간의 격렬한 운동,[4] 알코올 중독, 또는 치료되지 않은 (또는 불충분한) 타입 1 당뇨병.케톤체는 지방산의 [5]분해에 의해 간세포에서 생성된다.그들은 간에 저장된 글리코겐이 고갈된 후에 혈액으로 방출된다.(글리코겐 저장소는 일반적으로 단식 후 24시간 이내에 고갈됩니다.)[1]
케톤체는 또한 기억 형성을 유지하기 위해 음식 제한 기간 동안 아교세포에서 생산된다.
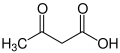
두 개의 아세틸-CoA 분자가 -CoAs(또는 조효소 A)를 잃으면, 아세트산이라고 불리는 공유가의 이합체를 형성할 수 있다.β-히드록시낙산염은 아세토아세테이트의 환원된 형태로, 케톤기가 알코올(또는 수산기)로 변환된다(오른쪽 그림 참조).둘 다 4탄소 분자로, 간을 제외하고 몸의 대부분의 조직에 의해 아세틸-CoA로 쉽게 전환될 수 있다.아세톤은 아세토아세테이트의 탈카복실화 형태이며, 아세토아세테이트는 간에서 해독을 통해서만 아세틸-CoA로 다시 전환될 수 있으며, 간에서 해독을 통해 젖산으로 전환되고, 젖산은 다시 피루브산으로 산화되고 아세틸-CoA로 전환될 수 있다.
케톤체는 케톤증, 케톤산증 사람의 입에서 쉽게 검출되는 독특한 냄새를 가지고 있다.종종 프루티 또는 유사한 매니큐어 리무버(일반적으로 아세톤 또는 아세테이트 에틸 함유)로 묘사됩니다.
3개의 내인성 케톤체 외에 β-케토펜탄산염 및 β-히드록시펜탄산염 등의 케톤체를 트리헵타닌 등의 합성 트리글리세리드 대사 결과 생성해도 된다.
생산.
지방조직에 축적된 지방은 인슐린 수치가 낮고 혈중 글루카곤과 에피네프린 수치가 높을 때 지방세포에서 유리지방산과 글리세롤로 혈액으로 방출된다.이는 식사와 단식, 기아, 격렬한 운동 사이에 혈당 수치가 떨어질 가능성이 높은 경우에 발생한다.지방산은 매우 높은 에너지 연료이며 미토콘드리아를 가진 모든 대사 세포에 의해 흡수된다.이것은 지방산이 [1][7]미토콘드리아에서만 대사될 수 있기 때문입니다.적혈구는 미토콘드리아를 포함하고 있지 않기 때문에 에너지 요구 사항을 위해 혐기성 당분해에 전적으로 의존한다.다른 모든 조직에서는 대사세포에 들어가는 지방산이 조효소 A와 결합하여 아실-CoA 사슬을 형성한다.이것들은 세포의 미토콘드리아로 전달되고, 거기서 그것들은 [1][7]β-산화라고 알려진 일련의 반응에 의해 아세틸-CoA 단위로 분해된다.
β-산화에 의해 생성된 아세틸-CoA는 옥살아세테이트와 결합하여 구연산을 형성함으로써 미토콘드리아의 구연산 회로로 진입한다.그 결과 아세틸-CoA의 아세틸기(위 오른쪽 그림 참조)가 CO와 물로 완전히2 연소됩니다.이 과정에서 방출되는 에너지는 산화 [1][7]아세틸기(또는 아세트산 분자)당 1 GTP와 11 ATP 분자의 형태로 포착된다.이는 간에서 특정 환경을 제외하고 지방산의 β 산화 발생 시 아세틸-CoA의 숙명이다.간에서 옥살아세트산은 단식, 기아, 저탄수화물 식사, 장시간 격렬한 운동 및 제어되지 않은 제1형 당뇨병 중 글루코네제닉 경로로 전부 또는 부분적으로 유도된다.이러한 상황에서 옥살아세트산은 말산염으로 수소화되어 미토콘드리아에서 제거되고 간세포의 세포질에서 포도당으로 전환되며, 여기서 포도당은 [1]혈액으로 방출된다.따라서 간에서 옥살로아세테이트는 혈중 저(또는 부재) 인슐린 및 고(高) 글루카곤 농도에 의해 유의한 당생성이 자극되면 아세틸-CoA와의 축합에 사용할 수 없다.이러한 상황에서 아세틸-CoA는 아세토아세테이트 및 베타-히드록시낙산염의 [1]형성으로 전환된다.아세토아세트산염, 베타-히드록시낙산염 및 이들의 자연분해 생성물인 아세톤은 [8]케톤체로 알려져 있다.케톤체는 간에서 혈액으로 방출된다.미토콘드리아를 가진 모든 세포는 혈액에서 케톤체를 추출하여 아세틸-CoA로 재변환할 수 있으며, 아세틸-CoA는 그들의 구연산 순환에서 연료로 사용될 수 있다. 왜냐하면 다른 어떤 조직도 간이 이것을 하는 방식으로 옥살아세테이트를 글루코네제닉 경로로 돌릴 수 없기 때문이다.유리 지방산과 달리, 케톤체는 혈액 뇌 장벽을 넘을 수 있고, 따라서 중추 신경계의 세포에 대한 연료로 이용 가능하며, 이러한 세포들이 정상적으로 [1]생존하는 포도당의 대체 물질로 작용합니다.굶주림, 저탄수화물 식단, 장시간 격렬한 운동 중 혈액 내 케톤체의 발생은 케톤증으로 이어질 수 있으며, 케톤산증처럼 통제 불능의 제1형 당뇨병의 극단적인 형태로 나타날 수 있다.
아세토아세테이트는 케토시스 중 입냄새와 소변에서 발생하는 이 냄새를 감지할 수 있는 사람들에게 매우 독특한 냄새를 가지고 있다.한편, 대부분의 사람들은 아세톤 냄새를 맡을 수 있는데, 아세톤 냄새는 케톤증이나 특히 케토산증에 [9]걸린 사람들의 입냄새도 특징입니다.
여러 기관에 걸친 연료 사용률
케톤체는 심장, 뇌, 근육에서 연료로 사용될 수 있지만 간에서는 연료로 사용될 수 없다.그들은 미토콘드리아에서 산화되었을 때 아세토아세테이트 분자당 2개의 구아노신 삼인산(GTP)과 22개의 아데노신 삼인산(ATP) 분자를 생성한다.케톤체는 간에서 다른 조직으로 운반되며, 아세토아세테이트 및 β-히드록시부틸레이트는 아세틸-CoA로 전환되어 환원당량(NADH 및2 FADH)을 생성할 수 있다.케톤체는 케톤체의 공급원이지만, 간은 티오포라아제(β-케토아실-CoA 전이효소)가 부족하기 때문에 에너지로 사용할 수 없다.아세톤은 간에서 저농도로 흡수되어 젖산염으로 끝나는 메틸글리옥살 경로를 통해 해독된다.장기간의 단식 또는 케톤성 식이요법에서 발생할 수 있는 고농도의 아세톤은 간 외부의 세포에 흡수되어 프로필렌 글리콜을 통해 다른 경로를 통해 대사된다.비록 경로가 ATP를 필요로 하는 다른 일련의 단계를 따르지만, 프로필렌 글리콜은 결국 [10]피루브산으로 변할 수 있다.
하트
심장은 정상적인 생리 조건 하에서 지방산을 연료로 우선적으로 사용한다.그러나 케톤성 조건 하에서 심장은 이를 [11]위해 케톤체를 효과적으로 사용할 수 있다.
뇌
수십 년 동안 간은 뇌 에너지 대사를 촉진하는 케톤체의 주요 공급원으로 여겨져 왔다.그러나 최근의 증거는 글루아세포가 음식 제한 시 기억 형성을 유지하기 위해 국소적으로 합성된 케톤체로 뉴런에 연료를 공급할 수 있다는 것을 보여주었다.
포도당이 정상보다 부족할 때 뇌는 케톤체로부터 연료 요구량의 일부를 얻는다.혈중 포도당 농도가 낮은 경우, 대부분의 다른 조직들은 케톤체와 포도당(지방산 등) 외에 대체 연료원을 가지고 있지만, 현재의 연구는 뇌가 일부 [13]포도당에 대한 필수 요구 사항을 가지고 있다는 것을 보여준다.3일 동안 엄격한 단식을 한 후,[14] 뇌는 케톤체로부터 에너지의 25%를 얻는다.약 24일 후에 케톤체는 뇌의 주요 연료가 되어 뇌 연료 소비량의 [15]3분의 2를 차지한다.많은 연구들은 인간의 뇌세포가 포도당이 거의 또는 전혀 없어도 생존할 수 있다고 제안하지만, 그 점을 증명하는 것은 윤리적으로 [15]의문스럽다.케톤은 뇌에서 지질 합성을 위한 중요한 기질이기 때문에 케톤이 연소되지 않는다.또한 오메가3 지방산으로부터 생성된 케톤은 [16]노년기의 인지능력 저하를 감소시킬 수 있다.
케톤생성은 진화 과정에서 인간 두뇌의 확장을 촉진하는 데 도움을 주었다.케톤생성이 일반적으로 더 큰 뇌의 진화와 생존의 열쇠라고 이전에 제안되었다.그러나, 세 개의 큰 뇌를 가진 포유류 계통(고래, 코끼리-마스토돈, 구세계 과일 박쥐)에서 HMGCS2(그리고 결과적으로 이 능력)의 상실은 [17]다른 것을 보여준다.
케토시스 및 케토산증
정상적인 개인에서는 간에서 케톤체가 지속적으로 생성되고 간외 조직에 의해 이용된다.혈중 케톤체 농도는 1 mg/dL 내외로 유지된다.소변에서의 그들의 배설은 매우 낮으며 일상적인 소변 검사(로테라 검사)[18]로 감지할 수 없다.
케톤체의 합성 속도가 이용 속도를 초과하면 혈액 중 케톤체의 농도가 높아집니다. 이를 케톤혈증이라고 합니다.이것은 케톤뇨 – 소변에 케톤체를 배설하는 케톤뇨로 이어진다.케톤혈증과 케톤뇨증의 전체적인 그림을 흔히 케톤증이라고 한다.아세토아세테이트 및/또는 아세톤의 입냄새는 케토시스의 일반적인 특징이다.
제1형 당뇨병은 급성 생물학적 스트레스(감염, 심장마비 또는 신체적 외상)를 겪거나 충분한 인슐린을 투여하지 못하면 당뇨병 케토산증의 병리 상태에 들어갈 수 있다.이러한 상황에서 혈중 인슐린 수치가 낮거나 부족한 것은 부적절하게 높은 글루카곤 [19]농도와 결합되어 간에서 포도당을 부적절하게 증가시키는 속도로 생성하도록 유도하여 지방산의 베타 산화로부터 발생하는 아세틸-CoA를 케톤체로 전환시킨다.결과적으로 매우 높은 수준의 케톤체는 혈장의 pH를 낮추는데, 이것은 반사적으로 신장이 매우 높은 산도를 가진 소변을 배설하도록 자극한다.혈중 포도당과 케톤의 높은 수치는 또한 수동적으로 소변으로 흘러들어간다. (관상액에서 포도당과 케톤을 다시 흡수하는 신장세관의 능력 부족으로 인해, 관상액으로 걸러지는 이러한 물질의 많은 양에 압도된다.포도당의 삼투압 이뇨는 혈액에서 수분과 전해질을 제거하여 잠재적으로 치명적인 탈수를 유발합니다.
저탄수화물 식단을 따르는 사람들은 또한 케토시스에 걸릴 것이다.이러한 유도 케토시스를 영양 케토시스라고 부르기도 하지만 케톤 체내 농도는 0.5~5mM인 반면 병리 케토산증은 15~[citation needed]25mM이다.
케토시스의 과정은 알츠하이머와[20] 엔젤만[21] 증후군의 증상을 개선하는 데 효과가 있는지 현재 조사되고 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d e f g h Stryer, Lubert (1995). Biochemistry (Fourth ed.). New York: W.H. Freeman and Company. pp. 510–515, 581–613, 775–778. ISBN 0-7167-2009-4.
- ^ Silva, B., Mantha, O. L., Schor, J., Pascual, A., Plais, P. Y., Pavlowsky, A. 및 Preat, T. (2022).국소적으로 합성된 케톤체를 가진 글리아 신경세포는 기아상태에서 기억을 유지시켜준다.자연대사, 4(2), 213–224.https://doi.org/10.1038/s42255-022-00528-6
- ^ Mary K. Campbell; Shawn O. Farrell (2006). Biochemistry (5th ed.). Cengage Learning. p. 579. ISBN 0-534-40521-5.
- ^ Koeslag, J.H.; Noakes, T.D.; Sloan, A.W. (1980). "Post-exercise ketosis". Journal of Physiology. 301: 79–90. doi:10.1113/jphysiol.1980.sp013190. PMC 1279383. PMID 6997456.
- ^ Berg, Jeremy (2019). Biochemistry (9 ed.). MacMillan. p. 724. ISBN 9781319402853.
- ^ Silva, B., Mantha, O. L., Schor, J., Pascual, A., Plais, P. Y., Pavlowsky, A. 및 Preat, T. (2022).국소적으로 합성된 케톤체를 가진 글리아 신경세포는 기아상태에서 기억을 유지시켜준다.자연대사, 4(2), 213–224.https://doi.org/10.1038/s42255-022-00528-6
- ^ a b c 지방산 산화
- ^ 워털루 대학교 케톤체 대사
- ^ "American Diabetes Association-Ketoacidosis". Archived from the original on 2010-04-29. Retrieved 2010-03-02.
- ^ "Archived copy" (PDF). Archived from the original (PDF) on 2015-09-24. Retrieved 2013-09-18.
{{cite web}}: CS1 maint: 제목으로 아카이브된 복사(링크) - ^ Kodde IF, van der Stok J, Smolenski RT, de Jong JW (January 2007). "Metabolic and genetic regulation of cardiac energy substrate preference". Comp. Biochem. Physiol. A. 146 (1): 26–39. doi:10.1016/j.cbpa.2006.09.014. PMID 17081788.
- ^ Silva, B., Mantha, O. L., Schor, J., Pascual, A., Plais, P. Y., Pavlowsky, A. 및 Preat, T. (2022).국소적으로 합성된 케톤체를 가진 글리아 신경세포는 기아상태에서 기억을 유지시켜준다.자연대사, 4(2), 213–224.https://doi.org/10.1038/s42255-022-00528-6
- ^ Clarke, DD; Sokoloff, L (1999). Siegel, GJ; Agranoff, BW; Albers, RW (eds.). Basic Neurochemistry: Molecular, Cellular and Medical Aspects (6th ed.). Philadelphia: Lippincott-Raven.
- ^ Hasselbalch, SG; Knudsen, GM; Jakobsen, J; Hageman, LP; Holm, S; Paulson, OB (1994). "Brain metabolism during short-term starvation in humans". Journal of Cerebral Blood Flow and Metabolism. 14 (1): 125–31. doi:10.1038/jcbfm.1994.17. PMID 8263048.
- ^ a b 케힐 GF기아 상태에서의 연료 대사.Annu Rev Nutrent 2006; 26:1 ~ 22
- ^ Freemantle, E.; Vandal, M. N.; Tremblay-Mercier, J.; Tremblay, S. B.; Blachère, J. C.; Bégin, M. E.; Thomas Brenna, J.; Windust, A.; Cunnane, S. C. (2006). "Omega-3 fatty acids, energy substrates, and brain function during aging". Prostaglandins, Leukotrienes and Essential Fatty Acids. 75 (3): 213–20. doi:10.1016/j.plefa.2006.05.011. PMID 16829066.
- ^ Jebb, David; Hiller, Michael (16 October 2018). "Recurrent loss of HMGCS2 shows that ketogenesis is not essential for the evolution of large mammalian brains". eLife. 7: e38906. doi:10.7554/eLife.38906.
- ^ Comstock, John P.; Garber, Alan J. (1990). Walker, H. Kenneth; Hall, W. Dallas; Hurst, J. Willis (eds.). Clinical Methods: The History, Physical, and Laboratory Examinations (3rd ed.). Boston: Butterworths. ISBN 040990077X. PMID 21250091.
- ^ Koeslag, J.H.; Saunders, P.T.; Terblanche, E. (2003). "Topical Review: A reappraisal of blood glucose homeostat which comprehensively explains the type 2 diabetes mellitus/syndrome X complex". Journal of Physiology. 549 (Pt 2): 333–346. doi:10.1113/jphysiol.2002.037895. PMC 2342944. PMID 12717005.
- ^ Henderson, Samuel T. (2008-07-01). "Ketone bodies as a therapeutic for Alzheimer's disease". Neurotherapeutics. 5 (3): 470–480. doi:10.1016/j.nurt.2008.05.004. ISSN 1933-7213. PMC 5084248. PMID 18625458.
- ^ "Evaluation of the Safety and Tolerability of a Nutritional Formulation in Angelman Syndrome". 18 August 2020.
외부 링크
- eMedicine에서 emergency/135 - 당뇨병 케토산증
- 지방대사는 unisanet.unisa.edu에서 확인할 수 있습니다.au
- 미국 국립 의학 도서관(MeSH)의 Ketone+Bodies
- McGuire, L. C; Cruickshank, A. M; Munro, P. T (2006). "Alcoholic ketoacidosis". Emergency Medicine Journal. 23 (6): 417–420. doi:10.1136/emj.2004.017590. PMC 2564331. PMID 16714496.