형광 상관 분광법
Fluorescence correlation spectroscopy형광 상관 분광법(FCS)은 형광 강도의 고정된 변동에 대한 통계적 분석이다.그것의 이론적 기초는 L에서 비롯되었다. Onsager의 회귀 가설.이 분석은 변동의 기초가 되는 물리적 프로세스의 운동적 매개변수를 제공한다.이것의 흥미로운 적용 중 하나는 용액의 형광 입자(분자)의 농도 변동에 대한 분석이다.이 애플리케이션에서는 적은 수의 형광 입자(분자)를 함유한 용액의 매우 작은 공간에서 방출되는 형광물질을 관찰한다.입자의 브라운 운동으로 형광 강도가 요동치고 있다.즉, 광학계에 의해 정의된 아공간내의 입자수가 평균수를 중심으로 임의로 변화하고 있는 것이다.이 분석은 입자가 공간을 통과할 때 형광 입자의 평균 수와 평균 확산 시간을 제공한다.결국 입자의 농도와 크기(분자)가 모두 결정된다.두 변수 모두 생화학적 연구, 생물물리학, 화학에서 중요하다.
FCS는 소량의 분자(나노몰라~피코몰라 농도)를 소량(~1μm3)으로 관측하기 때문에 매우 민감한 분석 도구다.[1]다른 방법(예: HPLC 분석)과는 대조적으로 FCS는 물리적 분리 과정이 없다. 대신 광학 장치를 통해 공간 분해능을 달성한다.게다가, FCS는 온전한 살아있는 세포에서 생화학적 경로에 형광 태그를 붙인 분자의 관찰을 가능하게 한다.[2]이것은 "상황 내 또는 생체내 생화학"이라는 새로운 영역을 열게 되는데, 이것은 온전한 세포와 장기의 생화학적 경로를 추적하는 것이다.[3]
일반적으로 FCS는 광학 현미경, 특히 콘포칼로컬 현미경 또는 2광자 흥분 현미경에서 사용된다.이러한 기법에서 빛은 표본에 초점을 맞추고 측정된 형광 강도 변동(확산, 물리적 또는 화학적 반응, 집적 등으로 인한)은 시간적 자기 상관을 이용하여 분석한다.측정된 속성은 본질적으로 크기 및/또는 변동량과 관련이 있기 때문에 개별 종들이 관측 용적(또는 볼륨에서 켜고 끄는)을 출입하는 수준에서 최적의 측정 체계가 있다.너무 많은 기업을 동시에 측정하는 경우 전체 신호에 비해 전체 변동은 작으며 해결할 수 없을 수 있다. 다른 방향으로는 개별 변동 사건이 너무 희박한 경우 한 측정은 지나치게 오래 걸릴 수 있다.FCS는 형광상 대 동적인 빛의 산란으로 형광상대가 형광상 형광상 형광상 형광상 형광상 형광상 형광상 형광상 형광상 형광상 형광상 형광상 형광상 형광상 형광상 형광상
적절한 모델이 알려지면 FCS를 사용하여 다음과 같은 정량적 정보를 얻을 수 있다.
- 확산 계수
- 유체 역학 반지름
- 평균 농도
- 운동 화학 반응 속도
- 싱글렛-스위트 역학
형광 표시기는 다양한 색상으로 나타나며 특정 분자(예: 단백질, 폴리머, 금속 복합체 등)에 구체적으로 결합될 수 있기 때문에 (복합 용액에서 연속적으로) 개별 분자의 행동을 연구하는 것이 가능하다.눈사태 광다이오드 같은 민감한 검출기가 개발되면서 고도로 희석된 샘플에서 개별 분자에서 나오는 형광 신호의 검출이 실용화됐다.이로써 FCS 실험은 재료 과학에서 생물학에 이르기까지 매우 다양한 표본에서 수행할 수 있는 가능성이 대두되었다.유전적으로 태그가 붙은 단백질(녹색 형광 단백질과 같은)을 가진 공학적 세포의 출현으로 FCS는 살아있는 세포의 분자역학 연구를 위한 일반적인 도구가 되었다.[4]
역사
신호 상관 기술은 FCS의 "인벤터"로 일반적으로 인정받고 있는 Magde, Elson, Webb에 의해 1972년에 형광에 처음으로 실험적으로 적용되었다.[5]이 기법은 이들 및 다른 저자들에 의해 곧이어 논문 그룹으로 더욱 발전되어 이론적 기초와 적용 유형을 확립하였다.[6][7][8]1990년경, 충분히 적은 수의 형광 입자를 검출할 수 있는 능력으로, 다음과 같은 두 가지 문제가 대두되었다.레이저 마이크로스코피 시스템의 형광 강도 및 3차원 컨코칼 측정 볼륨의 가우스 분포.[9]전자는 분자 정보를 추출하기 위한 형광 신호의 분포와 모멘트를 분석하게 되었고,[10][11] 결국 Brightness Analysis(밝기 분석)라고 알려진 방법의 집합이 되었다.해당 기간의 검토는 톰슨(1991)[12]을 참조한다.
1993년부터 시작하여 측정량을 더 잘 정의하고 배경을 거부하기 위해 측정 기법에서 많은 개선사항(공코칼로리 현미경 및 2-포톤 현미경 사용)을 사용함으로써 신호 대 잡음 비를 크게 개선하고 단일 분자 감도를 허용했다.[13][14][15]그 이후 FCS에 대한 관심이 새롭게 생겨났으며, 2007년 8월 현재 FCS를 이용한 논문은 웹 오브 사이언스(Web of Science)에서 발견된 3,000여개가 넘는다.리뷰는 Krichevsky와 보닛을[16] 참조하십시오.그 외에도 레이저 스캐닝과 회전 디스크 콘코칼로컬 현미경(정지된 단일 지점 측정에서), 자기 상관 대신 두 형광 채널 간 교차 상관(FCCS) 사용, FRET(Förster Community Energy Transfer) 삽입 사용 등 다양한 방법으로 FCS를 확장하는 활동이 활발히 전개되고 있다.형광의 소량
일반적인 FCS 설정
일반적인 FCS 설정은 레이저 라인(일반적으로 405–633nm(cw) 및 690–1100nm(펄스)의 파장)으로 구성되며, 이 파장은 이크루틱 미러에 의해 현미경 목표에 반영된다.레이저 빔은 형광 입자(분자)를 매우 높은 희석 속에 함유하고 있는 샘플에 집중되어 있어 초점 내에 몇 개(보통 1fL에서 1–100 분자)만 있다.입자가 초점 부피를 가로지르면 형광한다.이 빛은 동일한 목적에 의해 수집되며, 흥분광에 대해 적색으로 변하기 때문에 검출기에 도달하는 이분 거울(일반적으로 광전자 증배관, 눈사태 광다이오드 검출기 또는 초전도 나노와이어 단광 검출기)를 통과한다.결과 전자 신호는 나중에 분석할 강도 대 시간 추적으로 직접 저장하거나 자기 상관(특수 획득 카드 필요)을 직접 생성하도록 계산될 수 있다.FCS 곡선 자체는 시간 관측치만을 나타낸다.물리적 현상에 대한 결론은 적절한 모델을 사용하여 거기에서 도출되어야 한다.관심 매개변수는 자기 상관 곡선을 모델링된 기능 형태에 적합시킨 후에 발견된다.[17]
측정량
측정 용적은 관련 광학 소자에서 발생하는 조명(흥분)과 검출 기하학의 조합이다.결과 볼륨은 포인트 스프레드 함수(또는 PSF)에 의해 수학적으로 설명되며, 기본적으로 포인트 소스의 이미지다.PSF는 초점 직경에서 수백 나노미터의 타원체(비늘이 없는 경계)와 광학 축을 따라 거의 하나의 마이크로미터로 설명되는 경우가 많다.형상은 광학적 소자의 품질에 따라 크게 달라지며(그리고 결과 FCS 곡선에 미치는 영향이 크다) (난시를 피하고 기기에서 PSF의 실제 형상을 확인하는 것이 중요하다).콘코칼로컬 현미경의 경우, 그리고 작은 핀홀(공기 장치 1개 주변)의 경우, PSF는 가우스인에 의해 충분히 근사치가 된다.
여기서 는 피크 강도, r과 z는 방사형 및 축 위치, 및 는 방사형 및 축 반지름형 반지름,z > x 이 가우스 형태는 자기 상관의 기능적 형태를 도출할 때 가정한다.
일반적으로 y 는 200–300nm이고, 는 2–6배 크다.[18]측정 부피 파라미터를 교정하는 한 가지 일반적인 방법은 확산 계수와 농도가 알려진 종(아래 참조)에 대해 FCS를 수행하는 것이다.물 속 일반 불소 형상에 대한 확산 계수는 나중의 섹션에 제시되어 있다.
가우스 근사치는 광학적 디테일에 따라 다양한 정도로 작동하며, 근사치의 오차를 상쇄하기 위해 보정을 적용할 수 있다.[19]
자기 상관 함수
(임시) 자기 상관 함수는 시간 {\ 에 의해 이동된 시계열과의 상관관계로, 의 함수로서 :
여기서 ( t)= I( ) - I( ) 은 평균 강도로부터의 편차다.여기서 정규화(부정화)는 FCS에 가장 일반적으로 사용되는데, 그 는 = 0 G(0)에서의 상관관계는 측정 부피의 평균 입자 수와 관련되기 때문이다.
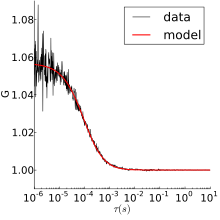
예를 들어, Rhodamine 6G를 자유롭게 확산시키기 위한 원시 FCS 데이터와 그 자기 상관을 오른쪽 그림으로 나타낸다.위의 그림은 형광 강도 대 시간을 보여준다.로다민 6G가 초점 부피 안팎으로 움직이면서 강도가 변동한다.맨 아래 그림에서는 동일한 데이터에 대한 자기 상관입니다.확산률과 농도에 대한 정보는 아래에 설명된 모델 중 하나를 사용하여 얻을 수 있다.
가우스 조명 프로파일 S ( , ) 의 경우 자기 상관 함수는 일반 마스터 공식에[20] 의해 제공된다.
where the vector denotes the stochastic displacement in space of a fluorophore after time . The expression is valid if the average number le 볼륨에 있는 플루오포어의 이(가) 낮으며, 어두운 상태 등이 있는 경우 플루오포어의 상태를 무시할 수 있다.특히 조사 중인 확산 운동의 종류에 대해서는 어떠한 가정도 하지 않았다.The formula allows for an interpretation of as (i) a return probability for small beam parameters and (ii) the moment-generating function of if 은(는) 다양하다.
자기 상관 함수 해석
관심 있는 양을 추출하기 위해 자기 상관 데이터를 적합시킬 수 있으며, 일반적으로 비선형 최소 제곱 알고리즘을 사용한다.적합치의 기능 형태는 역학 유형(및 문제의 광학 기하학)에 따라 달라진다.
정상확산
FCS에 사용되는 형광 입자는 작아서 용액에서 열 운동을 경험한다.따라서 가장 간단한 FCS 실험은 정상적인 3D 확산이며, 이에 대한 자기 상관은 다음과 같다.
여기서 = z / a는 측정량의 축 대 방사형 - 2 e radiiiii의 비율이며, D{\은 특징적인 거주 시간이다.이 형태는 가우스 측정량을 가정하여 도출되었다.일반적으로 적합에는 세 가지 자유 매개변수(G(), G ( G및 가 있으며, 여기서 확산 계수와 플루오포레 농도를 구할 수 있다.
이전 절에서 사용한 정규화에서 G(0)는 관측 용적 크기(평균 농도)를 알면 볼륨 <N>에 있는 평균 확산기 수를 표시하거나 동등하게 다음과 같은 평균 농도는 다음과 같다.
유효 부피는 측정 부피의 가우스 형태를 통합하여 다음과 같이 주어진다.
- D는 확산 계수를 제공한다.
변칙 확산
확산 입자가 장애물에 의해 방해받거나 힘(분자 모터, 흐름 등)에 의해 밀리는 경우, 평균 제곱 변위(MSD)가 시간에 따라 선형적으로 증가하는 일반 확산 모델에 의해 역학이 충분히 설명되지 않는 경우가 많다.대신에 확산은 변칙적인 확산으로 더 잘 설명될 수 있다. 여기서 MSD의 시간적 의존성은 파워 로에서와 같이 비선형이다.
여기서 는 비정상적인 확산 계수다."불규칙한 확산"은 일반적으로 이 매우 일반적인 모델만을 가리키며, 변칙적인 것으로 묘사될 수 있는 다른 많은 가능성들은 언급하지 않는다.또한, 전력법은 엄격한 의미에서 장애물의 분포가 프랙탈인 경우와 같이 엄격하게 정의된 시스템의 좁은 범위에 대해서만 예상되는 형태다.그럼에도 불구하고 전력법은 더 넓은 범위의 시스템에 유용한 근사치가 될 수 있다.
비정상적 확산을 위한 FCS 자기 상관 기능은 다음과 같다.
여기서 변칙적인 지수 이(가) 위와 같으며 피팅에서 자유 파라미터가 된다.
FCS를 사용하여 변칙적인 지수를 분자 혼잡의 정도를 나타내는 것으로 나타났다(더 큰 혼잡도의 경우 1보다 작고 1보다 작음).[21]
다산염 확산
크기가 다른 확산 입자(확산 계수)가 있는 경우, 단일 성분 형태의 합인 함수에 적합하는 것이 일반적이다.
합계가 i에 의해 지수화된 다른 크기의 입자 수를 초과하는 경우, i \ \ 는 가중치를 부여하며, 이는 각 유형의 양자 수율과 농도와 관련이 있다.이는 새로운 매개변수를 도입하기 때문에 고차원 공간을 검색해야 하므로 피팅을 더욱 어렵게 한다.비선형 최소 제곱 피팅은 일반적으로 적은 수의 , i 로 불안정해진다.특히 다분해 검체에 유용한 보다 견고한 피팅 체계는 최대 엔트로피 방법이다.[22]
흐름과 함께 확산
수평 방향의 v{\}과(와) 함께 확산될 경우 자기 상관은 다음과 같다.[23]
여기서 = x / v 는 흐름(확산 없음)만 있는 경우의 평균 거주 시간이다.
화학적 이완
가능한 광범위한 FCS 실험은 열 운동(그리고 "완화") 때문에 평형에서 계속 변동하는 화학 반응을 포함한다.또한 이완 과정인 확산과 대조적으로, 변동은 다른 에너지의 상태들 사이에서 변화를 일으킨다.화학적 이완을 보여주는 매우 간단한 시스템은 입자가 바운드되었을 때 신호만 생성하는 측정 볼륨의 고정 결합 부위가 될 것이다(예: FET 또는 확산 시간이 샘플링 간격보다 훨씬 빠른 경우).이 경우 자기 상관은 다음과 같다.
어디에
이완 시간이며 반응 운동학(on/off rate)에 의존한다.
평형 상수 K와 관련이 있다.
화학적 이완이 있는 대부분의 시스템도 측정 가능한 확산이 나타나며 자기 상관 기능은 시스템의 세부사항에 따라 달라질 것이다.확산과 화학 반응이 분리되면 결합 자기 상관은 화학적 및 확산 자기 상관의 산물이다.
트리플트 상태 보정
위의 자기 상관관계는 그 변동이 입자의 형광 성질의 변화에 기인하지 않는다고 가정한다.단, 녹색 형광 단백질, 로다민, Cy3 및 알렉사 플루오르 염료와 같은 (바이오) 유기 불소 형광물질의 대다수의 경우, 일부 조명의 입자가 트리플릿 상태(또는 다른 비방사성 부패 상태)로 흥분한 다음 특성 완화 시간 동안 광자를 방출하지 않는다 Flly 은(는) 마이크로초의 순서로 되어 있는데, 일반적으로 관심의 역학(예: D 보다 작지만 측정할 수 있을 만큼 크다.삼중수소 상태를 설명하기 위해 자기 상관에 곱셈 항이 추가된다.정상 확산의 경우:
여기서 은(는) 트리플릿 상태로 들어간 입자의 분율이며, 는 해당하는 트리플릿 상태 완화 시간이다.관심의 역학이 트리플트 상태 완화보다 훨씬 더 느리면 자기 상관의 짧은 시간 구성요소를 간단히 자를 수 있고 트리플트 항은 불필요하다.
일반 형광 탐침
FCS에서 사용되는 형광종은 전형적으로 관심의 생물분자인데, 이 생물분자에는 불소가 태그되어 있거나(예를 들어 면역항화학을 사용), 관심의 환경을 조사하기 위해 사용되는 벌거벗은 불소가 있다(예: 세포의 세포골격).다음 표는 상온에서 물에서 흔히 볼 수 있는 플루오르포체의 확산 계수와 그 흥분 파장을 보여준다.
| 형광염료 | [10m−102 s−1] | T [°C] | 흥분 파장 [nm] | 참조 |
|---|---|---|---|---|
| 로다민 6G | 2.8, 3.0, 4.14 ± 0.05, 4.20 ± 0.06 | 25 | 514 | [8][25][26][27] |
| 로다민 110 | 2.7 | 488 | [28] | |
| 테트라메틸로다민 | 2.6 | 543 | ||
| Cy3 | 2.8 | 543 | ||
| Cy5 | 2.5, 3.7 ± 0.15 | 25 | 633 | [29][30] |
| 카르복시플루오르세인 | 3.2 | 488 | ||
| 알렉사로488번길 | 1.96, 4.35 | 22.5±0.5 | 488 | [28][31] |
| 아토 655-말리미드 | 4.07 ± 0.1 | 25 | 663 | [26] |
| 아토 655-카르복실리카시드 | 4.26 ± 0.08 | 25 | 663 | [26] |
| 2′, 7′ 디플로로플루오르세인 (오레곤 그린 488) | 4.11 ± 0.06 | 25 | 498 | [26] |
FCS의 변화
FCS는 거의 항상 단일점, 단일 채널, 시간 자기 상관 측정에 대해 언급하지만, 역사적 맥락에서 벗어난 "불확실성 상관 분광법"이라는 용어는 그러한 제한이 없음을 내포하고 있다.FCS는 각 확장자가 다른 이름(대개 약어)을 생성하면서 서로 다른 연구자들에 의해 여러 가지 변형으로 확장되었다.
스폿 변동 형광 상관 분광학(svFCS)
FCS는 주어진 관측 부피에서 확산 시간을 제공하는 점 측정인 반면, svFCS는 다른 스폿 크기에서 확산 시간을 측정하기 위해 관측 지점을 변화시키는 기법이다.확산 시간과 현물 영역 사이의 관계는 선형이며 구속의 주요 기여를 해독하기 위해 구성될 수 있다.그 결과의 곡선을 확산법이라고 한다.이 기술은 생물학에서 살아있는 세포의 혈장막 조직을 연구하는 데 사용된다.
여기서 은 y축 절편이다.브라운 확산의 경우 = 0 .분리된 도메인으로 인해 구속되는 경우 > 0 된 도메인의 경우 < < 0 .
살아있는 세포와 시뮬레이션 용지에[32][33][34][35][36] 대한 svFCS 연구
샘플링-볼륨 제어 형광 상관 관계 분석(SVC-FCS):[37]
z-스캔 FCS[38]
FCS(Nano-Apertures): 회절벽 파괴[39]
STED-FCS:[40]
형광 교차 상관 분광법(FCCS)
FCS는 확산 시간의 차이를 이용한 분자 상호작용을 연구하기 위해 가끔 사용된다(예를 들어, 연관 반응의 생산물은 반응 물질보다 더 클 것이고 따라서 확산 시간이 개별적으로 더 클 것이다). 그러나 FCS는 분자 질량과 t에 관련된 다음 방정식에서 볼 수 있듯이 분자 질량에 상대적으로 둔감하다.입자 확산 시간(예: 단백질):
서 은(는) 샘플의 점성이고 M \은 형광종의 분자질량이다.실제로 확산 시간은 분자 질량이 4배 이상 차이가 나도록 충분히 달라야 한다(최소한 1.6배는 분자 질량이 4배 이상 달라야 한다는 것을 의미한다.[41]이중색 형광 교차 상관 분광법(FCCS)은 특히 반응의 질량 변화가 작은 경우 FCS보다 더 민감하게 상호작용을 구별하는 2개 이상의 형광 채널(반응제당 1개 채널)을 교차 상관시켜 상호작용을 측정한다.
밝기 분석 방법
이 방법의 집합에는 숫자와 밝기(N&B),[42] 광자 계수 히스토그램(PCH),[43] 형광 강도 분포 분석(FIDA),[44] 누적 분석 등이 있다.[45]및 공간 강도 분포 분석.[46]복수의 방법의 조합도 보고되고 있다.[47]형광 교차 상관 분광법은 다색체 우연을 살펴봄으로써 분자 질량에 대한 분산율의 약한 의존성을 극복한다.호모 상호 작용은?해결책은 밝기 분석에 있다.이 방법들은 형광의 강도 분포에서 이질성을 이용하여 표본 내 다른 종의 분자 밝기를 측정한다.조광기는 단광기에 비해 형광 라벨의 두 배수를 포함하므로 분자 밝기는 단광기의 약 두 배가 될 것이다.결과적으로 상대적 밝기는 과점화의 민감한 척도다.평균 분자 밝기 ⟩ {\ \langle \} )는 다음과 ( {2 {\ \}}) 및 평균 I {\ } \ \ \ \ \ \ \)와 관련이 있다[48]
여기서 와 는 각각 종 의 분수 강도 및 분자 밝기를 나타낸다
FET-FCS
분자 상호작용을 연구하기 위한 또 다른 FCS 기반 접근법은 형광 대신 형광 공명 에너지 전달(FRET)을 사용하며 FREAT-FCS라고 불린다.[49]FEAT의 경우 FCCS와 마찬가지로 두 가지 유형의 프로브가 있지만, 채널이 하나뿐이고 두 프로브가 상호작용을 보장할 수 있을 정도로 가까이 있을 때만 빛이 감지된다.FEAT 신호는 형광보다 약하지만 반응 중 신호만 있다는 장점이 있다(자외유체에서 제외).
FCS 검색 중
형광 상관 분광법(SFCS) 스캔에서 측정 용량은 정의된 방식으로 샘플 전체로 이동한다.스캔의 도입은 표준 FCS에서 자주 접하는 몇 가지 뚜렷한 문제를 완화하거나 제거하여 생물학적 시스템에서 형광 상관법의 적용가능성의 범위를 확장하는 능력에 의해 동기가 부여된다.[50]
FCS의 일부 변형들은 직렬 스캐닝 레이저 현미경에만 적용된다.Image Interference Spectroscopy와 그 변형은 모두 두 개의 광자현미경을 스캔하거나 스캔하는 데 구현되었지만 회전 디스크공초현미경과 같은 다른 현미경으로 전송되었다.래스터 ICS(RICS)[51]와 위치 민감 FCS(PSFCS)[52]는 영상 스캔의 일부 사이의 시간 지연을 분석에 통합한다.또한 스캔 시스템에서만 가능한 저차원 스캔(예: 원형 링)[53]은 단일 지점과 전체 이미지 측정 사이의 시간 척도에 액세스할 수 있다.스캐닝 경로도 입자를 적응적으로 따라가도록 만들어졌다.[54]
회전 디스크 FCS 및 공간 매핑
어떤 영상 상관 분광법도 회전식 디스크 콘코칼로 현미경으로 수행할 수 있는데, 실제로는 레이저 스캐닝 콘코칼로컬 현미경에 비해 더 빠른 영상 속도를 얻을 수 있다.이 접근방식은 최근 공간적으로 변화하는 복잡한 환경에서 확산에 적용되어 확산계수의 픽셀 해상도 지도를 제작하고 있다.[55]FCS와의 확산의 공간적 매핑은 이후 TIRF 시스템으로 확장되었다.[56]상관 기법을 사용한 동적 공간 매핑은 이전부터 적용되었지만 희박한 지점이나[57] 거친 분해능에서만 적용되었다.[58]
ICS(영상 상관 분광기)
움직임이 느릴 때(예를 들어 생물학적으로, 막내의 확산) 단일점 FCS 실험에서 적절한 통계를 얻는 데는 엄청나게 오랜 시간이 걸릴 수 있다.레이저 스캐닝 콘코칼로컬 현미경을 사용하여 여러 공간 지점에서 동시에 실험을 수행함으로써 더 많은 데이터를 얻을 수 있다.이 접근방식은 ICS(Image Interlative Spectroscopy)라고 불린다.[59]그런 다음 측정값을 함께 평균화할 수 있다.
ICS의 또 다른 변화는 입자의 농도에 대한 정보를 제공하는 영상에 공간 자기 상관을 수행한다.[60]그런 다음 상관 관계를 시간 단위로 평균화한다.카메라 화이트 노이즈가 시간이 지남에 따라 자기 상관을 하지 않는 반면, 그것은 공간 자기 상관 함수에 백색 노이즈 진폭을 생성하는데, 이는 형광 분자의 농도를 찾기 위해 자기 상관계 진폭을 장착할 때 설명되어야 한다.
시간적 및 공간적 상관관계 버전의 자연스러운 확장은 spatio-temporal ICS(STICS)이다.[58]STICS에서는 공간이나 시간의 명시적 평균이 없다(상관 관계에 내재된 평균만).비등방성 운동(예: 유도 흐름, 비대칭 확산)이 있는 시스템에서 STICS는 방향 정보를 추출할 수 있다.STICS(Fourier transformation에 의한)와 밀접하게 관련된 변화는 kICS(k-space Image Interference Spectroscopy)이다.[61]
ICS의 교차상관 버전도 있는데, 이는 공동 국부화된 형광 분자의 농도, 분포 및 역학을 산출할 수 있다.[59]형광 강도의 점-스프레드 함수가 겹쳐 개별 형광 기여도를 구별할 수 없을 때 분자는 공동 국지화된 것으로 간주된다.
입자 이미지 상관 분광기(PICS)[62]
PICS는 나노미터 길이와 밀리초 단위 시간대의 상관관계를 해결하는 강력한 분석 툴이다.주걱-임시 영상 상관 분광법을 채택하여 단일 입자 추적의 높은 위치 정확도를 활용한다.[58]기존의 여러 입자 궤적이 교차할 경우 기존의 추적 방법은 분해되지만, 이 방법은 개별 분자를 식별할 수 있는 한 임의로 큰 분자 밀도와 동적 변수(예: 확산 계수, 속도)에 대해 원칙적으로 작용한다.그것은 계산적으로 저렴하고 튼튼하며, 역학에 대한 사전 지식 없이 입자의 합주 내에서 움직임(예: 확산, 능동적 이동, 제한된 확산)을 식별하고 수량화할 수 있다.
입자 이미지 교차 상관 분광학(PICCS) 확장은 2색 현미경으로 관찰할 수 있듯이 여러 상호작용 파트너가 참여하는 생물학적 프로세스에 사용할 수 있다.[63]
FCS 초고해상도 광학변동영상(fcsSOFI)
초해상도 광학변동영상(SOFI)은 FCS와 유사하게 상관 방정식을 이용한 후처리 분석으로 회절 한계 이하의 공간 해상도를 달성하는 초해상도 기법이다.SOFI의 원래 보고에서는 정지상태로부터의 변동, 불소형 점멸의 변동을 사용했지만, FCS는 확산계수의 초해상도 공간지도를 생성하기 위해 프로브 확산으로부터 변동을 생성하는 SOFI와 결합되었다.[64]이것은 다공성 물질과 밀폐된 물질의 확산과 공간적 특성을 이해하기 위해 적용되었다.여기에는 아가로오스[64] 및 온도 반응 PNIPAM 하이드로겔,[65] 액체 결정,[64] 위상분리 고분자 및 RNA/단백 응축물이 포함된다.[66]
총 내부반사 FCS
TIRF(Total internal reflection fluorcence, TIRF)는 커버립 표면 근처의 얇은 층에만 민감한 현미경 접근법으로, 배경 형광을 크게 최소화한다.FCS는 그러한 종류의 현미경까지 확장되었으며, TIR-FCS라고 불린다.[67]TIRF의 형광 강도는 커버슬립(협착점을 가진 가우스 대신)과의 거리에 따라 기하급수적으로 떨어지기 때문에 자기 상관 기능은 다르다.
라이트 시트 형광 현미경을 이용한 FCS 영상 촬영
라이트 시트 형광 현미경이나 선택적 평면 이미징 현미경(SPIM)은 얇은 (레이저) 빛을 이용해 관찰 방향에 수직으로 하는 조명을 사용한다.특정 조건에서 이 조명 원리를 형광 상관 분광법과 결합하여 GFP 라벨 단백질과 같은 형광 입자의 이동성과 상호작용을 공간적으로 해결할 수 있다.[68]
기타 형광 다이너믹 접근법
FCS에는 형광종의 역학을 연구하는 데 널리 사용되는 두 가지 주요 비상관성 대안이 있다.
광 블리딩(FRAP) 후 형광 복구
FRAP에서는 한 지역이 강렬한 빛에 잠깐 노출되고 복구 불가능한 광채불화불소(불화불소)에 노출되며, 인근(불화불소)불소증 확산에 따른 형광 회복이 영상화된다.FCS에 비해 FRAP의 일차적인 이점은 세포 생물학에서 공통적인 정성적 실험을 쉽게 해석할 수 있다는 것이다.세포선, 즉 세포의 영역, 또는 약물을 적용하기 전과 후의 차이는 종종 간단한 영화 검사로 특징지어질 수 있다.FCS 실험에는 처리 수준이 필요하며 회전 확산, 진동, 광선블러링, 조명 및 형광 색상에 대한 의존성, 부적절한 통계 등 잠재적으로 교란할 수 있는 영향에 더 민감하다.FRAP에서는 측정량을 변경하기가 훨씬 쉬워 제어력을 높일 수 있다.실제로, 부피는 일반적으로 FCS보다 크다.FRAP 실험이 일반적으로 더 질적인 반면, 일부 연구자들은 FRAP를 양적으로 연구하고 결합 역학을 포함하고 있다.[69]세포생물학에서 FRAP의 단점은 광선블러링에 의한 세포의 자유로운 급진적 섭동이다.또한 농도나 회전확산, 공동 국지화를 측정할 수 없어 활용도가 떨어진다.FRAP는 FCS보다 훨씬 높은 불소농도를 요구한다.
입자 추적
입자 추적에서 입자 추적 알고리즘을 영화에 적용하여 입자 집합의 궤적을 측정한다.[1] 입자 추적은 상관관계가 하나의 부드러운 곡선으로 역학을 평균하는 FCS와는 달리 모든 동적 정보가 측정에서 유지된다는 장점이 있다.이점은 평균 제곱 변위를 직접 계산하여 정상 또는 전력 법칙 확산과 직접 비교할 수 있는 복잡한 확산을 보여주는 시스템에서 명백하다.입자 추적을 적용하기 위해서는 입자를 구별할 수 있어야 하며 따라서 FCS의 필요량보다 낮은 농도로 해야 한다.또한, 입자 추적은 소음에 더 민감하며, 때때로 결과에 예측할 수 없게 영향을 미칠 수 있다.
2-광자 및 3-광자 FCS 흥분
공간 분해능과 유기 및/또는 생물학적 샘플에서의 포토다마지/포토블레이싱을 최소화하는 두 가지 장점들은 2-포톤 또는 3-포톤 배설 FCS에 의해 얻어진다.[70][71][72][73][74]
| 위키미디어 커먼스는 형광 상관 분광법과 관련된 미디어를 보유하고 있다. |
참고 항목
참조
- ^ Chen, H, Farkas, E, & Webb, W. (2008)형광 상관 분광법의 생체내 적용.생물학자를 위한 생물물리학 도구, 제2권: 생체내 기법, 89, 3-+
- ^ Kwapiszewska, K.; Szczepański, K.; Kalwarczyk, T.; Michalska, B.; Patalas-Krawczyk, P.; Szymański, J.; Andryszewski, T.; Iwan, M.; Duszyński, J.; Hołyst, R. (2020). "Nanoscale Viscosity of Cytoplasm Is Conserved in Human Cell Lines". J. Phys. Chem. Lett. 11 (16): 6914–6920. doi:10.1021/acs.jpclett.0c01748. PMC 7450658. PMID 32787203.
- ^ Kwapiszewska, Karina; Kalwarczyk, Tomasz; Michalska, Bernadeta; Szczepański, Krzysztof; Szymański, Jędrzej; Patalas-Krawczyk, Paulina; Andryszewski, Tomasz; Iwan, Michalina; Duszyński, Jerzy; Hołyst, Robert (2019). "Determination of oligomerization state of Drp1 protein in living cells at nanomolar concentrations". Scientific Reports. 9 (1): 5906. Bibcode:2019NatSR...9.5906K. doi:10.1038/s41598-019-42418-0. PMC 6459820. PMID 30976093.
- ^ Kwapiszewska, Karina; Kalwarczyk, Tomasz; Michalska, Bernadeta; Szczepański, Krzysztof; Szymański, Jędrzej; Patalas-Krawczyk, Paulina; Andryszewski, Tomasz; Iwan, Michalina; Duszyński, Jerzy; Hołyst, Robert (2019). "Determination of oligomerization state of Drp1 protein in living cells at nanomolar concentrations". Scientific Reports. 9 (1): 5906. Bibcode:2019NatSR...9.5906K. doi:10.1038/s41598-019-42418-0. PMC 6459820. PMID 30976093.
- ^ Magde, D.; Elson, E. L.; Webb, W. W. (1972). "Thermodynamic fluctuations in a reacting system: Measurement by fluorescence correlation spectroscopy". Phys Rev Lett. 29 (11): 705–708. Bibcode:1972PhRvL..29..705M. doi:10.1103/physrevlett.29.705.
- ^ Ehrenberg, M.; Rigler, R. (1974). "Rotational brownian motion and fluorescence intensity fluctuations". Chem Phys. 4 (3): 390–401. Bibcode:1974CP......4..390E. doi:10.1016/0301-0104(74)85005-6.
- ^ Elson, E. L.; Magde, D. "Fluorescence correlation spectroscopy I. Conceptual basis and theory, (1974)". Biopolymers. 13: 1–27. doi:10.1002/bip.1974.360130102. S2CID 97201376.
- ^ a b Magde, D.; Elson, E. L.; Webb, W. W. (1974). "Fluorescence correlation spectroscopy II. An experimental realization". Biopolymers. 13 (1): 29–61. doi:10.1002/bip.1974.360130103. PMID 4818131. S2CID 2832069.
- ^ Qian, H.; Elson, E. L. (1991). "Analysis of confocal laser-microscope optics for 3-D fluorescence correlation spectroscopy". Applied Optics. 30 (10): 1185–1195. Bibcode:1991ApOpt..30.1185Q. doi:10.1364/AO.30.001185. PMID 20582127.
- ^ Palmer, A. G.; Thompson, N. L. (1989). "High-order fluorescence fluctuation analysis of model protein clusters". Proc Natl Acad Sci U S A. 86 (16): 6148–6152. Bibcode:1989PNAS...86.6148P. doi:10.1073/pnas.86.16.6148. PMC 297794. PMID 2548201.
- ^ Qian, H.; Elson, E. L. (1990). "Distribution of molecular aggregation by analysis of fluctuation moments". Proc Natl Acad Sci U S A. 87 (14): 5479–5483. Bibcode:1990PNAS...87.5479Q. doi:10.1073/pnas.87.14.5479. PMC 54348. PMID 2371284.
- ^ 톰슨 N L 1991 형광 스펙트럼 분석 기법의 주제 제 1, ed J R 라코위츠 (뉴욕: 플레넘) 페이지 337–78
- ^ 리글러, R, ü. 메츠1, J. 위덴렌, P. 카스크."카운트 비율이 높고 배경이 낮은 플루오렌스 상관관계 분광법: 번역적 확산 분석.유럽 생물물리학 저널(1993) 22(3), 159.
- ^ Eigen, M.; Rigler, M. (1994). "Sorting single molecules: application to diagnostics and evolutionary biotechnology". Proc. Natl. Acad. Sci. USA. 91 (13): 5740–5747. Bibcode:1994PNAS...91.5740E. doi:10.1073/pnas.91.13.5740. PMC 44073. PMID 7517036.
- ^ Rigler, M (1995). "Fluorescence correlations, single molecule detection and large number screening. Applications in biotechnology". J. Biotechnol. 41 (2–3): 177–186. doi:10.1016/0168-1656(95)00054-t. PMID 7544589.
- ^ Krichevsky, O.; Bonnet, G. (2002). "Fluorescence correlation spectroscopy: the technique and its applications". Rep. Prog. Phys. 65 (2): 251–297. Bibcode:2002RPPh...65..251K. doi:10.1088/0034-4885/65/2/203. S2CID 49429529.
- ^ Medina, M. A.; Schwille, P. (2002). "Fluorescence correlation spectroscopy for the detection and study of single molecules in biology". BioEssays. 24 (8): 758–764. doi:10.1002/bies.10118. PMID 12210537. S2CID 3860264.
- ^ Mayboroda, O. A.; van Remoortere, A.; Tanke, H. J.; Hokke, C. H.; Deelder, A. M. (2003). "A new approach for fluorescence correlation spectroscopy (FCS) based immunoassays". J. Biotechnol. 107 (2): 185–192. doi:10.1016/j.jbiotec.2003.10.007. PMID 14711501.
- ^ Hess, S.T.; Webb, W.W. (2002). "Focal volume optics and experimental artifacts in confocal fluorescence correlation spectroscopy". Biophys. J. 83 (4): 2300–2317. Bibcode:2002BpJ....83.2300H. doi:10.1016/s0006-3495(02)73990-8. PMC 1302318. PMID 12324447.
- ^ Höfling, F.; Bamberg, K.-U. & Franosch, T. (2011). "Anomalous transport resolved in space and time by fluorescence correlation spectroscopy". Soft Matter. 7 (4): 1358–1363. arXiv:1003.3762. Bibcode:2011SMat....7.1358H. doi:10.1039/C0SM00718H. S2CID 18905838.
- ^ Banks, D. S.; Fradin, C. (2005). "Anomalous diffusion of proteins due to molecular crowding". Biophys. J. 89 (5): 2960–2971. Bibcode:2005BpJ....89.2960B. doi:10.1529/biophysj.104.051078. PMC 1366794. PMID 16113107.
- ^ Sengupta, P.; Garai, K.; Balaji, J.; Periasamy, N.; Maiti, S. (2003). "Measuring Size Distribution in Highly Heterogeneous Systems with Fluorescence Correlation Spectroscopy". Biophys. J. 84 (3): 1977–1984. Bibcode:2003BpJ....84.1977S. doi:10.1016/s0006-3495(03)75006-1. PMC 1302767. PMID 12609900.
- ^ Kohler, R.H.; Schwille, P.; Webb, W.W.; Hanson, M.R. (2000). "Active protein transport through plastid tubules: velocity quantified by fluorescence correlation spectroscopy". J Cell Sci. 113 (22): 3921–3930. doi:10.1242/jcs.113.22.3921.
- ^ Widengren, J.; Mets; Rigler, R. (1995). "Fluorescence correlation spectroscopy of triplet states in solution: a theoretical and experimental study". J. Chem. Phys. 99 (36): 13368–13379. doi:10.1021/j100036a009.
- ^ Berland, K. M. (2004). "Detection of specific DNA sequences using dual-color two-photon fluorescence correlation spectroscopy". J. Biotechnol. 108 (2): 127–136. doi:10.1016/j.jbiotec.2003.11.006. PMID 15129721.
- ^ a b c d Müller, C.B.; Loman, A.; Pacheco, V.; Koberling, F.; Willbold, D.; Richtering, W.; Enderlein, J. (2008). "Precise measurement of diffusion by multi-color dual-focus fluorescence correlation spectroscopy". EPL. 83 (4): 46001. Bibcode:2008EL.....8346001M. doi:10.1209/0295-5075/83/46001.
- ^ Wang, F.; Shi, Y.; Luo, S.; Chen, Y.; Zhao, J. (2012). "Conformation transition of Poly(N-isopropylacrylamide) Single Chains in Its Cononsolvency Process: A Study by Fluorescence Correlation Spectroscopy and Scaling Analysis. (2012)". Macromolecules. 45 (22): 9196–9204. Bibcode:2012MaMol..45.9196W. doi:10.1021/ma301780f.
- ^ a b Pristinski, D.; Kozlovskaya, V.; Sukhishvili, S. A. (2005). "Fluorescence correlation spectroscopy studies of diffusion of a weak polyelectrolyte in aqueous solutions". J. Chem. Phys. 122 (1): 014907. Bibcode:2005JChPh.122a4907P. doi:10.1063/1.1829255. PMID 15638700.
- ^ Widengren, J.; Schwille, P. (2000). "Characterization of photoinduced isomerization and back-isomerization of the cyanine dye Cy5 by fluorescence correlation spectroscopy. (2000)". J. Phys. Chem. A. 104 (27): 6416–6428. Bibcode:2000JPCA..104.6416W. doi:10.1021/jp000059s.
- ^ Loman, A.; Dertinger, T.; Koberling, F.; Enderlein, J. (2008). "Comparison of optical saturation effects in conventional and dual-focus fluorescence correlation spectroscopy (2008)". Chem. Phys. Lett. 459 (1): 18–21. Bibcode:2008CPL...459...18L. doi:10.1016/j.cplett.2008.05.018.
- ^ Petráaek; Schwille, P. (2008). "Precise Measurement of Diffusion Coefficients using Scanning Fluorescence Correlation Spectroscopy". Biophys. J. 94 (4): 1437–1448. Bibcode:2008BpJ....94.1437P. doi:10.1529/biophysj.107.108811. PMC 2212689. PMID 17933881.
- ^ 와레지니에크 외(2005) 바이오피스 J.
- ^ 레네 외(2006) EMBO J.
- ^ Guia 외 (2011) Sci Signal.
- ^ 루프레히트 외 (2011) 바이오피스 J.
- ^ Billaudeau 외 연구진(2013) 효소에서의 방법
- ^ 마스다 외(2005) 바이오피스 J.
- ^ 험폴로크코바 외 연구진(2006) 바이오피스 J.
- ^ 벵거 외(2007) 바이오피스 J.
- ^ 에글링 외(2009) 자연
- ^ Meseth, U.; Wohland, T.; Rigler, R.; Vogel, H. (1999). "Resolution of fluorescence correlation measurements. (1999)". Biophys. J. 76 (3): 1619–1631. Bibcode:1999BpJ....76.1619M. doi:10.1016/s0006-3495(99)77321-2. PMC 1300138. PMID 10049342.
- ^ Digman, M. A.; Dalal, R.; Horwitz, A. F.; Gratton, E. (2008). "Mapping the number of molecules and brightness in the laser scanning microscope". Biophys. J. 94 (6): 2320–2332. Bibcode:2008BpJ....94.2320D. doi:10.1529/biophysj.107.114645. PMC 2257897. PMID 18096627.
- ^ Chen, Y.; Müller, J. D.; So, P. T. C.; Gratton, E. (1999). "The photon counting histogram in fluorescence fluctuation spectroscopy". Biophys. J. 77 (1): 553–567. Bibcode:1999BpJ....77..553C. doi:10.1016/s0006-3495(99)76912-2. PMC 1300352. PMID 10388780.
- ^ Kask, P.; Palo, K.; Ullmann, D.; Gall, K. (1999). "Fluorescence-intensity distribution analysis and its application in biomolecular detection technology". Proc. Natl. Acad. Sci. U.S.A. 96 (24): 13756–13761. Bibcode:1999PNAS...9613756K. doi:10.1073/pnas.96.24.13756. PMC 24137. PMID 10570145.
- ^ Müller, J. D. (2004). "Cumulant analysis in fluorescence fluctuation spectroscopy". Biophys. J. 86 (6): 3981–3992. Bibcode:2004BpJ....86.3981M. doi:10.1529/biophysj.103.037887. PMC 1304299. PMID 15189894.
- ^ Godin, Antoine (April 26, 2011). "Revealing protein oligomerization and densities in situ using spatial intensity distribution analysis". PNAS. 108 (17): 7010–7015. Bibcode:2011PNAS..108.7010G. doi:10.1073/pnas.1018658108. PMC 3084122. PMID 21482753.
- ^ Içbilir, Ali (2021). "Determination of G-protein–coupled receptor oligomerization by molecular brightness analyses in single cells". Nature Protocols. 16 (3): 1419–1451. doi:10.1038/s41596-020-00458-1. PMID 33514946. S2CID 231768809.
- ^ Qian, H.; Elson, E.L. (1990). "On the analysis of high order moments of fluorescence fluctuations". Biophys. J. 57 (2): 375–380. Bibcode:1990BpJ....57..375Q. doi:10.1016/s0006-3495(90)82539-x. PMC 1280678. PMID 2317556.
- ^ Remaut, K.; Lucas, B.; Braeckmans, K.; Sanders, N.N.; Smedt, S.C. De; Demeester, J. (2005). "FRET-FCS as a tool to evaluate the stability of oligonucleotide drugs after intracellular delivery". J Control Rel. 103 (1): 259–271. doi:10.1016/j.jconrel.2004.11.019. PMID 15710516.
- ^ Mashaghi, A.; et al. (2008). "Characterization of Protein Dynamics in Asymmetric Cell Division by Scanning Fluorescence Correlation Spectroscopy". Biophysical Journal. 95 (11): 5476–5486. Bibcode:2008BpJ....95.5476P. doi:10.1529/biophysj.108.135152. PMC 2586573. PMID 18805921.
- ^ Digman, M.A.; Sengupta, P.; Wiseman, P.W.; Brown, C.M.; Horwitz, A.R.; Gratton, E. (2005). "Fluctuation Correlation Spectroscopy with a Laser-Scanning Microscope: Exploiting the Hidden Time Structure". Biophys. J. 88 (5): L33–36. Bibcode:2005BpJ....88L..33D. doi:10.1529/biophysj.105.061788. PMC 1305524. PMID 15792971.
- ^ Skinner, J.P.; Chen, Y.; Mueller, J.D. (2005). "Position-Sensitive Scanning Fluorescence Correlation Spectroscopy". Biophys. J. 89 (2): 1288–1301. Bibcode:2005BpJ....89.1288S. doi:10.1529/biophysj.105.060749. PMC 1366613. PMID 15894645.
- ^ Ruan, Q.; Cheng, M.A.; Levi, M.; Gratton, E.; Mantulin, W.W. (2004). "Spatial-temporal studies of membrane dynamics: scanning fluorescence correlation spectroscopy (SFCS)". Biophys. J. 87 (2): 1260–1267. Bibcode:2004BpJ....87.1260R. doi:10.1529/biophysj.103.036483. PMC 1304464. PMID 15298928.
- ^ Berglund, A.; Mabuchi, H. (2005). "Tracking-FCS: Fluorescence correlation spectroscopy of individual particles" (PDF). Opt. Express. 13 (20): 8069–8082. Bibcode:2005OExpr..13.8069B. doi:10.1364/opex.13.008069. PMID 19498837.
- ^ Sisan, D.R.; Arevalo, R.; Graves, C.; McAllister, R.; Urbach, J.S. (2006). "Spatially resolved fluorescence correlation spectroscopy using a spinning disk confocal microscope". Biophysical Journal. 91 (11): 4241–4252. Bibcode:2006BpJ....91.4241S. doi:10.1529/biophysj.106.084251. PMC 1635679. PMID 16950838.
- ^ Kannan, B.; Guo, L.; Sudhaharan, T.; Ahmed, S.; Maruyama, I.; Wohland, T. (2007). "Spatially resolved total internal reflection fluorescence correlation microscopy using an electron multiplying charge-coupled device camera". Analytical Chemistry. 79 (12): 4463–4470. doi:10.1021/ac0624546. PMID 17489557.
- ^ Wachsmuth, M.; Waldeck, W.; Langowski, J. (2000). "Anomalous diffusion of fluorescent probes inside living cell nuclei investigated by spatially resolved fluorescence correlation spectroscopy". J. Mol. Biol. 298 (4): 677–689. doi:10.1006/jmbi.2000.3692. PMID 10788329. S2CID 21791229.
- ^ a b c Hebert, B.; Constantino, S.; Wiseman, P. W. (2005). "Spatio-temporal image correlation spectroscopy (STICS): theory, verification and application to protein velocity mapping in living CHO cells". Biophys. J. 88 (5): 3601–3614. Bibcode:2005BpJ....88.3601H. doi:10.1529/biophysj.104.054874. PMC 1305507. PMID 15722439.
- ^ a b Wiseman, P. W.; Squier, J. A.; Ellisman, M. H.; Wilson, K. R. (2000). "Two-photon video rate image correlation spectroscopy (ICS) and image cross-correlation spectroscopy (ICCS)". J. Microsc. 200 (Pt 1): 14–25. doi:10.1046/j.1365-2818.2000.00736.x. PMID 11012824. S2CID 6554931.
- ^ Petersen, N. O.; Wiseman, P. W.; Seger, O.; Magnusson, K. E. (1993). "Quantitation of membrane receptor distributions by image correlation spectroscopy: concept and application". Biophys. J. 65 (3): 1135–1146. Bibcode:1993BpJ....65.1135P. doi:10.1016/S0006-3495(93)81173-1. PMC 1225831. PMID 8241393.
- ^ Kolin, D.L.; Ronis, D.; Wiseman, P.W. (2006). "k-Space Image Correlation Spectroscopy: A Method for Accurate Transport Measurements Independent of Fluorophore Photophysics". Biophys. J. 91 (8): 3061–3075. Bibcode:2006BpJ....91.3061K. doi:10.1529/biophysj.106.082768. PMC 1578478. PMID 16861272.
- ^ Semrau, S.; Schmidt, T. (2007). "Particle Image Correlation Spectroscopy (PICS): Retrieving Nanometer-Scale Correlations from High-Density Single-Molecule Position Data". Biophys. J. 92 (2): 613–621. Bibcode:2007BpJ....92..613S. doi:10.1529/biophysj.106.092577. PMC 1751376. PMID 17085496.
- ^ Semrau, S.; Holtzer, L.; Gonzalez-Gaitan, M.; Schmidt, T. (2011). "Quantification of Biological Interactions with Particle Image Cross-Correlation Spectroscopy (PICCS)". Biophys. J. 100 (7): 1810–1818. Bibcode:2011BpJ...100.1810S. doi:10.1016/j.bpj.2010.12.3746. PMC 3072609. PMID 21463595.
- ^ a b c Kisley, L.; Higgins, D.; Weiss, S.; Landes, C.F. (2015). "Characterization of Porous Materials by Fluorescence Correlation Spectroscopy Super-resolution Optical Fluctuation Imaging". ACS Nano. 9 (9): 9158–9166. doi:10.1021/acsnano.5b03430. PMID 26235127.
- ^ Dutta, C.; Bishop, L. D. C.; Landes, C.F. (2020). "Imaging Switchable Protein Interactions with an Active Porous Polymer Support". J. Phys. Chem. B. 124 (22): 4412–4420. doi:10.1021/acs.jpcb.0c01807. PMID 32441098. S2CID 218836568.
- ^ Shayegan, M.; Michnick, S. W.; Leslie, S. L. (2019). "Probing Inhomogeneous Diffusion in the Microenvironments of Phase-Separated Polymers under Confinement". J. Am. Chem. Soc. 141 (19): 7751–7757. doi:10.1021/jacs.8b13349. PMID 31017394. S2CID 129941554.
- ^ Lieto, A.M.; Thompson, N.L. (2004). "Total Internal Reflection with Fluorescence Correlation Spectroscopy: Nonfluorescent Competitors". Biophys. J. 87 (2): 1268–1278. Bibcode:2004BpJ....87.1268L. doi:10.1529/biophysj.103.035030. PMC 1304465. PMID 15298929.
- ^ Capoulade, J.; Wachsmuth, M.; Hufnagel, L.; Knop, M. (September 2011). "Quantitative fluorescence imaging of protein diffusion and interaction in living cells". Nature Biotechnology. 29 (9): 835–839. doi:10.1038/nbt.1928. PMID 21822256. S2CID 10493584.
- ^ Sprague, B.L.; McNally, J.G. (2005). "FRAP analysis of binding: proper and fitting". Trends in Cell Biology. 15 (2): 84–91. doi:10.1016/j.tcb.2004.12.001. PMID 15695095.
- ^ Diaspro, A.; Robello, M. (1999). "Multi-photon Excitation Microscopy to Study Biosystems". European Microscopy and Analysis. 5: 5–7.
- ^ Bagatolli, L.A.; Gratton, E. (2000). "Two-photon fluorescence microscopy of coexisting lipid domains in giant unilamellar vesicles of binary phospholipid mixtures". Biophys J. 78 (1): 290–305. Bibcode:2000BpJ....78..290B. doi:10.1016/s0006-3495(00)76592-1. PMC 1300637. PMID 10620293.
- ^ Schwille, P.; Haupts, U.; Maiti, S.; Webb, W. (1999). "Molecular dynamics in living cells observed by fluorescence correlation spectroscopy with one- and two- photon excitation". Biophysical Journal. 77 (10): 2251–2265. Bibcode:1999BpJ....77.2251S. doi:10.1016/S0006-3495(99)77065-7. PMC 1300505. PMID 10512844.
- ^ 적외선 마이크로스펙트럼법, 형광 마이크로스펙트럼법, 적외선 화학 이미징 및 고분해능 핵 자기공명 분석, 콩종자, 체배아 및 단일세포, Baianu, I.C.2004, D. Luthria, 편집장 Pp.241–273, AOCS Pressure, Champaign, IL.
- ^ 근적외선 마이크로스펙트럼법, 적외선 화학 이미징 및 형광 현미경 검사법.2004.I에 의한 단일 암 세포 검출.C. Baianu, D.코스테스쿠, N. E. Hofmann 및 S. S. Korban, q-bio/0407006(2004년 7월)
추가 읽기
- 리글러 R.와 위덴렌 J. (1990년).형광 상관 분광학, BioScience(Ed)에 의한 단일 분자의 초민감 검출.Klinge & Owman) 페이지 180
- Oehlenschläger, F.; Schwille, P.; Eigen, M. (1996). "Detection of HIV-1 RNA by nucleic acid sequence-based amplification combined with fluorescence correlation spectroscopy". Proc. Natl. Acad. Sci. USA. 93 (23): 12811–12816. Bibcode:1996PNAS...9312811O. doi:10.1073/pnas.93.23.12811. PMC 24002. PMID 8917501.
외부 링크
- Haustein, Elke; Schwille, Petra (2004). "Single-molecule spectroscopic methods". Current Opinion in Structural Biology. 14 (5): 531–540. doi:10.1016/j.sbi.2004.09.004. hdl:11858/00-001M-0000-0029-D76C-C. PMID 15465312.
- FCS 강의실
- 스토어 인스티튜트 FCS 자습서
- 셀 마이그레이션 컨소시엄 FCS 튜토리얼
- 형광 상관 분광법(FCS)(Becker & Hickl GmbH, 웹 페이지)


 피크 강도, r과 z는 방사형 및 축 위치,
피크 강도, r과 z는 방사형 및 축 위치, 
 방사형 및 축 반지름형 반지름,
방사형 및 축 반지름형 반지름,















 특징적인 거주 시간이다.이 형태는 가우스 측정량을 가정하여 도출되었다.일반적으로 적합에는 세 가지 자유 매개변수(G(
특징적인 거주 시간이다.이 형태는 가우스 측정량을 가정하여 도출되었다.일반적으로 적합에는 세 가지 자유 매개변수(G(






 (가) 위와 같으며 피팅에서 자유 파라미터가 된다.
(가) 위와 같으며 피팅에서 자유 파라미터가 된다. 

 불안정해진다.특히 다분해 검체에 유용한 보다 견고한 피팅 체계는 최대 엔트로피 방법이다.
불안정해진다.특히 다분해 검체에 유용한 보다 견고한 피팅 체계는 최대 엔트로피 방법이다.
![\ G(\tau )=G(0){\frac {1}{(1+(\tau /\tau _{{D}}))(1+a^{{-2}}(\tau /\tau _{{D}}))^{{1/2}}}}\times \exp[-(\tau /\tau _{v})^{2}\times {\frac {1}{1+\tau /\tau _{D}}}]+G(\infty )](https://wikimedia.org/api/rest_v1/media/math/render/svg/2338429881fea18317141e28d9c1accc4c59f52c)






 (는) 트리플릿 상태로 들어간 입자의 분율이며,
(는) 트리플릿 상태로 들어간 입자의 분율이며,  해당하는 트리플릿 상태 완화 시간이다.관심의 역학이 트리플트 상태 완화보다 훨씬 더 느리면 자기 상관의 짧은 시간 구성요소를 간단히 자를 수 있고 트리플트 항은 불필요하다.
해당하는 트리플릿 상태 완화 시간이다.관심의 역학이 트리플트 상태 완화보다 훨씬 더 느리면 자기 상관의 짧은 시간 구성요소를 간단히 자를 수 있고 트리플트 항은 불필요하다. 

 y축 절편이다.브라운 확산의 경우
y축 절편이다.브라운 확산의 경우 
 도메인의 경우
도메인의 경우 

 (는) 샘플의 점성이고 M
(는) 샘플의 점성이고 M  형광종의 분자질량이다.실제로 확산 시간은 분자 질량이 4배 이상 차이가 나도록 충분히 달라야 한다(최소한 1.6배는 분자 질량이 4배 이상 달라야 한다는 것을 의미한다.
형광종의 분자질량이다.실제로 확산 시간은 분자 질량이 4배 이상 차이가 나도록 충분히 달라야 한다(최소한 1.6배는 분자 질량이 4배 이상 달라야 한다는 것을 의미한다.








