셀 구분
Cell sorting세포 분류는 유기체로부터 세포를 떼어내어 그 종류에 따라 분리하는 과정이다. 그 세포들은 관심 영역과 그 영향을 식별하기 위해 라벨이 붙고 태그가 붙는다.[1] 세포 크기, 형태학(모양), 표면 단백질 발현 등의 차이를 바탕으로 분리된다.[1] 그 결과 세포의 동음이의 개체군은 연구와 치료법으로서 중요한 응용을 한다.
방법들
셀 구분에는 단세포 구분법, 형광 활성 세포 구분법, 자기 활성화 세포 구분법 등 크게 3가지 방법이 있다. 가장 일반적으로 사용되는 방법은 FASS(형광 활성 셀 정렬)와 MACS(자기 활성화 셀 정렬)이다.[2] 이 방법들은 주로 혈액학, 세포유전학, 줄기세포 연구소에 사용된다. 그러나 수년간의 정교함과 세포분석에 대한 수요증가로 인해 연구자들은 기존의 FASS나 MACS 장치에 비해 장점이 많지만 상용화에는 많은 장벽을 보이는 미세유체 분류장치를 개발하기 위해 노력하고 있다.[3]
형광 활성
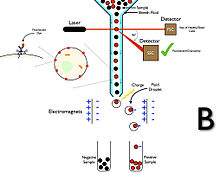
형광 활성 세포 선별(FASS)은 플로우 시토메트릭을 활용하여 세포의 이종 혼합을 선별하기 위해 형태학이 아닌 세포내 및 세포외 특성에 대한 빠르고 객관적이고 정량적인 측정을 제공한다.[4] 이것은 현재 세포를 분리하는 가장 일반적인 방법이며, 전하가 있는 작은 액체 방울로 세포들을 캡슐화하여 외부 전기장별로 분류하는 것을 포함한다.[5] FASS 장치는 상당히 비싸고 일반적으로 실험실 환경에서만 발견되지만 초당 약 5만 셀의 비율로 분류할 수 있고 99.9% 이상의 높은 순도에 도달하는 높은 성능을 가지고 있다. 그러나 그것들은 크고 세포 생존력을 손상시킬 수 있는 고압력을 이용한다.[3] FASS는 관심 이벤트의 성공적인 정렬을 달성하기 위해 함께 작동하는 몇 가지 시스템을 가지고 있다. 여기에는 유체학, 광학 및 분류 시스템이 포함된다. 형광을 이용하여, 사용자들은 많은 다른 특성화된 셀을 포함하는 표본 내에서 특정 사건 집단을 식별할 수 있다. 이 기술은 혈액학 실험실에서 광범위하게 사용된다. 그러나 연구자들은 다양한 형광 염료를 사용하여 다중 색상 패널을 설계할 수 있어 복수의 정밀하게 정의된 셀 유형의 성공적인 동시 정렬을 달성할 수 있다. 도표 A는 음의 셀 선택(미사용 그룹)의 FASS를 나타내고 도표 B는 양의 셀 선택(희망 그룹)의 FASS를 보여준다.
세포분류의 형광염료
형광 염료는 매우 다르게 작용할 수 있다. 일반적으로 형광 염료는 특정 파장의 일관성 있는 광원(레이저)에 의해 흥분되고 낮은 에너지와 긴 파장에서 빛을 발산하게 된다. 가장 흔한 염료는 세포에 제시된 항원에 결합하여 작용한다. 타겟팅된 일반 항원은 분화 클러스터(CD)이다.[6] 이것들은 특정 유형의 세포에 특정된다. 만약 당신이 당신의 관심 세포에 어떤 CD가 제시되어 있는지 알아낼 수 있다면, 당신은 그 세포만을 분류하는 FASS를 사용하여 그것 특유의 형광 염료로 당신의 샘플을 더럽힐 수 있다. 그러나 형광 염료가 작용하는 다른 많은 메커니즘들이 있다.
몇몇 염료는 막 전체에 퍼질 수 있다. 이 염료의 특성을 이용하여 사용자는 세포 내 활동뿐만 아니라 단백질의 표면적 표현도 특징 지을 수 있다. 예를 들어 죽은 세포에서는 프로피듐 요오드화합물(PI)이 DNA와 결합하는 핵에 침투할 수 있다. PI의 형광 신호는 세포 주기 분석을 위한 DNA 함량을 정량화하거나 샘플에서 죽은 세포를 식별하는 데 사용될 수 있다.
특정 형광 염료는 포름알데히드 내의 세포를 고정시키고 생존 가능한 세포를 잃는 것보다 운동 세포 내 활동을 특징짓는 데 사용될 수 있다. 아래 표에는 산화 스트레스로 인한 세포독성의 여러 파라미터를 측정하는 데 사용할 수 있는 염료가 간략하게 나와 있다.
| 염색하다 | 매개변수 | 작용기전 | 배출/배출 |
| DCFH-DA | 반응성 산소종 (ROS) | 에 대한 디세틸화 2' diclorofluorescin 2' diclorofluorcein(DCF)에 대해 과격한 조건에서 ROS와 반응하는 diclorofluorescin 2' dicloploorescin(DCF | 488nm/525nm |
| Rh123 | 미토콘드리아 막전위 (MMP) | 활성미토콘드리아에 의해 격리된 | 488nm/525nm |
| 인도-1 AM | 칼슘 수준 | 칼슘 이온의 유무에 따라 2개의 다른 파장에서 방출 | 350nm/[400nm/485nm] |
| PI | 라이브/데드 | 죽은 세포에만 침투하여 DNA에 결합 | 488nm/675nm |
이 실험 설정은 흐름 시토메트리 능력의 한 예에 불과하다. FASS 시스템에서 이러한 특성화된 세포는 이후 실험을 위해 분류되고 정화될 수 있다.
자석활성화
자기 활성 세포 선별(MACS)은 세포외 특성, 일반적으로 세포 표면 단백질(안티겐)을 기반으로 이기종 세포 혼합물을 풍부하게 하는 방법을 제공한다.이것은 라벨이 부착된 세포가 자기 기둥을 통해 전달되는 기둥 기반 분리 기법이다.[7] 마이크로비즈라고 불리는 자석 구슬은 세포 그룹과 짝을 이룬 다음, 자석 안에 놓이거나 완충 용액에서 배양되거나 흔들린 후 자기장에 노출된다.[8][9][10] 마이크로바이드와 짝을 이룬 세포는 자기장에 스스로를 부착하고 비장애 세포는 제거된다.[9][10] 그런 다음 이 프로세스를 반복하여 선택한 셀을 계속 제거할 수 있다.[8][10]
SEP 시스템은 라벨이 부착된 셀의 튜브를 자기장 내부에 배치하는 칼럼 프리 셀 분리 기법을 제공한다.[11] 음극으로 선택된 셀은 액상 서스펜션에 있는 동안 양극으로 선택된 셀은 튜브에 보관된다.
MACS 장치는 단일 스트림에 셀을 집중시킬 필요가 없고 대신 대량으로 셀을 분리할 수 있기 때문에 FASS 장치보다 훨씬 저렴하다. 이 방법은 대상 모집단 내 비표적 세포의 유입과 원천에서 멀리 떨어진 세포의 분류를 유발하는 고도로 비선형 자력으로 인해 목표 세포 순도가 낮아지는 문제를 안고 있다.[3] 그러나 MACS는 관리가 용이하고 살아있는 세포에 최소한의 손상을 입히기 때문에 특히 NPC(Neural progenator cell) 배양액과 함께 사용할 때 유익하다는 것을 보여주었다.[10]
NPC 문화는 특히 살아있는 뇌세포가 민감하고 서로를 오염시키는 경향이 있기 때문에 함께 일하기 어렵다.[10] 더 명확한 결과를 얻기 위해, 실험실은 더 깨끗한 재료가 필요하며, 이것은 더 순수한 NPC 라인을 의미한다.[10] 2019년에 실시된 연구(뉴욕줄기세포재단과 전측면 퇴화협회의 자금후원을 통해)는 MACS가 세포 라인에 최소한의 손상을 주고, 따라서 더 나은 품질의 세포를 유지하고, 더 많은 균일한 NPC를 수집하고, e를 찾을 수 있는 값싸고 간단한 방법이라는 것을 발견했다.신경 장애에 대한 [10]감염 치료 그들은 각 방법의 실행 가능성을 비교하기 위해 MACS와 FASS 방법을 모두 사용하여 CD271-(중간 줄기세포의 유용한 표시자)와 CD133+(암 줄기세포의 표시자)를 걸러냈다.[10]
MACS 방법은 또한 재생산(인공수정)과 망막 이식 치료에도 도움을 주는 데 사용되었다.[8][9] 생식을 돕는 경우, 세포사멸(죽거나 손상된 세포)이 분리되어 있어 더 많은 세포사멸(비파괴) 정자(비파괴) 세포를 채취하여 피험자의 생식 가능성을 높이는 데 사용할 수 있다.[8] 이러한 치료 유형은 반복적으로 할 때 더욱 효과가 있는 것으로 나타나 수정 중에 존재하는 비복구 세포의 양을 증가시켰다.[8]
프랑스에서의 2018년 연구(파리의 Insitut de la Vision과 Replanet France Association을 포함한 여러 개인과 기관의 지원을 받아)는 광수용체(빛에 반응하는 망막의 세포)가 맹목성을 치료하기 위해 이식될 수 있다는 것을 보여주기 위해 쥐와 MACS 방법을 사용했다.[9] 이 과정에서 마이크로비드를 CD73 효소에 부착해 레티날 오가노이드로부터 PR(광수용체)의 분리를 도왔다.[9] CD73+ 항원이 RCVRN+ 세포(눈 속의 칼슘 결합 단백질)로 자신을 표현했을 때, 이 CD73+와 RCVRN+의 조합은 수리를 위해 후두정 PR 전구체와 함께 사용될 수 있다는 것을 연구자들에게 보여주었다.[9] 비록 이 연구가 인간의 성공을 검증할 수는 없었지만, 그들은 손상되지 않은 광수용체와 CD73 항원을 결합한 성공과 쥐의 이식에 기초하여 추가적인 연구를 할 수 있는 기반을 가지고 있다.[9] 이식을 통한 세포분리와 결합의 성공은 총맹을 포함한 망막질환의 잠재적 치료법이 될 수 있음을 보여준다. 지금까지 일부 시력 보수만 보고됐다.[9]
미세유체장치
FASS와 MACS 장치의 일부 문제 때문에, 최근 미세유체 세포 정렬 장치가 조사되었고 임상 사용과 치료 시점 응용을 위한 상용화를 위한 시도로 연구가 진행되고 있다. 미세유체 소자는 경우에 따라 99% 정도의 타겟 셀 순도와 약 48,000 셀/초의 높은 셀 출력을 제공함으로써 다른 방법의 한계를 극복했다.[12][13] 다른 이점으로는 셀의 초점을 맞추기 위해 고압 피복 흐름의 필요성을 낮추어 셀 생존성을 손상시킬 위험 감소, 일부 장치를 사용한 다중 경로 정렬 기능, 5개의 서로 다른 분리 배출구 허용, 저렴한 제조 방법으로 인한 마이크로 유체 채널 비용 감소, 낮은 전력 소비, 그리고 스몰 등이 있다.일부 장치가 신용 카드 크기인 작은 크기의 [14][15]발자국
PDMS(Polydimethylsiloxane)와 에폭시 등의 소재를 활용한 소프트 리토그래피 기법으로 만들어진 소형 마이크로 채널의 개발은 기기 마이크로 채널의 유체 행동을 바탕으로 세포를 분류하는 독특한 방법을 제공한다. 이 장치들은 유체의 작용을 이용하여 이 마이크로미터 내의 작은 힘이 영역에게 용액의 세포를 조작하도록 명령한다. 세포를 분류하기 위해 진료지점 응용에 사용할 수 있고 샘플 용적이 적고 값비싼 장비가 필요 없는 솔루션에서 희귀 세포를 분류하는 방법을 개발하기 위해 노력해왔다. 암, 종양 또는 줄기세포와 같은 혈액 용액에서 희귀 세포를 분리하는 것은 연구실 환경에 한정된 값비싼 장비가 필요하거나 단일 세포의 수력 집중 흐름을 개발하기 위해 많은 샘플 용적이 필요한 다른 방법들 때문에 여전히 중요한 기술적 난제로 남아 있다.[16] 이러한 종류의 분류는 또한 이러한 영역에서 세포들을 분류하는 데 필요한 작은 힘 때문에 세포에 더 부드럽게 접근하는 것으로 인식되어, 분류 후 세포 생존성을 향상시킨다.[17] 다양한 방법을 능동적 방법과 수동적 방법으로 나눌 수 있다.
활동적인
활성 세포 분류는 현미경이나 카메라를 통해 표적 세포를 검출한 후 마이크로 유체 채널의 유체 흐름을 바꾸기 위한 작동 방법의 자동 또는 수동 작동을 포함한다. 일부 기법은 대상 세포를 식별하기 위해 FASS에서 사용되는 것과 유사한 형광 태깅을 이용한다. 특히 관심 있는 세포를 출구로 유도하여 추가 실험을 위해 세포를 함정에 빠뜨리기 위해 흐름 경로를 변경한다. 구분 후 흐름 특성을 변경하고 세포 생존성을 유지하는 작동 방법으로는 압전 작동,[18] 물방울 유전체,[19] 광학 조작,[20] 표면 음향파(SAW) 편향 등이 있다.[21][22] 이러한 방법은 분류와 데이터 획득을 위한 통제가 필요한 전문 장비나 복잡한 구성 요소 때문에 일반적으로 비용이 더 많이 든다.[3]
수동적
수동적 세포 분류는 크기와 형태학에 따라 세포를 변경하고 분리하기 위해 마이크로 채널 내의 유체의 동작을 이용한다. 콜로이드 용액의 유체는 채널의 벽과 유체의 상호작용으로 인해 속도 프로파일의 대상이 되며, 용액의 셀은 셀 크기에 따라 달라지는 다양한 드래그 및 관성력에 노출되어 속도 프로파일을 따라 다른 위치에서 균형을 맞춘다.[23] 곡선 마이크로유체 채널에서는 레이놀즈 수 및 곡률 반경으로 인해 단면 위치에 서로 다른 크기의 입자를 배치하는 Dean의 힘에 의해 vorticle이 형성된다.[24]
예를 들어, 곧은 채널에서, 콜로이드 용액에서 큰 세포가 가까이 다 가 마이크로 채널의 중심에 작은 세포보다 떨어져 벽과 이 벽에 끌린 힘의 평형으로 세포를 설정하는 것의 균형을 맞추속도 프로필에서 전단 경근신에서 세포는 벽에서 더 큰 발목 힘으로 인해 나타나고 있다.[25]
부력이 활성화됨
부력 활성 세포 선별(BACS)은 미세 분비가 세포 표면에 결합하는 항체를 통해 세포에 결합하는 분리 기법이다. 그런 다음 대상 세포는 생물학적 샘플에서 부양 작용을 통해 제거된다.[26]
싱글 셀 정렬
단세포 정렬은 세포내 및 세포외 특성을 바탕으로 이종 세포 혼합을 정렬하는 방법을 제공한다. 단일 셀 방법은 모호하거나 확실하지 않을 수 있는 셀룰러 특성을 이해할 수 있게 한다. 단일 셀을 정렬하는 방법에는 다음과 같은 몇 가지가 있다.
마이크로라프트 배열은 세포의 분리를 위한 빠르고 비용 효율적인 방법을 제공하며, 시간이 지남에 따라 세포를 분석하고, 세포내 및 세포외 특성을 모두 감시할 수 있는 독특한 능력을 가진 집단을 생성한다.[27] 이 체계는 고정된 세포 유형과 비고정적인 세포 유형 모두에 이상적이다.
외부 자극에 대한 반응을 관찰하는 단세포 방법(이 경우 리간드에 대한 세포 반응)은 마이크로 채널 밸브가 있는 마이크로 유체 소자를 사용하여 챔버에 단일 셀을 가두는 방법을 연구했다. 작동에는 23밸브 시스템이 사용되었고, 자극 반응 영상에는 형광 염료가 사용되었다.[28]
단일 세포 군집화 방법은 세포 내 특성에 기초하여 데이터 과학자가 설계한 일련의 통계적 방법이다. 이 프로세스에는 Single Cell RNA-Seq 데이터 수집, 클러스터링을 위한 데이터 사전 처리, 클러스터링 및 클러스터링 평가가 포함된다. 과학자들은 단일 세포 RNA-Seq 데이터에 기계 학습 방법(주로 클러스터링 분석)을 적용하여 세포를 다른 범주로 나눈다. 모든 방법을 수정하여 기술적 편견이 존재하는 상태에서 저표현 유전자의 중퇴, 모호한 세포표지 등의 RNA-Seq 데이터의 문제를 해결한다. 최신 [29]방법에는 SC3, [30]CIDR, Seurat 등이 있으며 자세한 내용은 Wiki 페이지를 참조하십시오. 단일 셀 RNA-Seq 클러스터링.
참조
- ^ Jump up to: a b Rosental, Benyamin; Kozhekbaeva, Zhanna; Fernhoff, Nathaniel; Tsai, Jonathan M.; Traylor-Knowles, Nikki (Dec 2017). "Coral cell separation and isolation by fluorescence-activated cell sorting (FACS)". BMC Cell Biology. 18 (1): 30. doi:10.1186/s12860-017-0146-8. ISSN 1471-2121. PMC 5575905. PMID 28851289.
- ^ Bowles, Kathryn R.; T. C. W., Julia; Qian, Lu; Jadow, Benjamin M.; Goate, Alison M. (2019-03-27). Hu, Wenhui (ed.). "Reduced variability of neural progenitor cells and improved purity of neuronal cultures using magnetic activated cell sorting". PLOS ONE. 14 (3): e0213374. doi:10.1371/journal.pone.0213374. ISSN 1932-6203. PMC 6436701. PMID 30917153.
- ^ Jump up to: a b c d Shields CW, Ohiri KA, Szott LM, López GP (March 2017). "Translating microfluidics: Cell separation technologies and their barriers to commercialization". Cytometry Part B. 92 (2): 115–125. doi:10.1002/cyto.b.21388. PMC 5149119. PMID 27282966.
- ^ Sun, Qiang; Wang, Xiaoning; Chen, Zhaolie; Ma, Li; Li, Wen; Li, Qihong; Yu, Kaitao; Ning, Xiangkai; Chen, Ang (2015-04-27). "Fluorescence-Activated Cell Sorting Analysis of Heterotypic Cell-in-Cell Structures". Scientific Reports. 5: 9588. Bibcode:2015NatSR...5E9588H. doi:10.1038/srep09588. ISSN 2045-2322. PMC 5386181. PMID 25913618.
- ^ Leary JF (October 2005). "Ultra high-speed sorting". Cytometry. Part A. 67 (2): 76–85. doi:10.1002/cyto.a.20160. PMID 16163688. S2CID 13337181.
- ^ "Human CD & Other Cellular Antigens - US". www.thermofisher.com. Retrieved 2018-12-11.
- ^ "MACS" (website). Miltenyi Biotech. Retrieved 2013-03-19.
- ^ Jump up to: a b c d e Dirican, Enver Kerem (2012), "Magnetic-Activated Cell Sorting of Human Spermatozoa", Practical Manual of in Vitro Fertilization, Springer New York, pp. 265–272, doi:10.1007/978-1-4419-1780-5_29, ISBN 9781441917799
- ^ Jump up to: a b c d e f g h Gagliardi, Giuliana; Ben M'Barek, Karim; Chaffiol, Antoine; Slembrouck-Brec, Amélie; Conart, Jean-Baptiste; Nanteau, Céline; Rabesandratana, Oriane; Sahel, José-Alain; Duebel, Jens; Orieux, Gael; Reichman, Sacha (September 2018). "Characterization and Transplantation of CD73-Positive Photoreceptors Isolated from Human iPSC-Derived Retinal Organoids". Stem Cell Reports. 11 (3): 665–680. doi:10.1016/j.stemcr.2018.07.005. PMC 6135113. PMID 30100409.
- ^ Jump up to: a b c d e f g h Bowles, Kathryn R.; T. C. W., Julia; Qian, Lu; Jadow, Benjamin M.; Goate, Alison M. (2019-03-27). "Reduced variability of neural progenitor cells and improved purity of neuronal cultures using magnetic activated cell sorting". PLOS ONE. 14 (3): e0213374. doi:10.1371/journal.pone.0213374. ISSN 1932-6203. PMC 6436701. PMID 30917153.
- ^ Kokaji AI, Holland S, Fairhurst MA, Thomas TE, Guilbault BG (April 2009). "A simple one-step method for isolating highly purified plasmacytoid dendritic cells from human peripheral blood". The Journal of Immunology. 182: 33–78.
- ^ Gossett DR, Weaver WM, Mach AJ, Hur SC, Tse HT, Lee W, Amini H, Di Carlo D (August 2010). "Label-free cell separation and sorting in microfluidic systems". Analytical and Bioanalytical Chemistry. 397 (8): 3249–67. doi:10.1007/s00216-010-3721-9. PMC 2911537. PMID 20419490.
- ^ Hulspas R, Villa-Komaroff L, Koksal E, Etienne K, Rogers P, Tuttle M, Korsgren O, Sharpe JC, Berglund D (October 2014). "Purification of regulatory T cells with the use of a fully enclosed high-speed microfluidic system". Cytotherapy. 16 (10): 1384–9. doi:10.1016/j.jcyt.2014.05.016. PMID 25065635.
- ^ Shields CW, Reyes CD, López GP (March 2015). "Microfluidic cell sorting: a review of the advances in the separation of cells from debulking to rare cell isolation". Lab on a Chip. 15 (5): 1230–49. doi:10.1039/C4LC01246A. PMC 4331226. PMID 25598308.
- ^ Ding X, Lin SC, Lapsley MI, Li S, Guo X, Chan CY, Chiang IK, Wang L, McCoy JP, Huang TJ (November 2012). "Standing surface acoustic wave (SSAW) based multichannel cell sorting". Lab on a Chip. 12 (21): 4228–31. doi:10.1039/C2LC40751E. PMC 3956451. PMID 22992833.
- ^ Zhou J, Kasper S, Papautsky I (November 2013). "Enhanced size-dependent trapping of particles using microvortices". Microfluidics and Nanofluidics. 15 (5): 611–623. doi:10.1007/s10404-013-1176-y. PMC 3810988. PMID 24187531.
- ^ Ding X, Lin SC, Lapsley MI, Li S, Guo X, Chan CY, Chiang IK, Wang L, McCoy JP, Huang TJ (November 2012). "Standing surface acoustic wave (SSAW) based multichannel cell sorting". Lab on a Chip. 12 (21): 4228–31. doi:10.1039/c2lc40751e. PMC 3956451. PMID 22992833.
- ^ Cho SH, Chen CH, Tsai FS, Godin JM, Lo YH (June 2010). "Human mammalian cell sorting using a highly integrated micro-fabricated fluorescence-activated cell sorter (microFACS)". Lab on a Chip. 10 (12): 1567–73. doi:10.1039/c000136h. PMC 3118392. PMID 20379604.
- ^ Agresti JJ, Antipov E, Abate AR, Ahn K, Rowat AC, Baret JC, Marquez M, Klibanov AM, Griffiths AD, Weitz DA (March 2010). "Ultrahigh-throughput screening in drop-based microfluidics for directed evolution". Proceedings of the National Academy of Sciences of the United States of America. 107 (9): 4004–9. Bibcode:2010PNAS..107.4004A. doi:10.1073/pnas.0910781107. PMC 2840095. PMID 20142500.
- ^ Chen Y, Chung AJ, Wu TH, Teitell MA, Di Carlo D, Chiou PY (May 2014). "Pulsed laser activated cell sorting with three dimensional sheathless inertial focusing". Small. 10 (9): 1746–51. doi:10.1002/smll.201302885. PMC 4324602. PMID 24536017.
- ^ Schmid L, Weitz DA, Franke T (October 2014). "Sorting drops and cells with acoustics: acoustic microfluidic fluorescence-activated cell sorter". Lab on a Chip. 14 (19): 3710–8. doi:10.1039/c4lc00588k. PMID 25031157. S2CID 9893236.
- ^ Ren L, Chen Y, Li P, Mao Z, Huang PH, Rufo J, Guo F, Wang L, McCoy JP, Levine SJ, Huang TJ (October 2015). "A high-throughput acoustic cell sorter". Lab on a Chip. 15 (19): 3870–3879. doi:10.1039/c5lc00706b. PMC 4641751. PMID 26289231.
- ^ Martel JM, Toner M (July 2014). "Inertial focusing in microfluidics". Annual Review of Biomedical Engineering. 16 (1): 371–96. doi:10.1146/annurev-bioeng-121813-120704. PMC 4467210. PMID 24905880.
- ^ Martel JM, Toner M (2013-11-26). "Particle Focusing in Curved Microfluidic Channels". Scientific Reports. 3: 3340. Bibcode:2013NatSR...3E3340M. doi:10.1038/srep03340.
- ^ Geislinger TM, Franke T (June 2014). "Hydrodynamic lift of vesicles and red blood cells in flow--from Fåhræus & Lindqvist to microfluidic cell sorting". Advances in Colloid and Interface Science. 208: 161–76. doi:10.1016/j.cis.2014.03.002. PMID 24674656.
- ^ "Cell Separation Terminology, Uses, Methods and Technologies". Akadeum Life Sciences. Retrieved 2017-09-11.
- ^ "The Isoraft System" (website). Cell Microsystems. Retrieved 2013-03-19.
- ^ Tan SJ, Kee MZ, Mathuru AS, Burkholder WF, Jesuthasan SJ (2013-11-08). "A microfluidic device to sort cells based on dynamic response to a stimulus". PLOS ONE. 8 (11): e78261. Bibcode:2013PLoSO...878261T. doi:10.1371/journal.pone.0078261. PMC 3826715. PMID 24250795.
- ^ Kiselev V, Kirschner K, Schaub M, et al. (2017). "SC3: consensus clustering of single-cell RNA-seq data". Nature Methods. 483 (486): 483–486. doi:10.1038/nmeth.4236. PMC 5410170. PMID 28346451.
- ^ Lin P, Troup M, Ho JW (2017). "CIDR: Ultrafast and accurate clustering through imputation for single-cell RNA-seq data". Genome Biol. 18 (59): 59. doi:10.1186/s13059-017-1188-0. PMC 5371246. PMID 28351406.
외부 링크
| 라이브러리 리소스 정보 셀 구분 |