우울 생물학
Biology of depression과학 연구 결과, 다른 뇌 영역이 주요 우울증 장애(MDD)를 가진 사람들에게서 변화된 활동을 보인다는 것이 밝혀졌으며, 이는 심리적 또는 상황적 원인을 강조하는 이론과는 달리 이 병의 생화학적 기원을 규명하려는 다양한 이론의 옹호자들을 고무시켰다. 이러한 원인 집단을 아우르는 요인으로는 마그네슘, 비타민 D, 상황적 기원이지만 생물학적 영향이 있는 트립토판 등의 영양 결핍이 있다. 수년에 걸쳐 우울증의 생물학적으로 근거한 원인에 관한 여러 이론이 제시되었는데, 여기에는 모노아민 신경전달물질, 신경성 플라스틱, 신경생성, 염증, 그리고 순환 리듬을 중심으로 한 이론들이 포함되어 있다. 갑상선 기능저하증과 미토콘드리아 질환을 포함한 신체적 질병도 우울증 증상을 유발할 수 있다.[1][2]
우울증과 관련된 신경회로는 보상뿐만 아니라 감정의 생성과 조절에 관련된 사람들을 포함한다. 이상 현상은 일반적으로 측면 전두엽 피질에서 발견되는데, 이 피질에는 일반적으로 감정의 조절이 수반되는 것으로 간주된다. 편도선, 전측응고피질(ACC), 전측피질(OFC), 선조체 등 감정과 보상의 생성에 관여하는 지역도 자주 관여한다. 이러한 영역은 모노아민 핵에 의해 내분되며, 잠정적인 증거는 비정상적인 모노아민 활동에서 잠재적인 역할을 시사한다.[3][4]
유전인자
유전자 연구의 어려움
역사적으로 후보 유전자 연구는 연구의 주요 초점이었다. 그러나 유전자의 수가 정확한 후보 유전자를 선택할 가능성을 감소시킴에 따라 1종 오류(허위 양성)가 발생할 가능성이 높다. 후보 유전자 연구는 잦은 유전자형 오류와 통계적으로 저전력 상태를 포함한 많은 결함을 종종 가지고 있다. 이러한 영향은 유전자와 유전자의 상호작용을 고려하지 않고 유전자의 일반적인 평가에 의해 복합된다. 이러한 제한은 어떤 후보 유전자도 게놈 전체 의의에 도달하지 못했다는 사실에 반영된다.[5]
유전자 후보
5-HTTPR
세로토닌 트랜스포터 프로모터 유전자의 짧은 알레르기는 우울증 위험 증가와 관련이 있지만 1990년대 이후 결과는 일관성이 없었다.[6][7][8][9][10] 유전자-환경 상호작용에 연계된 다른 유전자는 CRHR1, FKBP5, BDNF가 있는데, 이 중 처음 두 유전자는 HPA 축의 스트레스 반응과 관련이 있고, 후자는 신경 유전자와 관련이 있다. 우울증에 대한 5-HTTLPR의 후보 유전자 분석은 단독으로 또는 생명 스트레스와 결합하여 그 효과에 대해 결론을 내리지 못했다.[11]
2003년의 한 연구는 유전자와 환경 상호작용(GxE)이 세로토닌-트랜스포터 연계 촉진 지역(5-HTTPR)의 편차에 따라 일부 개인에서 삶의 스트레스가 우울한 에피소드에 대한 예측 변수인 이유를 설명할 수 있다고 제안했다.[12] 이 가설은 '오르치드 유전자'로 불렸던 과학 문헌과 대중 매체 모두에서 널리 논의되었지만 결정적으로 훨씬 더 큰 표본에서 복제가 되지 못했으며, 초기 연구에서 관찰된 효과 크기는 관찰된 다원성 우울증과 일치하지 않는다.[13]
BDNF
BDNF 다형성 역시 유전적 영향을 미친다는 가설을 세워왔지만, 초기 발견과 연구는 더 큰 표본에서 복제하지 못했고, 이전의 추정에 의해 발견된 효과 크기는 관찰된 다형성 우울증과 일치하지 않는다.[14]
SIRT1 및 LHPP
2015년 한족 여성 대상 GWAS 연구는 SIRT1과 LHPP 근처의 전자 영역에서 게놈 전체와 유의미한 연관성을 가진 두 가지 변종을 확인했다.[15][16]
노레피네프린 트랜스포터 다형성
노레피네프린 트랜스포터 다형증과 우울증 사이의 상관관계를 찾으려는 시도는 부정적인 결과를 낳았다.[17]
한 리뷰는 자주 연구되는 여러 후보 유전자를 확인했다. 5-HTT 수용체와 5-HT2A 수용체에 대한 유전자 부호화는 우울증 및 치료 반응과 일치하지 않는 연관성이 있었다. 뇌에서 파생된 신경퇴행성인자(BDNF) Val66Met 다형성(Polymorism)에 대해 혼합된 결과가 나왔다. 트립토판 히드록실라아제 유전자의 다형성은 자살행위와 잠정적으로 관련이 있는 것으로 밝혀졌다.[18] 2008년에 발표된 182건의 환자관리 유전자 연구의 메타 분석 결과, 아폴리포프로테인 E 베레실론 2는 보호성이 있으며, GNB3 825T, MTHFR 677T, SLC6A4 44bp 삽입 또는 삭제, SLC6A3 40 BPNTR 9/10 유전자형이 위험성을 부여했다.[19]
서커디안
우울증은 생체시계의 이상과 관련이 있을 수 있다.[20]
잘 싱크로나이즈드된 순환 리듬은 최적의 건강을 유지하는 데 매우 중요하다. 순환기 리듬의 부정적인 변화와 변화는 우울증을 포함한 다양한 신경학적 장애와 기분 장애와 연관되어 왔다.[21]
잠
수면장애는 우울증 환자에게서 가장 두드러진 증상이다.[22] 수면전극에 관한 연구는 비급속 안구운동 수면생산의 감소, 수면연속성의 방해, 급속한 안구운동(REM)수면의 저해와 같은 우울증의 특징적인 변화를 보여주었다.[23] 꿈을 꾸는 단계인 빠른 눈의 움직임(REM) 수면은 우울한 사람들에게 빨리 도착하고 강렬할 수 있다. 렘수면은 뇌간에서 세로토닌 수치가 감소하는 것에 의존하며,[24] 항우울제와 같은 화합물에 의해 손상되어 뇌간 구조에서 세로토닌 톤을 증가시킨다.[24] 전체적으로 세로토닌 체계는 수면 중에는 가장 덜 활동적이고 깨어 있을 때는 가장 활동적이다. 수면부족으로[20] 인한 장기간의 잠에서 깨어나면 세로토닌 신경세포가 활성화되어 선택적 세로토닌 재흡수 억제제(SSRIs)와 같은 항우울제의 치료효과와 유사한 과정이 발생한다. 우울한 사람들은 하룻밤 수면 부족을 겪고 나면 기분이 상당히 좋아질 수 있다. SSRI는 직접적으로 그들의 치료 효과에 대한 중앙 세로토닌 신경 전달의 증가에 의존할 수 있는데, 이것은 수면과 깨어있는 주기에 영향을 미치는 시스템과 동일한 시스템이다.[24]
빛요법
빛요법이 계절적 정서장애에 미치는 영향에 대한 연구는 빛 박탈이 세로토닌계통의 활동 감소와 수면 주기, 특히 불면증과 관련이 있음을 시사한다. 빛에 노출되는 것은 또한 세로토닌 시스템을 대상으로 하며, 우울증에서 이 시스템이 수행할 수 있는 중요한 역할을 더 많이 지원한다.[25] 수면부족과 빛요법은 모두 항우울제와 같은 뇌 신경전달물질 체계와 뇌 영역을 대상으로 하고 있으며, 현재는 우울증 치료에 임상적으로 사용되고 있다.[26] 경증요법, 수면부족, 수면시간 변위요법(수면전진요법)은 MDD(주요 우울장애)로 입원한 사람들의 깊은 우울증을 차단하기 위해 빠르게 병행하고 있다.[25]
수면길이가 증가하거나 감소하는 것은 우울증의 위험요인으로 보인다.[27] MDD를 앓고 있는 사람들은 심지어 비 계절적 우울증에서도 가끔 야행성과 계절적 증상의 심각성의 변화를 보인다. 주간 기분 개선은 등신경망의 활동과 관련이 있었다. 평균 코어 온도 증가도 관찰되었다. 한 가설은 우울증이 위상 변화의 결과라는 것을 제시했다.[28]
주간 빛 노출은 세로토닌 전달체 활동 감소와 관련이 있으며, 이는 일부 우울증의 계절성을 뒷받침할 수 있다.[29]
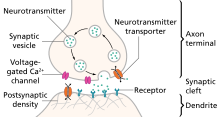
모노아민
모노아민(Monoamines)은 세로토닌, 도파민, 노레피네프린, 에피네프린 등을 포함하는 신경전달물질이다.[30]
모노아민 우울증 가설
많은 항우울제들은 모노아민 신경전달물질인 세로토닌의 시냅스 수치를 급격히 증가시키지만, 그것들은 또한 노레피네프린과 도파민의 수치를 증가시킬 수도 있다. 이러한 효능을 관찰한 결과 우울증에 대한 모노아민 가설이 생겨났는데, 이는 특정 신경전달물질의 결핍이 우울증의 원인이 되며, 특정 신경전달물질도 특정 증상과 연관되어 있다고 가정한다. 정상적인 세로토닌 수치는 기분과 행동 조절, 수면 및 소화와 연관되어 있으며, 노레피네프린과 전투-비행 반응, 그리고 움직임, 즐거움 및 동기 부여에 도파민이 연관되어 있다. 어떤 이들은 또한 수면과 자살에 있어 모노아민과 세로토닌, 이상혈증에 걸린 노레피네프린, 피로, 무관심, 인지장애, 동기 상실과 정신이상 증상에 따른 도파민 등의 표현형식의 관계를 제안했다.[31] 우울증의 모노아민 가설에 대한 주된 제한은 항우울제 치료의 시작과 증상의 인식 개선 사이의 치료적 지연이다. 이러한 치료적 지연에 대한 한 가지 설명은 시냅스 세로토닌의 초기 증가는 5-HT1A 자동수용기의 활동을 통해 등축에서 세로토닌 뉴런의 발사가 적응함에 따라 일시적일 뿐이라는 것이다. 항우울제의 치료 효과는 일정 기간 동안 자가수용체 감소를 통해 발생하며, 결국 세로토닌 뉴런의 발화를 증가시키는 것으로 생각된다.[32]

세로토닌
우울증에 대한 세로토닌의 초기 연구는 세로토닌 대사물인 5-히드록신돌레아세트산(5-HIAA)과 혈소판 결합과 같은 주변 조치를 조사했다. 결과는 일반적으로 일관성이 없었으며 중추신경계에 일반화되지 않았을 수 있다. 그러나 수용체 결합 연구와 약리학적 난제에 의한 증거는 우울증에서 세로토닌 신경전달의 기능장애에 대한 약간의 증거를 제공한다.[33] 세로토닌은 인지/행동 및 신경 수준 모두에서 나타나는 감정 처리 편견을 변화시킴으로써 간접적으로 기분에 영향을 줄 수 있다.[34][33] 약리학적으로 세로토닌 합성을 감소시키고, 약리학적으로 시냅스 세로토닌을 강화하면 각각 부정적 정서적 편향을 생성하여 감쇠시킬 수 있다. 이러한 정서적 처리 편견은 치료상의 차이를 설명할 수 있다.[34]
도파민
도파민성 시스템에서 다양한 이상이 관찰된 반면 결과는 일관성이 없었다. MDD가 있는 사람은 대조군에 비해 덱스트로암페타민에 대한 보상반응이 높아지며, 이는 자연적 저자극으로 인한 도파민성 경로 과민성에서 비롯된다는 주장이 제기됐다. D4 수용체와 D3 수용체의 다형성이 우울증에 연루되어 있는 반면, 연관성은 일관되게 복제되지 않았다. 사후에 이루어진 연구에서도 비슷한 모순이 발견되었지만, 다양한 도파민 수용체 작용제들은 MDD 치료에서 가능성을 보여준다.[35] 우울증을 앓고 있는 사람들에게서 흑색선병적 경로 활동이 감소하고 있다는 증거가 있다.[36] 우울증에서 도파민의 역할을 더욱 뒷받침하는 것은 도파민의 뇌척수액과 경구 대사물의 감소에 대한 일관된 발견과 변화된 도파민 수용체 D3와 도파민 전달체 발현에 대한 모템 후 발견이다.[37][38] 설치류에 대한 연구는 도파민성 시스템의 스트레스로 인한 기능 장애를 수반하는 잠재적 메커니즘을 지지해 왔다.[39]
카테콜아민
우울증에서의 부신 활동 감소를 나타내는 많은 증거들이 보고되었다. 연구 결과로는 티로신 수산화효소의 활성 감소, 로쿠스 코레울루스의 크기 감소, 알파2 아드레날린 수용체 밀도 증가, 알파1 아드레날린 수용체 밀도 감소 등이 있다.[37] 게다가 마우스 모델에서 노레피네프린 트랜스포터 녹아웃은 스트레스에 대한 내성을 증가시켜 우울증에 노레피네프린과 연관된다.[40]
모노아민의 역할을 연구하는데 사용되는 한 가지 방법은 모노아민 고갈이다. 트립토판(세로토닌의 전구체), 티로신, 페닐알라닌(도파민에 대한 전구체)이 고갈되면 우울증 소인이 있는 사람은 기분이 저하되지만 소인이 부족한 사람은 그렇지 않다. 반면 알파메틸-파라-티로신과의 도파민·노레피네프린 합성을 억제하는 것은 일관되게 기분 저하를 초래하지 않는다.[41]
모노아민 산화효소
모노아민 가설을 살펴보면 모노아민을 대사하는 효소인 모노아민 산화효소 A(MAO-A)가 우울증 환자에게 과도하게 활동할 수 있다는 것을 알 수 있다. 이것은 결국 모노아민의 낮은 수치를 야기할 것이다. 이 가설은 일부 우울한 사람들의 뇌에서 MAO-A의 활동이 현저하게 증가했다는 PET 연구로부터 지지를 받았다.[42] 유전자 연구에서, MAO-A와 관련된 유전자의 변화는 우울증과 일관적으로 연관되지 않았다.[43][44] 모노아민 가설에 대한 가정과는 반대로, MAO-A의 활동이 낮아졌지만 고조되지는 않은 것은 청소년기의 우울증 증상과 관련이 있었다. 이러한 연관성은 학대받은 청소년들에게만 관찰되었는데, 우울증 장애의 발달에 있어 생물학적(MAO 유전자)과 심리학적(염류치료) 요인이 모두 중요하다는 것을 알 수 있다.[45] 또한, 화학적 균형의 변화보다는 신경망 내의 정보처리의 붕괴가 우울증의 원인이 될 수 있다는 일부 증거가 있다.[46]
제한 사항
1990년대 이후, 연구는 모노아민 가설에 대한 여러 가지 한계를 밝혀냈고, 그 불충분성은 정신학계 내에서 비판 받아왔다.[47] 우선 세로토닌 시스템 기능장애가 우울증의 유일한 원인이 될 수는 없다. 항우울제로 치료된 모든 환자들이 일반적으로 시냅스 세로토닌의 급격한 증가에도 불구하고 호전성을 보이는 것은 아니다. 만약 상당한 기분 개선이 일어난다면, 이것은 적어도 2주에서 4주 동안 일어나지 않는 경우가 많다. 이러한 지연에 대한 한 가지 가능한 설명은 신경전달물질 활동 강화가 몇 주가 걸릴 수 있는 자동 수용체 감응화의 결과라는 것이다.[48] 집중적인 조사는 MDD를 가진 사람들에게서 특정 모노아민 시스템의 1차적인 기능장애에 대한 설득력 있는 증거를 찾지 못했다. 톈엡틴, 오피프라몰 등 모노아민 계통을 통해 작용하지 않는 항우울제는 오래 전부터 알려져 왔다. 세로토닌 대사물인 혈청 5-HIAA의 수치에 관해서도 일관성이 없는 발견이 있었다.[49] 모노아민 고갈을 유발하는 약리학적 작용제를 사용한 실험은 이러한 고갈이 건강한 사람들에게 우울증을 유발하지 않는다는 것을 보여주었다.[50][51] 또 다른 문제는 모노아민을 고갈시키는 약물이 항우울제 성질을 가질 수 있다는 것이다. 게다가, 일부 사람들은 우울증이 과페로토네르기 상태에 의해 나타날 수 있다고 주장해왔다.[52] 이미 제한되어 있는 모노아민 가설은 일반 대중에게 제시되었을 때 더욱 지나치게 단순화되었다.[53]
수용체 결합
2012년 현재, 양전자 방출 단층촬영(PET)을 이용하여 신경전달물질 수용체 발현이나 MDD를 가진 사람들의 뇌의 기능 차이를 판단하려는 노력은 일관되지 않는 결과를 보여 왔다. 2012년에는 PET영상 기술과 시약을 이용한 이시계는 D1 수용체 사람들의 정비 완료 일자와 선조체에서도 underexpressed 수 있다. 5-HT1A 수용체 결합 문학은 모순적이기도 하다; 하지만, 그것은mesiotemporal 피질의 전반적인 감소에 치우쳐 있다. 5-HT2A 수용체에 바인딩을 사용하여 사람들에 unregulated 듯 나타났다.MDD. 5-HTT 결합에 관한 연구의 결과는 가변적이지만 MDD에 있는 사람들의 수준이 더 높다는 것을 나타내는 경향이 있다. D2/D3 수용체 결합 연구가 있는 결과는 너무 일관성이 없어 결론을 도출할 수 없다. 증거는 MDD를 가진 사람들의 증가하는 MAO 활동을 지지하며, 그것은 특성 표시자일 수도 있다(치료에 대한 반응에 의해 바뀌지 않음). 무스카린 수용체 결합은 우울증에서 증가하는 것으로 보이며, 리간드 결합 역학적으로 볼 때, 콜린거 활성의 증가를 시사한다.[54]
우울증에서 수용체 결합에 대한 메타 분석은 세로토닌 전달체(5-HTT), 도파민1A 전달체(5-HT), 도파민 전달체(DAT) 등 4개다. 5-HTT에 대한 한 메타 분석에서는 중뇌와 편도체가 감소하여 전자는 더 나이와 상관관계가 있고 후자는 우울증 심각성과 상관관계가 있다고 보고했다.[55] 5-HTT의 양쪽 post-mortem고 exvivo에서 수용체 결합 연구를 포함 또 다른 메타 분석하는 동안 vivo 연구에서 발견한 것은 선조체라,amygdala과 중뇌, 사후 연구에 있어 어느 중요한 조합을 발견했다 5-HTT감소 보도했다.[56]5-HT1A 전 측 대상 피질 영역,mesiotemporal 엽, 집어내거나, hippocam 줄여질 발견되었다.고름, 하지만 편도선이나 후두엽에서는 그렇지 않다. 가장 일반적으로 사용되는 5-HT1A 리간드는 내생 세로토닌에 의해 대체되지 않으며 수용체 밀도나 친화력이 감소함을 나타낸다.[57] 도파민 운반체 결합은 우울증에서도 변하지 않는다.[58]
감정 처리 및 신경 회로
감성 바이어스
MDD를 가진 사람들은 행복한 얼굴을 더 부정적으로 평가하는 경향, 슬픈 표현에 더 많은 주의력을 할당하는 경향과 같은 감정 처리에서 많은 편견을 보인다.[59] 우울한 사람들은 또한 행복하고, 화나고, 역겹고, 두렵고, 놀랐지만 슬픈 얼굴은 인식하지 못한다.[60] 기능적 신경영상촬영은 부정적인 감정 자극에 반응하여 다양한 뇌 부위의 과잉활동과 긍정적인 자극에 반응하는 저자극성을 입증했다. 한 메타 분석은 우울한 피실험자들이 좌측 등측 전방 전전뇌피질에서 활동이 감소하고, 부정적인 자극에 반응하여 편도체에서 활동이 증가했다고 보고했다.[61] 또 다른 메타 분석은 노약자가 아닌 순진한 약물 치료를 받고 있고 합병증이 없는 우울증 환자군에서 해마와 홍반 활동이 증가했다고 보고했다.[62] 항우울제의 치료 지연은 항우울제가 감정 처리를 변형시켜 기분 변화를 일으킨 결과라고 제안되어 왔다. 이는 급성 및 부성격 SSRI 투여 모두 긍정적인 얼굴에 대한 반응을 증가시킨다는 관찰에 의해 뒷받침된다.[63] 항우울제 처리는 변연, 전전후, 방추 부위의 혼합물 편향을 역전시키는 것으로 나타난다. dlPFC 반응이 강화되고 부정적인 감정을 처리하는 동안 편도체가 감쇠되며, 전자는 또는 상하의 규제 증가를 반영하는 것으로 생각된다. 방추형 회오리 및 기타 시각 처리 영역은 항우울제 치료로 양성 자극에 더욱 강하게 반응하며, 이는 양성 처리 편향을 반영하는 것으로 생각된다.[64] 이러한 효과는 세로토닌이나 노라드레날린 항우울제에만 국한되지 않고 심뇌 자극과 같은 다른 형태의 치료에서도 나타난다.[65]
신경 회로
우울증에서 기능 신경 영상화의 한 메타 분석은 감정 처리 편향을 반영하기 위해 가정된 비정상적인 신경 활동 패턴을 관찰했다. 제어장치와 관련하여 MDD를 가진 사람들은 펄스 핵, 인슐라, 등측전측응고피질(dACC)로 구성된 안전망(SN)에서 회로의 과활성화를 보였으며 선조체 및 dlPFC로 구성된 규제회로의 활동도 감소하였다.[66]

우울증에서의 초기 생물학적 발견을 설명하기 위해 변연고문학적 모델이라고 불리는 신경원자 모델이 제안되었다. 그 모델은 우울증의 특정한 증상들을 신경학적 이상과 연관시키려 한다. 편도체의 자극이 부정적인 기억의 거슬리는 기억의 기억과 관련이 있는 것으로 보고됨에 따라, 높아진 휴식 편도체의 활동은 반론을 뒷받침하는 것으로 제안되었다. ACC는 전유전자(pgACC)와 아유전자영역(sgACC)으로 나뉘었고, 전자는 전기생리학적으로 공포와 연관되어 있으며, 후자는 신진대사학적으로 건강한 과목에 슬픔과 관련되어 있다. 보상 학습에서 지역의 역할을 고려할 때, 횡방향 전전방 영역의 이상과 함께 횡방향 궤도 및 섬광 영역의 과도한 활동이 부적응 감정 반응의 근거가 되는 것으로 제안되었다.[68][69] 이 모델과 코르티코 베이스 갱년기-탈라모-코르티컬 루프의 이상에 더 초점을 맞춘 또 다른 용어인 "피질 선조체 모델"은 최근 문헌에 의해 지지를 받고 있다. 선조체 활동 감소, OFC 활동 증가, sgACC 활동 증가 등은 모두 제안된 모델과 일치하는 결과였다. 그러나 편도체는 변연체적 모델과는 달리 활동이 감소하는 것으로 보고되었다. 또한, 시술에 의해 횡방향 전전측 부위만 변조되어 전전측 부위가 상태 표시기(즉, 기분에 따라 달라짐)인 반면, 구문학적 이상은 특성 표시기(즉, 민감성을 반영함)인 것으로 나타났다.[70]
보상
전체적으로 우울증의 심각성은 보상에 대한 무감각한 신경반응과 상관관계가 없지만, 무쾌감증은 보상체계의 활동 감소와 직접적인 상관관계가 있다.[71] 우울증에서의 보상 연구는 보상과 무쾌감의 정의와 개념화에 있어서 이질성에 의해 제한된다. 무헤도니아는 대체로 즐거움을 느끼는 능력이 감소하는 것으로 정의되지만, 설문지와 임상 평가는 동기부여적인 '욕구'와 소모적인 '리킹'을 구분하는 경우는 드물다. 많은 연구들이 우울한 대상자들이 긍정적인 자극을 덜 긍정적이고 자극적이지 않다고 제시하지만, 많은 연구들은 차이를 발견하지 못한다. 게다가, 자당류와 같은 자연적인 보상에 대한 대응은 약화되지 않는 것으로 보인다. 일반적인 감정적 블러밍은 우울증에서 "무쾌감" 증상을 설명할 수 있는데, 이는 양성과 음성의 자극 모두의 메타 분석에서 강도의 등급이 낮아진 것을 보여주기 때문이다.[72][73] 무쾌감증은 우울증의 두드러진 증상인 만큼 우울증을 건강한 피험자와 직접 비교하면 아전뇌전뇌결막피질(sgACC) 활성화가 증가하고 복측 선조체 활성화가 감소하며, 특히 긍정적인 자극에 반응하는 핵침착체(NACC)가 감소한다.[74] 보상 패러다임 중 NAcc 활성 감소의 발견은 상당히 일치하지만, NAcc는 기능적으로 다양한 범위의 뉴런으로 구성되며, 이 지역의 혈액-산소 수준의 의존성(BOLD) 신호 감소는 다른 활성 감소 또는 억제 출력의 감소 등 다양한 것을 나타낼 수 있다.[75] 그럼에도 불구하고, 이 지역들은 보상 처리에 있어서 중요하며, 우울증에서의 기능장애는 무쾌감증의 근저라고 생각된다. 세로토닌 항우울제의 표적이 잘 되지 않는 잔류 무쾌감증은 선조체 내 5-HT2C 수용체 활성화에 의한 도파민 방출 억제에서 기인한다고 가정한다.[74] OFC(내측 전방 피질)의 보상에 대한 반응은 우울증에서 감쇠되는 반면, 측면 OFC 반응은 처벌로 강화된다. 측면 OFC는 보상이나 처벌의 부재에 대한 지속적인 대응을 보여주며, 변화하는 우발상황에 대응하여 행동을 수정하는 데 필요하다고 생각된다. LOFC의 과민성은 동물에게 학습된 무력감과 비슷한 효과를 만들어냄으로써 우울증으로 이어질 수 있다.[76]
sgACC에서 높은 응답은 보상 관련 작업을 포함한 여러 패러다임을 사용하는 신경 영상화 연구에서 일관된 발견이다.[74][77][78] 치료는 sgACC의 감쇠 활성과도 관련이 있으며,[79] sgACC의 설치류 호몰로뉴(IL) 내 뉴런의 억제는 항우울제 효과를 발생시킨다.[80] sgACC의 과잉활동은 보상이나 긍정적인 자극에 대한 체반응을 약화시킴으로써 우울증을 유발하는 가설을 세워왔다.[81] 작업 중 sgACC에서 기능자기공명영상반응에 대한 연구와 달리, sgACC에서는 휴식대사가 감소한다. 그러나 이는 우울증과 관련된 sgACC 볼륨의 현저한 감소를 교정할 때에만 명백하다; 신경병리학 연구에 따르면 sgACC 세포 표지를 감소시켰다는 보고에 따라 세포 수준에서 구조적 이상이 명백하다. Drevets 등이 이러한 연구 결과에서 제안한 우울증 모델은 sgACC 활동 감소를 통해 교감신경계 활동과 HPA 축 피드백이 약화되는 결과를 초래한다고 시사한다.[82] 감정 조절 중 우울증 대상자의 신경영상화를 조사한 한 리뷰의 저자들은 증가된 sgACC 활동 패턴이 우울증에서 자동 감정반응을 조절할 필요가 있다는 가설을 세웠기 때문에 sgACC에서의 활동은 우울증에서도 인과관계가 없을 수 있다. 양성 감정 처리 중 보다 광범위한 sgACC 및 일반 전두엽 모집은 양성 감정 및 대상 무쾌감증에 대한 무감각한 아문학적 반응과 관련이 있었다. 이는 전전두피질의 과도한 모집에 의한 긍정적인 감정의 하향 조절을 반영하기 위해 저자들이 해석한 것이다.[83]
신경안내술
주요 우울증을 가진 사람들에게서 많은 신경 이미지 발견이 지속적으로 보고되고 있는 반면, 우울한 인구의 이질성은 이러한 발견을 해석하는 데 어려움을 나타낸다. 예를 들어, 모집단 전체에서 평균화하면 특정 부분군 관련 소견이 숨겨질 수 있다. 반면 감소된 dlPFC 활성도는 우울증에서 보고되는 반면, 부분군은 높은 dlPFC 활성도를 나타낼 수 있다. 평균 분석은 또한 실제로 피험자의 하위그룹에 존재하는 해마 부피 감소와 같은 통계적으로 유의미한 발견을 산출할 수 있다.[84] 우울증의 종적 일관성을 포함한 이러한 문제들과 다른 문제들 때문에, 대부분의 신경 모델은 모든 우울증에 적용될 수 없을 것 같다.[70]
구조 신경영상화

시드 기반 d 매핑을 사용하여 수행된 메타 분석은 많은 전두엽 부위의 회색 물질 감소를 보고하였다. 조기발견 일반우울증에 대한 한 메타 분석은 양쪽 전측방정맥피질(ACC)과 등심방전뇌피질(dmPFC)에서 회백질 감소를 보고했다.[86] 첫 번째 에피소드 우울증에 대한 한 메타 분석은 무의약품과 결합 모집단에서 회색 물질 감소의 뚜렷한 패턴을 관찰했다; 의약 무의 우울증은 우등변 전전뇌피질, 우측 편도체 및 우측 하대 측두회 감소와 관련이 있었다; 의약 무와 m의 조합에 대한 분석에듀파인 우울증은 좌측 인슐라, 우측 보조 운동 영역, 우측 중간 측두 회에서 감소하는 것을 발견했다.[87] 비록 MDD의 첫 번째 에피소드를 가진 사람들에게 제한되지는 않았지만, 약물 투여와 약물 투여가 없는 모집단을 구분하는 또 다른 검토에서는 양쪽 상, 우측 중간 및 좌측 하전두회(Parahippocampus)와 함께 양쪽 하전두회(Parahippocampus)에서 결합된 모집단의 감소를 발견했다. 탈라믹 및 ACC 회색 물질의 증가가 각각 의약품 없는 모집단에 보고되었다.[88] "활성화 가능성 추정치"를 사용하여 수행된 메타 분석은 편평 피질, dACC 및 편도체의 감소를 보고하였다.[89]
통계적 파라메트릭 매핑을 사용하여, 한 메타 분석은 ACC, 내측 전전전두피질, 하전두회, 해마, 쇄골전두피질 회백질의 이전 연구 결과를 복제했다. 그러나 OFC와 환두전두피질 회백질의 감소도 보고되었다.[90]
ENIGMA 컨소시엄의 우울증에 대한 두 가지 연구가 발표되었는데 하나는 피질 두께, 다른 하나는 피질량이었다. 양쪽의 OFC, ACC, 인슐라, 중간 측두교, 방추교, 후두교피에서 피질 두께가 감소된 것이 보고되었으며, 표면적 결손은 내두경, 하두경, 전두엽 및 중앙 전부에서 발견되었다.[91] 초기 우울증에서 특히 두드러졌던 해마와 편도체의 감소를 포함한 문하성 이상.[92]

부분적 음이소트로피(FA)를 이용한 백질 무결성 평가 연구에 대해 다중 메타 분석이 수행되었다. 첫 번째 에피소드 약물 순진성과 [94][95]일반적인 주요 우울증 인구 모두에서 감소된 FA가 코퍼스 콜로섬(CC)에 보고되었다.[93][96] CC 감소 정도는 연구마다 다르다. 항우울제를 복용하지 않은 MDD 환자들은 CC의[94] 체내와 CC의 게뉴에만 감소가 있는 것으로 보고되었다.[95] 한편, 일반 MDD 샘플은 CC의 본체,[95] CC의 본체 및 genu,[93] CC의 genu만 감소하는 것으로 보고되었다.[96] FA 감소는 내부 캡슐(ALIC)[94][93]의 앞쪽 사지와 우수한 종방향 피시큘러스에서도 보고되었다.[94][95]
기능성 신경영상화
휴식 상태 활동에 대한 연구는 지역적 동질성(ReHO), 저주파수 변동(ALFF), 저주파수 변동(FALFF), 동맥 스핀 라벨링(ASL), 지역 뇌혈류 양전자 방출 단층촬영 측정 등 다수의 휴식 상태 활동 지표를 활용했다.신진대사
ALFF와 fALFF를 사용한 연구는 전자가 주로 더 많은 복측 소견을 보고하고 후자는 더 등측 소견을 보고하면서 ACC 활동의 상승을 보고하였다.[97] ALFF와 CBF 연구의 결합 분석은 왼쪽 인슐라에서 수렴되었으며, 이전에 치료받지 않은 사람들은 인슐라 활동이 증가했다. 또한 증가된 카테터 CBF도 보고되었다[98]. 복수의 휴식 활동 지표를 결합한 메타 분석은 전측두엽, 선조체 및 탈라믹 활동 증가와 왼쪽 인슐라, 중앙 후회 및 방추형 회오리 활동 감소로 보고되었다.[99] PET/SPECT 휴면 상태 연구의 활성화 가능성 추정치(ALE) 메타 분석 결과 왼쪽 인슐라, 전생 및 등측 전측두엽 피질의 활성도가 감소하고, 쇄골, 전방 해마 및 편도체의 활동이 증가했다고 보고되었다.[100] PET/SPECT 연구의 ALE 메타 분석과 비교했을 때, 다중선 밀도 분석을 사용한 연구는 시상하부의 맥동핵에서만 과잉 활동을 보고하였다.[66]
뇌영역
MDD를 가진 사람들의 뇌에 대한 연구는 보통 뇌의 여러 부분들 사이의 상호 작용의 방해된 패턴을 보여준다. 우울증의 생물학을 보다 완전하게 이해하려는 연구에 뇌의 몇 가지 영역이 관련되어 있다.
하위 유전자 계량법
연구 결과, 하위 유전자 응고법으로 알려진 브로드만 영역 25는 치료 내성 우울증에 대사적으로 지나치게 활동적이라는 것이 밝혀졌다. 이 지역은 세로토닌 전달체가 매우 풍부하며 식욕과 수면의 변화에 영향을 미치는 시상하부와 뇌간, 기분과 불안감에 영향을 미치는 편도체와 인슐라, 기억 형성에 중요한 역할을 하는 해마, 그리고 일부 부분을 포함하는 광대한 네트워크의 주지사로 여겨진다. 자존감을 담당하는 전두엽 피질이야 따라서 이 지역의 장애나 정상 크기보다 작은 규모의 장애는 우울증의 원인이 된다. 뇌심장 자극은 치료 저항성 우울증을 가진 사람들에게서 뇌의 활동을 줄이기 위해 이 지역을 대상으로 했다.[101]: 576–578 [102]
전두엽 피질
한 리뷰는 대조군에 비해 우울증이 있는 사람들의 전두엽 피질에서 저자극성을 보고했다.[103] 전두엽 피질은 감정 처리와 조절에 관여하고 있으며, 이 과정의 기능장애는 우울증의 병리학에 관여할 수도 있다. 항우울제 치료에 대한 한 연구는 항우울제 투여에 따른 PFC 활성의 증가를 발견했다.[104] 한 메타 분석 2012년에 발표되는 전두엽 피질의 지역 부정적인 자극에 MDD.[66]한 연구를 가진 사람들에게 반응에hypoactive다 지역의 등과pregenualcingulate, 양자 중전두엽회, 집어내거나, 상측두이랑 번째를 포함하여 네트워크의 전두엽 피질의 지역은 일부라고 추측을 발견했다.에서 그러나 저자들은 MDD에 있는 사람들에게서 저혈압인 것처럼 보인다. 그러나 저자들은 배제 기준, 일관성의 결여, 그리고 작은 표본들이 결과를 제한한다고 경고했다.[100]
아미그달라
감정 처리와 관련된 구조인 편도체는 주요 우울장애를 가진 사람들에게 지나치게 활동적인 것으로 보인다.[102] 비치료 우울증 환자의 편도체는 약물을 투여한 사람보다 더 작은 경향이 있지만, 종합 데이터는 우울증과 건강한 사람 사이의 차이를 보여주지 않는다.[105] 감정 처리 작업 중에는 오른쪽 편도체가 왼쪽보다 활발하지만, 인지 작업 중에는 차이가 없고, 정지 상태에서는 왼쪽 편도만 더 과민하게 나타난다.[106] 그러나 한 연구는 감정 처리 작업 중 편도선 활동에서 아무런 차이를 발견하지 못했다.[107]
해마
해마의 위축증은 우울증 동안 관찰되어 스트레스와 신경생식의 동물 모델과 일치한다.[108][109]
스트레스는 해마의 신경생성 억제뿐만 아니라 몇몇 주요 뇌 부위의 모노아민기 변화를 통해 우울증과 우울증 같은 증상을 일으킬 수 있다.[110] 이것은 HPA 축 기능 장애뿐만 아니라 감정과 인지 관련 뇌 부위의 변화로 이어진다. 이 장애를 통해 스트레스의 영향은 5-HT에 미치는 영향을 포함하여 악화될 수 있다. 게다가, 이러한 효과들 중 일부는 항우울제 작용에 의해 역전되는데, 이것은 해마의 신경 유전자를 증가시킴으로써 작용할 수도 있다. 이것은 HPA 활성과 응력 반응성의 회복으로 이어지고, 따라서 5-HT에 대한 스트레스에 의해 유발되는 유해한 영향을 복원한다.[111]
시상하부-피티하수체-아드레날린 축은 다양한 종류의 스트레스 요인에 대한 신체의 반응 중에 활성화되는 내분비 구조물의 연쇄다. HPA 축은 세 가지 구조, 즉 뇌하수체를 자극하는 CRH를 방출하여 부신을 자극하는 ACTH를 방출하여 코티솔을 방출하는 시상하부를 포함한다. 코티솔은 뇌하수체와 시상하부에 부정적인 피드백 효과를 준다. MDD를 가진 사람들에게서 종종 우울한 사람들에게서 활성화되는 것을 보여주지만, 이것의 이면에 있는 메커니즘은 아직 알려져 있지 않다.[112] MDD에 있는 사람들에서는 기저 코티솔 수치 증가와 덱사메타손 도전에 대한 비정상적인 반응이 관찰되었다.[113] 초기 생활 스트레스는 HPA 기능 장애의 잠재적 원인으로 가정되어 왔다.[114][115] HPA 축 규정은 피드백 메커니즘을 시험하는 덱사메타손 억제 시험을 통해 검사될 수 있다. 덱사메타손의 비억제는 우울증에서 흔히 발견되지만 진단 도구로 사용될 만큼 일관성이 없다.[116] HPA축은 골밀도 감소, MDD에 있는 사람들에게서 발견되는 체중 증가와 같은 일부 변화에 대한 책임을 지면서 변화한다. 현재 개발 중인 한 약품인 케토코나졸은 MDD 치료에 있어 유망한 것으로 나타났다.[117]
해마 신경생식
해마의 신경생성 감소는 해마의 부피 감소로 이어진다. 유전적으로 더 작은 해마는 심리적 외상과 외부 스트레스를 처리하는 능력이 감소하고, 그에 따른 심리적 질병에 대한 경향이 감소하는 것과 연관되어 있다.[118] 가족적인 위험이나 어린 시절의 트라우마가 없는 우울증은 정상적인 해마 부피와 관련이 있지만 국소적인 기능장애와 관련이 있다.[119]
애니멀 모델
우울증에는 많은 동물 모델이 존재하지만 우울증은 주로 주관적인 감정 변화를 수반한다는 점에서 한계가 있다. 그러나 이러한 변화들 중 일부는 생리학과 행동에 반영되는데, 그 중 후자는 많은 동물 모델의 표적이 된다. 이러한 모델은 일반적으로 유효성의 네 가지 측면, 즉 모형의 핵심 증상의 반영, 모형의 예측 타당성, 생물학적 타당성에 따라 평가된다.[120][121][122]
우울한 행동들을 유도하는 데 다른 모델;사용되고 있는 optogenetics과 후각 bulbectomy 또는 circuit 특정한 조작, 5-HT1A하는 같은 유전적 모델이나 선별적으로bred 동물들과 같은neuroanatomical 조작, ch을 포함한[120]모델 환경 조작 인간의 우울증과 관련된 관련.ronic 가벼운 스트레스,[123] 어린 시절의 스트레스, 그리고 배운 무력감 우울한 행동을 만드는 데 있어서 이러한 모델의 타당성은 여러 가지 행동 테스트를 통해 평가될 수 있다. 예를 들어 무쾌감증과 동기부여 결손은 자당이나 뇌내 자기 자극과 같은 보상적 자극에 대한 동물의 관여 수준을 검사하여 평가할 수 있다. 불안하고 자극적인 증상은 공개 현장 테스트, 새로움 억제된 먹이 공급 또는 상승된 플러스 마제와 같은 스트레스 또는 새로운 환경 앞에서 탐색적 행동으로 평가할 수 있다. 피로, 정신운동가 빈곤, 동요는 기관차 활동, 그루밍 활동, 열린 현장 실험으로 평가할 수 있다.
동물 모델은 우울증의 특성상 여러 가지 한계를 가지고 있다. 동물들 사이에서는 루머, 낮은 자존감, 죄책감, 우울한 기분 등 우울증의 일부 핵심 증상은 주관적인 보고가 필요하기 때문에 평가할 수 없다.[122] 진화적인 관점에서, 패배의 상관관계가 있는 행동은 더 이상의 손실을 막기 위한 적응적 대응이라고 생각된다. 따라서 패배나 절망을 유도하려는 우울증을 모형화하려는 시도는 실제로 질병이 아닌 적응을 반영할 수도 있다. 게다가, 우울증과 불안은 종종 공존하지만, 동물 모델에서 두 사람의 관계를 끊는 것은 달성하기 어렵다.[120] 대부분의 선별 테스트가 급성 영향을 평가하는 반면 항우울제는 일반적으로 인간에서 작용하는 데 몇 주가 걸린다는 점에서 유효성에 대한 약리학적 평가는 임상 약리 요법학과는 자주 단절된다.[124]
신경회선
보상에 관련된 영역은 우울증의 동물 모델에서 공통적으로 조작 대상이며, 여기에는 측핵(NAC), 복측피질(VTA), 복측피질(VP), 측측하베눌라(LHB), 내측전전두피질(mPFC) 등이 포함된다. 인간에 대한 잠정적인 fMRI 연구는 우울증에서 LHB 활동이 증가했음을 보여준다.[125] 측면 하베눌라는 보상 누락 시 VTA에서 도파민 뉴런의 억제를 유도하기 위해 RMTg에 투영된다. 우울증의 동물 모델에서, 복측 티그먼트 영역으로 투영되는 LHb 뉴런에서 증가된 활동이 보고되었다(도파민 방출을 눈에 띄게 감소). LHb는 또한 우울한 행동을 생성하기 위한 간접적인 메커니즘을 제공할 수 있는 역반응 mPFC 뉴런에 투영한다.[126] 학습된 무력감 유발 LHb 시냅스 잠재력은 항우울제 치료에 의해 역전되어 예측 유효성을 제공한다.[125] LHb에 대한 다수의 입력은 우울한 행동을 유발하는 것과 관련되어 있다. 국가 조치계획(NAc)에서 LHb까지 GABAergic 예측을 침묵시키면 사회적 공격성에 유도된 조건화된 장소 선호도가 감소하고, 이러한 단말의 활성화는 CPP를 유도한다. 복부 팔리덤 발화 역시 약리학적으로 유효한 스트레스 유발 우울증에 의해 증가되며, 이러한 뉴런의 침묵은 우울증의 행동 상관관계를 완화시킨다.[125] MDD를 가진 사람들의 생체내 잠정적인 증거는 도파민 신호 전달의 이상을 암시한다.[127] 이것은 우울증의 동물 모델에서 VTA 활동과 조작을 연구하는 초기 연구로 이어졌다. VTA 뉴런의 대규모 파괴는 우울한 행동을 강화하는 반면 VTA 뉴런은 만성 스트레스에 반응하여 발화를 감소시킨다. 그러나 VTA의 보다 최근의 특정 조작은 다양한 결과를 낳는데, 여기에는 특정 동물 모델, VTA 조작 기간, VTA 조작 방법 및 VTA 조작 하위 영역이 모두 잠재적으로 서로 다른 결과를 초래할 수 있다.[128] 무쾌감증을 포함한 스트레스와 사회적 패배 유발 우울증 증상은 도파민 D2 수용체-압축성 뉴런(D2-MSN)에 대한 흥분성 입력이 잠재하고 도파민 D1 수용체-압축성 뉴런(D1-MSN)에 대한 흥분성 입력이 위축되는 것과 관련이 있다. D1-MSNs의 광유전성 소변은 우울증상을 완화하고 보람을 느끼는 반면, D2-MSN과 마찬가지로 우울증세를 강화한다. 복측 해마에서 글루타민제 투입물을 섭취하면 사회적 상호작용이 감소하고, 이러한 투영을 강화하면 스트레스로 인한 우울증에 민감해질 수 있다.[128] mPFC의 다양한 영역의 조작은 우울한 행동을 생산하고 약화시킬 수 있다. 예를 들어 mPFC 뉴런을 억제하면 특히 내경피질에서 억제하면 우울한 행동을 감쇠시킨다. mPFC 자극과 관련된 상반된 발견은, infralimbic 피질에서 비교적 구체적인 발견과 비교했을 때, 예비성 피질 및 infralimbic 피질이 반대되는 영향을 중재할 수 있다는 것을 [80]암시한다. raphe nuclei에 대한 mPFC 투영은 대부분 GABAergic이고 세로토닌 뉴런의 발화를 억제한다. 이들 지역의 구체적인 활성화는 강제 수영 시험에서 움직이지 않는 것을 감소시키지만, 개방된 운동장이나 강제 수영 행동에 영향을 미치지는 않는다. 강간의 억제는 통제되지 않는 스트레스의 행동적 표현형을 통제된 스트레스의 표현형식에 더 가까운 표현형으로 이동시킨다.[129]
변화신경탄성
최근의 연구들은 우울증에서 변화된 신경 재생성의 역할에 대한 주의를 환기시켰다. 검토 결과 다음과 같은 세 가지 현상이 수렴되었다.
- 만성 스트레스로 시냅스 및 덴드리트성 가소성이 있음
- 우울증 환자는 신경 재생성 장애의 증거를 보여준다. (예를 들어, 수지상 나무의 단축 및 복잡성 감소)
- 항우울제는 분자 및 덴드리트 수준 모두에서 신경 재생성을 향상시킬 수 있다.
결론은 붕괴된 신경성 플라스틱은 우울증의 근본적인 특징이며 항우울제에 의해 역전된다는 것이다.[130]
MDD 환자의 BDNF 혈중 수치는 항우울제 치료와 함께 크게 증가하며 증상 감소와 관련이 있다.[131] 후 박격포 연구와 쥐 모형은 MDD를 가진 사람들의 전두엽 피질 두께에서 신경 밀도가 감소했음을 보여준다. 랫드 모형은 인간의 MRI 발견과 일치하는 조직학적 변화를 보여준다. 그러나 인간의 신경 유전자에 대한 연구는 제한적이다. 항우울제는 동물 모델과 인간 둘 다에서 신경생물의 변화를 역전시키는 것으로 보인다.[132]
염증
다양한 리뷰를 통해 일반적인 염증이 우울증에 영향을 줄 수 있다는 것을 발견했다.[133][134] MDD를 가진 사람들의 사이토카인들에 대한 한 메타 분석에서 대조군에 비해 프로-염증 IL-6과 TNF-a의 수치가 증가했다는 것을 발견했다.[135] 첫 번째 이론은 인터페론 요법이 그것을 받는 많은 사람들에게 우울증을 유발한다는 것을 알았을 때 나왔다.[136] MDD를 가진 사람들의 사이토카인 수치에 대한 메타 분석은 IL-1, IL-6, C-reactive 단백질의 수치가 증가하였지만 IL-10은 증가하지 않았다.[137][138] 활성화 마커, 네오프테린, IFN 감마선, sTNFR, IL-2 수용체를 나타내는 T-Cells의 수가 증가하여 우울증에서 관찰되었다.[139] 우울증 질환에서 염증의 다양한 원인이 가정되어 왔고 외상, 수면 문제, 식이요법, 흡연, 비만 등이 포함된다.[140] 사이토카인은 신경전달물질을 조작함으로써 질병행동의 발생에 관여하는데, 이는 우울증 증상과 일부 겹치는 것을 공유한다. 영향을 받는다고 가정된 신경전달물질에는 항우울제의 공통 표적인 도파민과 세로토닌이 포함된다. 사이토카인에 의한 인돌라민-2,3 디옥시게네아제 유도는 면역 기능장애가 우울증을 일으키는 메커니즘으로 제안되어 왔다.[141] 한 리뷰는 우울증의 성공적인 치료 후에 사이토카인 수치가 정상화된다는 것을 발견했다.[142] 2014년 발간된 메타 분석 결과 NSAID와 조사용 사이토카인 억제제 등 항염증제 사용이 우울증 증상을 감소시킨 것으로 나타났다.[143] 운동은 스트레스 요인으로 작용하여 IL-6과 TNF-a의 수치를 낮추고 항염증 시토카인 IL-10의 수치를 증가시킬 수 있다.[144]
염증은 또한 인간의 신진대사 과정과 밀접하게 연관되어 있다. 예를 들어, 비타민 D의 낮은 수치는 우울증에 대한 더 큰 위험과 관련이 있다.[145] 우울증에서 대사 바이오마커의 역할은 활발한 연구 영역이다. 최근의 연구는 플라즈마 스테롤과 우울증 증상 심각도 사이의 잠재적 관계를 탐구했다.[146]
산화 응력
DNA 산화 표식인 8-Oxo-2'-deoxyguanosine이 MDD를 가진 사람들의 혈장과 소변 모두에서 증가된 것으로 밝혀졌다. 이는 혈액, 소변, 뇌척수액에서 발견되는 F2-이소프로스테인 수치 증가와 함께 MDD에 있는 사람들의 지질과 DNA 손상이 증가했음을 나타낸다. 8-Oxo-2' Deoxyguanosine에 대한 연구는 측정 방법과 우울증 유형에 따라 다르지만 F2-이소프로스테인 수치는 우울증 유형에 따라 일관되었다. 저자들은 생활습관 요인, HPA 축의 잘못된 규제, 면역체계, 자율신경계 등을 가능한 원인으로 제시했다.[147] 또 다른 메타 분석에서는 산화 손상 제품 및 산화 용량 감소와 관련하여 유사한 결과가 발견되었다.[148] 산화 DNA 손상은 MDD에 영향을 미칠 수 있다.[149]
미토콘드리아 기능 장애:
대조군과 관련된 산화 스트레스 표시는 MDD를 가진 사람들에게서 발견되었다.[150] 이 마커들은 만성 염증에 영향을 미치는 것으로 보여지는 높은 수준의 RNS와 ROS를 포함하고 있으며, 미토콘드리아에서 전자 전송 사슬과 생화학적 폭포를 손상시킨다. 이것은 미토콘드리아 기능 장애를 초래하는 호흡기 사슬의 효소의 활동을 감소시킨다.[151] 뇌는 에너지가 많이 소모되고 포도당을 글리코겐으로 저장하는 능력이 거의 없기 때문에 미토콘드리아에 크게 의존한다. 미토콘드리아 기능장애는 우울한 뇌에서 관찰된 위축된 신경성 재생성과 관련이 있다.[152]
대규모 뇌망 이론
하나의 뇌 영역을 연구하는 대신에, 대규모 뇌 네트워크를 연구하는 것은 정신과 신경계 질환을 이해하는 또 다른 접근법인데,[153] 이는 최근 여러 뇌 영역이 이러한 질환에 관련되어 있다는 연구결과가 뒷받침하고 있다. 이러한 네트워크의 장애를 이해하는 것은 이러한 장애를 치료하기 위한 개입에 대한 중요한 통찰력을 제공할 수 있다. 최근의 연구는 사이코패스학에서 적어도 3개의 대규모 뇌 네트워크가 중요하다는 것을 시사한다.[153]
중앙집행망
중앙집행망은 등측 전전두피질, 측후두두피질 등 전두두피질로 구성된다.[154][155] 이 네트워크는 작업기억, 문제해결, 의사결정에서 정보의 유지 및 이용과 같은 고도의 인지기능에 관여한다.[153][156] 이 네트워크의 결함은 우울증을 포함한 대부분의 주요 정신 질환과 신경 질환에서 흔히 나타난다.[157][158] 이 네트워크는 일상생활에 매우 중요하기 때문에 우울한 사람들은 시험 응시나 결정력 같은 기본적인 활동에서 장애를 보일 수 있다.[159]
기본 모드 네트워크
디폴트 모드 네트워크는 전두엽 피질 및 후두정맥에 있는 허브를 포함하며, 내측두엽과 각회에서는 네트워크의 다른 두드러진 영역을 포함한다.[153] 디폴트 모드 네트워크는 보통 마음을 뒤지고 사회적 상황에 대해 생각할 때 활성화된다. 이와는 대조적으로 인지과학에서 조사된 특정 작업(예: 단순한 주의 작업) 동안 기본 네트워크는 종종 비활성화된다.[160][161] 연구에 따르면, 우울한 참여자들이 (즉, 반복적인 자기 중심적 사고를 할 때) 일반적인 건강한 참여자들이 반론을 제기할 때보다 디폴트 모드 네트워크(내측 전방 피질 및 후측 정맥주사를 포함한다)의 지역들이 더 큰 활동을 보인다고 한다.[162] 또한 MDD를 가진 사람들은 건강한 개인, 치매 또는 자폐증에 비해 디폴트 모드 네트워크와 하위 유전자 정맥 및 인접 뇌전두 피질 사이의 연결성이 증가함을 보여준다. 많은 연구들은 하위 유전자가 주요 우울증을 특징짓는 기능장애에 중요한 역할을 한다고 제시한다.[163] 추론 중 디폴트 모드 네트워크의 활성화 증가와 핵심 디폴트 모드 영역과 하위 유전자 사이의 비정형 연결은 우울증을 특징짓는 부정적이고 자기 중심적인 생각에서 우울한 개인이 "걸리는" 경향을 뒷받침할 수 있다.[164] 그러나 이러한 네트워크 상호작용이 우울증의 특정 증상에 어떻게 매핑되는지에 대한 정확한 이해를 얻기 위해서는 추가 연구가 필요하다.
안전망
안전 네트워크는 전측 정측 및 전측 내측에 있는 핵심 노드를 포함하는 정측 전방 공작망이다.[154] 만족 네트워크는 외부 자극과 내부 사건 중 가장 관련성이 높은 것을 감지하고 방향을 잡는 데 관여하는 대규모 두뇌 네트워크다.[153] 부정적인 감정 상태를 경험하는 경향(신경증 척도를 높게 평가)을 가진 개인은 이미 결정이 내려졌더라도 의사 결정 중에 오른쪽 앞가슴이 증가하는 것을 보여준다.[165] 이 비정상으로 우측 전방 내측에서 높은 활동이 일어나는 것은 부정적이고 걱정스러운 감정의 경험에 기여한다고 생각된다.[166] 주요 우울 장애에서 불안은 종종 우울증을 특징짓는 감정 상태의 일부분이다.[167]
참조
- ^ Anglin, Rebecca E.; Tarnopolsky, Mark A.; Mazurek, Michael F.; Rosebush, Patricia I. (January 2012). "The Psychiatric Presentation of Mitochondrial Disorders in Adults". The Journal of Neuropsychiatry and Clinical Neurosciences. 24 (4): 394–409. doi:10.1176/appi.neuropsych.11110345. ISSN 0895-0172. PMID 23224446.
- ^ CARROLL, BERNARD J. (October 2004). "Psychoneuroendocrinology: The Scientific Basis of Clinical Practice. Edited by O. M. Wolkowitz and A. J. Rothschild. (Pp. 606; $73.95; ISBN 0-88048-857-3 pb.) American Psychiatric Publishing, Inc.: Arlington, Virginia, 2003". Psychological Medicine. 34 (7): 1359–1360. doi:10.1017/S0033291704213678. ISSN 0033-2917. S2CID 73645516.
- ^ Kupfer DJ, Frank E, Phillips ML (17 March 2012). "Major depressive disorder: new clinical, neurobiological, and treatment perspectives". Lancet. 379 (9820): 1045–55. doi:10.1016/S0140-6736(11)60602-8. PMC 3397431. PMID 22189047.
- ^ aan het Rot M, Mathew SJ, Charney DS (3 February 2009). "Neurobiological mechanisms in major depressive disorder". Canadian Medical Association Journal. 180 (3): 305–13. doi:10.1503/cmaj.080697. PMC 2630359. PMID 19188629.
- ^ Levinson, Douglas F.; Nichols, Walter E. (2018). "24. Genetics of Depression". In Charney, Dennis S.; Sklar, Pamela; Buxbaum, Joseph D.; Nestler, Eric J. (eds.). Charney & Nestlers Neurobiology of Mental Illness (5th ed.). New York: Oxford University Press. p. 310.
- ^ Caspi, Avshalom; Sugden, Karen; Moffitt, Terrie E.; Taylor, Alan; Craig, Ian W.; Harrington, HonaLee; McClay, Joseph; Mill, Jonathan; Martin, Judy; Braithwaite, Antony; Poulton, Richie (July 2003). "Influence of Life Stress on Depression: Moderation by a Polymorphism in the 5-HTT Gene". Science. 301 (5631): 386–89. Bibcode:2003Sci...301..386C. doi:10.1126/science.1083968. PMID 12869766. S2CID 146500484.
- ^ Kendler KS, Kuhn JW, Vittum J, Prescott CA, Riley B (May 2005). "The interaction of stressful life events and a serotonin transporter polymorphism in the prediction of episodes of major depression: a replication". Archives of General Psychiatry. 62 (5): 529–35. doi:10.1001/archpsyc.62.5.529. PMID 15867106.
- ^ Risch N, Herrell R, Lehner T, Liang KY, Eaves L, Hoh J, Griem A, Kovacs M, Ott J, Merikangas KR (June 2009). "Interaction between the serotonin transporter gene (5-HTTLPR), stressful life events, and risk of depression: a meta-analysis". JAMA. 301 (23): 2462–71. doi:10.1001/jama.2009.878. PMC 2938776. PMID 19531786.
- ^ Munafò MR, Durrant C, Lewis G, Flint J (February 2009). "Gene X environment interactions at the serotonin transporter locus". Biological Psychiatry. 65 (3): 211–19. doi:10.1016/j.biopsych.2008.06.009. PMID 18691701. S2CID 5780325.
- ^ Karg K, Burmeister M, Shedden K, Sen S (May 2011). "The serotonin transporter promoter variant (5-HTTLPR), stress, and depression meta-analysis revisited: evidence of genetic moderation". Archives of General Psychiatry. 68 (5): 444–54. doi:10.1001/archgenpsychiatry.2010.189. PMC 3740203. PMID 21199959.
- ^ Culverhouse RC, Saccone NL, Horton AC, Ma Y, Anstey KJ, Banaschewski T, et al. (January 2018). "Collaborative meta-analysis finds no evidence of a strong interaction between stress and 5-HTTLPR genotype contributing to the development of depression". Molecular Psychiatry. 23 (1): 133–142. doi:10.1038/mp.2017.44. PMC 5628077. PMID 28373689.
- ^ Nierenberg, AA (2009). "The long tale of the short arm of the promoter region for the gene that encodes the serotonin uptake protein". CNS Spectrums. 14 (9): 462–3. doi:10.1017/s1092852900023506. PMID 19890228. S2CID 24236284.
- ^ Border, Richard; Johnson, Emma; Evans, Luke; Smolen, Andrew; Berley, Noah; Sullivan, Patrick; Keller, Matthew (1 May 2019). "No support for historic candidate gene or candidate gene-by-interaction hypotheses for major depression across multiple large samples". American Journal of Psychiatry. 176 (5): 376–387. doi:10.1176/appi.ajp.2018.18070881. PMC 6548317. PMID 30845820.
- ^ Border, Richard; Johnson, Emma; Evans, Luke; Smolen, Andrew; Berley, Noah; Sullivan, Patrick; Keller, Matthew (1 May 2019). "No support for historic candidate gene or candidate gene-by-interaction hypotheses for major depression across multiple large samples". American Journal of Psychiatry. 176 (5): 376–387. doi:10.1176/appi.ajp.2018.18070881. PMC 6548317. PMID 30845820.
- ^ Converge Consortium; Bigdeli, Tim B.; Kretzschmar, Warren; Li, Yihan; Liang, Jieqin; Song, Li; Hu, Jingchu; Li, Qibin; Jin, Wei; Hu, Zhenfei; Wang, Guangbiao; Wang, Linmao; Qian, Puyi; Liu, Yuan; Jiang, Tao; Lu, Yao; Zhang, Xiuqing; Yin, Ye; Li, Yingrui; Xu, Xun; Gao, Jingfang; Reimers, Mark; Webb, Todd; Riley, Brien; Bacanu, Silviu; Peterson, Roseann E.; Chen, Yiping; Zhong, Hui; Liu, Zhengrong; et al. (2015). "Sparse whole-genome sequencing identifies two loci for major depressive disorder". Nature. 523 (7562): 588–91. Bibcode:2015Natur.523..588C. doi:10.1038/nature14659. PMC 4522619. PMID 26176920.
- ^ Smoller, Jordan W (2015). "The Genetics of Stress-Related Disorders: PTSD, Depression, and Anxiety Disorders". Neuropsychopharmacology. 41 (1): 297–319. doi:10.1038/npp.2015.266. PMC 4677147. PMID 26321314.
- ^ Zhao, Xiaofeng; Huang, Yinglin; Ma, Hui; Jin, Qiu; Wang, Yuan; Zhu, Gang (15 August 2013). "Association between major depressive disorder and the norepinephrine transporter polymorphisms T-182C and G1287A: a meta-analysis". Journal of Affective Disorders. 150 (1): 23–28. doi:10.1016/j.jad.2013.03.016. ISSN 1573-2517. PMID 23648227.
- ^ Lohoff, Falk W. (6 December 2016). "Overview of the Genetics of Major Depressive Disorder". Current Psychiatry Reports. 12 (6): 539–546. doi:10.1007/s11920-010-0150-6. ISSN 1523-3812. PMC 3077049. PMID 20848240.
- ^ López-León, S.; Janssens, A. C. J. W.; González-Zuloeta Ladd, A. M.; Del-Favero, J.; Claes, S. J.; Oostra, B. A.; van Duijn, C. M. (1 August 2008). "Meta-analyses of genetic studies on major depressive disorder". Molecular Psychiatry. 13 (8): 772–785. doi:10.1038/sj.mp.4002088. ISSN 1476-5578. PMID 17938638.
- ^ a b Carlson, Neil R. (2013). Physiology of behavior (11th ed.). Boston: Pearson. pp. 578–582. ISBN 978-0-205-23939-9. OCLC 769818904.
- ^ Satyanarayanan, Senthil Kumaran; Su, Huanxing; Lin, Yi-Wen; Su, Kuan-Pin (19 October 2018). "Circadian Rhythm and Melatonin in the Treatment of Depression". Current Pharmaceutical Design. 24 (22): 2549–2555. doi:10.2174/1381612824666180803112304. PMID 30073921. S2CID 51904516.
- ^ Fang, Hong; Tu, Sheng; Sheng, Jifang; Shao, Anwen (April 2019). "Depression in sleep disturbance: A review on a bidirectional relationship, mechanisms and treatment". Journal of Cellular and Molecular Medicine. 23 (4): 2324–2332. doi:10.1111/jcmm.14170. PMC 6433686. PMID 30734486.
- ^ Wang, Yi-Qun; Li, Rui; Zhang, Meng-Qi; Zhang, Ze; Qu, Wei-Min; Huang, Zhi-Li (31 August 2015). "The Neurobiological Mechanisms and Treatments of REM Sleep Disturbances in Depression". Current Neuropharmacology. 13 (4): 543–553. doi:10.2174/1570159x13666150310002540. PMC 4790401. PMID 26412074.
- ^ a b c Adrien J. (2003). "Neurobiological bases for the relation between sleep and depression". Sleep Medicine Reviews. 6 (5): 341–51. doi:10.1053/smrv.2001.0200. PMID 12531125.
- ^ a b Terman M (2007). "Evolving applications of light therapy". Sleep Medicine Reviews. 11 (6): 497–507. doi:10.1016/j.smrv.2007.06.003. PMID 17964200.
- ^ Benedetti F, Barbini B, Colombo C, Smeraldi E (2007). "Chronotherapeutics in a psychiatric ward". Sleep Medicine Reviews. 11 (6): 509–22. doi:10.1016/j.smrv.2007.06.004. PMID 17689120.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Zhai, Long; Zhang, Hua; Zhang, Dongfeng (1 September 2015). "Sleep Duration and Depression Among Adults: A Meta-Analysis of Prospective Studies". Depression and Anxiety. 32 (9): 664–670. doi:10.1002/da.22386. ISSN 1520-6394. PMID 26047492. S2CID 19071838.
- ^ Germain, Anne; Kupfer, David J. (6 December 2016). "Circadian rhythm disturbances in depression". Human Psychopharmacology. 23 (7): 571–585. doi:10.1002/hup.964. ISSN 0885-6222. PMC 2612129. PMID 18680211.
- ^ Savitz, Jonathan B.; Drevets, Wayne C. (1 April 2013). "Neuroreceptor imaging in depression". Neurobiology of Disease. 52: 49–65. doi:10.1016/j.nbd.2012.06.001. ISSN 1095-953X. PMID 22691454.
- ^ Carlson, Neil R. (2005). Foundations of Physiological Psychology (6th ed.). Boston: Pearson A and B. p. 108. ISBN 978-0-205-42723-9. OCLC 60880502.
- ^ Marchand; Valentina; Jensen. "Neurobiology of Mood disorders". Hospital Physician: 17–26.
- ^ Hjorth, S; Bengtsson, HJ; Kullberg, A; Carlzon, D; Peilot, H; Auerbach, SB (June 2000). "Serotonin autoreceptor function and antidepressant drug action". Journal of Psychopharmacology (Oxford, England). 14 (2): 177–85. doi:10.1177/026988110001400208. PMID 10890313. S2CID 33440228.
- ^ a b COWEN, P (September 2008). "Serotonin and depression: pathophysiological mechanism or marketing myth?". Trends in Pharmacological Sciences. 29 (9): 433–436. doi:10.1016/j.tips.2008.05.004. PMID 18585794.
- ^ a b Harmer, CJ (November 2008). "Serotonin and emotional processing: does it help explain antidepressant drug action?". Neuropharmacology. 55 (6): 1023–8. doi:10.1016/j.neuropharm.2008.06.036. PMID 18634807. S2CID 43480495.
- ^ Dunlop, Boadie W.; Nemeroff, Charles B. (1 April 2007). "The Role of Dopamine in the Pathophysiology of Depression". Archives of General Psychiatry. 64 (3): 327–37. doi:10.1001/archpsyc.64.3.327. ISSN 0003-990X. PMID 17339521.
- ^ Willner, Paul (1 December 1983). "Dopamine and depression: A review of recent evidence. I. Empirical studies". Brain Research Reviews. 6 (3): 211–224. doi:10.1016/0165-0173(83)90005-X. PMID 6140979. S2CID 974017.
- ^ a b HASLER, GREGOR (4 December 2016). "Pathophysiology of Depression: Do We Have Any Solid Evidence of Interest to Clinicians?". World Psychiatry. 9 (3): 155–161. doi:10.1002/j.2051-5545.2010.tb00298.x. ISSN 1723-8617. PMC 2950973. PMID 20975857.
- ^ Kunugi, Hiroshi; Hori, Hiroaki; Ogawa, Shintaro (1 October 2015). "Biochemical markers subtyping major depressive disorder". Psychiatry and Clinical Neurosciences. 69 (10): 597–608. doi:10.1111/pcn.12299. ISSN 1440-1819. PMID 25825158.
- ^ Lammel, S.; Tye, K. M.; Warden, M. R. (1 January 2014). "Progress in understanding mood disorders: optogenetic dissection of neural circuits". Genes, Brain and Behavior. 13 (1): 38–51. doi:10.1111/gbb.12049. ISSN 1601-183X. PMID 23682971.
- ^ Delgado PL, Moreno FA (2000). "Role of norepinephrine in depression". J Clin Psychiatry. 61 Suppl 1: 5–12. PMID 10703757.
- ^ Ruhe, HG; Mason, NS; Schene, AH (2007). "Mood is indirectly related to serotonin, norepinephrine and dopamine levels in humans: a meta-analysis of monoamine depletion studies". Molecular Psychiatry. 12 (4): 331–359. doi:10.1038/sj.mp.4001949. PMID 17389902.
- ^ Meyer JH, Ginovart N, Boovariwala A, et al. (November 2006). "Elevated monoamine oxidase a levels in the brain: An explanation for the monoamine imbalance of major depression". Archives of General Psychiatry. 63 (11): 1209–16. doi:10.1001/archpsyc.63.11.1209. PMID 17088501.
- ^ Huang SY, Lin MT, Lin WW, Huang CC, Shy MJ, Lu RB (19 December 2007). "Association of monoamine oxidase A (MAOA) polymorphisms and clinical subgroups of major depressive disorders in the Han Chinese population". World Journal of Biological Psychiatry. 10 (4 Pt 2): 544–51. doi:10.1080/15622970701816506. PMID 19224413. S2CID 30281258.
- ^ Yu YW, Tsai SJ, Hong CJ, Chen TJ, Chen MC, Yang CW (September 2005). "Association study of a monoamine oxidase a gene promoter polymorphism with major depressive disorder and antidepressant response". Neuropsychopharmacology. 30 (9): 1719–23. doi:10.1038/sj.npp.1300785. PMID 15956990.
- ^ Cicchetti D, Rogosch FA, Sturge-Apple ML (2007). "Interactions of child maltreatment and serotonin transporter and monoamine oxidase A polymorphisms: depressive symptomatology among adolescents from low socioeconomic status backgrounds". Dev. Psychopathol. 19 (4): 1161–80. doi:10.1017/S0954579407000600. PMID 17931441. S2CID 32519363.
- ^ Castrén, E (2005). "Is mood chemistry?". Nature Reviews Neuroscience. 6 (3): 241–46. doi:10.1038/nrn1629. PMID 15738959. S2CID 34523310.
- ^ Hirschfeld RM (2000). "History and evolution of the monoamine hypothesis of depression". Journal of Clinical Psychiatry. 61 Suppl 6: 4–6. PMID 10775017.
- ^ Davis, Kenneth L.; et al., eds. (2002). Neuropsychopharmacology : the fifth generation of progress : an official publication of the American College of Neuropsychopharmacology (5th ed.). Philadelphia, Pa.: Lippincott Williams & Wilkins. pp. 1139–1163. ISBN 9780781728379.
- ^ Jacobsen, Jacob P. R.; Medvedev, Ivan O.; Caron, Marc G. (5 September 2012). "The 5-HT deficiency theory of depression: perspectives from a naturalistic 5-HT deficiency model, the tryptophan hydroxylase 2Arg439His knockin mouse". Philosophical Transactions of the Royal Society B: Biological Sciences. 367 (1601): 2444–2459. doi:10.1098/rstb.2012.0109. ISSN 0962-8436. PMC 3405680. PMID 22826344.
- ^ Delgado PL, Moreno FA (2000). "Role of norepinephrine in depression". J Clin Psychiatry. 61 Suppl 1: 5–12. PMID 10703757.
- ^ Delgado PL (2000). "Depression: the case for a monoamine deficiency". Journal of Clinical Psychiatry. 61 Suppl 6: 7–11. PMID 10775018.
- ^ Andrews, Paul W.; Bharwani, Aadil; Lee, Kyuwon R.; Fox, Molly; Thomson, J. Anderson (1 April 2015). "Is serotonin an upper or a downer? The evolution of the serotonergic system and its role in depression and the antidepressant response". Neuroscience and Biobehavioral Reviews. 51: 164–188. doi:10.1016/j.neubiorev.2015.01.018. ISSN 1873-7528. PMID 25625874. S2CID 23980182.
- ^ Lacasse, Jeffrey R.; Leo, Jonathan (8 November 2005). "Serotonin and Depression: A Disconnect between the Advertisements and the Scientific Literature". PLOS Medicine. 2 (12): e392. doi:10.1371/journal.pmed.0020392. PMC 1277931. PMID 16268734.

- ^ Savitz, Jonathan; Drevets, Wayne (2013). "Neuroreceptor imaging in depression". Neurobiology of Disease. 52: 49–65. doi:10.1016/j.nbd.2012.06.001. PMID 22691454.
- ^ Gryglewski, G; Lanzenberger, R; Kranz, GS; Cumming, P (July 2014). "Meta-analysis of molecular imaging of serotonin transporters in major depression". Journal of Cerebral Blood Flow and Metabolism. 34 (7): 1096–103. doi:10.1038/jcbfm.2014.82. PMC 4083395. PMID 24802331.
- ^ Kambeitz, JP; Howes, OD (1 November 2015). "The serotonin transporter in depression: Meta-analysis of in vivo and post mortem findings and implications for understanding and treating depression". Journal of Affective Disorders. 186: 358–66. doi:10.1016/j.jad.2015.07.034. PMID 26281039.
- ^ Wang, L; Zhou, C; Zhu, D; Wang, X; Fang, L; Zhong, J; Mao, Q; Sun, L; Gong, X; Xia, J; Lian, B; Xie, P (13 September 2016). "Serotonin-1A receptor alterations in depression: a meta-analysis of molecular imaging studies". BMC Psychiatry. 16 (1): 319. doi:10.1186/s12888-016-1025-0. PMC 5022168. PMID 27623971.
- ^ Li, Z; He, Y; Tang, J; Zong, X; Hu, M; Chen, X (15 March 2015). "Molecular imaging of striatal dopamine transporters in major depression—a meta-analysis". Journal of Affective Disorders. 174: 137–43. doi:10.1016/j.jad.2014.11.045. PMID 25497470.
- ^ Bourke, Cecilia; Douglas, Katie; Porter, Richard (1 August 2010). "Processing of facial emotion expression in major depression: a review". The Australian and New Zealand Journal of Psychiatry. 44 (8): 681–696. doi:10.3109/00048674.2010.496359. ISSN 1440-1614. PMID 20636189. S2CID 20302084.
- ^ Dalili, M. N.; Penton-Voak, I. S.; Harmer, C. J.; Munafò, M. R. (7 December 2016). "Meta-analysis of emotion recognition deficits in major depressive disorder". Psychological Medicine. 45 (6): 1135–1144. doi:10.1017/S0033291714002591. ISSN 0033-2917. PMC 4712476. PMID 25395075.
- ^ Groenewold, Nynke A.; Opmeer, Esther M.; de Jonge, Peter; Aleman, André; Costafreda, Sergi G. (1 February 2013). "Emotional valence modulates brain functional abnormalities in depression: evidence from a meta-analysis of fMRI studies". Neuroscience and Biobehavioral Reviews. 37 (2): 152–163. doi:10.1016/j.neubiorev.2012.11.015. ISSN 1873-7528. PMID 23206667. S2CID 9980163.
- ^ Müller, VI; Cieslik, EC; Serbanescu, I; Laird, AR; Fox, PT; Eickhoff, SB (1 January 2017). "Altered Brain Activity in Unipolar Depression Revisited: Meta-analyses of Neuroimaging Studies". JAMA Psychiatry. 74 (1): 47–55. doi:10.1001/jamapsychiatry.2016.2783. PMC 5293141. PMID 27829086.
- ^ Harmer, C. J.; Goodwin, G. M.; Cowen, P. J. (31 July 2009). "Why do antidepressants take so long to work? A cognitive neuropsychological model of antidepressant drug action". The British Journal of Psychiatry. 195 (2): 102–108. doi:10.1192/bjp.bp.108.051193. PMID 19648538.
- ^ Delaveau, P; Jabourian, M; Lemogne, C; Guionnet, S; Bergouignan, L; Fossati, P (April 2011). "Brain effects of antidepressants in major depression: a meta-analysis of emotional processing studies". Journal of Affective Disorders. 130 (1–2): 66–74. doi:10.1016/j.jad.2010.09.032. PMID 21030092.
- ^ Pringle, A; Harmer, CJ (December 2015). "The effects of drugs on human models of emotional processing: an account of antidepressant drug treatment". Dialogues in Clinical Neuroscience. 17 (4): 477–87. doi:10.31887/DCNS.2015.17.4/apringle. PMC 4734885. PMID 26869848.
- ^ a b c Hamilton, J. Paul; Etkin, Amit; Furman, Daniella J.; Lemus, Maria G.; Johnson, Rebecca F.; Gotlib, Ian H. (1 July 2012). "Functional neuroimaging of major depressive disorder: a meta-analysis and new integration of base line activation and neural response data". The American Journal of Psychiatry. 169 (7): 693–703. doi:10.1176/appi.ajp.2012.11071105. ISSN 1535-7228. PMID 22535198.
- ^ Drevets, WC; Price, JL; Furey, ML (September 2008). "Brain structural and functional abnormalities in mood disorders: implications for neurocircuitry models of depression". Brain Structure & Function. 213 (1–2): 93–118. doi:10.1007/s00429-008-0189-x. PMC 2522333. PMID 18704495.
- ^ Drevets, WC (April 2001). "Neuroimaging and neuropathological studies of depression: implications for the cognitive-emotional features of mood disorders". Current Opinion in Neurobiology. 11 (2): 240–9. doi:10.1016/S0959-4388(00)00203-8. PMID 11301246. S2CID 36416079.
- ^ Mayberg, Helen (1 August 1997). "Limbic-cortical dysregulation: a proposed model of depression". The Journal of Neuropsychiatry and Clinical Neurosciences. 9 (3): 471–481. doi:10.1176/jnp.9.3.471. ISSN 0895-0172. PMID 9276848.
- ^ a b Graham, Julia; Salimi-Khorshidi, Gholamreza; Hagan, Cindy; Walsh, Nicholas; Goodyer, Ian; Lennox, Belinda; Suckling, John (1 November 2013). "Meta-analytic evidence for neuroimaging models of depression: State or trait?". Journal of Affective Disorders. 151 (2): 423–431. doi:10.1016/j.jad.2013.07.002. PMID 23890584.
- ^ Anticevic, A; Schleifer, C; Youngsun, TC (December 2015). "Emotional and cognitive dysregulation in schizophrenia and depression: understanding common and distinct behavioral and neural mechanisms". Dialogues in Clinical Neuroscience. 17 (4): 421–34. doi:10.31887/DCNS.2015.17.4/aanticevic. PMC 4734880. PMID 26869843.
- ^ Rømer Thomsen, K; Whybrow, PC; Kringelbach, ML (2015). "Reconceptualizing anhedonia: novel perspectives on balancing the pleasure networks in the human brain". Frontiers in Behavioral Neuroscience. 9: 49. doi:10.3389/fnbeh.2015.00049. PMC 4356228. PMID 25814941.
- ^ Treadway, MT; Zald, DH (January 2011). "Reconsidering anhedonia in depression: lessons from translational neuroscience". Neuroscience and Biobehavioral Reviews. 35 (3): 537–55. doi:10.1016/j.neubiorev.2010.06.006. PMC 3005986. PMID 20603146.
- ^ a b c Sternat T, Katzman MA (1 January 2016). "Neurobiology of hedonic tone: the relationship between treatment-resistant depression, attention-deficit hyperactivity disorder, and substance abuse". Neuropsychiatric Disease and Treatment. 12: 2149–64. doi:10.2147/NDT.S111818. PMC 5003599. PMID 27601909.
- ^ Russo, SJ; Nestler, EJ (September 2013). "The brain reward circuitry in mood disorders". Nature Reviews. Neuroscience. 14 (9): 609–25. doi:10.1038/nrn3381. PMC 3867253. PMID 23942470.
- ^ Rolls, ET (September 2016). "A non-reward attractor theory of depression" (PDF). Neuroscience and Biobehavioral Reviews. 68: 47–58. doi:10.1016/j.neubiorev.2016.05.007. PMID 27181908. S2CID 8145667.
- ^ Miller, CH; Hamilton, JP; Sacchet, MD; Gotlib, IH (October 2015). "Meta-analysis of Functional Neuroimaging of Major Depressive Disorder in Youth". JAMA Psychiatry. 72 (10): 1045–53. doi:10.1001/jamapsychiatry.2015.1376. PMID 26332700.
- ^ Graham, J; Salimi-Khorshidi, G; Hagan, C; Walsh, N; Goodyer, I; Lennox, B; Suckling, J (November 2013). "Meta-analytic evidence for neuroimaging models of depression: state or trait?". Journal of Affective Disorders. 151 (2): 423–31. doi:10.1016/j.jad.2013.07.002. PMID 23890584.
- ^ Drevets, WC; Savitz, J; Trimble, M (August 2008). "The subgenual anterior cingulate cortex in mood disorders". CNS Spectrums. 13 (8): 663–81. doi:10.1017/S1092852900013754. PMC 2729429. PMID 18704022.
- ^ a b Lammel, S; Tye, KM; Warden, MR (January 2014). "Progress in understanding mood disorders: optogenetic dissection of neural circuits". Genes, Brain, and Behavior. 13 (1): 38–51. doi:10.1111/gbb.12049. PMID 23682971.
- ^ Groenewold, NA; Opmeer, EM; de Jonge, P; Aleman, A; Costafreda, SG (February 2013). "Emotional valence modulates brain functional abnormalities in depression: evidence from a meta-analysis of fMRI studies". Neuroscience and Biobehavioral Reviews. 37 (2): 152–63. doi:10.1016/j.neubiorev.2012.11.015. PMID 23206667. S2CID 9980163.
- ^ Drevets, WC; Savitz, J; Trimble, M (August 2008). "The subgenual anterior cingulate cortex in mood disorders". CNS Spectrums. 13 (8): 663–81. doi:10.1017/S1092852900013754. PMC 2729429. PMID 18704022.
Together, these data suggest the hypothesis that dysfunction of the sgACC results in understimulation of parasympathetic tone in mood disorders.
- ^ Rive, MM; van Rooijen, G; Veltman, DJ; Phillips, ML; Schene, AH; Ruhé, HG (December 2013). "Neural correlates of dysfunctional emotion regulation in major depressive disorder. A systematic review of neuroimaging studies". Neuroscience and Biobehavioral Reviews. 37 (10 Pt 2): 2529–53. doi:10.1016/j.neubiorev.2013.07.018. PMID 23928089. S2CID 33607901.
- ^ Dunlop, BW; Mayberg, HS (December 2014). "Neuroimaging-based biomarkers for treatment selection in major depressive disorder". Dialogues in Clinical Neuroscience. 16 (4): 479–90. doi:10.31887/DCNS.2014.16.4/bdunlop. PMC 4336918. PMID 25733953.
- ^ Wise, T; Radua, J; Via, E; Cardoner, N; Abe, O; Adams, TM; Amico, F; Cheng, Y; Cole, JH; de Azevedo Marques Périco, C; Dickstein, DP; Farrow, TFD; Frodl, T; Wagner, G; Gotlib, IH; Gruber, O; Ham, BJ; Job, DE; Kempton, MJ; Kim, MJ; Koolschijn, PCMP; Malhi, GS; Mataix-Cols, D; McIntosh, AM; Nugent, AC; O'Brien, JT; Pezzoli, S; Phillips, ML; Sachdev, PS; Salvadore, G; Selvaraj, S; Stanfield, AC; Thomas, AJ; van Tol, MJ; van der Wee, NJA; Veltman, DJ; Young, AH; Fu, CH; Cleare, AJ; Arnone, D (October 2017). "Common and distinct patterns of grey-matter volume alteration in major depression and bipolar disorder: evidence from voxel-based meta-analysis". Molecular Psychiatry. 22 (10): 1455–1463. doi:10.1038/mp.2016.72. PMC 5622121. PMID 27217146.
- ^ Bora, E; Fornito, A; Pantelis, C; Yücel, M (April 2012). "Gray matter abnormalities in Major Depressive Disorder: a meta-analysis of voxel based morphometry studies". Journal of Affective Disorders. 138 (1–2): 9–18. doi:10.1016/j.jad.2011.03.049. PMID 21511342.
- ^ Zhang, H; Li, L; Wu, M; Chen, Z; Hu, X; Chen, Y; Zhu, H; Jia, Z; Gong, Q (January 2016). "Brain gray matter alterations in first episodes of depression: A meta-analysis of whole-brain studies". Neuroscience and Biobehavioral Reviews. 60: 43–50. doi:10.1016/j.neubiorev.2015.10.011. PMID 26592799. S2CID 207092294.
- ^ Zhao, YJ; Du, MY; Huang, XQ; Lui, S; Chen, ZQ; Liu, J; Luo, Y; Wang, XL; Kemp, GJ; Gong, QY (October 2014). "Brain grey matter abnormalities in medication-free patients with major depressive disorder: a meta-analysis". Psychological Medicine. 44 (14): 2927–37. doi:10.1017/S0033291714000518. PMID 25065859.
- ^ Sacher, J; Neumann, J; Fünfstück, T; Soliman, A; Villringer, A; Schroeter, ML (October 2012). "Mapping the depressed brain: a meta-analysis of structural and functional alterations in major depressive disorder". Journal of Affective Disorders. 140 (2): 142–8. doi:10.1016/j.jad.2011.08.001. PMID 21890211.
- ^ Arnone, D; Job, D; Selvaraj, S; Abe, O; Amico, F; Cheng, Y; Colloby, SJ; O'Brien, JT; Frodl, T; Gotlib, IH; Ham, BJ; Kim, MJ; Koolschijn, PC; Périco, CA; Salvadore, G; Thomas, AJ; Van Tol, MJ; van der Wee, NJ; Veltman, DJ; Wagner, G; McIntosh, AM (April 2016). "Computational meta-analysis of statistical parametric maps in major depression". Human Brain Mapping. 37 (4): 1393–404. doi:10.1002/hbm.23108. PMC 6867585. PMID 26854015.
- ^ Schmaal, L; Hibar, DP; Sämann, PG; Hall, GB; Baune, BT; Jahanshad, N; Cheung, JW; van Erp, TGM; Bos, D; Ikram, MA; Vernooij, MW; Niessen, WJ; Tiemeier, H; Hofman, A; Wittfeld, K; Grabe, HJ; Janowitz, D; Bülow, R; Selonke, M; Völzke, H; Grotegerd, D; Dannlowski, U; Arolt, V; Opel, N; Heindel, W; Kugel, H; Hoehn, D; Czisch, M; Couvy-Duchesne, B; Rentería, ME; Strike, LT; Wright, MJ; Mills, NT; de Zubicaray, GI; McMahon, KL; Medland, SE; Martin, NG; Gillespie, NA; Goya-Maldonado, R; Gruber, O; Krämer, B; Hatton, SN; Lagopoulos, J; Hickie, IB; Frodl, T; Carballedo, A; Frey, EM; van Velzen, LS; Penninx, BWJH; van Tol, MJ; van der Wee, NJ; Davey, CG; Harrison, BJ; Mwangi, B; Cao, B; Soares, JC; Veer, IM; Walter, H; Schoepf, D; Zurowski, B; Konrad, C; Schramm, E; Normann, C; Schnell, K; Sacchet, MD; Gotlib, IH; MacQueen, GM; Godlewska, BR; Nickson, T; McIntosh, AM; Papmeyer, M; Whalley, HC; Hall, J; Sussmann, JE; Li, M; Walter, M; Aftanas, L; Brack, I; Bokhan, NA; Thompson, PM; Veltman, DJ (June 2017). "Cortical abnormalities in adults and adolescents with major depression based on brain scans from 20 cohorts worldwide in the ENIGMA Major Depressive Disorder Working Group". Molecular Psychiatry. 22 (6): 900–909. doi:10.1038/mp.2016.60. PMC 5444023. PMID 27137745.
- ^ Schmaal, L; Veltman, DJ; van Erp, TG; Sämann, PG; Frodl, T; Jahanshad, N; Loehrer, E; Tiemeier, H; Hofman, A; Niessen, WJ; Vernooij, MW; Ikram, MA; Wittfeld, K; Grabe, HJ; Block, A; Hegenscheid, K; Völzke, H; Hoehn, D; Czisch, M; Lagopoulos, J; Hatton, SN; Hickie, IB; Goya-Maldonado, R; Krämer, B; Gruber, O; Couvy-Duchesne, B; Rentería, ME; Strike, LT; Mills, NT; de Zubicaray, GI; McMahon, KL; Medland, SE; Martin, NG; Gillespie, NA; Wright, MJ; Hall, GB; MacQueen, GM; Frey, EM; Carballedo, A; van Velzen, LS; van Tol, MJ; van der Wee, NJ; Veer, IM; Walter, H; Schnell, K; Schramm, E; Normann, C; Schoepf, D; Konrad, C; Zurowski, B; Nickson, T; McIntosh, AM; Papmeyer, M; Whalley, HC; Sussmann, JE; Godlewska, BR; Cowen, PJ; Fischer, FH; Rose, M; Penninx, BW; Thompson, PM; Hibar, DP (June 2016). "Subcortical brain alterations in major depressive disorder: findings from the ENIGMA Major Depressive Disorder working group". Molecular Psychiatry. 21 (6): 806–12. doi:10.1038/mp.2015.69. PMC 4879183. PMID 26122586.
- ^ a b c d Chen, G; Hu, X; Li, L; Huang, X; Lui, S; Kuang, W; Ai, H; Bi, F; Gu, Z; Gong, Q (24 February 2016). "Disorganization of white matter architecture in major depressive disorder: a meta-analysis of diffusion tensor imaging with tract-based spatial statistics". Scientific Reports. 6: 21825. Bibcode:2016NatSR...621825C. doi:10.1038/srep21825. PMC 4764827. PMID 26906716.
- ^ a b c d Chen, G; Guo, Y; Zhu, H; Kuang, W; Bi, F; Ai, H; Gu, Z; Huang, X; Lui, S; Gong, Q (2 June 2017). "Intrinsic disruption of white matter microarchitecture in first-episode, drug-naive major depressive disorder: A voxel-based meta-analysis of diffusion tensor imaging". Progress in Neuro-psychopharmacology & Biological Psychiatry. 76: 179–187. doi:10.1016/j.pnpbp.2017.03.011. PMID 28336497. S2CID 4610677.
- ^ a b c d Jiang, J; Zhao, YJ; Hu, XY; Du, MY; Chen, ZQ; Wu, M; Li, KM; Zhu, HY; Kumar, P; Gong, QY (May 2017). "Microstructural brain abnormalities in medication-free patients with major depressive disorder: a systematic review and meta-analysis of diffusion tensor imaging". Journal of Psychiatry & Neuroscience. 42 (3): 150–163. doi:10.1503/jpn.150341. PMC 5403660. PMID 27780031.
- ^ a b Wise, T; Radua, J; Nortje, G; Cleare, AJ; Young, AH; Arnone, D (15 February 2016). "Voxel-Based Meta-Analytical Evidence of Structural Disconnectivity in Major Depression and Bipolar Disorder". Biological Psychiatry. 79 (4): 293–302. doi:10.1016/j.biopsych.2015.03.004. PMID 25891219.
- ^ Zhou, M; Hu, X; Lu, L; Zhang, L; Chen, L; Gong, Q; Huang, X (3 April 2017). "Intrinsic cerebral activity at resting state in adults with major depressive disorder: A meta-analysis". Progress in Neuro-psychopharmacology & Biological Psychiatry. 75: 157–164. doi:10.1016/j.pnpbp.2017.02.001. PMID 28174129. S2CID 20054773.
- ^ Li, W; Chen, Z; Wu, M; Zhu, H; Gu, L; Zhao, Y; Kuang, W; Bi, F; Kemp, GJ; Gong, Q (1 March 2017). "Characterization of brain blood flow and the amplitude of low-frequency fluctuations in major depressive disorder: A multimodal meta-analysis". Journal of Affective Disorders. 210: 303–311. doi:10.1016/j.jad.2016.12.032. PMID 28068619.
- ^ Kühn, S; Gallinat, J (March 2013). "Resting-state brain activity in schizophrenia and major depression: a quantitative meta-analysis". Schizophrenia Bulletin. 39 (2): 358–65. doi:10.1093/schbul/sbr151. PMC 3576173. PMID 22080493.
- ^ a b Fitzgerald, PB; Laird, AR; Maller, J; Daskalakis, ZJ (June 2008). "A meta-analytic study of changes in brain activation in depression". Human Brain Mapping. 29 (6): 683–95. doi:10.1002/hbm.20426. PMC 2873772. PMID 17598168.
- ^ Carlson, Neil R. (2012). Physiology of Behavior Books a La Carte Edition (11th ed.). Boston: Pearson College Div. ISBN 978-0-205-23981-8.
- ^ a b Miller, Chris H.; Hamilton, J. Paul; Sacchet, Matthew D.; Gotlib, Ian H. (1 October 2015). "Meta-analysis of Functional Neuroimaging of Major Depressive Disorder in Youth". JAMA Psychiatry. 72 (10): 1045–1053. doi:10.1001/jamapsychiatry.2015.1376. ISSN 2168-6238. PMID 26332700.
- ^ Wessa, Michèle; Lois, Giannis (30 November 2016). "Brain Functional Effects of Psychopharmacological Treatment in Major Depression: A Focus on Neural Circuitry of Affective Processing". Current Neuropharmacology. 13 (4): 466–479. doi:10.2174/1570159X13666150416224801. ISSN 1570-159X. PMC 4790403. PMID 26412066.
- ^ Outhred, Tim; Hawkshead, Brittany E.; Wager, Tor D.; Das, Pritha; Malhi, Gin S.; Kemp, Andrew H. (1 September 2013). "Acute neural effects of selective serotonin reuptake inhibitors versus noradrenaline reuptake inhibitors on emotion processing: Implications for differential treatment efficacy" (PDF). Neuroscience and Biobehavioral Reviews. 37 (8): 1786–1800. doi:10.1016/j.neubiorev.2013.07.010. ISSN 1873-7528. PMID 23886514. S2CID 15469440.
- ^ Hamilton, J. Paul; Siemer, Matthias; Gotlib, Ian H. (8 September 2009). "Amygdala volume in Major Depressive Disorder: A meta-analysis of magnetic resonance imaging studies". Molecular Psychiatry. 13 (11): 993–1000. doi:10.1038/mp.2008.57. ISSN 1359-4184. PMC 2739676. PMID 18504424.
- ^ Palmer, Susan M.; Crewther, Sheila G.; Carey, Leeanne M. (14 January 2015). "A Meta-Analysis of Changes in Brain Activity in Clinical Depression". Frontiers in Human Neuroscience. 8: 1045. doi:10.3389/fnhum.2014.01045. ISSN 1662-5161. PMC 4294131. PMID 25642179.
- ^ Fitzgerald, Paul B.; Laird, Angela R.; Maller, Jerome; Daskalakis, Zafiris J. (5 December 2016). "A Meta-Analytic Study of Changes in Brain Activation in Depression". Human Brain Mapping. 29 (6): 683–695. doi:10.1002/hbm.20426. ISSN 1065-9471. PMC 2873772. PMID 17598168.
- ^ Cole, James; Costafreda, Sergi G.; McGuffin, Peter; Fu, Cynthia H. Y. (1 November 2011). "Hippocampal atrophy in first episode depression: a meta-analysis of magnetic resonance imaging studies". Journal of Affective Disorders. 134 (1–3): 483–487. doi:10.1016/j.jad.2011.05.057. ISSN 1573-2517. PMID 21745692.
- ^ Videbech, Poul; Ravnkilde, Barbara (1 November 2004). "Hippocampal volume and depression: a meta-analysis of MRI studies". The American Journal of Psychiatry. 161 (11): 1957–1966. doi:10.1176/appi.ajp.161.11.1957. ISSN 0002-953X. PMID 15514393.
- ^ Mahar, I; Bambico, FR; Mechawar, N; Nobrega, JN (January 2014). "Stress, serotonin, and hippocampal neurogenesis in relation to depression and antidepressant effects". Neuroscience and Biobehavioral Reviews. 38: 173–92. doi:10.1016/j.neubiorev.2013.11.009. PMID 24300695. S2CID 207090692.
- ^ Willner, P; Scheel-Krüger, J; Belzung, C (December 2013). "The neurobiology of depression and antidepressant action". Neuroscience and Biobehavioral Reviews. 37 (10 Pt 1): 2331–71. doi:10.1016/j.neubiorev.2012.12.007. PMID 23261405. S2CID 46160087.
- ^ Pariante CM, Lightman SL (September 2008). "The HPA axis in major depression: classical theories and new developments". Trends Neurosci. 31 (9): 464–468. doi:10.1016/j.tins.2008.06.006. PMID 18675469. S2CID 13308611.
- ^ Belvederi Murri, Martino; Pariante, Carmine; Mondelli, Valeria; Masotti, Mattia; Atti, Anna Rita; Mellacqua, Zefiro; Antonioli, Marco; Ghio, Lucio; Menchetti, Marco; Zanetidou, Stamatula; Innamorati, Marco; Amore, Mario (1 March 2014). "HPA axis and aging in depression: systematic review and meta-analysis". Psychoneuroendocrinology. 41: 46–62. doi:10.1016/j.psyneuen.2013.12.004. ISSN 1873-3360. PMID 24495607. S2CID 24419374.
- ^ Juruena, Mario F. (1 September 2014). "Early-life stress and HPA axis trigger recurrent adulthood depression". Epilepsy & Behavior. 38: 148–159. doi:10.1016/j.yebeh.2013.10.020. ISSN 1525-5069. PMID 24269030. S2CID 24251067.
- ^ Heim, Christine; Newport, D. Jeffrey; Mletzko, Tanja; Miller, Andrew H.; Nemeroff, Charles B. (1 August 2008). "The link between childhood trauma and depression: Insights from HPA axis studies in humans". Psychoneuroendocrinology. 33 (6): 693–710. doi:10.1016/j.psyneuen.2008.03.008. ISSN 0306-4530. PMID 18602762. S2CID 2629673.
- ^ Arana, G. W.; Baldessarini, R. J.; Ornsteen, M. (1 December 1985). "The dexamethasone suppression test for diagnosis and prognosis in psychiatry. Commentary and review". Archives of General Psychiatry. 42 (12): 1193–1204. doi:10.1001/archpsyc.1985.01790350067012. ISSN 0003-990X. PMID 3000317.
- ^ Varghese, Femina P.; Brown, E. Sherwood (1 January 2001). "The Hypothalamic-Pituitary-Adrenal Axis in Major Depressive Disorder: A Brief Primer for Primary Care Physicians". Primary Care Companion to the Journal of Clinical Psychiatry. 3 (4): 151–155. doi:10.4088/pcc.v03n0401. ISSN 1523-5998. PMC 181180. PMID 15014598.
- ^ Gilbertson, M. W.; Shenton, M. E.; Ciszewski, A.; Kasai, K.; Lasko, N. B.; Orr, S. P.; Pitman, R. K. (2002). "Smaller hippocampal volume predicts pathologic vulnerability to psychological trauma". Nature Neuroscience. 5 (11): 1242–7. doi:10.1038/nn958. PMC 2819093. PMID 12379862.
- ^ Vythilingam, Meena; Vermetten, Eric; Anderson, George M.; Luckenbaugh, David; Anderson, Eric R.; Snow, Joseph; Staib, Lawrence H.; Charney, Dennis S.; Bremner, J. Douglas (15 July 2004). "Hippocampal volume, memory, and cortisol status in major depressive disorder: effects of treatment". Biological Psychiatry. 56 (2): 101–112. doi:10.1016/j.biopsych.2004.04.002. ISSN 0006-3223. PMID 15231442. S2CID 34280275.
- ^ a b c Krishnan, V; Nestler, EJ (2011). Animal models of depression: molecular perspectives. Current Topics in Behavioral Neurosciences. Vol. 7. pp. 121–47. doi:10.1007/7854_2010_108. ISBN 978-3-642-19702-4. PMC 3270071. PMID 21225412.
- ^ Belzung, C; Lemoine, M (7 November 2011). "Criteria of validity for animal models of psychiatric disorders: focus on anxiety disorders and depression". Biology of Mood & Anxiety Disorders. 1 (1): 9. doi:10.1186/2045-5380-1-9. PMC 3384226. PMID 22738250.
- ^ a b Alcantara, Lyonna F.; Praise, Eric M.; Bolanos-Guzman, Carlos A. (2018). "26. Animal Models of Mood Disorders". In Charney, Dennis; Sklar, Pamela; Nestler, Eric; Buxbaum, Joseph (eds.). Charney & Nestler's Neurobiology of Mental Illness (5th ed.). New York: Oxford University Press. pp. 329–333.
- ^ Yan, HC; Cao, X; Das, M; Zhu, XH; Gao, TM (August 2010). "Behavioral animal models of depression". Neuroscience Bulletin. 26 (4): 327–37. doi:10.1007/s12264-010-0323-7. PMC 5552573. PMID 20651815.
- ^ Czéh, B; Fuchs, E; Wiborg, O; Simon, M (4 January 2016). "Animal models of major depression and their clinical implications". Progress in Neuro-psychopharmacology & Biological Psychiatry. 64: 293–310. doi:10.1016/j.pnpbp.2015.04.004. PMID 25891248. S2CID 207410936.
- ^ a b c Yang, Y; Wang, H; Hu, J; Hu, H (February 2018). "Lateral habenula in the pathophysiology of depression". Current Opinion in Neurobiology. 48: 90–96. doi:10.1016/j.conb.2017.10.024. PMID 29175713.
- ^ Proulx, CD; Hikosaka, O; Malinow, R (September 2014). "Reward processing by the lateral habenula in normal and depressive behaviors". Nature Neuroscience. 17 (9): 1146–52. doi:10.1038/nn.3779. PMC 4305435. PMID 25157511.
- ^ Belujon, P; Grace, AA (1 December 2017). "Dopamine System Dysregulation in Major Depressive Disorders". The International Journal of Neuropsychopharmacology. 20 (12): 1036–1046. doi:10.1093/ijnp/pyx056. PMC 5716179. PMID 29106542.
- ^ a b Knowland, D; Lim, BK (5 January 2018). "Circuit-based frameworks of depressive behaviors: The role of reward circuitry and beyond". Pharmacology Biochemistry and Behavior. 174: 42–52. doi:10.1016/j.pbb.2017.12.010. PMC 6340396. PMID 29309799.
- ^ Heller, AS (2016). "Cortical-Subcortical Interactions in Depression: From Animal Models to Human Psychopathology". Frontiers in Systems Neuroscience. 10: 20. doi:10.3389/fnsys.2016.00020. PMC 4780432. PMID 27013988.
- ^ Christopher Pittenger; Ronald S Duman (2008). "Stress, Depression, and Neuroplasticity: A Convergence of Mechanisms". Neuropsychopharmacology. 33 (1): 88–109. doi:10.1038/sj.npp.1301574. PMID 17851537.
- ^ Brunoni, André Russowsky; Lopes, Mariana; Fregni, Felipe (1 December 2008). "A systematic review and meta-analysis of clinical studies on major depression and BDNF levels: implications for the role of neuroplasticity in depression". International Journal of Neuropsychopharmacology. 11 (8): 1169–1180. doi:10.1017/S1461145708009309. ISSN 1461-1457. PMID 18752720.
- ^ Serafini, Gianluca (22 June 2012). "Neuroplasticity and major depression, the role of modern antidepressant drugs". World Journal of Psychiatry. 2 (3): 49–57. doi:10.5498/wjp.v2.i3.49. ISSN 2220-3206. PMC 3782176. PMID 24175168.
- ^ Krishnadas, Rajeev; Cavanagh, Jonathan (1 May 2012). "Depression: an inflammatory illness?". Journal of Neurology, Neurosurgery, and Psychiatry. 83 (5): 495–502. doi:10.1136/jnnp-2011-301779. ISSN 1468-330X. PMID 22423117.
- ^ Patel, Amisha (1 September 2013). "Review: the role of inflammation in depression". Psychiatria Danubina. 25 Suppl 2: S216–223. ISSN 0353-5053. PMID 23995180.
- ^ Dowlati, Yekta; Herrmann, Nathan; Swardfager, Walter; Liu, Helena; Sham, Lauren; Reim, Elyse K.; Lanctôt, Krista L. (1 March 2010). "A meta-analysis of cytokines in major depression". Biological Psychiatry. 67 (5): 446–457. doi:10.1016/j.biopsych.2009.09.033. ISSN 1873-2402. PMID 20015486. S2CID 230209.
- ^ Dantzer, Robert; O’Connor, Jason C.; Freund, Gregory G.; Johnson, Rodney W.; Kelley, Keith W. (3 December 2016). "From inflammation to sickness and depression: when the immune system subjugates the brain". Nature Reviews Neuroscience. 9 (1): 46–56. doi:10.1038/nrn2297. ISSN 1471-003X. PMC 2919277. PMID 18073775.
- ^ Hiles, Sarah A.; Baker, Amanda L.; de Malmanche, Theo; Attia, John (1 October 2012). "A meta-analysis of differences in IL-6 and IL-10 between people with and without depression: exploring the causes of heterogeneity". Brain, Behavior, and Immunity. 26 (7): 1180–1188. doi:10.1016/j.bbi.2012.06.001. hdl:1959.13/1040816. ISSN 1090-2139. PMID 22687336. S2CID 205862714.
- ^ Howren, M. Bryant; Lamkin, Donald M.; Suls, Jerry (1 February 2009). "Associations of depression with C-reactive protein, IL-1, and IL-6: a meta-analysis". Psychosomatic Medicine. 71 (2): 171–186. doi:10.1097/PSY.0b013e3181907c1b. ISSN 1534-7796. PMID 19188531. S2CID 10130027.
- ^ Maes, Michael (29 April 2011). "Depression is an inflammatory disease, but cell-mediated immune activation is the key component of depression". Progress in Neuro-Psychopharmacology & Biological Psychiatry. 35 (3): 664–675. doi:10.1016/j.pnpbp.2010.06.014. ISSN 1878-4216. PMID 20599581. S2CID 11653910.
- ^ Berk, Michael; Williams, Lana J; Jacka, Felice N; O’Neil, Adrienne; Pasco, Julie A; Moylan, Steven; Allen, Nicholas B; Stuart, Amanda L; Hayley, Amie C; Byrne, Michelle L; Maes, Michael (12 September 2013). "So depression is an inflammatory disease, but where does the inflammation come from?". BMC Medicine. 11: 200. doi:10.1186/1741-7015-11-200. ISSN 1741-7015. PMC 3846682. PMID 24228900.
- ^ Leonard, Brian; Maes, Michael (1 February 2012). "Mechanistic explanations how cell-mediated immune activation, inflammation and oxidative and nitrosative stress pathways and their sequels and concomitants play a role in the pathophysiology of unipolar depression". Neuroscience and Biobehavioral Reviews. 36 (2): 764–785. doi:10.1016/j.neubiorev.2011.12.005. ISSN 1873-7528. PMID 22197082. S2CID 37761511.
- ^ Raedler, Thomas J. (1 November 2011). "Inflammatory mechanisms in major depressive disorder". Current Opinion in Psychiatry. 24 (6): 519–525. doi:10.1097/YCO.0b013e32834b9db6. ISSN 1473-6578. PMID 21897249. S2CID 24215407.
- ^ Köhler, Ole; Benros, Michael E.; Nordentoft, Merete; Farkouh, Michael E.; Iyengar, Rupa L.; Mors, Ole; Krogh, Jesper (1 December 2014). "Effect of anti-inflammatory treatment on depression, depressive symptoms, and adverse effects: a systematic review and meta-analysis of randomized clinical trials". JAMA Psychiatry. 71 (12): 1381–1391. doi:10.1001/jamapsychiatry.2014.1611. ISSN 2168-6238. PMID 25322082.
- ^ Medina, Johnna L.; Jacquart, Jolene; Smits, Jasper A. J. (2015). "Optimizing the exercise prescription for depression: the search for biomarkers of response". Current Opinion in Psychology. 4: 43–47. doi:10.1016/j.copsyc.2015.02.003. ISSN 2352-250X. PMC 4545504. PMID 26309904.
- ^ Parker GB, Brotchie H, Graham RK (January 2017). "Vitamin D and depression". J Affect Disord. 208: 56–61. doi:10.1016/j.jad.2016.08.082. PMID 27750060.
- ^ Cenik B, Cenik C, Snyder MP, Brown ES (2017). "Plasma sterols and depressive symptom severity in a population-based cohort". PLOS ONE. 12 (9): e0184382. Bibcode:2017PLoSO..1284382C. doi:10.1371/journal.pone.0184382. PMC 5590924. PMID 28886149.
- ^ Black, Catherine N.; Bot, Mariska; Scheffer, Peter G.; Cuijpers, Pim; Penninx, Brenda W. J. H. (1 January 2015). "Is depression associated with increased oxidative stress? A systematic review and meta-analysis". Psychoneuroendocrinology. 51: 164–175. doi:10.1016/j.psyneuen.2014.09.025. ISSN 1873-3360. PMID 25462890. S2CID 6896118.
- ^ Liu, Tao; Zhong, Shuming; Liao, Xiaoxiao; Chen, Jian; He, Tingting; Lai, Shunkai; Jia, Yanbin (1 January 2015). "A Meta-Analysis of Oxidative Stress Markers in Depression". PLOS ONE. 10 (10): e0138904. Bibcode:2015PLoSO..1038904L. doi:10.1371/journal.pone.0138904. ISSN 1932-6203. PMC 4596519. PMID 26445247.
- ^ Raza MU, Tufan T, Wang Y, Hill C, Zhu MY (August 2016). "DNA Damage in Major Psychiatric Diseases". Neurotox Res. 30 (2): 251–67. doi:10.1007/s12640-016-9621-9. PMC 4947450. PMID 27126805.
- ^ Liu, Tao; Zhong, Shuming; Liao, Xiaoxiao; Chen, Jian; He, Tingting; Lai, Shunkai; Jia, Yanbin (7 October 2015). "A Meta-Analysis of Oxidative Stress Markers in Depression". PLOS ONE. 10 (10): e0138904. Bibcode:2015PLoSO..1038904L. doi:10.1371/journal.pone.0138904. ISSN 1932-6203. PMC 4596519. PMID 26445247.
- ^ M, Morris G and Berk (2015). "The many roads to mitochondrial dysfunction in neuroimmune and neuropsychiatric disorders". BMC Medicine. 13: 68. doi:10.1186/s12916-015-0310-y. PMC 4382850. PMID 25889215.
- ^ Allen, Josh; Romay-Tallon, Raquel; Brymer, Kyle J.; Caruncho, Hector J.; Kalynchuk, Lisa E. (6 June 2018). "Mitochondria and Mood: Mitochondrial Dysfunction as a Key Player in the Manifestation of Depression". Frontiers in Neuroscience. 12: 386. doi:10.3389/fnins.2018.00386. ISSN 1662-453X. PMC 5997778. PMID 29928190.
- ^ a b c d e Menon, Vinod (October 2011). "Large-scale brain networks and psychopathology: a unifying triple network model". Trends in Cognitive Sciences. 15 (10): 483–506. doi:10.1016/j.tics.2011.08.003. PMID 21908230. S2CID 26653572.
- ^ a b Seeley, W.W; et al. (February 2007). "Dissociable intrinsic connectivity networks for salience processing and executive control". The Journal of Neuroscience. 27 (9): 2349–56. doi:10.1523/JNEUROSCI.5587-06.2007. PMC 2680293. PMID 17329432.
- ^ Habas, C; et al. (1 July 2009). "Distinct cerebellar contributions to intrinsic connectivity networks". The Journal of Neuroscience. 29 (26): 8586–94. doi:10.1523/JNEUROSCI.1868-09.2009. PMC 2742620. PMID 19571149.
- ^ Petrides, M (2005). "Lateral prefrontal cortex: architecture and functional organization". Philosophical Transactions of the Royal Society B. 360 (1456): 781–795. doi:10.1098/rstb.2005.1631. PMC 1569489. PMID 15937012.
- ^ Woodward, N.D.; et al. (2011). "Functional resting-state networks are differentially affected in schizophrenia". Schizophrenia Research. 130 (1–3): 86–93. doi:10.1016/j.schres.2011.03.010. PMC 3139756. PMID 21458238.
- ^ Menon, Vinod; et al. (2001). "Functional neuroanatomy of auditory working memory in schizophrenia: relation to positive and negative symptoms". NeuroImage. 13 (3): 433–446. doi:10.1006/nimg.2000.0699. PMID 11170809. S2CID 12757905.
- ^ Levin, R.L.; et al. (2007). "Cognitive deficits in depression and functional specificity of regional brain activity". Cognitive Therapy and Research. 31 (2): 211–233. doi:10.1007/s10608-007-9128-z. S2CID 22374128.
- ^ Qin, P; Northoff, G (2011). "How is our self related to midline regions and the default mode network?". NeuroImage. 57 (3): 1221–1233. doi:10.1016/j.neuroimage.2011.05.028. PMID 21609772. S2CID 16242246.
- ^ Raichle, M.E.; et al. (2001). "A default mode of brain function". Proceedings of the National Academy of Sciences of the United States of America. 98 (2): 676–682. Bibcode:2001PNAS...98..676R. doi:10.1073/pnas.98.2.676. PMC 14647. PMID 11209064.
- ^ Cooney, R.E.; et al. (2010). "Neural correlates of rumination in depression". Cognitive, Affective, & Behavioral Neuroscience. 10 (4): 470–478. doi:10.3758/cabn.10.4.470. PMC 4476645. PMID 21098808.
- ^ Broyd, S.J.; et al. (2009). "Default mode brain dysfunction in mental disorders: a systematic review". Neuroscience & Biobehavioral Reviews. 33 (3): 279–296. doi:10.1016/j.neubiorev.2008.09.002. PMID 18824195. S2CID 7175805.
- ^ Hamani, C; et al. (15 February 2011). "The subcallosal cingulate gyrus in the context of major depression". Biological Psychiatry. 69 (4): 301–8. doi:10.1016/j.biopsych.2010.09.034. PMID 21145043. S2CID 35458273.
- ^ Feinstein, J.S.; et al. (September 2006). "Anterior insula reactivity during certain decisions is associated with neuroticism". Social Cognitive and Affective Neuroscience. 1 (2): 136–142. doi:10.1093/scan/nsl016. PMC 2555442. PMID 18985124.
- ^ Paulus, M.P; Stein, M.B. (2006). "An insular view of anxiety". Biological Psychiatry. 60 (4): 383–387. doi:10.1016/j.biopsych.2006.03.042. PMID 16780813. S2CID 17889111.
- ^ Antony, M.M. (2009). Oxford Handbook of Anxiety and Related Disorders. Oxford University Press.
추가 읽기
- Szafran, K; Faron-Górecka, A; Kolasa, M; Kuśmider, M; Solich, J; Zurawek, D; Dziedzicka-Wasylewska, M (2013). "Potential role of G protein-coupled receptor (GPCR) heterodimerization in neuropsychiatric disorders: a focus on depression" (PDF). Pharmacol Rep. 65 (6): 1498–505. doi:10.1016/s1734-1140(13)71510-x. PMID 24552997.
- Naumenko, VS; Popova, NK; Lacivita, E; Leopoldo, M; Ponimaskin, EG (July 2014). "Interplay between serotonin 5-HT1A and 5-HT7 receptors in depressive disorders". CNS Neurosci Ther. 20 (7): 582–90. doi:10.1111/cns.12247. PMC 6493079. PMID 24935787.