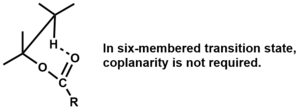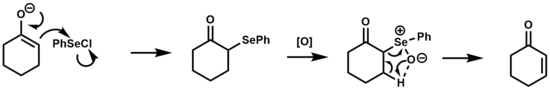Ei 메커니즘
Ei mechanism유기화학에서 열적 동기제거 또는 순환성 동기제거라고도 하는 E 메커니즘i(Emilination Internal/Intramolinal)은 알카인 골격의 두 변성 대체물이 주기적 전환 상태를 통해 동시에 떠나 동기제거에서 알케인을 형성하는 특별한 유형의 제거반응이다.[1]이러한 유형의 제거는 열적으로 활성화되며 산성 또는 염기가 필요한 일반 제거와 달리 추가 시약이 필요하지 않거나 많은 경우 충전된 중간 물질을 포함하기 때문에 독특하다.이 반응 메커니즘은 열분해에서 흔히 발견된다.
일반 기능
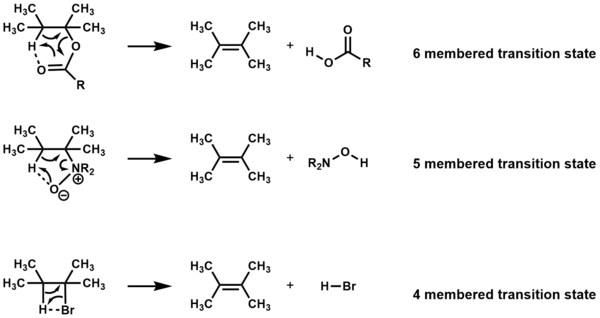
다른 시약이 없는 가열 시 주기적 전환 상태를 통해 제거되는 화합물은i E 반응으로 지정된다.화합물에 따라 4mb, 5mb 또는 6mb의 전환 상태를 통해 제거가 이루어진다.[1][2]
제거는 4mb와 5membed transition state에 대해 일치하고 원자가 conlanar이어야 하지만,[3] 6membed transition state에는 conlanity가 필요하지 않다.[1]
증거 상당한 양의 같은 Ei 메커니즘의 존재를 지원하기 위해:1)그 반응의 반응 속도론 첫번째 것으로 밝혀졌다 2)free-radical 산화 방지제의 사용,[5][6]은 코프 제거를 위해 3)동위 원소 연구 indica이 없free-radical 메커니즘이 연관되어 있는지 여부를 나타내는 값의 반응들 중 그 비율에 영향을 주지 않았다는 order,[4].te은 C-H그리고 C-N 본드는 전환 상태에서 부분적으로 파손되며,[7] 이는 전환 상태에서 결합이 길어지는 것을 보여주는 계산에 의해서도 지원되며 4) 다른 메커니즘의 개입 없이 Ei 메커니즘은 전적으로 동기화 제거 제품을 제공한다.
E반응의i 제품성분에 영향을 미치는 요인은 많지만, 일반적으로는 호프만의 법칙을 따르고 가장 덜 대체된 위치에서 β-수소를 상실하여 대체되는 알켄(Zaitsev의 법칙과는 반대)을 갖게 된다.[1]제품 조성에 영향을 미치는 요인으로는 강직 효과, 결합, 형성 알켄의 안정성 등이 있다.
반복 기판의 경우, Z-이소머는 일반적으로 전환 상태의 불안정한 거슈 상호작용 때문에 작은 제품이지만, 일반적으로 선택성이 높지 않다.[2]
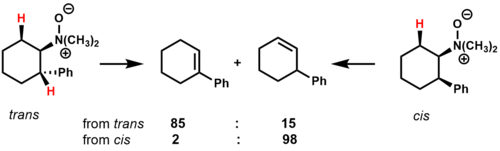
N, N-디메틸-2-페닐사이클로헥시아민-N-산화물의 열분해효과는 변환 상태의 안정성이 순환 기질에 대한 제품 조성에 어떤 영향을 미치는지 보여준다.[2]
트랜스 이소머에는 제거할 수 있는 두 개의 cis-β-하이드로겐이 있다.주요 생산물은 페닐 링과 결합하는 알켄으로, 아마도 전환 상태에 대한 안정화 효과 때문일 것이다.시스 이소머에는 제거할 수 있는 시스-B-수소가 단 한 개뿐이어서, 비결합 레지오이소머를 주요 생산물로 제시한다.
에스터 (아세트산) 열분해
에스테르의 열성 분해는 열적 동기 제거의 한 예다.400 °C 이상의 온도에서 β-하이드로겐을 함유한 에스테르는 6-membed transition 상태를 통해 카르복실산을 제거하여 알켄을 발생시킬 수 있다.[2][6]
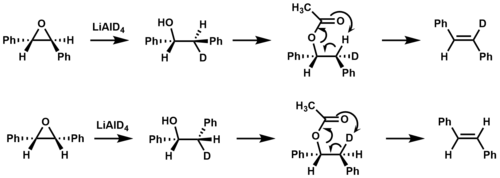
동위원소 라벨링은 스틸베인의 형성에 있어 에스테르 열분해 중에 동기 제거가 발생함을 확인하기 위해 사용되었다.[9]
황 기반
황산화물 제거
β-hydroxy penyl sulfoxide는 tautomerization 후 β-케토 에스테르와 methyl ketones를 생성하여 5회 주기 전환 상태를 통해 열제거를 거치는 것으로 조사되었다.[10]
아군 알코올은 Ei 메커니즘을 통해 β'-수소 함량을 포함하는 β-히드로xy penyl sulfoxide로부터 형성될 수 있으며, β, β-불규칙-불규칙성을 부여한다.[11]
1,3-다이엔은 트리에틸아민 성분이 있는 아릴황화 아릴알코올을 처리해 형성된 것으로 밝혀졌다.[12]처음에 황산염 에스테르에 이어 [2,3]-시방성 재배열이 형성되어 열 동기 제거를 거쳐 1,3-다이엔을 산출한다.
추가예프 제거
추가이프 제거는 크산틴 에스테르의 열분해로서 올레핀이 생긴다.[1][13]크산틴 에스테르를 형성하기 위해 알코올은 염기성 있는 곳에서 이황화탄소와 반응하여 금속 크산틴이 발생하여 알킬링제(일반적으로 요오드화 메틸)로 갇히게 된다.올레핀은 β-수소 및 크산틴 에스테르의 열적 동기 제거를 통해 형성된다.결과 부산물인 카보닐황화물과 메타네티올이 매우 안정적이기 때문에 그 반응은 되돌릴 수 없다.
추가예프 제거는 에스테르 열분해와 매우 유사하지만 제거에 성공하려면 훨씬 낮은 온도가 필요하기 때문에 재배열하기 쉬운 기판에 유용하다.
버지스 탈수 반응
황산염 에스테르 중간을 통해 올레핀을 산출하기 위해 2차 알코올과 3차 알코올이 탈수되는 것을 버지스 탈수 반응이라고 한다.[13][14][15]사용되는 반응 조건은 일반적으로 매우 온화하며 민감한 기질에 대한 다른 탈수 방법보다 어느 정도 유리하다.이 반응은 C 링에 엑소-메틸렌 그룹을 설치하기 위해 택솔의 첫 번째 전체 합성 동안 사용되었다.[16]
첫째, 알코올은 버지스 시약에 있는 트리에틸아민을 대체하여 황산염 에스테르 중간을 형성한다.β-산화물 추상화 및 황산염 에스테르 제거는 6주기의 순환 전환 상태를 통해 알켄을 산출한다.
티오황산염 제거
티오술핀은 황산화물과 유사한 방식으로 제거할 수 있다.대표적으로 알리신을 티오아크로레인에 조각한 것이 비닐디티인을 형성하게 된다.그러한 반응은 마늘과 알륨의 다른 식물들의 항산화 화학에서 중요하다.
셀레늄 기반
셀렌산화물 제거
셀렌산화물 제거는 케톤, 에스테르, 알데히드를 α,β-불포화 유도체로 변환하는 데 사용되어 왔다.[1][17]
이 반응의 메커니즘은 5-membed 주기 전환 상태를 통한 열 동기화 제거인 황산화물 제거와 유사하다.셀레녹시드는 β-제거에 대한 반응성이 증가하기 때문에 황산화물보다 이러한 유형의 변환에 선호되며, 경우에 따라 상온에서 제거가 가능하다.[2]
제거 단계 후에 생성된 아레네셀렌산은 산성 또는 중성 조건에서 β-히드록시 셀레니드를 산출하기 위해 올레핀과 반응할 수 있는 디페닐 이델렌화물과 평형을 이룬다.기본 조건에서는 이 측 반응이 억제된다.[18]
그리코 제거
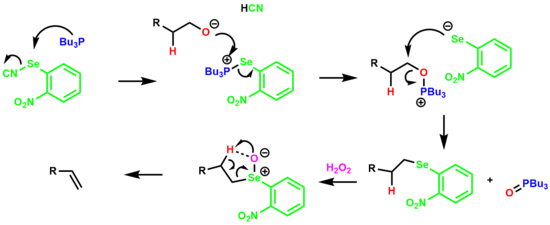
1차 알코올에서 o-니트로페닐 셀렌산화 중간을 통해 알켄을 주기 위한 1차 알코올의 탈수 현상을 그리코 제거라고 한다.[19][20]
그 반응은 알코올과 반응하여 옥사포스포늄 소금을 형성하는 셀레노포스포늄 소금의 형성과 함께 시작된다.아릴 셀레늄 음이온은 알킬 아릴 셀레니드 종을 형성하는 트리뷰틸인산화물을 대체한다.그런 다음 셀레니드는 셀레노사이드로 이어지는 과산화수소로 처리되며, 셀레노사이드로 인해 β-수소가 5인 순환 전환 상태를 통해 제거되어 알켄이 생성된다.
전자를 빼는 니트로 집단은 올레핀의 제거율과 최종 수율을 모두 높이는 것으로 나타났다.
질소 기반
Cope Remission
Cope 제거(Cope reaction)는 Ei 메커니즘을 통해 알켄과 히드록시아민(hydroxylamine)을 산출하기 위한 3차 아민 산화물을 제거하는 것이다.[13][21]Cope 제거는 마노피라노사이아민 흉내를 합성하는데 사용되었다.[22]3차 아민은 m-클로로페록시벤조산(mCPBA)을 이용하여 아민산화물로 산화되었으며, 주기적 전환상태를 통해 β-수소 및 아민산화물의 열적 동기제거를 위해 고온에 노출되어 알켄이 생성되었다.표시된 수소(녹색)는 동기 제거에 사용할 수 있는 유일한 수소라는 점에 주목할 필요가 있다.
순환 아민산화물(5, 7-10-membed 질소, 링 포함)도 내부 동기 제거를 통해 단자 알케인을 함유한 아사이클릭 히드록시아민(acycycyclic hydroxylamine, alken, alken.[13]
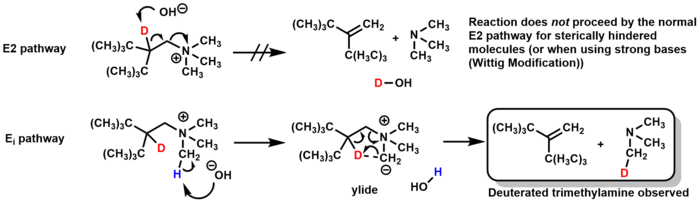
호프만 제거 특별 사례
호프만 제거를 위한 메커니즘은 일반적으로 E2이지만 특정 상황에서 E 경로를i 통과할 수 있다.일부 강직적으로 방해를 받는 분자의 경우 염기성 분자는 β-수소 대신 아민에 있는 메틸 그룹을 디프로톤화하여, 5-엠베드 전환 상태를 통해 트리메틸아민(trimethylamine)을 제거하여 알켄을 형성한다.중수소 라벨링 연구는 중수화 트리메틸아민(그리고 E2 메커니즘에서 형성되는 중수화물은 없음)의 형성을 관찰함으로써 이 메커니즘을 확인했다.[23]
위틱 수정 호프만 제거는 동일한 Ei 메커니즘을 거치게 되지만, 산화은과 물을 베이스로 사용하는 대신 위틱 수정은 알킬리튬이나 KNH2/액체 NH3와 같은 강한 베이스를 사용한다.[24][25]
요오드소 제거
α-탄소의 전자 유출 그룹이 강한 2차 및 3차 알킬 요오드화물은 m-클로로퍼벤조산(mCPBA)에 노출되었을 때 순환 순환성 동기 제거를 거치는 것으로 밝혀졌다.[26]그 반응은 피하이드산의 동시 제거 전에 요오드산 중간을 거치는 것이 제안된다.
이 반응의 범위는 1차 알킬 요오드화물을 포함하지 않는데, 이는 반응 조건 하에서 알코올로 변환되는 피하이드로 중간 재배열되기 때문이다.강한 전자 밀어내기 그룹은 재배열 경로를 억제하여 순환 순환 동기 제거 경로가 우세할 수 있다.
참조
- ^ a b c d e f March, Jerry (2007). Advanced Organic Chemistry (6th ed.). New York: Wiley. ISBN 0471720917.
- ^ a b c d e 캐리, F. A.; 선부르크, R. J. 고급 유기 화학: 반응과 합성, 5차 에드; 파트 B; 스프링거:2010년 뉴욕
- ^ 브란코, J. (1997년)."아비니시오 및 밀도 기능성 방법에 의한 유기 아민 산화물, 황산화물, 인산화물의 열 동기화 제거 반응에 관한 이론적 연구"테오, 화학 389 257-263
- ^ O'Connor, G.L.; Nace, H. R. (1953)"추개프 반응 및 관련 반응에 대한 추가 연구"J. Am. Chem. Soc. 75 2118-.
- ^ 바튼, D.H.R.; A.J.; 윌리엄스, R.J. (1953)"열 제거 반응의 특수성.제3부.(---Menthyl Benzoate")의 열분해.J. Chem Soc. 453 1715- .
- ^ a b 앤슬린, E. V.; 더거티, D. A. 현대 물리 유기 화학, 머독, J. 에드.2006년 대학 과학 서적
- ^ 라이트, D.R.; 심스, L.B.;프라이, A. (1983)"탄소-14 운동 동위원소 효과와 (2-페닐틸)디메틸아민 산화물의 동기-제거 반응에서의 운동 연구"J. Am. Chem. Soc. 105 3714.
- ^ 칸, S.D; 에릭슨, J.A. (1994년)"열적 동기 제거 반응에 대한 이론적 연구.Ethyl Formate, Ethyl Xantate 및 Ethyl Phosinate 제거의 상대 비율".J. Am. Chem. Soc. 116 6271-6276.
- ^ 커틴, D.Y.; 켈롬, D.B. (1953)"dl-erythro와 dl-threo-2-Deutero-1,2-diphenylanol 및 파생상품의 제거 및 대체반응"J. Am. Chem. Soc. 75 6011-
- ^ 키노시타, M.; 쿠니다, N.; 노카미, J. (1975)"B-하이드록시 술폭시드를 케톤스에 용해"4면체 레트 33 2841-28444
- ^ 오카와라, R.; 우에타, K.; 노카미, J. (1978)"B-하이드록시 술프록시데스 2세의 용혈.앨리릭 알코올의 합성".4면체 레트 49 4903-4904
- ^ 월로위츠, S.; 라이히, H.J. (1982)"순차적 황산염-술포화수소[2,3] 시그마티안성 재배열 및 동기 제거에 의한 아릴 알코올의 1,3-다이엔 변환"J. Am. Chem. Soc. 104 7051-7059.
- ^ a b c d Kurti, L.; Czako, B. 유기 합성에서의 명명된 반응의 전략적 응용, 2005년 학술 출판사.
- ^ E.A. 테일러; 펜턴, H.R.J.; 버지스, E.M. (1970)"N-Carboalkoxysulfamate Esters의 합성 응용 프로그램".J. Am. Chem. Soc. 92 5224-5226.
- ^ E.A. 테일러; 펜턴, H.R.J.; 버지스, E.M. (1973)"알킬 N-카르보메트호수황산염 에스터스의 열반응"J. Org. 화학. 38 26-
- ^ Holton, R.A.; 외 연구진(1994)."제1차 택솔 총합성 2. C와 D반지의 완성"J. Am. Chem. Soc. 116 1599-1600.
- ^ 라우어, R.F; Young, M.W.; Sharfleless, K.B. (1973)"셀레녹시데스의 반응:열 동기화 제거 및 H2O-18 교환".테트라헤드론 레트 22 1979-1982
- ^ 라이히, H.J.; 월로위츠; 트렌드, J.E.;차우, F.; 웬델본, D.F. (1978년)"알킬 셀레녹시데스의 싱 제거.셀렌산을 포함한 부작용.구조 및 용제가 요율에 미치는 영향".J. Org. 화학. 43 1697-
- ^ P.A. 그리코; 길만, S.; 니시자와, M. (1976년)"오르간젤레늄 화학.알킬 아릴 셀레니데스 알코올의 페이실 원스텝 합성"J. Org. 화학로411485번길
- ^ 젊은, M.W.; 샤플리스, B.K. (1975)"올레핀 합성.전자 유출 대체물에 의한 알킬 아릴 셀레녹시드 제거율 향상"J. Org. 화학 40, 947-
- ^ 틀:축구단 Cope; 포스터, T.T.; 투글, P.H. (1949)"올레핀과 다이얼킬하이드록시아민에 아민산화물 열분해"J. Am. Chem. Soc. 71 3929-.
- ^ 바셀라, A.; 레멘, L. (2002)"만노피라노사이아민들의 적절한 편향적 모방:B-마노시다제 억제제?"헬프. 침. 액타 85 1118-
- ^ Cope, A.C.; Mehta, A.S. (1963년)"호프만 제거 반응의 기계화:고도로 브랜딩된 쿼터나리 수산화물의 열분해에서의 이라이드 중간".J. Am. Chem. Soc. 85 1949.
- ^ 위틱, G.; 폴스터, R.(1957)앤 화학 102번지 612번지
- ^ 바흐, R.D.; 베어, K.W., 안드르제제프스키, D. (1972)"호프만 제거 반응의 위티그 수정.알파' 베타 메커니즘에 대한 증거"J. Am. Chem. Soc 94 8608-.
- ^ 라이히, H. J., 피케, S. L. (1978년)"하이퍼밸런트 오르간오다이오딘 화학.알킬 요오드소 화합물의 동기화 제거".J. Am. Chem. Soc. 100 4888-