세포 이행
Cell migration세포 이동은 다세포 유기체의 개발과 유지에 있어 중심적인 과정이다.배아 발달, 상처 치유 및 면역 반응은 모두 특정 위치로 세포의 조직적인 움직임을 필요로 한다.세포는 화학 신호나 기계 [1]신호를 포함한 특정 외부 신호에 반응하여 이동하는 경우가 많습니다.이 과정에서 발생하는 오류는 지적 장애, 혈관 질환, 종양 형성 및 전이를 포함한 심각한 결과를 초래합니다.세포가 이동하는 메커니즘에 대한 이해는 예를 들어 침습성 종양세포를 제어하기 위한 새로운 치료 전략의 개발로 이어질 수 있다.
점성이 높은 환경(레이놀즈 수가 낮음)으로 인해 셀은 이동하기 위해 지속적으로 힘을 생성해야 합니다.세포는 매우 다른 메커니즘에 의해 활발한 움직임을 일으킨다.훨씬 덜 복잡한 원핵 생물들(그리고 정자 세포들)은 스스로를 추진하기 위해 편모나 섬모를 사용한다.진핵 세포 이동은 전형적으로 훨씬 더 복잡하고 다른 이동 메커니즘의 조합으로 구성될 수 있다.그것은 일반적으로 세포골격에 의해 움직이는 세포 모양의 급격한 변화를 수반한다.매우 다른 두 가지 이행 시나리오는 크롤링 모션(가장 일반적으로 연구됨)과 블링 운동성이다.[2][3]기어다니는 동작의 전형적인 예는 연구와 [4]교육에 널리 사용되어 온 물고기 표피 각질세포의 경우이다.
세포 이행 연구
표면이나 3D에 부착된 배양 세포의 이동은 일반적으로 현미경을 [5][6][3]사용하여 연구된다.세포 이동이 매우 느리기 때문에 이동 중인 세포에 대한 몇 개의 µm/분, 시간 경과 현미경 영상을 녹화하여 이동 속도를 높입니다.이러한 비디오(그림 1)는 선도 세포 전면이 연속적인 수축과 팽창의 특징적인 행동을 가지고 매우 활발하다는 것을 보여준다.일반적으로 리딩 프런트(leading front)가 셀을 앞으로 당기는 메인 모터라고 알려져 있습니다.
공통 기능
포유류의 세포 이동의 기초가 되는 과정은 (비숙주)[7] 이동의 과정과 일치하는 것으로 여겨진다.공통 관측치에는 다음이 포함됩니다.
- 전방 가장자리(전방)에서의 세포질 변위
- 후연(후면)으로 향하는 배측 자극 이물질의 층 제거
후자의 특징은 표면 분자의 집합체가 형광 항체와 가교되거나 작은 구슬이 [8]세포 전면에 인공적으로 결합될 때 가장 쉽게 관찰된다.
다른 진핵세포들도 비슷하게 이동하는 것이 관찰된다.아메바 딕티오스텔륨 디스코이디움은 순환성 AMP에 반응하여 지속적으로 화학작용을 보이기 때문에 연구자들에게 유용하다; 그들은 배양된 포유동물 세포보다 더 빠르게 움직인다; 그리고 그들은 세포 [9]행동에 대한 특정 유전자 생성물을 연결하는 과정을 단순화하는 반수체 게놈을 가지고 있다.
이동의 분자 과정
세포가 어떻게 전방 가장자리를 발전시키는지에 대한 두 가지 주요 이론이 있다: 세포골격 모델과 막 흐름 모델.양쪽 기본 프로세스가 셀 확장에 기여할 수 있습니다.
세포골격모델(A)
선행 엣지
실험 결과 세포 앞쪽 [10]가장자리에 빠른 액틴 중합이 있는 것으로 나타났습니다.이러한 관찰은 액틴 필라멘트의 형성이 앞쪽 가장자리를 "밀어"주고 세포의 앞쪽 [11][12]가장자리를 발전시키는 주요 운동력이라는 가설을 이끌어냈다.또한 세포골격요소는 세포의 [13]혈장막과 광범위하고 긴밀하게 상호작용할 수 있다.
후행 에지
다른 세포골격 구성요소(미소관 등)는 세포 이동에서 중요한 기능을 한다.미세튜브는 세포 이동 중 후연 수축에 필요한 수축력을 상쇄하는 "스트럿" 역할을 하는 것으로 밝혀졌다.셀의 후미 가장자리에 있는 미세튜브가 역동적일 때, 그들은 수축이 가능하도록 개조할 수 있다.역학이 억제되면 미세관은 개조할 수 없기 때문에 수축력에 [14]대항할 수 있다.미세관 역학이 억제된 세포들의 형태학에서는 세포들이 앞 가장자리를 연장할 수 있지만([15]이동 방향으로 편파되어 있음) 후연을 수축하는 데 어려움이 있음을 나타냅니다.반면에, 높은 약물 농도, 즉 미세관을 탈중합시키는 미세관 돌연변이는 세포 이동을 회복시킬 수 있지만 방향성의 상실이 있다.미세관은 세포 이동을 억제하는 동시에 방향성을 확립하는 역할을 한다는 결론을 내릴 수 있다.
막흐름모델(B)
이동 세포의 전면은 또한 내부 막 풀에서 나온 막이 세포 내 [16]순환의 끝에 세포 표면으로 되돌아가는 장소이다.[17] 이는 주로 세포 전면에 막이 추가됨으로써 앞쪽 가장자리의 확장이 발생함을 시사합니다.만약 그렇다면, 거기서 형성되는 액틴 필라멘트는 추가된 막을 안정화시켜 전면에 [18]거품 같은 구조(또는 블리브)가 아니라 구조화된 확장(라멜라)이 형성되도록 할 수 있다.세포가 움직이기 위해서는, 새로운 "발"을 앞으로 가져와야 합니다.이러한 발은 세포 후면을 향해 세포 내이식되고 세포 외이식에 의해 세포 전면에 가져와 기질에 새로운 부착을 형성하기 위해 재사용될 가능성이 있습니다.
Dictyostelium amoebae의 경우 제한적([20][21][22]높은) 온도에서 막 재활용에 영향을 미치는 세 가지 조건부 온도에 민감한 돌연변이가 세포 이동에 있어 세포 이동에 있어 세포 이동의 중요성에 대한 추가적인 지지를 제공한다.게다가, 이러한 아메배는 매우 빠르게 움직입니다 – 약 5분 안에 약 1셀 길이입니다.원통형(케모탁스 처리 중 대략적으로 사실)으로 간주될 경우, 5분마다 1개의 셀 표면적을 재활용해야 하며,[23] 이는 대략적으로 측정된 것과 같다.

아메로이드 이동의 기계적 기초
접착제 크롤링은 진핵세포에 의해 나타나는 유일한 이동모드가 아니다.중요한 것은, 여러 종류의 세포(Dictyostelium amoebae, 호중구, 전이성 암세포 및 대식세포)가 접착에 의존하지 않고 이동할 수 있는 것으로 밝혀졌다.역사적으로, 물리학자 E. M. 퍼셀은 (1977년) 세포 스케일에 적용되는 낮은 레이놀즈 수 유체 역학 조건 하에서, 후방 표면 흐름은 미세한 물체가 앞으로 [25]헤엄치는 메커니즘을 제공할 수 있다고 이론을 세웠다.수십 년 후, 아메보이드 세포와 호중구가 모두 이소덴스 [26]매체에 매달려 있는 동안 화학 유인제 선원을 향해 화학 운동할 수 있다는 것이 발견되었을 때(2010년) 이 세포 이동 모델에 대한 실험적인 뒷받침이 제공되었다.그 후 광유전학을 사용하여 유착 없이 아메보이드 방식으로 이동하는 세포가 주변 [24][27]유체에 접선력을 가함으로써 세포를 추진시킬 수 있는 세포 후방을 향해 혈장 막 흐름을 보인다는 것이 밝혀졌다.세포 뒤쪽에서 전면으로 막이 포함된 소포를 편파적으로 전달하면 세포 [24]크기를 유지하는 데 도움이 됩니다.Dictyostelium discoideum [28]세포에서도 후방 막 흐름이 관찰되었다.이러한 관찰은 후방 세포 표면막 흐름에 의존하는 세포 이동 모델을 강력하게 지원한다(모델 B, 위).흥미롭게도, 세포상 클러스터의 이동은 또한 [29]후방 표면 흐름의 유사한 메커니즘에 의해 뒷받침되는 것으로 밝혀졌다.
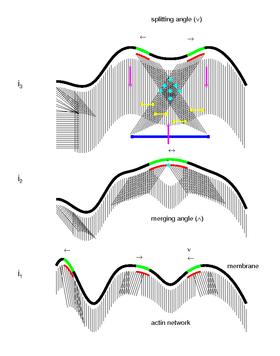
세포운동의 집합적 생체역학 및 분자 메커니즘
몇몇 수학적 모델에 기초하여, 최근의 연구들은 세포 [30]운동의 집합적 생체역학과 분자 메커니즘을 위한 새로운 생물학적 모델을 가정한다.마이크로 도메인이 세포골격의 질감을 짜고 그 상호작용이 새로운 접착 부위의 형성을 위한 위치를 표시하도록 제안되었다.이 모델에 따르면 마이크로 도메인 시그널링 다이내믹스는 세포골격과 그 기질과의 상호작용을 조직한다.마이크로도메인은 액틴 필라멘트의 활성 중합작용을 유발하고 유지하므로 막에서의 그들의 전파와 지그재그 운동은 세포 경계에 대한 광범위한 각도에서 지향하는 곡면 또는 선형 필라멘트의 고도로 상호 연결된 네트워크를 생성한다.또한 마이크로 도메인 상호작용은 세포 주변에 새로운 국소 접착 부위의 형성을 나타낸다.그 후 액틴 네트워크와의 미오신 상호작용은 막 수축/부활, 역행 흐름 및 전진 운동을 위한 수축력을 생성한다.마지막으로, 오래된 국소 접착 부위에 지속적으로 응력을 가하면 칼슘에 의해 유발되는 칼파인 활성화가 발생하고 결과적으로 국소 접착이 분리되어 사이클이 완료될 수 있다.
이행 셀의 극성
이행하는 셀에는 극성이 있습니다.전면과 후면이 있습니다.그게 없다면, 그들은 모든 방향으로 동시에 움직일 것이다. 즉, 확산될 것이다.이 극성이 세포 내부의 분자 수준에서 어떻게 형성되는지는 알려지지 않았다.랜덤하게 곡선을 그리고 있는 셀에서는 셀의 다른 영역(들)이 새로운 전선을 형성함에 따라 전면이 쉽게 수동적이 될 수 있다.케모탁스 세포에서는 세포가 자극성 화학물질의 고농도로 진행됨에 따라 전면의 안정성이 향상되는 것으로 보인다.이 극성은 분자 수준에서 내부 세포 표면의 특정 영역에 대한 특정 분자의 제한에 의해 반영됩니다.따라서 인지질 PIP3와 활성 Rac 및 CDC42는 세포 전면에, Rho GTPase 및 PTEN은 [31][32]후방을 향해 발견된다.
필라멘트 형태의 액틴과 미세관은 세포의 [citation needed]극성을 확립하고 유지하는 데 중요하다고 믿어진다.액틴 필라멘트를 파괴하는 약물은 다종다양하고 복잡한 효과를 가지며, 이는 이러한 필라멘트가 많은 세포 과정에서 수행하는 광범위한 역할을 반영한다.이동 과정의 일부로서 막 소포는 이러한 필라멘트를 따라 세포 전면으로 운반될 수 있습니다.케모탁스화 세포에서 타깃으로의 이동 지속성의 증가는 세포 내의 필라멘트 구조의 배열의 안정성 향상과 극성 결정으로 인해 발생할 수 있다.이어서 이들 필라멘트 구조는 PIP3 및 PTEN과 같은 분자가 내부 세포막에 어떻게 배치되는지에 따라 세포 내부에 배치될 수 있다.그리고 이것들이 어디에 위치하는지 차례로 화학 유인물질 신호에 의해 결정되는 것으로 보입니다. 이것들은 세포 표면의 특정 수용체에 영향을 미칩니다.
비록 미세튜브가 세포 이동에 영향을 미치는 것으로 오랫동안 알려져 있지만, 그렇게 하는 메커니즘은 여전히 논쟁의 여지가 있다.평탄한 표면에서 미세관은 이동에 필요하지 않지만 세포 이동에 대한 방향성과 전단의 [15][33]효율적인 돌출을 제공하기 위해 필요하다.존재하는 경우, 미세관은 약물 치료나 튜브린 [15]돌연변이에 의해 동태가 억제될 때 세포 이동을 지연시킨다.
세포 운동성의 맥락에서의 역문제
세포 운동성의 역문제라는 연구 분야가 확립되었다.[34][35][30] 이 접근방식은 셀의 행동 또는 형상 변화가 이러한 변화를 일으키는 기본 메커니즘에 대한 정보를 포함한다는 생각에 기초한다.세포 운동을 읽는 것, 즉 기초가 되는 생물물리학적 및 기계적 화학적 과정을 이해하는 것이 가장 중요하다.그 수학적 모델 이 작품들에서 개발되[37][36] 살아 있는 세포 영상 시퀀스의 분석 지역적으로 통과하게 되고 그 세포 내에서 액틴 네트워크, microdomains, 같은 분자적 구조, 강조 및 프로세스에 대해 추가적인 추론하기에 이 정보를 사용하는 세포의 물리적 형상과 물질적인 속성을 결정한다.chemot축, 접착 및 역행 흐름.
「 」를 참조해 주세요.
레퍼런스
- ^ Mak, M.; Spill, F.; Roger, K.; Zaman, M. (2016). "Single-Cell Migration in Complex Microenvironments: Mechanics and Signaling Dynamics". Journal of Biomechanical Engineering. 138 (2): 021004. doi:10.1115/1.4032188. PMC 4844084. PMID 26639083.
- ^ Huber, F; Schnauss, J; Roenicke, S; Rauch, P; Mueller, K; Fuetterer, C; Kaes, J (2013). "Emergent complexity of the cytoskeleton: from single filaments to tissue". Advances in Physics. 62 (1): 1–112. Bibcode:2013AdPhy..62....1H. doi:10.1080/00018732.2013.771509. PMC 3985726. PMID 24748680. 온라인.
- ^ a b Pebworth, Mark-Phillip; Cismas, Sabrina A.; Asuri, Prashanth (2014). "A novel 2.5D culture platform to investigate the role of stiffness gradients on adhesion-independent cell migration". PLOS ONE. 9 (10): e110453. Bibcode:2014PLoSO...9k0453P. doi:10.1371/journal.pone.0110453. ISSN 1932-6203. PMC 4195729. PMID 25310593.
- ^ Prieto, Daniel; Aparicio, Gonzalo; Sotelo-Silveira, Jose R. (19 June 2017). "Cell migration analysis: A low-cost laboratory experiment for cell and developmental biology courses using keratocytes from fish scales". Biochemistry and Molecular Biology Education. 45 (6): 475–482. doi:10.1002/bmb.21071. PMID 28627731.
- ^ Dormann, Dirk; Weijer, Cornelis J (2006-08-09). "Imaging of cell migration". The EMBO Journal. 25 (15): 3480–3493. doi:10.1038/sj.emboj.7601227. ISSN 0261-4189. PMC 1538568. PMID 16900100.
- ^ Shih, Wenting; Yamada, Soichiro (2011-12-22). "Live-cell Imaging of Migrating Cells Expressing Fluorescently-tagged Proteins in a Three-dimensional Matrix". Journal of Visualized Experiments (58). doi:10.3791/3589. ISSN 1940-087X. PMC 3369670. PMID 22215133.
- ^ "What is Cell Migration?". Cell Migration Gateway. Cell Migration Consortium. Archived from the original on 22 October 2014. Retrieved 24 March 2013.
- ^ Abercrombie, M; Heaysman, JE; Pegrum, SM (1970). "The locomotion of fibroblasts in culture III. Movements of particles on the dorsal surface of the leading lamella". Experimental Cell Research. 62 (2): 389–98. doi:10.1016/0014-4827(70)90570-7. PMID 5531377.
- ^ Willard, Stacey S; Devreotes, Peter N (2006-09-27). "Signaling pathways mediating chemotaxis in the social amoeba, Dictyostelium discoideum". European Journal of Cell Biology. 85 (9–10): 897–904. doi:10.1016/j.ejcb.2006.06.003. ISSN 0171-9335. PMID 16962888.
- ^ Wang, Y. L. (1985). "Exchange of actin subunits at the leading edge of living fibroblasts: possible role of treadmilling". The Journal of Cell Biology. 101 (2): 597–602. doi:10.1083/jcb.101.2.597. PMC 2113673. PMID 4040521.
- ^ Mitchison, T; Cramer, LP (1996). "Actin-Based Cell Motility and Cell Locomotion". Cell. 84 (3): 371–9. doi:10.1016/S0092-8674(00)81281-7. PMID 8608590. S2CID 982415.
- ^ Pollard, Thomas D; Borisy, Gary G (2003). "Cellular Motility Driven by Assembly and Disassembly of Actin Filaments". Cell. 112 (4): 453–65. doi:10.1016/S0092-8674(03)00120-X. PMID 12600310. S2CID 6887118.
- ^ Doherty, Gary J.; McMahon, Harvey T. (2008). "Mediation, Modulation, and Consequences of Membrane-Cytoskeleton Interactions". Annual Review of Biophysics. 37: 65–95. doi:10.1146/annurev.biophys.37.032807.125912. PMID 18573073.
- ^ Yang, Hailing; Ganguly, Anutosh; Cabral, Fernando (2010). "Inhibition of Cell Migration and Cell Division Correlates with Distinct Effects of Microtubule Inhibiting Drugs". The Journal of Biological Chemistry. 285 (42): 32242–50. doi:10.1074/jbc.M110.160820. PMC 2952225. PMID 20696757.
- ^ a b c Ganguly, A; Yang, H; Sharma, R; Patel, K; Cabral, F (2012). "The Role of Microtubules and Their Dynamics in Cell Migration". J Biol Chem. 287 (52): 43359–69. doi:10.1074/jbc.M112.423905. PMC 3527923. PMID 23135278.
- ^ Bretscher, M. S. (1983). "Distribution of receptors for transferrin and low density lipoprotein on the surface of giant HeLa cells". Proceedings of the National Academy of Sciences. 80 (2): 454–8. Bibcode:1983PNAS...80..454B. doi:10.1073/pnas.80.2.454. PMC 393396. PMID 6300844.
- ^ Hopkins, CR; Gibson, A; Shipman, M; Strickland, DK; Trowbridge, IS (1994). "In migrating fibroblasts, recycling receptors are concentrated in narrow tubules in the pericentriolar area, and then routed to the plasma membrane of the leading lamella". J Cell Biol. 125: 1265–74. PMID 7515888.
- ^ Bretscher, M (1996). "Getting Membrane Flow and the Cytoskeleton to Cooperate in Moving Cells". Cell. 87 (4): 601–6. doi:10.1016/S0092-8674(00)81380-X. PMID 8929529. S2CID 14776455.
- ^ Bretscher, MS (1992). "Circulating integrins: alpha5-beta1, alpha6-beta4 and Mac-1, but not alpha3-beta1, alpha4-beta1 or LFA-1". EMBO J. 11: 405–10. PMID 1531629.
- ^ Thompson, CR; Bretscher, MS (2002). "Cell polarity and locomotion, as well as endocytosis, depend on NSF". Development. 129: 4185–92. PMID 12183371.
- ^ Bretscher, MS; Clotworthy, M (2007). "Using single loxP sites to enhance homologous recombination: ts mutants in Sec1 of Dictyostelium discoideum". PLoS One. 2: e724. PMID 17684569.
- ^ Zanchi, R; Howard, G; Bretscher, MS; Kay, RR (2010). "The exocytic gene secA is required for Dictyostelium cell motility and osmoregulation". J Cell Biol. 123: 3226–34. PMID 20807800.
- ^ Aguado-Velasco, C; Bretscher, MS (1999). "Circulation of the Plasma Membrane in Dictyostelium". Mol Biol Cell. 10: 4419–27. PMID 10588667.
- ^ a b c O'Neill, Patrick; Castillo-Badillo, Jean; Meshik, Xenia; Kalyanaraman, Vani; Melgarejo, Krystal; Gautam, N (2018). "Membrane flow drives an adhesion-independent amoeboid cell migration mode". Developmental Cell. 46 (1): 9–22. doi:10.1016/j.devcel.2018.05.029. PMC 6048972. PMID 29937389.
- ^ Purcell, E. M. (1977). "Life at Low Reynolds Number". American Journal of Physics. 45 (3): 3–11. Bibcode:1977AmJPh..45....3P. doi:10.1119/1.10903. hdl:2433/226838.
- ^ Barry, N.P.; Bretscher, M.S. (2010). "Dictyostelium amoebae and neutrophils can swim". Proc Natl Acad Sci U S A. 107: 11376–80. PMID 20534502.
- ^ Bell, George R. R.; Collins, Sean R. (2018). ""Rho"ing a cellular boat with rearward membrane flow". Developmental Cell. 107 (1): 1–3. doi:10.1016/j.devcel.2018.06.008. PMID 29974859.
- ^ Tanaka, Masahito; Kikuchi, Takeomi; Uno, Hiroyuki; Okita, Keisuke; Kitanishi-Yumura, Toshiko; Yumura, Shigehiko (2017). "Turnover and flow of the cell membrane for cell migration". Scientific Reports. 7 (1): 12970. Bibcode:2017NatSR...712970T. doi:10.1038/s41598-017-13438-5. PMC 5636814. PMID 29021607.
- ^ Shellard, Adam; Szabo, Andras; Trepat, Xavier; Mayor, Roberto (2018). "Supracellular contraction at the rear of neural crest cell groups drives collective chemotaxis". Science. 362 (6412): 339–343. Bibcode:2018Sci...362..339S. doi:10.1126/science.aau3301. PMC 6218007. PMID 30337409.
- ^ a b c Coskun, Hasan; Coskun, Huseyin. (March 2011). "Cell physician: reading cell motion. A mathematical diagnostic technique through analysis of single cell motion". Bull Math Biol. 73 (3): 658–82. doi:10.1007/s11538-010-9580-x. PMID 20878250. S2CID 37036941.
- ^ Parent, C. A.; Devreotes, PN (1999). "A Cell's Sense of Direction". Science. 284 (5415): 765–70. Bibcode:1999Sci...284..765P. doi:10.1126/science.284.5415.765. PMID 10221901.
- ^ Ridley, A. J.; Schwartz, MA; Burridge, K; Firtel, RA; Ginsberg, MH; Borisy, G; Parsons, JT; Horwitz, AR (2003). "Cell Migration: Integrating Signals from Front to Back". Science. 302 (5651): 1704–9. Bibcode:2003Sci...302.1704R. doi:10.1126/science.1092053. PMID 14657486. S2CID 16029926.
- ^ Meyer, A.S.; Hughes-Alford, S.K.; Kay, J.E.; Castillo, A.; Wells, A.; Gertler, F.B.; Lauffenburger, D.A. (2012). "2D protrusion but not motility predicts growth factor–induced cancer cell migration in 3D collagen". J. Cell Biol. 197 (6): 721–729. doi:10.1083/jcb.201201003. PMC 3373410. PMID 22665521.
- ^ Coskun, Huseyin. (2006). Mathematical Models for Ameboid Cell Motility and Model Based Inverse Problems – via ProQuest.
- ^ Coskun, Huseyin; Li, Yi; Mackey, Mackey A. (Jan 2007). "Ameboid cell motility: a model and inverse problem, with an application to live cell imaging data". J Theor Biol. 244 (2): 169–79. doi:10.1016/j.jtbi.2006.07.025. PMID 16997326.
- ^ "Profiling Cells with Math". Mathematical Association of America.
- ^ "Mathematicians use cell 'profiling' to detect abnormalities – including cancer". ScienceDaily.