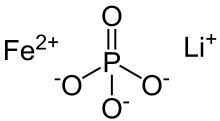
인산리튬철
Lithium iron phosphate | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 철(2+)인산리튬(1:1:1:1) | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.124.705 |
| EC 번호 |
|
PubChem CID | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| FeLiO 4P | |
| 몰 질량 | 157.757 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
인산리튬철(LFP)은 LiFe라는 공식의 무기화합물이다.PO
4. 물에 녹지 않는 회색, 적회색, 갈색 또는 검은색 고체입니다.이 소재는 리튬이온배터리의 일종인 리튬인산철 [1]배터리의 성분으로 주목을 받고 있습니다.이 배터리 화학은 전동 공구, 전기 자동차, 태양광 설비[2] 및 최근에는 대규모 그리드 규모의 에너지 [3]저장소에서 사용하는 것을 목표로 하고 있습니다.
가전제품에 사용되는 리튬전지(Li-ion)는 대부분 리튬코발트산화물(LiCoO
2), 리튬망간산화물(LiMnO
2
4), 리튬니켈산화물(LiNiO
2) 등 다른 리튬 화합물로 만든 캐소드를 사용한다.양극은 일반적으로 흑연으로 만들어진다.
인산리튬 철은 미네랄 트리필라이트의 형태로 자연적으로 존재하지만, 이 물질은 배터리에 사용하기에는 순도가 부족합니다.
LiMPO
4
LiMPO의
4 일반 화학식에서는 LiFe의 화합물PO
4 패밀리는 올리빈 구조를 채택했다.M은 Fe뿐만 아니라 Co, Mn, [4]Ti도 포함한다.최초의 상용
4 LiMPO가 C/LiFePO였기
4 때문에 LiMPO의
4 전체 그룹은 비공식적으로 "인산 리튬 철" 또는 "LiFePO
4"로 불린다.단, 배터리의 음극 재료로는 올리빈형 상을 둘 이상 사용할 수 있다.AMPO
y
4, LiMFePO
1−x
4, LiFe 등의 올리빈 화합물POM은
4−z LiMPO와
4 같은 결정 구조를 가지고 있어 음극으로 대체할 수 있습니다.모두 "LFP"라고 할 수 있습니다.
망간, 인산염, 철 및 리튬도 감람 구조를 형성한다.이 구조는 리튬 충전지의 [5]음극에 유용한 기여자입니다.이는 리튬이 망간, 철, 인산염과 결합할 때 발생하는 올리빈 구조 때문이다(위에서 설명한 바와 같이).리튬 충전 배터리의 올리빈 구조는 가격이 저렴하고 안정적이며 [6]에너지를 안전하게 저장하는 데 사용될 수 있기 때문입니다.
이력 및 제작
아루무감 맨티람과 존 B. Goodenough는 리튬 이온 [7][8][9]배터리용 음극 재료의 폴리아니온 클래스를 최초로 확인했습니다.LiFePO는
4 1996년 Padhi [10][11]등에 의해 배터리에 사용되는 폴리아니언 등급에 속하는 음극 물질로 식별되었다.LiFe에서 리튬의 가역 추출PO와
4 FePO에
4 리튬을 삽입하는 것이 시연되었다.중성자 회절은 LFP가 리튬 [12]배터리의 큰 입출력 전류의 보안을 보장할 수 있음을 확인했다.
이 재료는 다양한 철 및 리튬 염을 인산염 또는 인산염으로 가열하여 제조할 수 있습니다.열수 [13]합성을 사용하는 경로를 포함하여 많은 관련 경로가 설명되었습니다.
물리적 및 화학적 특성
LiFePO에서
4 리튬은 +1 전하, 철 +2 전하로 인산염의 -3 전하 균형을 잡습니다.Li를 제거하면 이 물질은 [14]FePO의 제철 형태로
4 변환됩니다.
철 원자와 6개의 산소 원자는 FeO로 묘사되는
6 팔면체 배위 구를 형성하며, Fe 이온은 중심에 있습니다.인산염기인 PO는
4 사면체이다.3차원 프레임워크는 O 모서리를 공유하는 FeO
6 8면체로 형성됩니다.리튬 이온은 8면체 채널 내에 지그재그로 존재한다.결정학에서 이 구조는 직교 결정계의 P공간군에mnb 속하는 것으로 생각된다.격자 상수는 a = 6.008Ω, b = 10.334Ω, c = 4.693Ω이다.단위 셀의 부피는 291.4Ω입니다3.
기존의 두 음극 재료인 LiMnO와
4 LiCoO와
2 달리, LiMPO의
4 리튬 이온은 격자의 1차원 자유 부피로 이동합니다.충전/방전 중에 리튬 이온은 Fe의 산화와 함께 추출됩니다.
LiFe에서 리튬 추출PO는
4 유사한 구조의 FePO를 생성합니다
4.FePO는
4 단위 세포 부피가 272.4Ω인3 P 공간 그룹을mnb 채택하여 석화된 전구체보다 약간 작다.리튬 이온의 추출은 산화리튬의 경우와 마찬가지로 격자 부피를 감소시킨다.LiMPO의
4 모서리 공유
6 FeO 8면체는 PO3−
4 사면체의 산소 원자에 의해 분리되며 연속 FeO
6 네트워크를 형성할 수 없어 전도성이 저하됩니다.
거의 촘촘히 채워진 산화물 중심 육각형 배열은 Li 이온이 내부로 이동할 수 있는+
자유 부피를 상대적으로 적게 제공합니다.이 때문에 주위온도에서는 Li의+
이온전도율이 상대적으로 낮다.FePO
4 석화와 LiFe 석화의 상세PO를
4 검토했습니다.석화물질의 2상이 관련되어 있다.[14][15]
적용들
LFP 셀은 동작전압 3.3V, 전하밀도 170mAh/g, 고출력 밀도, 긴 사이클 수명 및 고온에서의 안정성을 갖추고 있습니다.
LFP의 주요 상업적 장점은 과열과 폭발은 물론 긴 수명, 높은 전력 밀도 및 작동 온도 범위가 넓다는 것입니다.발전소와 자동차는 [16][17]LFP를 사용한다.
BAE는 하이브리드라이브 오리온7 하이브리드 버스가 약 180kW의 LFP 배터리 셀을 사용한다고 발표했다.AES는 예비 용량과 주파수 조정을 포함한 전력 네트워크의 보조 서비스를 제공할 수 있는 수조 와트의 배터리 시스템을 개발했습니다.중국에서는 BAK와 Tenzin Lishen이 이 지역에서 활동하고 있다.
비교
LFP는 동작전압(3.2볼트, Co계 음극화학은 3.7볼트)으로 기존 리튬전지보다 용량이 25% 적지만 니켈수소전지보다 70% 많다.
LFP 배터리와 다른 리튬 이온 배터리 유형의 주요 차이점은 LFP 배터리에 코발트가 포함되어 있지 않고(재료 소싱에 대한 윤리적 의문 제거) 방전 곡선이 평평하다는 것입니다.
LFP 배터리는 LFP의 전기적 절연 특성과 낮은 최대 충전/방전 전압으로 인해 단점이 있습니다.에너지 밀도는 LiCoO보다
2 상당히 낮습니다(니켈-금속 수소 배터리보다 높지만).
리튬 코발트 산화물 기반 배터리 화학 제품은 과다 충전 시 열 폭주 위험이 높고 코발트가 비싸고 지리적으로 널리 보급되지 않습니다.니켈 망간 코발트(NMC)와 같은 다른 화학 물질은 대부분의 응용 분야에서 LiCo 화학 세포를 대체했습니다.Ni 대 Mn 대 Co의 원래 비율은 3:3:3이었지만, 오늘날 세포는 8:1:1 또는 6:2:2의 비율로 만들어지고 있어 Co 함량이 대폭 감소하였다.
LiFePO4 배터리는 밀봉된 납산 배터리와 유사하며, 납산 용도의 드롭인 대체품으로 종종 홍보되고 있습니다.인산리튬 철과 납산의 가장 주목할 만한 차이점은 리튬 배터리 용량이 방전 속도와 무관하다는 사실이다.예를 들어 0.8C와 같이 매우 높은 방전 속도에서 납산 배터리의 용량은 정격 용량의 60%에 불과합니다.따라서 방전 속도가 종종 0.1C보다 큰 주기적 용도에서는 낮은 정격의 리튬 배터리가 동등한 납산 배터리보다 실제 용량이 더 높은 경우가 많습니다.즉, 동일한 용량 정격에서 리튬은 더 비싸지만, 더 낮은 용량의 리튬 배터리를 더 저렴한 가격에 동일한 용도로 사용할 수 있습니다.라이프 사이클을 고려할 때 소유 비용은 납산 [18]배터리에 비해 리튬 배터리의 가치를 더욱 높입니다.
지적 재산.
LFP 성분의 근원특허는 4개 기관이 보유하고 있다.텍사스-오스틴 대학에서 이 물질의 발견을 위해.Hydro-Qébec, University de Montréal 및 프랑스 국립과학연구센터(CNRS)는 전도성을 향상시키고 실제로 산업 발전에 적합한 [19]LFP를 만드는 탄소 코팅에 대해 설명합니다.이러한 특허는 성숙한 대량 생산 기술의 기초가 됩니다.최대 생산능력은 월 250톤이다.A123의 LiMFePO의
1−x
4 주요 특징은 나노-LFP로 물리적 특성을 수정하고 양극에 귀금속을 첨가하며 특수 흑연을 음극으로 사용하는 것입니다.
포스텍의 LiMPO의
4 주요 특징은 적절한 카본 코팅으로 캐패시턴스와 전도성을 높인다는 것입니다.LiFe의 특장점Ale의 PO • zM은 페라이트 및 결정 성장을 안정적으로 제어하여 얻을 수 있는 높은 캐패시턴스와 낮은 임피던스를 제공합니다
4.이러한 개선된 제어는 높은 과포화 상태에서 전구체에 강한 기계적 교반력을 가함으로써 실현되며, 이는 금속 산화물과 LFP의 결정화를 유도한다.
2005년과 2006년 미국에서의 특허 소송에서 텍사스 오스틴 오스틴 대학교 오스틴 대학교와 하이드로 퀘벡 대학교는 LiFe가 다음과 같이 주장했습니다.캐소드가
4 특허권을 침해해서US 5910382 및 US 6514640.특허 클레임은 배터리 음극 재료의 독특한 결정 구조와 화학식을 포함했습니다.
2006년 4월 7일, A123은 UT의 특허에 대한 비침해 및 무효 선언을 요구하는 소송을 제기했다.A123은 미국 특허상표청(USPTO)에 2건의 재심사절차를 별도로 제출하여 선행기술에 근거해 특허를 무효화하려고 했습니다.
UT는 비슷한 재판 절차에서 침해 혐의를 받고 있는 LFP 제품을 상품화한 Valence Technology, Inc.("발렌스")를 고소했다.
USPTO는 2008년 4월 15일 382 특허에 대한 재심사 증명서를, 2009년 5월 12일 640 특허에 대한 재심사 증명서를 발행하여 이들 특허의 주장을 수정하였습니다.이로써 Hydro-Quebec이 Valence와 A123을 상대로 제기한 현재의 특허 침해 소송을 진행할 수 있게 되었습니다.2011년 4월 27일 Markman의 심리 후 텍사스 서부지방법원은 재심사된 특허의 청구범위가 당초 허가된 것보다 좁다고 판결했다.
2008년 12월 9일, 유럽 특허청은 0904607이라는 번호로 구데노 박사의 특허를 취소했다.이 결정은 기본적으로 유럽 자동차 애플리케이션에서 LFP를 사용하는 특허 위험을 줄였습니다.그 결정은 [20]참신성의 결여에 근거하고 있는 것으로 생각된다.
최초의 대규모 합의는 NTT와 텍사스 오스틴 대학(UT)의 소송으로,[21] 2008년 10월에 NTT는 3000만달러에 대해 일본 최고 민사 재판소에서 합의한다고 발표했다.NTT의 특허는 올리빈 LFP에 관한 것으로, 현재 D사가 사용하고 있는 AMPO(A는 알칼리 금속, M은 Co와 Fe의 조합)의
y
4 일반 화학식이다.화학적으로는 거의 동일하지만
y
4 특허의 관점에서 NTT의 AMPO는 UT가 취급하는 소재와는 다르다.AMPO는
y
4 LiMPO보다
4 용량이 큽니다.사건의 핵심은 UT 연구소에서 이 자료를 개발한 NTT 엔지니어 오카다 시게토가 UT의 지적 재산을 훔쳤다는 혐의였다.
2020년 사업자 단체인 '북조선이다.PO+C은 주요 IP소유하게 되었고 자격증을 제공한다.존슨 Matthey, 국립 과학 기술 연구소, 몬트리올 대학교, 그리고 하이드로 퀘벡사 사이에 있는 컨소시엄이다.
조사.
전력 밀도
자유 선진당 2단점:이 둘은 그charge/discharge율 제한하는 낮은 전도성(과전압 고등)과 낮은 리튬 확산 상수, 가지고 있다.delithiated FePO4에서 지휘했을 때의 입자들을 추가하면 그것의 전자 전도도를 발생시킵니다.예를 들어, LiMPO4 가루에 흑연과 carbon[22]처럼 좋은 확산 기능이 포함을 수행하는 입자들을 크게 입자 사이에는, LiMPO4의 효율성을 증가시키고 가역 용량을 전도 이론적인 값의 95%를 향상시킨다.하지만, 전도성 첨가물이 추가 또한 에너지 저장하는데 기여하지 않는다에는 셀에서"질량 죽은"선물을 증가시킨다.LiMPO4charge/discharge 현재만큼 큰 섭씨 5도에서도 좋은 자전거 성능을 보여 준다.[23]
안정성.
주로 자유 선진당이 무기 산화물과 자유 선진당의 후원 구조가 더 안정적이고 전도율을 증가시킵니다.전통 LiCoO2 산화물 코팅 쇼에 자전거 성능이 향상된다.이 코팅 또한 LiCoO2 용량의 부식을 저해하고 회사 해산을 금하고 있다.마찬가지로, LiMPO4 ZnO[24]과 ZrO2,[25] 같은 무기로 코팅된 더 나은 사이클링 일생 동안, 더 큰 용량과 빠른 방전에 더 나은 특성을 가지고 있다.는 전도성 탄소의 추가 효율을 높인다.미쓰이 Zosen과 Aleees 구리와 은 증가된 효율과 같은 금속 입자를 진행해 그 추가 보도했다.[26]LiMPO4 금속 첨가물 1wt%로 돌이킬 수 있는 용량 높은 방전 미만에서 140mAh/g과 에너지 효율 현재 가지고 있다.
금속 치환
LiMPO4에 있는 철 또는 리튬을 다른 금속들 넣는 것 또한 효율성을 높일 수 있다.아연과 철은 이온 [27]반경이 비슷하기 때문에 철 대신 아연을 사용하면 LiMPO의
4 결정성이 높아집니다.순환 볼트메트리는 LiFeMPO가 금속 치환 후 리튬 이온 삽입 및 추출의 가역성이 높다는 것을 확인합니다
1−x
x
4.리튬 추출 중에 Fe(II)가 Fe(II)로 산화되어 격자 부피가 축소된다.부피가 줄어들면 리튬의 복귀 경로가 바뀝니다.
합성 프로세스
안정성과 품질을 갖춘 대량생산은 여전히 많은 과제에 직면해 있다.
리튬산화물과 마찬가지로 LiMPO는
4 고체합성, 유화건조, 솔겔공정, 용액공침착, 기상증착, 전기화학합성, 전자선조사, 마이크로파공정[vague], 수열합성, 초음파열분해 및 스프레이열분해 등의 다양한 방법으로 합성할 수 있다.
에멀전 건조공정에서는 우선 등유에 유화제를 혼합한다.다음으로 리튬염과 철염의 용액을 첨가한다.이 과정은 나노 탄소 [28]입자를 생성한다.열수 합성은 결정성이 좋은 LiMPO를 생성한다
4.폴리에틸렌 글리콜을 첨가한 후 [29]열가공하여 도전성 탄소를 얻는다.기상 증착은 박막 LiMPO를
4 [30]생성합니다.화염분무 열분해 시4 FePO에 탄산리튬 및 포도당을 혼합하여 전해질을 충전한다.그런 다음 혼합물을 화염 내부에 주입하고 합성 LiFe를 수집하기 위해 여과합니다.PO
4.[31]
온도의 영향
리튬인산철 배터리에 대한 온도의 영향은 고온과 저온의 영향으로 나눌 수 있습니다.
일반적으로 LFP 화학 배터리는 리튬 코발트 배터리와 같은 열폭주 반응에 덜 민감합니다. LFP 배터리는 온도가 높을 때 더 나은 성능을 발휘합니다.연구 결과, 실온(23°C)에서 초기 용량 손실은 약 40-50mAh/g인 것으로 나타났습니다.그러나 40°C와 60°C에서 용량 손실은 각각 약 25와 15mAh/g이지만, 이러한 용량 손실은 상온 용량 [32]손실의 경우처럼 벌크 손실 대신 20 사이클에 걸쳐 확산되었다.
단, 이는 짧은 사이클 시간 동안만 해당됩니다.이후 1년 동안 실시된 연구에 따르면 LFP 배터리의 전체 사이클이 2배 증가했음에도 불구하고 LFP 셀의 온도가 상승함에 따라 용량 운명률은 증가했지만, 상승하는 온도는 NCA 셀에 영향을 미치거나 NMC [33]셀의 에이징에 무시할 수 있는 영향을 미치지 않는 것으로 나타났다.이러한 용량 감소는 주로 온도가 상승함에 따라 고체 전해질 인터페이스(SEI) 형성 반응이 가속화되기 때문입니다.
LFP 배터리는 특히 온도 저하로 인해 높은 위도 영역에서의 사용이 방해될 수 있습니다.23, 0, -10 및 -20 °C 온도에서 LFP/C 샘플의 초기 방전 용량은 141.8, 92.7, 57.9 및 46.7 mAh/g이며 쿨롱 효율 91.2%, 74.5%, 63.6%, 61.3%입니다.이러한 손실은 전극 내에서 리튬 이온의 느린 확산과 낮은 온도에서 발생하는 SEI의 형성에 의해 설명되며, 이는 전해질-전극 인터페이스에서 [34]전하 전달 저항을 증가시킵니다.저용량 형성의 또 다른 가능한 원인은 리튬 도금입니다.이상과 같이 온도가 낮으면 전극 내의 리튬 이온 확산률이 낮아져 리튬 도금 속도가 인터칼레이션 속도와 경쟁할 수 있다.온도가 낮을수록 성장률이 높아지고 초기 지점이 낮은 충전 상태로 전환되므로 도금 프로세스가 [35]더 일찍 시작됩니다.리튬 도금은 리튬을 다 사용하므로 리튬이 흑연으로 전환되는 것과 경쟁하므로 배터리 용량이 줄어듭니다.집적된 리튬 이온은 분리기를 관통할 수 있는 "플레이트" 또는 덴드라이트의 형태로 전극 표면에 퇴적되어 배터리가 완전히 [36]단락됩니다.
「 」를 참조해 주세요.
레퍼런스
- ^ 박, OK, 조, Y, 리, S, 유, H.-C, 송, H.K., 조, J. "올리빈과 스피넬 중 누가 전기차를 운전할 것인가?" 에너지 환경.Sci. 2011, 제4권, 1621-1633페이지.doi:10.1039/c0ee00559b
- ^ Ozawa, Ryan (7 July 2015). "New Energy Storage Startup to Take Hawaii Homes Off-Grid". Hawaii Blog. Retrieved 2015-07-09.
- ^ "Google Looks to Batteries as Replacement for Diesel Generators". 16 December 2020.
- ^ Fedotov, Stanislav S.; Luchinin, Nikita D.; Aksyonov, Dmitry A.; Morozov, Anatoly V.; Ryazantsev, Sergey V.; Gaboardi, Mattia; Plaisier, Jasper R.; Stevenson, Keith J.; Abakumov, Artem M.; Antipov, Evgeny V. (2020-03-20). "Titanium-based potassium-ion battery positive electrode with extraordinarily high redox potential". Nature Communications. 11 (1): 1484. Bibcode:2020NatCo..11.1484F. doi:10.1038/s41467-020-15244-6. ISSN 2041-1723. PMC 7083823. PMID 32198379.
LiTiPO4F
- ^ Kim, Jongsoon (2012). "Thermal Stability of Fe-Mn Binary Olivine Cathodes for Li Rechargeable Batteries". Journal of Materials Chemistry. The Royal Society of Chemistry. 22 (24): 11964. doi:10.1039/C2JM30733B. Retrieved 19 Oct 2012.
- ^ Wang, J.; Sun, X. "Olivine Lifepo4:향후의 에너지 스토리지의 나머지 과제」, 에너지 환경.Sci. 2015, 제8권, 1110-1138페이지.doi:10.1039/C4E04016C
- ^ Masquelier, Christian; Croguennec, Laurence (2013). "Polyanionic (Phosphates, Silicates, Sulfates) Frameworks as Electrode Materials for Rechargeable Li (or Na) Batteries". Chemical Reviews. 113 (8): 6552–6591. doi:10.1021/cr3001862. PMID 23742145.
- ^ Manthiram, A.; Goodenough, J. B. (1989). "Lithium insertion into Fe2(SO4)3 frameworks". Journal of Power Sources. 26 (3–4): 403–408. Bibcode:1989JPS....26..403M. doi:10.1016/0378-7753(89)80153-3.
- ^ Manthiram, A.; Goodenough, J. B. (1987). "Lithium insertion into Fe2(MO4)3 frameworks: Comparison of M = W with M = Mo". Journal of Solid State Chemistry. 71 (2): 349–360. Bibcode:1987JSSCh..71..349M. doi:10.1016/0022-4596(87)90242-8.
- ^ "LiFePO
4: 충전용 새로운 음극 재료", A.K.Padhi, K.S.난준다스와미, J.B.Goodenough, 전기화학회 회의 요약, 1996년 5월 1일, 페이지 73 - ^ "리튬 배터리 충전용 양극 물질로서의 포스포 올리빈" A. K. Padhi, K. S. Nanjundaswamy, J. B. Goodenough, J. Electrochem.Soc., 제144권, 제4호, 1188-1194페이지(1997년 4월)
- ^ Nature Materials, 2008, 7, 707-711.
- ^ Jugović, Dragana; Uskoković, Dragan (2009-05-15). "A review of recent developments in the synthesis procedures of lithium iron phosphate powders". Journal of Power Sources. 190 (2): 538–544. Bibcode:2009JPS...190..538J. doi:10.1016/j.jpowsour.2009.01.074. ISSN 0378-7753. Retrieved 2017-11-21.
- ^ a b Love, Corey T.; Korovina, Anna; Patridge, Christopher J.; Swider-Lyons; Karen E.; Twigg, Mark E.; Ramaker, David E. (2013). "Review of LiFePO
4 phase transition mechanisms and new observations from X-ray absorption spectroscopy". Journal of the Electrochemical Society. 160 (5): A3153–A3161. doi:10.1149/2.023305jes. - ^ Malik, R.; A.; Ceder, G., "LiFe의 Li 삽입 메커니즘에 대한 비판적 검토"PO
4 전극", J. 전기화학.Soc. 2013, 제160권, A3179-A3197페이지.doi:10.1149/2.029305jes - ^ 올리빈 구조(LiFePO4) 음극 소재 충전식 리튬 이온 배터리 - Kumar 등, 2015년 11월 15일, 2020년 4월 1일 회수
- ^ Warren, Chris (March 12, 2016). "What You Need To Know About LiFePO4 Batteries".
- ^ "Lead Acid Vs LiFePO4 Batteries". Power Sonic - Trusted Battery Solutions. 25 February 2020.
- ^ Basel, Clariant Ltd. "Especialidades químicas da Clariant". Clariant Ltd.
- ^ "EPO Revokes Univ. Of Texas European Patent on Lithium Metal Phosphates; Boon for Valence".
- ^ "NTT Settles Lawsuit over Li-ion Battery Patents".
- ^ Deb, Aniruddha; Bergmann, Uwe; Cairns, Elton J.; Cramer, Stephen P. (June 2004). "Structural Investigations of LiFePO 4 Electrodes by Fe X-ray Absorption Spectroscopy". The Journal of Physical Chemistry B. 108 (22): 7046–7051. doi:10.1021/jp036361t.
- ^ Haas, O.; Deb, A.; Cairns, E. J.; Wokaun, A. (2005). "Synchrotron X-Ray Absorption Study of LiFePO[sub 4] Electrodes". Journal of the Electrochemical Society. 152 (1): A191. doi:10.1149/1.1833316.
- ^ Kwon, Sang Jun; Kim, Cheol Woo; Jeong, Woon Tae; Lee, Kyung Sub (October 2004). "Synthesis and electrochemical properties of olivine LiFePO4 as a cathode material prepared by mechanical alloying". Journal of Power Sources. 137 (1): 93–99. Bibcode:2004JPS...137...93K. doi:10.1016/j.jpowsour.2004.05.048.
- ^ Dominko, R.; Bele, M.; Gaberscek, M.; Remskar, M.; Hanzel, D.; Goupil, J.M.; Pejovnik, S.; Jamnik, J. (February 2006). "Porous olivine composites synthesized by sol–gel technique". Journal of Power Sources. 153 (2): 274–280. Bibcode:2006JPS...153..274D. doi:10.1016/j.jpowsour.2005.05.033.
- ^ León, B.; Vicente, C. Pérez; Tirado, J. L.; Biensan, Ph.; Tessier, C. (2008). "Optimized Chemical Stability and Electrochemical Performance of LiFePO[sub 4] Composite Materials Obtained by ZnO Coating". Journal of the Electrochemical Society. 155 (3): A211–A216. doi:10.1149/1.2828039.
- ^ Liu, H.; Wang, G.X.; Wexler, D.; Wang, J.Z.; Liu, H.K. (January 2008). "Electrochemical performance of LiFePO4 cathode material coated with ZrO2 nanolayer". Electrochemistry Communications. 10 (1): 165–169. doi:10.1016/j.elecom.2007.11.016.
- ^ Croce, F.; D' Epifanio, A.; Hassoun, J.; Deptula, A.; Olczac, T.; Scrosati, B. (2002). "A Novel Concept for the Synthesis of an Improved LiFePO[sub 4] Lithium Battery Cathode". Electrochemical and Solid-State Letters. 5 (3): A47–A50. doi:10.1149/1.1449302.
- ^ Ni, J.F.; Zhou, H.H.; Chen, J.T.; Zhang, X.X. (August 2005). "LiFePO4 doped with ions prepared by co-precipitation method". Materials Letters. 59 (18): 2361–2365. doi:10.1016/j.matlet.2005.02.080.
- ^ Cho, Tae-Hyung; Chung, Hoon-Taek (June 2004). "Synthesis of olivine-type LiFePO4 by emulsion-drying method". Journal of Power Sources. 133 (2): 272–276. Bibcode:2004JPS...133..272C. doi:10.1016/j.jpowsour.2004.02.015.
- ^ Hamid, N.A.; Wennig, S.; Hardt, S.; Heinzel, A.; Schulz, C.; Wiggers, H. (October 2012). "High-capacity cathodes for lithium-ion batteries from nanostructured LiFePO4 synthesized by highly-flexible and scalable flame spray pyrolysis". Journal of Power Sources. 216: 76–83. Bibcode:2012JPS...216...76H. doi:10.1016/j.jpowsour.2012.05.047.
- ^ Andersson, Anna S; Thomas, John O; Kalska, Beata; Häggström, Lennart (2000). "Thermal Stability of LiFePO4 -Based Cathodes". Electrochemical and Solid-State Letters. 3: 66–68. doi:10.1149/1.1390960. Retrieved 2021-11-18.
- ^ Preger, Yulia; Barkholtz, Heather M.; Fresquez, Armado; Campbell, Danel L.; Juba, Benjamin W. (2020). "Degradation of Commercial Lithium-Ion Cells as a Function of Chemistry and Cycling Conditions". Journal of the Electrochemical Society. 167 (12): 120532. Bibcode:2020JElS..167l0532P. doi:10.1149/1945-7111/abae37. S2CID 225506214. Retrieved 2021-11-18.
- ^ Rui, X.H.; Jin, Y.; Feng, X.Y.; Zhang, L.C.; Chen, C.H. (February 2011). "A comparative study on the low-temperature performance of LiFePO4/C and Li3V2(PO4)3/C cathodes for lithium-ion batteries". Journal of Power Sources. 196 (4): 2109–2114. doi:10.1016/j.jpowsour.2010.10.063. ISSN 0378-7753. Retrieved 2021-11-18.
- ^ Petzl, Mathias; Danzer, Michael A. (May 2014). "Nondestructive detection, characterization, and quantification of lithium plating in commercial lithium-ion batteries". Journal of Power Sources. 254: 80–87. Bibcode:2014JPS...254...80P. doi:10.1016/j.jpowsour.2013.12.060. ISSN 0378-7753. Retrieved 2021-11-18.
- ^ Liu, Huaqiang; Wei, Zhongbao; He, Weidong; Zhao, Jiyun (October 2017). "Thermal issues about Li-ion batteries and recent progress in battery thermal management systems: A review". Energy Conversion and Management. 150: 304–330. doi:10.1016/j.enconman.2017.08.016. ISSN 0196-8904. Retrieved 2021-11-18.


