인포글루코무타제
Phosphoglucomutase| 인포글루코무타제 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 5.4.2.2 | ||||||||
| CAS 번호. | 9001-81-4 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 입력 | ||||||||
| 엑스퍼시 | 나이스자이메 뷰 | ||||||||
| 케그 | KEG 입력 | ||||||||
| 메타사이크 | 대사통로 | ||||||||
| 프리암 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
인광글루코무타제(Phosphoglucomutase, EC 5.4.2.2)는 α-D-글루코스 모노머에 있는 인산염 그룹을 전방 방향의 1에서 6까지 또는 역방향의 6에서 1까지 전달하는 효소다.
보다 정확히 말하면 포도당 1인산염과 포도당 6인산염의 상호 변환을 용이하게 한다.
생물학적 함수
당분해에서 역할
글리코겐 인산염화효소가 글리코겐 폴리머에서 글루코실 잔류물의 인산염 분열을 촉매한 후, 자유 포도당은 1-탄소 위에 인산염 그룹을 가진다.이 포도당 1-인산염 분자는 그 자체가 유용한 대사 매개체가 아니지만, 인산염 1-인산염을 포도당 6-인산염으로 변환하는 촉매제가 된다(이 반응의 메커니즘은 아래 참조).
포도당 6인산염의 대사 운명은 그것이 생성되는 시점의 세포의 필요에 따라 달라진다.만약 세포에 에너지가 부족하면 포도당 6인산염은 글리코플릭 경로를 따라 이동하게 되고 결국 아데노신 3인산염의 두 분자가 생성된다.세포에 생합성 매개체가 필요한 경우 포도당 6인산염은 펜토오스 인산염 경로로 들어가 세포 조건에 따라 늑골 및/또는 NADPH를 생성하는 일련의 반응을 겪게 된다.
만약 글리코겐화합이 간에서 일어나고 있다면, 포도당 6-인산염은 효소 포도당 6-인산염에 의해 포도당으로 전환될 수 있다; 그리고 나서 간에서 생산되는 포도당은 다른 장기에 사용하기 위해 혈류로 방출된다.이와는 대조적으로 근육세포는 포도당 6-인산효소가 없기 때문에 나머지 신체와 글리코겐 저장소를 공유할 수 없다.
글리코제네시스에서의 역할
인광글루코무타아제는 혈당 수치가 높을 때 이와 반대로 작용하기도 한다.이 경우 인광글루코무타제는 포도당 6-인산염(헥소키나아제의 작용에 의해 포도당으로부터 쉽게 생성되는 것)의 포도당 1-인산염으로의 변환을 촉진한다.
이 포도당-1-인산염은 UDP-글루코스-피로인산염에 의해 촉매된 반응으로 UDP-글루코스를 생성하기 위해 UTP와 반응할 수 있다.인슐린에 의해 활성화되면 글리코겐 신타아제는 UDP-글루코오스 콤플렉스에서 글루코겐 폴리머에 포도당을 클리핑한다.
반응 메커니즘
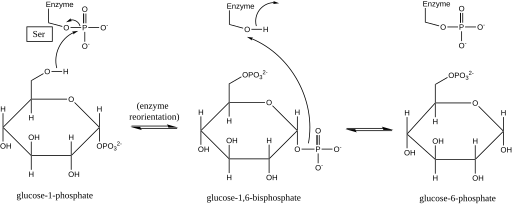
인광글루코무타제는 인광 그룹을 기질과 교환함으로써 인광 그룹 이동에 영향을 미친다.[1]동위원소 라벨링 실험은 이 반응이 포도당 1,6-비스인산 중간을 통해 진행되는 것을 확인했다.[2]
전방반응의 첫 번째 단계는 효소에서 포도당 1인산염으로 인산염 그룹이 전달되어 포도당 1,6-비스인산염을 형성하고 효소의 탈인산 형태를 남기는 것이다.[2]그 후 효소는 비스포스포산산 중간 중간의 1-인산염을 탈인산화 효소에 적절하게 위치시키기 위해 급속한 확산 재방향을 겪는다.[3]기질-광속 관계와 유도전달시험 결과, 탈인산화 효소는 포도당-1,6-비스인산염 중간에서 효소로 인산염 그룹의 전달을 촉진하여 인산염화인산인산화효소를 재생하고 포도당 6-인산염(앞쪽 방향으로)을 산출한다는 것이 밝혀졌다.[4][5]이후 구조 연구에서는 효소의 단일 부위가 인산염과 탈인산화가 되는 것이 활성 부위 세린 잔류물의 산소임을 확인했다(아래 도표 참조).[6][7]일반적으로 마그네슘 또는 카드뮴인 이발성 금속 이온은 효소 활성을 위해 필요하며 활성 사이트 세린에 에스테르화된 인광 그룹과 직접적으로 복잡하다는 것이 입증되었다.[8]
이러한 포도당 1,6-비스인산 중간 형성은 인산염 무타아제에 의해 촉매된 2-인산염과 3-인산염의 상호 변환과 유사하며, 이 중 2,3-비스인산염은 중간으로 생성된다.[9]
구조
토끼 근육인포글루코무타아제는 이 효소 구조의 상당부분 용해화의 원형 역할을 해왔으나, 새로운 박테리아에서 유래한 결정 구조는 많은 동일한 정의 특성을 보인다.[10]각 인광글루코무타제 단층체는 효소의 기본 공간 구성을 바탕으로 I-IV라는 네 개의 시퀀스 영역으로 나눌 수 있다(오른쪽 이미지 참조).[11]
각 모노머는 각각 4개의 구별되는 α/β 구조 단위로 구성되며, 각 모노머의 β-시트 내 4개의 가닥 중 하나를 포함하고 주어진 시퀀스 영역의 잔류물로만 구성된다(오른쪽 이미지 참조).[11]효소의 소수성 내부에 활성 부위(Ser-116, 인산화 및 탈인산화 효소의 임계 잔류물 포함)를 매립하면 기질이 활성 부지에 접근할 수 있도록 하면서 역생산적으로 임계 인광체 결합에서 물을 배제하는 역할을 한다.[12]
질병 관련성
인간의 근육에는 거의 동일한 촉매 성질을 가진 두 개의 인광글루코무타제인 PGM I과 PGM II가 포함되어 있다.[13] 이러한 형태들 중 하나 또는 다른 하나가 일부 인간에게는 선천적으로 누락되어 있다.[14]
PGM결핍은 매우 희귀한 질환으로, 일련의 잘 특징지어지는 생리적인 증상을 가지고 있지 않다.이 조건은 혐기성 글리콜리시스 시험관내 연구에서 검출할 수 있는데, 이는 포도당 1-인산염 후 젖산 생성 경로의 블록을 포도당 6-인산염 이전에 밝힌다.[15]
PGM1 결핍은 CDG 신드롬 타입 1t(CDG1T, 이전에는 글리코겐 저장 질병 타입 14(GSD XIV)로 알려져 있다.[16]
유전자
참고 항목
참조
- ^ Jagannathan V, Luck JM (June 1949). "Phosphoglucomutase: II Mechanism of Action". The Journal of Biological Chemistry. 179 (2): 569–75. doi:10.1016/S0021-9258(19)51252-2. PMID 18149991.
- ^ a b Najjar VA, Pullman ME (May 1954). "The Occurrence of a Group Transfer Involving Enzyme (phosphoglucomutase) and Substrate". Science. 119 (3097): 631–634. Bibcode:1954Sci...119..631N. doi:10.1126/science.119.3097.631. PMID 13156640.
- ^ Ray Jr WJ, Peck EJ (1972). "Phosphomutases". In Boyer PD (ed.). The Enzymes. Vol. 6 (3rd ed.). New York: Academic Press. pp. 407–477. doi:10.1016/S1874-6047(08)60047-5. ISBN 978-0-12-122706-7.
- ^ Ray WJ, Roscelli GA (April 1964). "A Kinetic Study of the Phosphoglucomutase Pathway". The Journal of Biological Chemistry. 239 (4): 1228–36. doi:10.1016/S0021-9258(18)91416-X. PMID 14165931.
- ^ Britton HG, Clarke JB (November 1968). "The mechanism of the phosphoglucomutase reaction. Studies on rabbit muscle phosphoglucomutase with flux techniques". The Biochemical Journal. 110 (2): 161–80. doi:10.1042/bj1100161. PMC 1187194. PMID 5726186.
- ^ Ray WJ, Mildvan AS, Grutzner JB (December 1977). "Phosphorus nuclear magnetic resonance studies of phosphoglucomutase and its metal ion complexes". Archives of Biochemistry and Biophysics. 184 (2): 453–63. doi:10.1016/0003-9861(77)90455-6. PMID 23074.
- ^ Ray WJ, Hermodson MA, Puvathingal JM, Mahoney WC (August 1983). "The complete amino acid sequence of rabbit muscle phosphoglucomutase". The Journal of Biological Chemistry. 258 (15): 9166–74. doi:10.1016/S0021-9258(17)44646-1. PMID 6223925.
- ^ Rhyu GI, Ray WJ, Markley JL (January 1984). "Enzyme-bound intermediates in the conversion of glucose 1-phosphate to glucose 6-phosphate by phosphoglucomutase. Phosphorus NMR studies". Biochemistry. 23 (2): 252–60. doi:10.1021/bi00297a013. PMID 6230103.
- ^ Sutherland EW, Cohn M (October 1949). "The mechanism of the phosphoglucomutase reaction". The Journal of Biological Chemistry. 180 (3): 1285–95. doi:10.1016/S0021-9258(19)51242-X. PMID 18148026.
- ^ Mehra-Chaudhary R, Mick J, Tanner JJ, Henzl MT, Beamer LJ (April 2011). "Crystal structure of a bacterial phosphoglucomutase, an enzyme involved in the virulence of multiple human pathogens". Proteins. 79 (4): 1215–29. doi:10.1002/prot.22957. PMC 3066478. PMID 21246636.
- ^ a b Dai JB, Liu Y, Ray WJ, Konno M (March 1992). "The crystal structure of muscle phosphoglucomutase refined at 2.7-angstrom resolution". The Journal of Biological Chemistry. 267 (9): 6322–37. doi:10.1016/S0021-9258(18)42699-3. PMID 1532581.
- ^ Ray WJ, Puvathingal JM, Liu YW (July 1991). "Formation of substrate and transition-state analogue complexes in crystals of phosphoglucomutase after removing the crystallization salt". Biochemistry. 30 (28): 6875–85. doi:10.1021/bi00242a011. PMID 1829964.
- ^ Joshi JG, Handler P (June 1969). "Phosphoglucomutase. VI. Purification and properties of phosphoglucomutases from human muscle". The Journal of Biological Chemistry. 244 (12): 3343–51. doi:10.1016/S0021-9258(18)93132-7. PMID 4978319.
- ^ Brown DH (1986). "Glycogen metabolism and glycolysis in muscle". Myology: Basic and Clinical. New York: McGraw-Hill. pp. 673–95. ISBN 978-0-07-079570-9.
- ^ Sugie H, Kobayashi J, Sugie Y, Ichimura M, Miyamoto R, Ito T, et al. (April 1988). "Infantile muscle glycogen storage disease: phosphoglucomutase deficiency with decreased muscle and serum carnitine levels". Neurology. 38 (4): 602–5. doi:10.1212/WNL.38.4.602. PMID 2965317. S2CID 11491932.
- ^ "Orphanet: Glycogen storage disease due to phosphoglucomutase deficiency". www.orpha.net. Retrieved May 13, 2021.
{{cite web}}: CS1 maint : url-status (링크)