갈륨 스캔
Gallium scan| 갈륨-67 스캔 | |
|---|---|
| 동의어 | 갈륨 이미징 |
| ICD-10-PCS | C?1?LZZ(평면) C?2?LZZ(단층) |
| ICD-9-CM | 92.18 |
| OPS-301 코드 | 3-70c |
| 메드라인플러스 | 003450 |
갈륨스캔은 갈륨-67(67Ga) 또는 갈륨-68(68Ga) 방사선의약품 중 하나를 사용하여 특정 유형의 조직, 즉 조직의 질병 상태의 이미지를 얻는 일종의 핵의학 시험이다. 갈륨 구연산 갈륨과 질산 갈륨과 같은 갈륨 염을 사용할 수 있다. 소금은 자유롭게 용해된 갈륨 이온 가가3+ 활성이기 때문에 소금의 형태는 중요하지 않다.[1] 가염과 가염 모두 흡수가 비슷한 메커니즘을 가지고 있다.[2] 갈륨은 다른 형태로도 사용될 수 있다. 예를 들어, Ga-PSMA는 암 영상촬영에 사용된다. 갈륨-67의 감마 방출은 감마 카메라로, 갈륨-68의 양전자 방출은 양전자 방출 단층촬영(PET)으로 이미징된다.
갈륨염은 종양, 염증, 급성 및 만성 감염 모두에 의해 흡수되어 이러한 병리학적 과정을 이미징할 수 있다.[3][4] 갈륨은 특히 척추를 수반하는 골수염의 영상화와 원인 불명의 발열의 원인이 될 수 있는 오래되고 만성적인 감염의 영상화에 유용하다.[5][6]
갈륨-68 DOTA 스캔은 옥트레오티드 스캔(옥트레오티드를 소마토스타틴 수용체 리간드로 사용한 인듐-111 스캔의 일종)을 대체하는 경우가 늘고 있다. 갈륨-68은 DOTATOC와 같은 옥트레오티드 파생 화학물질과 결합되며, 갈륨이 방출하는 양전자는 PET-CT 스캔에 의해 이미징된다. 그러한 스캔들은 신경내분비 종양과 췌장암을 찾는데 유용하다.[7][8]
갈륨 구연산염 스캔
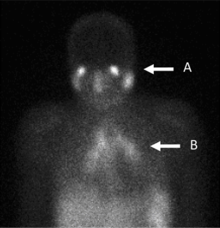
과거에는 갈륨 스캔이 임파종 스테이징의 금본위제였는데, FDG(Flueloxyglucose)를 이용한 양전자 방출 단층촬영(PET)으로 대체되기 전까지는 갈륨 스캔이 림프종 스테이징의 금본위제였다.[9][10] 갈륨 영상촬영은 여전히 염증과 만성 감염을 영상화하는 데 사용되며, 많은 종류의 암세포가 정상조직보다 많은 양을 차지하기 때문에 여전히 의심받지 않는 종양을 발견하기도 한다. 따라서 갈륨-67 섭취의 증가는 새로운 또는 오래된 감염, 어떤 원인에 의한 염증 집중 또는 암 종양을 나타낼 수 있다.
갈륨 이미징은 인듐 백혈구 이미징과 테크네튬 항산화란울로세포 항체가 감염의 검출 메커니즘으로 대체하면서 구식 기법이 될 수 있다는 주장이 제기됐다. 종양, 특히 림프종의 검출에 대해서는 갈륨 이미징이 여전히 사용되고 있지만, 향후에는 fluoxyglucose PET 이미징으로 대체될 수도 있다.[11]
감염에서 갈륨 스캔은 척추 골수염(뼈감염) 영상, 폐감염, 염증, 만성감염 등에서 인듐백혈구 촬영에 비해 유리하다. 부분적으로 이것은 갈륨이 중성미자 죽음 이후에도 중성미자 막에 결합되기 때문이다. 인듐 백혈구 영상촬영은 급성 감염증(중립세포가 여전히 빠르고 활발하게 감염에 국소화되는 곳)과 척추와 관련이 없는 골수염, 복부 및 골반 감염에 더 좋다. 갈륨 스캔과 인듐 백혈구 영상 모두 출처를 알 수 없는 발열(설명 없는 발열 온도)을 영상화하는 데 사용할 수 있다. 그러나 인듐 백혈구 스캔은 급성 감염에 의해 야기되는 그러한 사례의 25%만을 촬영할 것이며 갈륨은 만성 감염과 종양과 같은 다른 발열원들에도 국소화될 것이다.[12][13]
메커니즘
신체는 일반적으로 가를3+ 철분(Fe-III)인 것처럼 취급하며, 따라서 자유 동위원소 이온은 감염 부위 등 염증 부위와 급속 세포 분열 부위에서 결합(그리고 집중)된다.[14] 갈륨(III) (Ga3+)은 중성미자의 전이린, 백혈구 락토페린, 박테리아 사이데로포레스, 염증성 단백질, 세포-메모체에 결합하며, 살아있거나 죽는다.[15]
락토페린은 백혈구 내에 포함되어 있다. 갈륨은 락토페린과 결합하여 염증 부위로 운반되거나, 감염 부위에서 세균성 파괴증 동안 분비되는 락토페린에 결합될 수 있다(그리고 대식세포 수용체와의 결합으로 인해 남아 있다).[16] 갈륨-67은 박테리아 자체의 시데로포레 분자에도 부착되며, 이러한 이유로 세균 감염이 있는 백혈구 환자에게도 사용될 수 있다(여기서는 박테리아 단백질에 직접 부착되며, 백혈구는 필요하지 않다).[17] 흡수력은 전달 수용체, 혐기성 종양 대사, 종양 관류 및 혈관 투과성을 포함한 종양 성질과 관련이 있는 것으로 생각된다.[18][19]
공통 적응증
- 원인 불명의 열이 있는 환자의 발열원을 국소화하기 위한 전신 조사.[20]
- 특히 면역 촉진 환자에서 폐 및 일반 염증/감염의 검출.[21]
- 사코이드증이나 결핵과 같은 활성 림프구 또는 과립성 염증 작용의 평가 및 추적.[22]
- 라벨이 부착된 백혈구보다 갈륨-67이 선호되는 척추 골수염 및/또는 디스크 공간 감염 진단
- 복막섬유화증 진단 및 사후관리
- 약물로 인한 폐독성 평가 및 추적(예: Bloomycin, Amiodarone)
- WBC 스캔 대상자가 아닌 환자 평가(WBC는 6000명 미만)
이러한 모든 상태는 갈륨-68을 사용하는 PET 스캔에서도 볼 수 있다는 점에 유의하십시오.
테크닉
메인(67Ga) 기법은 섬광을 이용해 2차원 영상을 제작한다. 추적기가 주입된 후, 영상은 일반적으로 감마 카메라가 24시간, 48시간, 경우에 따라 72시간, 96시간 후에 촬영한다.[23][24] 각 이미지 세트는 이미징되는 영역의 크기에 따라 30~60분이 소요된다. 염증이 있거나 급속한 세포분열이 일어나고 있기 때문에 결과 이미지는 많은 양의 추적기를 모은 밝은 영역을 가질 것이다. 단일 사진 방출 컴퓨터 단층 촬영(SPECT) 영상도 획득할 수 있다. 일부 영상 센터에서 SPECT 영상은 갈륨 스캔의 생리학적 영상 정보와 CT 스캔의 해부학적 정보를 겹치기 위해 퓨전 소프트웨어 또는 SPECT/CT 하이브리드 카메라를 사용하여 컴퓨터 단층 촬영(CT) 스캔과 결합할 수 있다.
일반적인 주사 선량은 약 150메가크렐이다.[25] 이 때 높은 배경은 잘못된 부정적인 결과를 낳기 때문에 영상촬영은 보통 24시간보다 빨라서는 안 된다. 48시간의 전신 영상이 적당하다. 장에 혼동이 있을 경우 주입 후 1주일 이상이라도 지연된 영상을 얻을 수 있다. SPECT는 필요에 따라 수행할 수 있다. 구강 이완제나 관장은 영상촬영 전에 투여해 장 활동을 줄이고 대장에 대한 투여량을 줄일 수 있지만 장 준비의 유용성은 논란이 되고 있다.[24]
갈륨-67 복용량의 10%~25%는 주사 후 24시간 이내에 배설된다(대부분은 신장을 통해 배설된다). 24시간 후에 주된 배설 통로는 대장이다.[24] 표적기관(평균 스캔에서 방사선량이 가장 많은 기관)은 대장(대장)이다.[23]
정상 스캔에서 갈륨의 흡수는 양성소견을 나타내지 않는 광범위한 위치에서 관찰된다. 이것들은 전형적으로 연조직, 간, 뼈를 포함한다. 국소화의 다른 부위는 비인두선 및 열상선, 유방(특히 젖먹이 또는 임신 중), 일반적으로 상처, 신장, 방광 및 대장일 수 있다.[26]
갈륨 PSMA 스캔
양성자 방출 동위원소 Ga는 전립선암 세포에 존재하는 단백질인 전립선 특이 막 항원(PSMA)을 표적으로 삼는데 사용할 수 있다. 이 기술은 MRI나 CT 스캔에 비해 전이성 질환의 검출이 개선되는 것으로 나타났다.[27]
2020년 12월 미국 식품의약국(FDA)은 가 PSMA-11의 미국 내 의료용 사용을 승인했다.[28][29] 전립선암에 걸린 남성의 전립선특정막항원(PSMA) 양성병변 양전자방출단층촬영(PET)에 표시된다.[30][29] UCLA 바이오메디컬 사이클로트론 시설에서 제조한다.[29] FDA는 전립선암에 걸린 남성 참가자의 두 가지 임상시험(Trial 1/NCT02919111과 동일한 임상시험 1/NCT00336847, Trial 2/NCT02940262)의 증거를 바탕으로 Ga PSMA-11을 승인했다.[29] 일부 참가자들은 최근 전립선암 진단을 받았다.[29] 다른 참가자들은 이전에도 치료를 받았으나 전립선 특이 항원이나 PSA가 증가해 암이 퍼지고 있다는 의혹이 있었다.[29] 이 실험은 미국의 두 곳에서 실시되었다.[29]
FDA는 Ga PSMA-11을 1급 의약품으로 간주하고 있다.[31]
공통 적응증
갈륨 PSMA 스캐닝은 특히 PSA 값이 낮은 전립선암의 생화학적 재발 사례와 전이 가능성이 높다고 판단되는 고위험성 질환 환자에게 주로 권장된다.[32][33]
테크닉
체중의 킬로그램 당 1.8–2.2 메가바이트의 Ga PSMA-11을 정맥주사로 투여하는 것이 권장된다. 영상촬영은 시술 후 약 60분 후에 중간에서 두개골 밑부분까지 획득해야 한다.[32][34]
갈륨 DOTA 스캔
68Ga DOTA 결합 펩타이드(Ga DOTA-TATATE, DOTA-TOC, DOTA-NOC 포함)는 NET(신경내분비 종양)의 양전자 방출 단층 촬영에 사용된다. 스캔은 옥트레오티드 기반의 소마토스타틴 아날로그(에도트레오타이드 등)를 방사선으로 사용한다는 점에서 SPECT 옥트레오타이드 스캔과 유사하며, 오크레오타이드 스캔과 유사한 적응증 및 용도가 있으나 영상 화질이 크게 개선된다.[35] 소마토스타틴 수용체는 많은 NET에서 과다압축되므로 Ga DOTA 결합 펩타이드(펩타이드)가 이러한 위치에서 우선 섭취되며 스캔에 시각화된다.[36] NETs의 진단 및 스테이징뿐만 아니라, Lutetium-177 또는 yttrium-90 DOTA 치료에 대비하여 계획 및 선량측정에 Ga DOTA 결합 펩타이드 영상을 사용할 수 있다.[37][38]
2016년 6월 미국에서 Netspot(갈륨 Ga-68 도타테이트 주사제 조제 키트)이 의료용으로 승인되었다.[39][40]
2019년 8월 미국에서 성인 및 어린이 대상 소마토스타틴 수용체 양성신경내분비종양(NET) 국산화용 PET 영상과 함께 사용할 수 있도록 가에도트레오티드 주사(68Ga DOTATOC)가 의료용으로 승인됐다.[41][42][43]
미국 식품의약국(FDA)은 알려진 334개 또는 신경-내분비 종양 의심증상 3개 임상시험(Trial 1/NCT#1619865, Trial 2/NCT#1869725, Trial 3/NCT#2441062)의 증거를 바탕으로 가에도트레오티드(DOTATOC)를 승인했다.[42] 그 재판은 미국에서 실시되었다.[42]
갈륨-67의 방사화학
갈륨-67 구연산염은 사이클로트론에 의해 생산된다. 농축된 Zn-68의 전하 입자 폭격은 갈륨-67을 생산하는데 사용된다. 갈륨-67은 구연산을 혼합하여 갈륨 구연산을 형성한다. 갈륨-67의 반감기는 78시간이다.[44] 전자 포획에 의해 분해된 다음 감마 카메라에 의해 검출되는 제제 감마선을 방출한다. 1차 배출량은 93keV(농도 39%)로 가장 많고 185keV(21%), 300keV(17%)[45]: 64 순이다. 영상촬영의 경우, 일반적으로 약 93, 184 keV 또는 93, 184 및 296 keV를 중심으로 복수의 감마 카메라 에너지 윈도우가 사용된다.[24]
갈륨-68의 방사화학
68Ga는 270.8일 반감기를 가진 게르마늄-68의 붕괴로부터 생산되거나,[46] 저에너지 사이클로트론을 통한 아연-68의 조사로 생산된다. 발전기 사용은 예를 들어 사이클로트론이 없는 현장에서 다른 PET 동위원소를 생산하는 데 일반적으로 사용되는 최소 인프라로 Ga 공급이 쉽게 생산될 수 있음을 의미한다. 그것은 양전자 방출과 전자 포획에 의해 아연-68로 분해된다.[47] 양전자 방출의 최대 에너지는 1.9 MeV이다.[45]: 65
참고 항목
참조
- ^ Treves, S. Ted (2014). Pediatric nuclear medicine and molecular imaging (4th ed.). Springer. p. 480. ISBN 9781461495512.
- ^ Jain, Sanjay K. (2017). Imaging Infections: From Bench to Bedside. Springer. p. 34. ISBN 9783319545929.
- ^ Verberne SJ와 O. P. P. Temmerman(2017). 12 - 인공관절 감염 영상 - 예술, J.J. 크리스 PJI(Periprosticulatic Joint Densis) 관리. J. 거츠, 우드헤드 출판사: 259-285.
- ^ Verberne, SJ; Raijmakers, PG; Temmerman, OPP (2016). "The Accuracy of Imaging Techniques in the Assessment of Periprosthetic Hip Infection: A Systematic Review and Meta-Analysis". The Journal of Bone and Joint Surgery. American Volume. 98 (19): 1638–1645. doi:10.2106/jbjs.15.00898. PMID 27707850. Archived from the original on 2016-12-16. Retrieved 2016-12-18.
- ^ Termaat, MF; Raijmakers, PG; Scholten, HJ; Bakker, FC; Patka, P; Haarman, HJ (November 2005). "The accuracy of diagnostic imaging for the assessment of chronic osteomyelitis: a systematic review and meta-analysis". The Journal of Bone and Joint Surgery. American Volume. 87 (11): 2464–71. doi:10.2106/JBJS.D.02691. PMID 16264122. S2CID 26280068.
- ^ Becker, W. (October 1995). "The contribution of nuclear medicine to the patient with infection". European Journal of Nuclear Medicine. 22 (10): 1195–1211. doi:10.1007/BF00800606. PMID 8542906. S2CID 19293222.
- ^ Hofman, M.S.; Kong, G.; Neels, O.C.; Eu, P.; Hong, E.; Hicks, R.J. (2012). "High management impact of Ga-68 DOTATATE (GaTate) PET/CT for imaging neuroendocrine and other somatostatin expressing tumours". Journal of Medical Imaging and Radiation Oncology. 56 (1): 40–47. doi:10.1111/j.1754-9485.2011.02327.x. PMID 22339744. S2CID 21843609.
- ^ Scott, A, et al. (2018). "Management of Small Bowel Neuroendocrine Tumors". Journal of Oncology Practice. 14 (8): 471–482. doi:10.1200/JOP.18.00135. PMID 30096273.
- ^ Bryan, R Nick (2010). Introduction to the science of medical imaging. Cambridge: Cambridge University Press. p. 200. ISBN 9780521747622.
- ^ Bleeker-Rovers, C. P.; Vos, F. J.; van der Graaf, W. T. A.; Oyen, W. J. G. (16 June 2011). "Nuclear Medicine Imaging of Infection in Cancer Patients (With Emphasis on FDG-PET)". The Oncologist. 16 (7): 980–991. doi:10.1634/theoncologist.2010-0421. PMC 3228133. PMID 21680576.
- ^ Ziessman, Harvey A.; O'Malley, Janis P.; Thrall, James H. (2013). Nuclear Medicine: The Requisites E-Book. Elsevier Health Sciences. p. 281. ISBN 978-0323112925.
- ^ Palestro, Christopher J. (April 1994). "The current role of gallium imaging in infection". Seminars in Nuclear Medicine. 24 (2): 128–141. doi:10.1016/S0001-2998(05)80227-2. PMID 8023169.
- ^ Shields, Thomas W.; LoCicero, Joseph; Reed, Carolyn E.; Feins, Richard H. (2009). General Thoracic Surgery. Lippincott Williams & Wilkins. p. 2106. ISBN 9780781779821.
- ^ Love, C; Palestro, CJ (June 2004). "Radionuclide imaging of infection". Journal of Nuclear Medicine Technology. 32 (2): 47–57, quiz 58–9. PMID 15175400.
- ^ Tsan, MF (January 1985). "Mechanism of gallium-67 accumulation in inflammatory lesions". Journal of Nuclear Medicine. 26 (1): 88–92. PMID 3880816.
- ^ Greenberg, Alex M; Prein, Joachim (2007). Craniomaxillofacial reconstructive and corrective bone surgery principles of internal fixation using AO/ASIF technique. New York: Springer. p. 79. ISBN 9780387224275.
- ^ Weiner, R.E. (1996). "The mechanism of 67Ga localization in malignant disease". Nuclear Medicine and Biology. 23 (6): 745–751. doi:10.1016/0969-8051(96)00119-9. PMID 8940716.
- ^ Biersack, Hans-Jürgen; Freeman, Leonard M (2007). Clinical nuclear medicine. Berlin: Springer. p. 324. ISBN 978-3-540-28026-2.
- ^ Hoffer, P (1980). "Gallium: mechanisms". Journal of Nuclear Medicine. 21 (3): 282–5. PMID 6988551.
- ^ "Gallium scan". MedlinePlus. Retrieved 14 September 2017.
- ^ "ACR–SPR Practice Parameter for the Performance of Scintigraphy for Inflammation and Infection" (PDF). American College of Radiology. 2014.
- ^ "Lung gallium scan". MedlinePlus. Retrieved 14 September 2017.
- ^ a b Bombardieri, Emilio; Aktolun, Cumali; Baum, Richard P.; Bishof-Delaloye, Angelica; Buscombe, John; Chatal, Jean François; Maffioli, Lorenzo; Moncayo, Roy; Mortelmans, Luc; Reske, Sven N. (2 September 2003). "67Ga Scintigraphy Procedure Guidelines for Tumour Imaging" (PDF). EANM.
- ^ a b c d "Society of Nuclear Medicine Procedure Guideline for Gallium Scintigraphy in Inflammation" (PDF). SNMMI. 2 June 2004.
- ^ "Notes for Guidance on the Clinical Administration of Radiopharmaceuticals and Use of Sealed Radioactive Sources" (PDF). Administration of Radioactive Substances Advisory Committee. January 2016. Retrieved 7 September 2016.
- ^ Palestro, Christopher J. (2012). "SPECT and PET in the Assessment of Bone Infections". In Fogelman, Ignac; Gnanasegaran, Gopinath; van der Wall, Hans (eds.). Radionuclide and hybrid bone imaging. Berlin: Springer. pp. 523–559. doi:10.1007/978-3-642-02400-9_20. ISBN 978-3-642-02399-6.
- ^ Maurer, Tobias; Eiber, Matthias; Schwaiger, Markus; Gschwend, Jürgen E. (23 February 2016). "Current use of PSMA–PET in prostate cancer management". Nature Reviews Urology. 13 (4): 226–235. doi:10.1038/nrurol.2016.26. PMID 26902337. S2CID 2448922.
- ^ "Drug Approval Package: Gallium Ga 68 PSMA-11". U.S. Food and Drug Administration (FDA). 16 December 2020. Retrieved 25 December 2020.
- ^ a b c d e f g "Drug Trials Snapshot: Ga 68 PSMA-11". U.S. Food and Drug Administration (FDA). 1 December 2020. Retrieved 11 December 2020.
 이 글은 공개 도메인에 있는 이 출처의 텍스트를 통합한다..
이 글은 공개 도메인에 있는 이 출처의 텍스트를 통합한다.. - ^ https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/212642s000lbl.pdf
- ^ "New Drug Therapy Approvals 2020". U.S. Food and Drug Administration (FDA). 31 December 2020. Retrieved 17 January 2021.
- ^ a b Fendler, Wolfgang P.; Eiber, Matthias; Beheshti, Mohsen; Bomanji, Jamshed; Ceci, Francesco; Cho, Steven; Giesel, Frederik; Haberkorn, Uwe; Hope, Thomas A.; Kopka, Klaus; Krause, Bernd J.; Mottaghy, Felix M.; Schöder, Heiko; Sunderland, John; Wan, Simon; Wester, Hans-Jürgen; Fanti, Stefano; Herrmann, Ken (10 March 2017). "68Ga-PSMA PET/CT: Joint EANM and SNMMI procedure guideline for prostate cancer imaging: version 1.0". European Journal of Nuclear Medicine and Molecular Imaging. 44 (6): 1014–1024. doi:10.1007/s00259-017-3670-z. PMID 28283702. S2CID 5882407.
- ^ Rai, Bhavan Prasad; Baum, Richard Paul; Patel, Amit; Hughes, Robert; Alonzi, Roberto; Lane, Tim; Adshead, Jim; Vasdev, Nikhil (September 2016). "The Role of Positron Emission Tomography With 68Gallium (Ga)-Labeled Prostate-specific Membrane Antigen (PSMA) in the Management of Patients With Organ-confined and Locally Advanced Prostate Cancer Prior to Radical Treatment and After Radical Prostatectomy". Urology. 95: 11–15. doi:10.1016/j.urology.2015.12.048. PMID 26790588.
- ^ Afaq, Asim; Batura, Deepak; Bomanji, Jamshed (14 February 2017). "New frontiers in prostate cancer imaging: clinical utility of prostate-specific membrane antigen positron emission tomography". International Urology and Nephrology. 49 (5): 803–810. doi:10.1007/s11255-017-1541-y. PMID 28197764. S2CID 3902900.
- ^ Mojtahedi, Alireza; Thamake, Sanjay; Tworowska, Izabela; Ranganathan, David; Delpassand, Ebrahim S (15 August 2014). "The value of 68Ga-DOTATATE PET/CT in diagnosis and management of neuroendocrine tumors compared to current FDA approved imaging modalities: a review of literature". American Journal of Nuclear Medicine and Molecular Imaging. 4 (5): 426–434. ISSN 2160-8407. PMC 4138137. PMID 25143861.
- ^ Virgolini, Irene; Ambrosini, Valentina; Bomanji, Jamshed B.; Baum, Richard P.; Fanti, Stefano; Gabriel, Michael; Papathanasiou, Nikolaos D.; Pepe, Giovanna; Oyen, Wim; De Cristoforo, Clemens; Chiti, Arturo (2 July 2010). "Procedure guidelines for PET/CT tumour imaging with 68Ga-DOTA-conjugated peptides: 68Ga-DOTA-TOC, 68Ga-DOTA-NOC, 68Ga-DOTA-TATE" (PDF). European Journal of Nuclear Medicine and Molecular Imaging. 37 (10): 2004–2010. doi:10.1007/s00259-010-1512-3. PMID 20596866. S2CID 11469889.
- ^ Kam, B. L. R.; Teunissen, J. J. M.; Krenning, E. P.; de Herder, W. W.; Khan, S.; van Vliet, E. I.; Kwekkeboom, D. J. (3 March 2012). "Lutetium-labelled peptides for therapy of neuroendocrine tumours". European Journal of Nuclear Medicine and Molecular Imaging. 39 (S1): 103–112. doi:10.1007/s00259-011-2039-y. PMC 3304065. PMID 22388631.
- ^ Taïeb, David; Garrigue, Philippe; Bardiès, Manuel; Abdullah, Ahmad Esmaeel; Pacak, Karel (October 2015). "Application and Dosimetric Requirements for Gallium-68–labeled Somatostatin Analogues in Targeted Radionuclide Therapy for Gastroenteropancreatic Neuroendocrine Tumors". PET Clinics. 10 (4): 477–486. doi:10.1016/j.cpet.2015.06.001. PMC 4617555. PMID 26384594.
- ^ "Netspot (kit for the preparation of gallium Ga 68 dotatate injection)". U.S. Food and Drug Administration (FDA). 21 June 2016. Retrieved 18 October 2020. Lay summary (PDF).
{{cite web}}: Cite는 사용되지 않는 매개 변수를 사용한다.lay-url=(도움말) - ^ "Netspot- 68ga-dotatate kit". DailyMed. 23 October 2019. Retrieved 18 October 2020.
- ^ "GA-68-DOTATOC- edotreotide gallium ga-68 injection, solution". DailyMed. 3 September 2019. Retrieved 17 March 2020.
- ^ a b c "Drug Trials Snapshots: Ga-68-DOTATOC". U.S. Food and Drug Administration (FDA). 21 August 2019. Retrieved 17 March 2020.
 이 글은 공개 도메인에 있는 이 출처의 텍스트를 통합한다..
이 글은 공개 도메인에 있는 이 출처의 텍스트를 통합한다.. - ^ "Drug Approval Package: Gallium Dotatoc GA 68". U.S. Food and Drug Administration (FDA). 23 September 2019. Retrieved 18 October 2020.
- ^ IAEA (2009). Cyclotron produced radionuclides: physical characteristics and production methods (PDF). Vienna: International Atomic Energy Agency. p. 116. ISBN 9789201069085.
- ^ a b Delacroix, D; Guerre, J P; Leblanc, P; Hickman, C (2002). Radionuclide and Radiation Protection Data Handbook (2nd ed.). Ashford: Nuclear Technology Publishing. ISBN 978-1870965873.
- ^ Banerjee, Sangeeta Ray; Pomper, Martin G. (June 2013). "Clinical applications of Gallium-68". Applied Radiation and Isotopes. 76: 2–13. doi:10.1016/j.apradiso.2013.01.039. PMC 3664132. PMID 23522791.
- ^ Bé, M M; Chisté, V; Mougeot, X; Chechev, V; Kondev, F; Nichols, A L; Huang, X; Wang, B (2013). Monographie BIPM: Table of radionuclides Vol. 7. Paris: Bureau International des Poids et Mesures. p. 33. ISBN 9789282222485.
외부 링크
- "68Ga-DOTATATE". Drug Information Portal. U.S. National Library of Medicine.



