DNA 연결효소
DNA ligase| DNA 연결효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 염색체 손상을 치료하는 DNA 연결효소에 대한 예술가의 개념 | |||||||||
| 식별자 | |||||||||
| 에코노. | 6.5.1.1 | ||||||||
| CAS no. | 9015-85-4 | ||||||||
| 데이터베이스 | |||||||||
| 인텐즈 | IntEnz 보기 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASY | 나이스자임뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프리암 | 옆모습 | ||||||||
| PDB 구조 | RCSB PDB 피디비 PDBsum | ||||||||
| 유전자 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
| 리가아제 I, DNA, ATP 의존적 | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| 식별자 | |||||||
| 기호. | LIG1 | ||||||
| NCBI유전자 | 3978 | ||||||
| HGNC | 6598 | ||||||
| 오밈 | 126391 | ||||||
| RefSeq | NM_000234 | ||||||
| 유니프로트 | P18858 | ||||||
| 기타자료 | |||||||
| 로커스 | Chr.19 [1] | ||||||
| |||||||
| 리가제 III, DNA, ATP 의존적 | |||||||
|---|---|---|---|---|---|---|---|
| 식별자 | |||||||
| 기호. | LIG3 | ||||||
| NCBI유전자 | 3980 | ||||||
| HGNC | 6600 | ||||||
| 오밈 | 600940 | ||||||
| RefSeq | NM_002311 | ||||||
| 유니프로트 | P49916 | ||||||
| 기타자료 | |||||||
| 로커스 | Chr. 17 q11.2-q12 | ||||||
| |||||||
DNA 연결효소는 포스포다이에스터 결합의 형성을 촉매함으로써 DNA 가닥의 결합을 촉진하는 효소의 한 종류입니다.생물체에서 이중 DNA의 단일 가닥 분열을 복구하는 역할을 하지만, 일부 형태(예: DNA 리가제 IV)는 이중 가닥 분열(즉, 상보적 DNA의 양쪽 가닥의 분열)을 특별히 복구할 수 있습니다.단일 가닥 절단은 이중나선의 상보 가닥을 주형으로 사용하여 DNA 리가제에 의해 복구되며,[1] DNA 리가제는 DNA를 완전히 복구하기 위한 최종 포스포다이에스터 결합을 생성합니다.
DNA 연결효소는 DNA 복구 및 DNA 복제에 모두 사용됩니다(포유류 연결효소 참조).또한, DNA 리게이스는 재조합 DNA 실험을 위해 분자생물학 실험실에서 광범위하게 사용됩니다(Research applications 참조).정제된 DNA 연결효소는 DNA 분자를 결합하여 재조합 DNA를 형성하는 유전자 복제에 사용됩니다.
효소기전
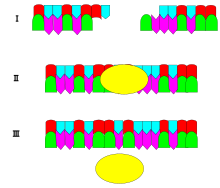
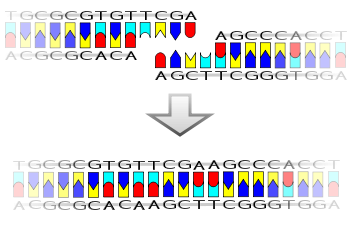
DNA 리게이스의 메커니즘은 하나의 뉴클레오타이드("수용체")의 3' 하이드록실 말단 사이에 2개의 공유 포스포다이에스터 결합을 형성하는 것입니다.형성된 각각의 포스포다이에스터 결합에 대해 두 개의 ATP 분자가 소비됩니다.리가제의 반응에는 AMP가 필요하며, 다음과 같은 4단계로 진행됩니다.
- DNA절편의 닉이나 오카자키절편 등의 활동
- 효소의 활성 중심에 있는 라이신 잔기의 아데닐화(AMP 첨가), 피로인산.
- AMP의 5' 인산으로의 전달, 피로인산 결합 형성
- 공여체의 5' 인산염과 수용체의 3' 하이드록실 사이의 포스포다이에스터 결합의 형성.[2]
리가제는 또한 막다른 말단과 함께 작용하지만, 더 높은 효소 농도와 다양한 반응 조건이 필요합니다.
종류들
대장균
대장균 DNA 연결효소는 연결 유전자에 의해 암호화됩니다.대부분의 원핵생물뿐만 아니라 대장균의 DNA 리가제는 니코틴아마이드 아데닌 다이뉴클레오티드(NAD)를 절단하여 얻은 에너지를 이용하여 포스포다이에스터 결합을 형성합니다.[3]폴리에틸렌 글리콜로 분자가 밀집하는 상황을 제외하고는 무뚝뚝한 끝의 DNA를 결찰하지 않으며, RNA를 DNA에 효율적으로 결합시킬 수 없습니다.
대장균 DNA 리가제의 활성은 적절한 농도의 DNA 중합효소에 의해 강화될 수 있습니다.강화는 DNA 중합효소 1의 농도가 결찰될 DNA 조각보다 훨씬 낮을 때만 작동합니다.Pol I DNA 중합효소의 농도가 높을수록 대장균 DNA 연결효소에[4] 악영향을 미침
T4
박테리오파지 T4(대장균 박테리아를 감염시키는 박테리오파지)의 DNA 리가아제.T4 리가아제는 실험실 연구에서 가장 일반적으로 사용됩니다.[5]그것은 DNA, 올리고뉴클레오티드, RNA와 RNA-DNA 잡종의 응집성 또는 뭉툭한 말단을 연결할 수 있지만 단일 가닥 핵산은 연결할 수 없습니다.그것은 또한 대장균 DNA 연결효소보다 훨씬 더 효율적으로 무뚝뚝한 말단 DNA를 연결할 수 있습니다.대장균 DNA 리가제의 경우와 달리 T4 DNA 리가제의 경우 NAD를 이용할 수 없으며 보조 인자로서 ATP에 대한 절대적인 필요성을 가지고 있습니다.T4 DNA 리가제의 시험관내 활성을 향상시키기 위해 몇몇 공학이 행해졌습니다; 예를 들어, 성공적인 접근법 하나,시험된 T4 DNA 연결효소는 여러 대체 DNA 결합 단백질에 융합되었고, p50 또는 NF-kB 중 하나를 융합 파트너로 가진 구성체가 야생형 T4 DNA 연결효소보다 복제 목적으로 둔치 말단 연결에서 160% 이상 더 활성임을 발견했습니다.[6]플라스미드 벡터에 단편을 삽입하는 일반적인 반응은 0.01에서 1 단위의 연결효소를 사용합니다.T4 DNA 리가제의 최적 배양 온도는 16 °C입니다.
박테리오파지 T4 리가제의 돌연변이는 자외선 조사와[7][8] 알킬화제 메틸메탄설포네이트[9] 모두에 대한 민감도를 증가시켰는데, 이는 DNA 리가제의 존재가 이러한 작용제에 의한 DNA 손상의 복구에 사용됨을 보여줍니다.
포유류
포유류에는 네 가지의 특정한 리가제의 종류가 있습니다.
- DNA ligase I: 리보뉴클레아제 H가 오카자키 단편으로부터 RNA 프라이머를 제거한 후에 지연 가닥의 초기 DNA를 연결합니다.
- DNA ligase III: 뉴클레오티드 절제 수복 및 재조합 단편의 과정 중 DNA 밀봉을 돕기 위한 DNA 수복 단백질 XRCC1과 복합체.알려진 모든 포유류 DNA 리게이스 중에서, 오직 Lig III만이 미토콘드리아에 존재하는 것으로 밝혀졌습니다.
- DNA 리가제 IV: XRCC4와 복합체.비동형 말단 결합 DNA 이중 가닥 파괴 수리 경로의 마지막 단계를 촉매합니다.면역체계 발달 과정에서 면역글로불린과 T세포 수용체 위치의 다양성을 발생시키는 과정인 V(D)J 재조합에도 필요합니다.
- DNA 리가제의 II: DNA 리가제의 단백질 분해에 의한 정제 아티팩트.처음에, 그것은 또 다른 DNA 리게이스로 인식되어 왔고, 그것이 DNA 리게이스의 특이한 명명법의 이유입니다.[10]
진핵생물과 일부 미생물의 DNA 연결효소는 NAD 대신 아데노신 삼인산(ATP)을 사용합니다.[3]
온도조절가능
열친화성 박테리아로부터 유래된 이 효소는 기존의 DNA 연결효소보다 훨씬 높은 온도에서 안정적이고 활성화되어 있습니다.반감기는 65°C일 때 48시간이고 95°C일 때 1시간 이상입니다.Ampligase DNA Ligase는 최소 500번의 열 순환(94 °C/80 °C) 또는 16시간의 순환 동안 활성이 있는 것으로 나타났습니다.10이러한 탁월한 온도 조절성을 통해 매우 높은 하이브리드화 강도 및 라이그 특이성을 얻을 수 있습니다.[11]
활동량 측정
DNA 리가제의 활성을 측정하는 데 사용되는 단위는 적어도 세 가지입니다.[12]
- 와이스 단위 - 37C에서° 20분 내에 무기 피로인산으로부터 ATP로의 1 nmole의 교환을 촉매하는 리가제의 양.이것이 가장 많이 사용되는 것입니다.
- Modrich-Lehman unit - 이것은 거의 사용되지 않으며, 한 단위는 표준 조건에서 30분 내에 100 nmol의 d(nA-T)를 exonuclease-III 저항성 형태로 변환하는 데 필요한 효소의 양으로 정의됩니다.
- 많은 리게이스의 상업적 공급자들은 리게이스가 응집된 말단을 연결하는 능력에 기초하여 임의의 단위를 사용합니다.이러한 단위는 종종 정량적인 것보다 주관적이고 정밀도가 부족합니다.
리서치 어플리케이션
DNA 연결효소는 재조합 DNA 서열을 생성하는 현대 분자생물학 연구에서 필수적인 도구가 되었습니다.예를 들어, DNA 연결효소는 제한효소와 함께 DNA 조각, 종종 유전자를 플라스미드에 삽입하는 데 사용됩니다.
최적의 온도를 제어하는 것은 응집이 끝난 조각의 결찰을 포함하는 효율적인 재조합 실험을 수행하는 데 중요한 측면입니다.대부분의 실험은 37°C에서 가장 활성화된 T4 DNA Ligase (박테리오파지 T4로부터 분리)를 사용합니다.[13]그러나 응집 말단 단편("끈적은 말단")을 갖는 최적의 결찰 효율을 위해, 최적의 효소 온도를 끈적인 말단의 용융 온도 T와m 균형을 맞출 필요가 있으며,[14] 높은 온도가 수소 결합을 방해하기 때문에 끈적인 말단의 상동 쌍은 안정적이지 않을 것입니다.끈끈한 단부가 이미 안정적으로 어닐링되어 있을 때 가장 효율적인 것이 라이징 반응이며, 따라서 어닐링 단의 파괴는 낮은 라이징 효율을 초래할 것입니다.오버행이 짧을수록 T가m 낮아집니다.
뭉툭한 끝의 DNA 조각들은 어닐에 응집력 있는 끝이 없기 때문에, 용해 온도는 결찰 반응의 정상 온도 범위 내에서 고려할 요소가 아닙니다.뭉툭한 말단 결찰의 한계 요인은 연결효소의 활성이 아니라 DNA 단편 말단 간의 정렬 수이다.따라서 무딘 말단 DNA에 대한 가장 효율적인 결찰 온도는 가장 많은 정렬이 발생할 수 있는 온도일 것입니다.대부분의 무뚝뚝한 끝 결찰은 밤새 14-25 °C에서 수행됩니다.안정적으로 어닐링된 말단이 없다는 것은 또한 결찰 효율이 떨어짐을 의미하므로 더 높은 결찰기 농도를 사용해야 합니다.[14]
DNA 리가제의 새로운 사용은 나노 화학 분야, 특히 DNA 종이접기 분야에서 볼 수 있습니다.DNA 기반 자가 조립 원리는 생체 분자, 나노 기계, 나노 전자 및 광전자 구성 요소와 같은 나노 스케일의 물체를 조직하는 데 유용한 것으로 입증되었습니다.그러한 나노 구조의 조립은 DNA 분자의 복잡한 그물망의 생성을 요구합니다.비록 DNA 자가 조립이 알루미늄 호일의 이화성 표면 제공과 같은 다양한 기질을 사용하여 외부의 도움 없이도 가능하지만, DNA 연결효소는 DNA 위에 DNA 격자 구조를 만드는 데 필요한 효소적 도움을 제공할 수 있습니다.[15]
역사
최초의 DNA 연결효소는 1967년 겔러트, 리먼, 리처드슨, 휴르비츠 연구소에 의해 정제되고 특징지어졌습니다.[16]세포 잔해 제거 및 스트렙토마이신 첨가로 시작하여 여러 DEAE(Diethylaminoethyl)-셀룰로오스 컬럼 세척 및 최종 포스포셀룰로오스 분획을 수행하는 6단계 크로마토그래피-분획 공정을 사용하여 Weiss와 Richardson에 의해 최초로 정제되고 특징지어졌습니다.최종 추출물은 대장균 배지에 처음 기록된 활성의 10%를 포함하고 있었습니다. 이 과정에서 반응을 최적화하기 위해 ATP와 Mg++가 필요한 것으로 나타났습니다.상업적으로 이용 가능한 일반적인 DNA 연결효소는 원래 박테리오파지 T4, 대장균 그리고 다른 박테리아에서 발견되었습니다.[17]
장애
인간 DNA 리가제의 유전적 결핍은 면역 결핍, 방사선 민감성, 발달 이상으로 특징지어지는 임상 증후군과 관련이 있으며, LIG4 증후군(Ligase IV syndrome)은 DNA 리가제의 4번 변이와 관련된 희귀 질환으로 dsDNA 파괴-수리 메커니즘을 방해합니다.Ligase IV 증후군은 개인에게 면역 결핍을 유발하고 흔히 소두증 및 골수 저형성증과 관련이 있습니다.[18]DNA 연결효소의 결핍 또는 오작동으로 인해 발생하는 질병 목록은 다음과 같습니다.
색소침착증
XP로 흔히 알려진 XP는 햇빛으로부터 오는 자외선(UV)에 극도로 민감한 것이 특징인 유전 질환입니다.이 상태는 대부분 태양에 노출된 피부와 눈에 영향을 미칩니다.어떤 영향을 받은 사람들은 신경계와 관련된 문제를 가지고 있기도 합니다.[19]
아탁시아 텔랑기텍타시아
ATM 유전자의 돌연변이는 악액질-신경절증을 유발합니다.ATM 유전자는 세포 분열을 조절하고 DNA 복구에 관여하는 단백질을 만들기 위한 지침을 제공합니다.이 단백질은 신경계와 면역계를 포함한 여러 신체계의 정상적인 발달과 활동에 중요한 역할을 합니다.ATM 단백질은 세포가 손상되거나 부서진 DNA 가닥을 인식하는 것을 돕고, 부서진 DNA 가닥을 고정시키는 효소를 활성화함으로써 DNA 복구를 조정합니다.손상된 DNA 가닥의 효율적인 복구는 세포의 유전 정보의 안정성을 유지하는 데 도움이 됩니다.환아는 일반적으로 보행의 어려움, 균형 및 손 조정 문제, 비자발적인 홱 움직이는 동작(코레아), 근육 경련(근종), 신경 기능 장애(신경병증)가 발생합니다.움직임 문제는 일반적으로 사람들로 하여금 청소년기에 휠체어의 도움을 필요로 하게 합니다.이 장애를 가진 사람들은 또한 말을 흐리고 눈을 옆으로 움직이게 하는데 어려움을 겪습니다.[20]
판코니 빈혈
판코니 빈혈은 골수 부전으로 이어지는 희귀한 유전성 혈액 질환입니다.FA는 골수가 몸이 정상적으로 활동하기에 충분한 양의 새로운 혈구를 만드는 것을 막습니다.FA는 골수가 많은 결함있는 혈구를 만들게 할 수도 있습니다.이것은 백혈병과 같은 심각한 건강 문제로 이어질 수 있습니다.[21]
블룸 증후군
블룸 증후군은 햇빛에 민감한 피부를 유발하며, 대개 코와 뺨에 붉은 피부가 나비 모양으로 나타나는 현상이 발생합니다.피부 발진은 일반적으로 태양에 노출되는 손등이나 팔뚝과 같은 다른 부위에도 나타날 수 있습니다.발진에 혈관이 확장된 작은 무리가 나타나는 경우가 많습니다. 눈에도 혈관 확장증이 나타날 수 있습니다.다른 피부 특징으로는 주변보다 더 밝거나 어두운 피부 조각이 있습니다(각각 색소 과다 침착 또는 색소 과다 침착).이러한 패치는 태양에 노출되지 않은 피부 부위에 나타나며, 그 발달은 발진과 관련이 없습니다.
마약 표적으로
최근의 연구들에서, 인간 DNA 리가제 I은 암을 치료하기 위한 가능한 치료제로서 DNA 리가제 억제제를 식별하기 위해 컴퓨터 보조 약물 설계에 사용되었습니다.[22]과도한 세포 성장은 암 발생의 특징이기 때문에, DNA 리가제의 기능을 방해하는 표적 화학요법은 보조적인 암 형태를 방해할 수 있습니다.또한, DNA 리게이스는 크게 ATP- 및 NAD-의존성의+ 두 가지 카테고리로 나눌 수 있음이 밝혀졌습니다.이전의 연구는 NAD 의존성+ DNA 연결효소가 생물의 박테리아 영역 밖의 산발적인 세포성 또는 바이러스성 틈새에서 발견되었음을 보여주었지만, 진핵생물에 NAD 의존성+ 연결효소가 존재하는 예는 없습니다.NAD 의존성+ 리게이스는 ATP 의존적 인간 DNA 리게이스와 비교하여 비-핵성 생물에만 존재하고 독특한 기질 특이성 및 NAD+ 의존적인 독특한 도메인 구조를 가지고 새로운 항균제 개발을 위한 이상적인 목표입니다.[16]
참고 항목
참고문헌
- ^ Pascal JM, O'Brien PJ, Tomkinson AE, Ellenberger T (November 2004). "Human DNA ligase I completely encircles and partially unwinds nicked DNA". Nature. 432 (7016): 473–8. Bibcode:2004Natur.432..473P. doi:10.1038/nature03082. PMID 15565146. S2CID 3105417.
- ^ Lehman IR (November 1974). "DNA ligase: structure, mechanism, and function". Science. 186 (4166): 790–7. Bibcode:1974Sci...186..790L. doi:10.1126/science.186.4166.790. PMID 4377758. S2CID 86549159.
- ^ a b Foster JB, Slonczewski J (2010). Microbiology: An Evolving Science (Second ed.). New York: W. W. Norton & Company. ISBN 978-0-393-93447-2.
- ^ Yang Y, LiCata VJ (February 2018). "Pol I DNA polymerases stimulate DNA end-joining by Escherichia coli DNA ligase". Biochemical and Biophysical Research Communications. 497 (1): 13–18. doi:10.1016/j.bbrc.2018.01.165. PMID 29409896.
- ^ "Ligases" (PDF). Enzyme Resources Guide. Promega Corporation. pp. 8–14.
- ^ Wilson RH, Morton SK, Deiderick H, Gerth ML, Paul HA, Gerber I, Patel A, Ellington AD, Hunicke-Smith SP, Patrick WM (July 2013). "Engineered DNA ligases with improved activities in vitro". Protein Engineering, Design & Selection. 26 (7): 471–8. doi:10.1093/protein/gzt024. PMID 23754529.
- ^ Baldy MW (1968). "Repair and recombination in phage T4. II. Genes affecting UV sensitivity". Cold Spring Harbor Symposia on Quantitative Biology. 33: 333–8. doi:10.1101/sqb.1968.033.01.038. PMID 4891973.
- ^ Baldy MW (February 1970). "The UV sensitivity of some early-function temperature-sensitive mutants of phage T4". Virology. 40 (2): 272–87. doi:10.1016/0042-6822(70)90403-4. PMID 4909413.
- ^ Baldy MW, Strom B, Bernstein H (March 1971). "Repair of alkylated bacteriophage T4 deoxyribonucleic acid by a mechanism involving polynucleotide ligase". Journal of Virology. 7 (3): 407–8. doi:10.1128/JVI.7.3.407-408.1971. PMC 356131. PMID 4927528.
- ^ Tomkinson, Alan E; Sallmyr, Annahita (5 September 2013). "Structure and function of the DNA ligases encoded by the mammalian LIG3 gene". Gene. 531 (2): 150–157. doi:10.1016/j.gene.2013.08.061. PMC 3881560. PMID 24013086.
- ^ "Ampligase- Thermostable DNA Ligase". www.epibio.com. Retrieved 2017-05-15.
- ^ Russell DW, Sambrook J (2001). "Chapter 1: Plasmids and Their Usefulness in Molecular Cloning". Molecular cloning: a laboratory manual. Vol. 1 (3rd ed.). Cold Spring Harbor, N.Y: Cold Spring Harbor Laboratory. pp. 1–159. ISBN 978-0-87969-577-4.
- ^ Baneyx F, Lucotte G (1993). Introduction to Molecular Cloning Techniques. Chichester: John Wiley & Sons. p. 156. ISBN 978-0-471-18849-0.
- ^ a b Tabor S (May 2001). "DNA ligases". Current Protocols in Molecular Biology. Chapter 3: Unit 3.14. doi:10.1002/0471142727.mb0314s08. ISBN 978-0-471-14272-0. PMID 18265223. S2CID 23944826.
- ^ Bhanjadeo MM, Nayak AK, Subudhi U (2017). "Surface-assisted DNA self-assembly: An enzyme-free strategy towards formation of branched DNA lattice". Biochemical and Biophysical Research Communications. 485 (2): 492–498. doi:10.1016/j.bbrc.2017.02.024. PMID 28189681.
- ^ a b c Shuman S (June 2009). "DNA ligases: progress and prospects". The Journal of Biological Chemistry. 284 (26): 17365–9. doi:10.1074/jbc.R900017200. PMC 2719376. PMID 19329793.
- ^ Weiss B, Richardson CC (April 1967). "Enzymatic breakage and joining of deoxyribonucleic acid, I. Repair of single-strand breaks in DNA by an enzyme system from Escherichia coli infected with T4 bacteriophage". Proceedings of the National Academy of Sciences of the United States of America. 57 (4): 1021–8. Bibcode:1967PNAS...57.1021W. doi:10.1073/pnas.57.4.1021. PMC 224649. PMID 5340583.
- ^ Altmann T, Gennery AR (October 2016). "DNA ligase IV syndrome; a review". Orphanet Journal of Rare Diseases. 11 (1): 137. doi:10.1186/s13023-016-0520-1. PMC 5055698. PMID 27717373.
- ^ "xeroderma pigmentosum". Genetics Home Reference. Retrieved 2017-05-15.
- ^ "ataxia-telangiectasia". Genetics Home Reference. Retrieved 2017-05-15.
- ^ "What Is Fanconi Anemia?". NHLBI, NIH. Retrieved 2017-05-15.
- ^ Tomkinson AE, Howes TR, Wiest NE (June 2013). "DNA ligases as therapeutic targets". Translational Cancer Research. 2 (3). PMC 3819426. PMID 24224145.
외부 링크
- DNA Ligase : 이달의 PDB 분자
- 데이비드슨 칼리지의 리가제의 일반적인 정보
- OpenWetWare DNA결찰 프로토콜
- UniProt용 PDB에서 사용할 수 있는 모든 구조 정보에 대한 개요: PDBe-KB의 P00970(DNA ligase).
- UniProt용 PDB에서 사용 가능한 모든 구조 정보에 대한 개요: PDBe-KB의 P18858(DNA ligase 1).
- PDBe-KB에서 UniProt용 PDB: P49916(DNA ligase 3)에서 사용 가능한 모든 구조 정보에 대한 개요입니다.
