헤메 C
Heme C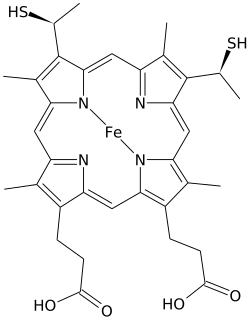 | |
| 식별자 | |
|---|---|
3D 모델(JSmol) | |
| 켐스파이더 | |
| 메슈 | 헤메+C |
펍켐 CID | |
| |
| |
| 특성. | |
| 욘스페3436442 | |
| 어금질량 | 684.64904 g/1964 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
헤메 C(또는 헴 C)는 헤메의 중요한 종류다.
역사
헤메 C의 정확한 구조는 20세기 중반 스웨덴 생화학자인 K.-G. Paul에 의해 출판되었다.[1] 이 작품은 스웨덴의 위대한 생화학자 휴고 이론이 처음으로 추론한 구조를 확인시켜 주었다. Heme C의 구조는 Heme의 형태인 감소된 Fe(II)의 NMR과 IR 실험을 바탕으로 1975년에 확인되었다.[2] 티오에테르 결합에 관한 절대적 입체화학 구성을 포함한 heme C의 구조는 척추동물 단백질인 시토크롬 c에[3] 대해 처음 제시되었고 현재는 단백질을 포함한 많은 다른 heme C로 확장되었다.
특성.
헤메 C는 헤메 B의 두 비닐 사이드 체인이 아포프로테인과의 공밸런트, 티오테르 연결로 대체된다는 점에서 헤메 B와 다르다. 두 개의 티오에더 연결은 일반적으로 단백질의 시스틴 잔류물에 의해 만들어진다. 이러한 연결은 heme C가 홀로프로틴, 시토크롬 c와 쉽게 분리되는 것을 허용하지 않는데, 이는 가벼운 조건에서도 heme-단백질 콤플렉스와 분리될 수 있는 보다 쉽게 분리된 heme B와 비교된다. 이것은 매우 광범위한 사이토크롬 c 구조와 기능을 허용하며, 무수한 c 타입의 시토크롬은 주로 전자 운반체 역할을 한다. 시토크롬 c에 대한 리독스 잠재력은 단백질 구조와 용제 상호작용의 작은 변화에 의해 "세밀하게 조정"될 수 있다.[4]
홀로프로테인에 바인딩된 heme C 단위의 수는 매우 다양하다. 척추동물 세포의 경우 단백질당 1헤메 C가 원칙이지만 박테리아의 경우 이 숫자는 홀로프로테인당 2, 4, 5, 6 또는 심지어 16헤메 C 그룹이다. 일반적으로 Heme C 그룹의 수와 배열이 관련이 있고 적절한 홀로프로테인 기능을 위해 요구된다는 것에 동의한다. 예를 들어, 여러 헤메 C 그룹을 포함하는 단백질은 다중 전자 전달 반응에 관여하는데, 특히 중요한 것은 대기 질소를 두 개의 유기 암모니아 분자로 줄이는 데 필요한 6개의 전자 감소다. 헴 C 대 아미노산 비율이 세균성 헴프롬의 경우 높은 것이 일반적이기 때문에, 일부 사이토크롬 c 단백질의 내부는 다른 헴프롬에 비해 많은 헴 C 그룹으로 채워져 나타난다. 종종 단일 세포 유기체에서 추출되는 일부 혈단백질에는 다섯 개의 히메스 C가 포함될 수 있다.[5] bc1 콤플렉스는 C형 heme을 함유한 또 다른 중요한 효소다.
테오테더 연결은 홀로프로테인에게는 큰 기능의 자유를 허락하는 것처럼 보인다. 일반적으로 c형 시토크롬은 시토크롬 b보다 더 넓은 범위의 산화 감소 전위에 걸쳐 "정밀 조정"될 수 있다. 이것은 시토크롬 c가 평생에 걸쳐 거의 어디에나 있는 중요한 이유일 수 있다. 헤메 C는 또한 세포질 사이토크롬 c의 몇 분자만이 여전히 헤메 C를 포함하고 있어야 하는 세포사멸에 중요한 역할을 한다.[6] 시토크롬 c는 인간의 혈청으로 측정할 수 있으며 염증 표식기로도 사용할 수 있다.[7]
이러한 적도 공밸런트 결합 외에 헤메철도 보통 두 개의 아미노산의 측면 사슬에 축방향으로 조응하여 철을 육각류로 만든다. 예를 들어, 포유류와 참치 시토크롬 c는 히스티딘과 메티오닌의 측면 사슬에 축방향으로 조화된 단일 헤메 C를 포함한다.[8] 단백질에 heme를 고정하는 두 개의 공밸런트 결합 때문에, heme C의 철은 때때로 리신이나 심지어 물의 아미노 그룹에 축방향으로 결합된다.
참조
- ^ Paul, K.G.; Högfeldt, Erik; Sillén, Lars Gunnar; Kinell, Per-Olof (1950). "The splitting with silver salts of the cysteine-porphyrin bonds in cytochrome c". Acta Chemica Scandinavica. 4: 239–244. doi:10.3891/acta.chem.scand.04-0239.
- ^ Caughey, W.S.; Smythe, G.A.; O'Keeffe, D.H.; Maskasky, J.E.; Smith, M.L. (1975). "Heme A of Cytochrome c Oxidase". Journal of Biological Chemistry. 250 (19): 7602–7622. doi:10.1016/S0021-9258(19)40860-0. PMID 170266.
- ^ Takano T.; Trus B.L.; Mandel N.; Mandel G.; Kallai O.B.; Swanson R.; Dickerson R.E. (1977). "Tuna cytochrome c at 2.0 A resolution. II. Ferrocytochrome structure analysis". Journal of Biological Chemistry. 252 (2): 776–785. doi:10.1016/S0021-9258(17)32784-9. PMID 188826.
- ^ Berghuis, A.M.; Brayer, G.D. (1992). "Oxidation state-dependent conformational changes in cytochrome c.". J. Mol. Biol. 223 (4): 959–976. doi:10.1016/0022-2836(92)90255-i. PMID 1311391.
- ^ Gwyer James D., Richardson David J., Butt Julea N. (2005). "Diode or Tunnel-Diode Characteristics? Resolving the Catalytic Consequences of Proton Coupled Electron Transfer in a Multi-Centered Oxidoreductase". Journal of the American Chemical Society. 127 (43): 14964–14965. doi:10.1021/ja054160s. PMID 16248601.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Bowman, S.E.J., Bren, K.L. (2008). "The chemistry and biochemistry of heme C: functional bases for covalent attachment". Nat. Prod. Rep. 25 (6): 1118–1130. doi:10.1039/b717196j. PMC 2654777. PMID 19030605.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Eleftheriadis, T.; Pissas, G.; Liakopoulos, V.; Stafanidis, I. (2016). "Cytochrome c as a Potentially Clinical Useful Marker of Mitochondrial and Cellular Damage". Front. Immunol. 7: 279. doi:10.3389/fimmu.2016.00279. PMC 4951490. PMID 27489552.
- ^ Yeh, S.R., Han, S., and Rousseau, D.L. (1998). "Cytochrome c folding and unfolding". Accounts of Chemical Research. 31 (11): 727–735. doi:10.1021/ar970084p.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크)


