프로토포르피린 IX
Protoporphyrin IX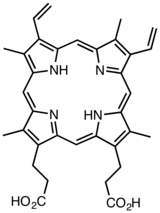 | |
| 식별자 | |
|---|---|
3D 모델(JSmol) | |
| 체비 | |
| 첸블 | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.008.213 |
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| 채널343444 | |
| 몰 질량 | 562.658 g/g |
| 밀도 | 1.27g/cm3 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
프로토포르피린 IX는 포르피린으로 분류되는 유기 화합물로, 헴(헤모글로빈)과 클로로필과 같은 다른 중요한 화합물의 전구체로서 살아있는 유기체에 중요한 역할을 한다.그것은 물에 녹지 않는 짙은 색상의 고체이다.이름은 종종 PPIX로 축약됩니다.
프로토포르피린 IX는 방향족 특성이 현저한 테트라피롤 매크로사이클인 돼지코어를 포함한다.프로토포르피린 IX는 고리 평면에서 반대([1]트랜스) 방향으로 구부러진 N-H 결합을 제외하고 기본적으로 평면이다.
명명법
일반 용어인 프로토포르피린은 4개의 피롤 고리에 있는 외부 수소 원자를 다른 관능기로 치환한 포르핀 유도체를 말한다.접두사 proto는 종종 과학 명명법에서 '최초'를 의미하기 때문에 Hans Fischer는 포르피린의 [2]첫 번째 등급으로 protorphyrin이라는 이름을 만든 것으로 생각된다.피셔는 철분 결핍 헴이 "프로토" 포르피린, [3][4]특히 휴고 캄메레르의 포르피린에 대해 언급했다.현대에서 '프로토'는 메틸, 비닐 및 카르복시에틸/프로피온산 측기를 [5]가진 포르피린 종을 나타낸다.
피셔는 또한 15개의 프로토포르피린 유사체를 포함하는 로마 숫자 명명 체계를 만들었지만,[6] 명명 체계는 체계적이지 않다.헴의 다른 이름은 철 프로토포르피린 IX(철 PPIX)이다.PPIX는 4개의 메틸기를 포함한다. -CH3(M), 2개의 비닐-CH=CH2(V) 및 2개의 프로피온산기 CH-CH-COOH22(P).접미사 "IX"는 이러한 체인이 c2,c3-c7,c8-c12,c13-c17,c18 [6]각각의 위치에서 외부 사이클을 중심으로 원형 순서로 발생함을 나타냅니다.
PPIX의 메틴 브릿지는 알파(c5), 베타(c10), 감마(c15), 델타(c20)로 명명됩니다.헴의 맥락에서 헴산소화효소에 의한 대사성 생체변환에 의해 α-메틴 브릿지가 선택적으로 개방되어 빌리베르딘/빌리루빈이 형성된다.이 경우 결과 빌린은 부모 분자가 알파 위치에서 분해된 프로토포르피린 IX임을 나타내는 접미사 IXα를 가진다.비효소 산화로 인해 다른 브리지 위치에서 [7]링이 열릴 수 있습니다.이러한 맥락에서 그리스 문자의 사용은 1932년 [8]게오르크 바칸의 선구적인 작업에서 비롯되었다.
특성.
- 자외선이 화합물을 비추면 밝은 빨간색으로 형광을 발할 수 있다.
- 그것은 또한 달걀 껍데기의 성분으로 그들의 특징적인 갈색을 만들어준다.
자연발생
이 화합물은 자연에서 두 개의 내부 수소 원자가 2가의 금속 양이온으로 대체되는 복합체의 형태로 발견됩니다.철(II)(철) 양이온2+ Fe와 복합되었을 때, 분자는 헴이라고 불립니다.헴은 몇몇 중요한 단백질에 있는 보철기이다.이러한 헴 함유 단백질에는 헤모글로빈, 미오글로빈 및 시토크롬c가 포함된다.복합체는 [9]아연과 같은 다른 금속 이온과도 형성될 수 있습니다.
생합성
이 화합물은 모노피롤(포르포빌리노겐)과 테트라피롤(포르피리노겐, 특히 우로포르피리노겐 III)을 통해 비순환 전구체로부터 합성된다.이 전구체는 프로토포르피리노겐 IX로 변환되고, 프로토포르피리노겐 IX는 프로토포르피린 [9]IX로 산화된다.마지막 단계는 프로토포르피리노겐 산화효소에 의해 매개된다.
프로토포르피린 IX는 헴, 시토크롬 c, 클로로필과 같은 생물학적으로 필수적인 보철 그룹의 중요한 전구체이다.그 결과, 글리신이나 숙시닐-CoA 등의 염기성 전구체 또는 글루탐산으로부터 이 테트라피롤을 합성할 수 있다.프로토포르피린 IX를 합성하는 광범위한 유기체에도 불구하고, 그 과정은 고등 [10][11][12]식물에서 몇 가지 뚜렷한 예외를 제외하고는 박테리아에서 포유류에 이르기까지 대부분 보존된다.
이러한 분자의 생합성에서 금속 양이온은 킬라타아제라고 불리는 효소에 의해 프로토포르피린 IX에 삽입된다.예를 들어 페로켈라타아제(Ferrochelatase)는 화합물을 헴 B(Fe-protorphyrin IX 또는 protohem IX)로 변환한다.클로로필 생합성에서 마그네슘 킬라타아제는 이를 Mg-프로토포르피린 IX로 변환한다.
메탈로프로토포르피린 IX 유도체 설명
프로토포르피린 IX는 공기 중의 철염과 반응하여 복합 FeCl(PIX)[13]을 얻는다.염소와 배위된 헴을 헴이라고 한다.PPIX와 배위되어 있을 때 Fe 이외의 많은 금속이 헴 유사 복합체를 형성한다.코발트 유도체는 산소 [14]운반체 역할도 하기 때문에 특히 관심을 끈다.다른 금속들 - 니켈, 주석, 크롬 -은 치료적 가치를 [15]위해 조사되었다.
팔레프론은 프로토포르피린 [16]IX의 이나트륨 소금이다.
역사
Laidlaw는 [4]1904년에 처음으로 PPIX를 분리했을지도 모른다.
「 」를 참조해 주세요.
레퍼런스
- ^ Winslow S. Caughey, James A. Ibers (1977). "Crystal and Molecular Structure of the Free Base Porphyrin, Protoporphyrin IX Dimethyl Ester". J. Am. Chem. Soc. 99 (20): 6639–6645. doi:10.1021/ja00462a027. PMID 19518.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Vicente, Maria da G.H.; Smith, Kevin M. (2014). "Syntheses and Functionalizations of Porphyrin Macrocycles". Current Organic Synthesis. 11 (1): 3–28. doi:10.2174/15701794113106660083. ISSN 1570-1794. PMC 4251786. PMID 25484638.
- ^ Fischer, Hans (1930). "On haemin and the relationships between haemin and chlorophyll" (PDF). Nobel Prize.
{{cite web}}: CS1 maint :url-status (링크) - ^ a b With, Torben K. (1980-01-01). "A short history of porphyrins and the porphyrias". International Journal of Biochemistry. 11 (3–4): 189–200. doi:10.1016/0020-711X(80)90219-0. ISSN 0020-711X. PMID 6993245.
- ^ Neves, Ana Carolina de Oliveira; Galván, Ismael (2020). "Models for human porphyrias: Have animals in the wild been overlooked?". BioEssays. 42 (12): 2000155. doi:10.1002/bies.202000155. ISSN 1521-1878. PMID 33155299. S2CID 226269267.
- ^ a b Moss, G. P. (1988-12-15). "Nomenclature of tetrapyrroles. Recommendations 1986 IUPAC-IUB Joint Commission on Biochemical Nomenclature (JCBN)". European Journal of Biochemistry. 178 (2): 277–328. doi:10.1111/j.1432-1033.1988.tb14453.x. ISSN 0014-2956. PMID 3208761.
- ^ Berk, Paul D.; Berlin, Nathaniel I. (1977). International Symposium on Chemistry and Physiology of Bile Pigments. U.S. Department of Health, Education, and Welfare, Public Health Service, National Institutes of Health.
- ^ Barkan, Georg; Schales, Otto (1938). "A Hæmoglobin from Bile Pigment". Nature. 142 (3601): 836–837. Bibcode:1938Natur.142..836B. doi:10.1038/142836b0. ISSN 1476-4687. S2CID 4073510.
- ^ a b Paul R. Ortiz de Montellano (2008). "Hemes in Biology". Wiley Encyclopedia of Chemical Biology. John Wiley & Sons. doi:10.1002/9780470048672.wecb221. ISBN 978-0470048672.
- ^ A. R. Battersby; C. J. R. Fookes; G. W. J. Matcham; E. McDonald (1980). "Biosynthesis of the pigments of life: formation of the macrocycle". Nature. 285 (5759): 17–21. Bibcode:1980Natur.285...17B. doi:10.1038/285017a0. PMID 6769048. S2CID 9070849.
- ^ F. J. Leeper (1983). "The biosynthesis of porphyrins, chlorophylls, and vitamin B12". Natural Product Reports. 2 (1): 19–47. doi:10.1039/NP9850200019. PMID 3895052.
- ^ G. Layer; J. Reichelt; D. Jahn; D. W. Heinz (2010). "Structure and function of enzymes in heme biosynthesis". Protein Science. 19 (6): 1137–1161. doi:10.1002/pro.405. PMC 2895239. PMID 20506125.
- ^ Chang, C. K.; DiNello, R. K.; Dolphin, D. (1980). "Iron Porphines". Inorganic Syntheses. Inorg. Synth. Inorganic Syntheses. Vol. 20. pp. 147–155. doi:10.1002/9780470132517.ch35. ISBN 9780470132517.
- ^ Dias, Sı́Lvio L.P; Gushikem, Yoshitaka; Ribeiro, Emerson S.; Benvenutti, Edilson V. (2002). "Cobalt(II) hematoporphyrin IX and protoporphyrin IX complexes immobilized on highly dispersed titanium(IV) oxide on a cellulose microfiber surface: Electrochemical properties and dissolved oxygen reduction study". Journal of Electroanalytical Chemistry. 523 (1–2): 64–69. doi:10.1016/S0022-0728(02)00722-2.
- ^ Verman, Hendrik J.; Ekstrand, Bradley C.; Stevenson, David K. (1993). "Selection of Metalloporphyrin Heme Oxygenase Inhibitors Based on Potency and Photoreactivity". Pediatric Research. 33 (2): 195–200. doi:10.1203/00006450-199302000-00021. PMID 8433895. S2CID 9223457.
- ^ PubChem. "Protoporphyrin disodium". pubchem.ncbi.nlm.nih.gov. Retrieved 2021-04-15.




