항핵항체
Anti-nuclear antibody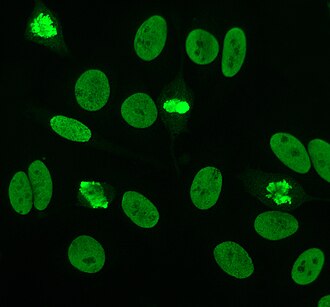
항핵항체(ANA, 일명 항핵인자 또는 ANF)[1]는 세포핵의 내용에 결합하는 자동항체다. 정상적인 개인에서 면역체계는 외국 단백질(항체)에는 항체를 생성하지만 인간 단백질(자동항체)에는 항체를 생성하지 않는다. 인간 항원에 대한 항체가 생성되는 경우도 있다.[2]
항로항체, 항라항체, 항Sm항체, 항nRNP항체, 항Scl-70항체, 항DSDNA항체, 항히스톤항체, 핵모공복합체 항체, 항중심항체, 항스p100항체 등 ANA의 아형이 많다. 이러한 항체 하위 유형은 각각 핵 내의 다른 단백질이나 단백질 복합체에 결합한다. 그들은 자기 면역성, 암, 감염을 포함한 많은 장애에서 발견되는데, 상태에 따라 항체의 기형이 다르다. 이를 통해 전신 루푸스 에리테마토스, ö그렌 증후군,[3] 슬러더마,[4] 혼합결합조직질환,[5] 다면염, 피부염, 자가면역간염[6], 약물유발 루푸스 등 일부 자가면역질환 진단에 ANA를 사용할 수 있다.[7]
ANA 테스트는 개인의 혈청 내에 존재하는 자가항암을 검출한다. ANA를 검출하고 정량화하는 데 사용되는 일반적인 테스트는 간접 면역유동성 및 효소 연계 면역유동성 검사(ELISA)이다. 면역유동성에서는 자가 항균성의 수준이 십일조로 보고된다. 이것은 자동항체체가 여전히 검출 가능한 혈청 중 가장 높은 희석이다. 1:160 이상 희석 시 양의 자동 항티바디 티트는 일반적으로 임상적으로 유의한 것으로 간주된다. 1:160 미만의 긍정적인 십일조는 건강한 인구의 최대 20%에 존재한다. 특히 노인들. 1:160 이상의 양성 십일조는 자가면역 장애와 밀접한 관련이 있지만 건강한 사람의 5%에서도 발견된다.[8][9] 자가항체검사는 자가면역 장애 진단에 유용하며, 모니터링 수준은 질병의 진행을 예측하는 데 도움이 된다.[7][10][11] 양성 ANA 테스트는 진단을 지원하는 다른 임상 또는 실험실 데이터가 없는 경우 거의 유용하지 않다.[12]
면역성 및 자가면역성
인체는 병원균에 대한 많은 방어 메커니즘을 가지고 있는데, 그 중 하나가 바로 구강 면역이다. 이 방어 메커니즘은 면역 자극에 반응하여 항체(대형 당단백질)를 생성한다. 이 과정에는 림프구(T세포와 B세포)와 항원이 세포 제시를 하는 등 면역체계의 많은 세포가 필요하다. 이 세포들은 이질적인 단백질(항원제)의 검출에 따른 면역 반응을 조정하여 이들 항원에 결합하는 항체를 생성한다. 정상적인 생리학에서 인간의 단백질(자동항체)을 인식하는 림프구는 프로그램된 세포사멸(사멸)을 겪거나 비기능적이 된다. 이러한 자기 강박성은 림프구가 인간의 세포 항원에 대한 면역 반응을 부추기지 않아야 한다는 것을 의미한다. 그러나 때로는 이 과정이 오작동하고 항체가 인간의 항원에 대항하여 생성되어 자가면역질환을 일으킬 수도 있다.[2]
ANA 하위 유형
ANA는 몇몇 건강한 사람들뿐만 아니라 많은 장애에서 발견된다. 이러한 질환은 전신 루푸스 에리테마토시스(SLE), 류마티스 관절염, ö그렌 증후군, 슬러더마, 다면염, 피부염, 1차 담도경화증, 약물 유도 루푸스, 자가면역 간염, 다면성 루푸스, 디스코이드 루푸스, 갑상선 질환, 청소년 특발성 관절염, 시뇨병, 주, 주술 등이 포함된다.나일강 피부염, 특발성 혈소판성 자반증, 감염 및 암. 이러한 항체는 그 특이성에 따라 세분될 수 있으며, 각 부분집합은 특정 장애에 대한 각기 다른 예방을 가지고 있다.[7][13]
추출가능핵항원
추출 가능한 핵항원(ENA)은 자가면역장애를 가진 사람들에게서 원래 항체 표적으로 확인되었던 자가면역제의 집단이다. 그것들은 식염수로 세포핵에서 추출될 수 있기 때문에 ENA라고 불린다.[7][14] ENA는 리보뉴클레오프로틴과 비히스테론 단백질로 구성되는데, 시제품 혈청을 제공한 기증자의 이름(Sm, Ro, La, Jo), 항체가 발견된 질병 설정 이름(SS-A, SS-B, Scl-70)[15]으로 명명된다.
Anti-Ro/SS-A 및 Anti-La/SS-B

각각 SS-A와 SS-B로도 알려진 항로 항체와 항라 항체는 외분비선에 영향을 미치는 자가면역 장애인 1차 쇠그렌 증후군에서 흔히 발견된다. 두 항체의 존재는 s그렌 증후군의 30~60%에서 발견되며, 항로 항체만 j그렌 증후군의 50~70%, 피하 관여의 SLE의 30%에서 발견되며, 항-라 항체는 거의 격리상태에서 발견되지 않는다.[10][16] SLE에서도 항-La 항체가 발견되지만, Sjögren의 증후군 또한 일반적으로 존재한다.[17] 항로항체는 자가면역간질환, 코엘리악질환, 자가면역류마티스질환, 심장신생아 루푸스 홍반, 다면염 등 다른 질환에서도 덜 발견된다.[18][19] 임신 중에는 항로 항체가 태반을 건너 아기에게 심장[20][21] 차단과 신생아 루푸스를 일으킬 수 있다.[22] 쇠그렌 증후군에서 항로항체와 항라항체는 조기발병, 질병 지속시간 증가, 편선확대, 분비선 밖의 질병, 림프구에 의한 분비샘 침투와 관련이 있다.[11] 항로 항체는 45kDa, 52kDa, 54kDa 및 60kDa 단백질과 RNA로 구성된 Ro-RNP 복합체의 구성요소에 한정된다. 60kDa DNA/RNA 결합 단백질과 52kDa T세포 규제 단백질은 항로 항체의 가장 우수한 특성 항원이다. 집합적으로, 이 단백질들은 hyRNAs, hY1-hY5와 연관된 리보핵단백질(RNP) 복합체의 일부분이다. La 항원은 RNA 중합효소 III의 48kDa 전사종말인자로, Ro-RNP 복합체와 관련된다.[15][16][23][24]
쇠그렌 증후군의 항체 생성 메커니즘은 완전히 이해되지는 않지만, 세포사멸(프로그램화된 세포사멸)과 분자모사술이 역할을 할 수도 있다.[11] 로와 라 항원은 사멸을 겪고 있는 세포의 표면에 발현되며 면역계의 세포와 상호작용으로 침샘 내의 염증을 일으킬 수 있다. 항체는 또한 분자 흉내를 통해 생성될 수 있는데, 교차 반응 항체가 바이러스와 인간 단백질 모두에 결합한다. 이것은 항원 중 하나인 Ro나 La와 함께 발생할 수 있으며, 이후에 상피세포가 퍼지는 것으로 알려진 과정을 통해 다른 단백질에 대한 항체를 생성할 수 있다. 레트로바이러스 개그 단백질은 라 단백질과 유사성을 보이며, 쇠그렌 증후군의 분자 흉내를 위한 가능한 예로 제안된다.[11][19]
Anti-Sm
Anti-Smith (Anti-Smith) 항체는 SLE의 매우 특별한 표식이다. SLE가 없는 사람의 약 99%는 항Sm 항체가 부족하지만 SLE를 가진 사람의 20%만이 항체를 가지고 있다. 이들은 SLE에서 중추신경계 관여, 신장병, 폐섬유화, 심막염과 관련이 있지만 질병 활동과는 관련이 없다. 항Sm 항체의 항원은 소형 핵 리보핵단백질(snRNPs)의 핵심 단위로서 A에서 G로 불리며 U1, U2, U4, U5, U6 snRNP에 바인딩된다. 가장 일반적으로, 항체는 B, B, D 단위에 특정된다.[25][26] 분자 및 역학 연구는 단백질이 엡스타인-바르 바이러스 단백질과 어느 정도 유사하기 때문에 분자 흉내에 의해 항Sm 항체가 유도될 수 있다는 것을 시사한다.[27][28]
Anti-nRNP/anti-U1-RNP
항 U1-RNP 항체로도 알려진 항핵 리보핵단백질(anti-nRNP) 항체는 SLE의 30~40%에서 발견된다. 그것들은 종종 항-Sm 항체와 함께 발견되지만, 그것들은 다른 임상적 연관성과 연관되어 있을 수 있다. 이 항체들은 SLE 외에도 혼합 결합조직 질환과 연관성이 높다. 항-nRNP 항체는 snRNP의 A와 C 핵심 단위를 인식하고, 이로 인해 주로 U1-snRNP에 바인딩된다.[25][29] RNP에 대한 면역 반응은 세포막에 있는 핵성분의 세포 표백에 의해 발생할 수 있다. U1-RNP 폴리펩타이드와 엡스타인-바르 바이러스 폴리펩타이드의 유사성 때문에 분자 모방도 이러한 단백질에 대한 항체 생성을 위한 가능한 메커니즘으로 제시되어 왔다.[30]
항-Scl-70/항-토포아세라제 I
Scl-70 항체는 sclorderma와 연관되어 있다.[31] 경피세포에 대한 항체의 민감도는 약 34%이지만, 경피적 관여가 분산된 경우(40%)가 높고, 경피적 관여가 제한적인 경우(10%)가 낮다. 항체의 특이성은 다른 류머티즘 질환과 정상 개인에서 각각 98%, 99.6%이다.[7][32] 이러한 항체는 슬러더마 외에도 SLE를 가진 사람의 약 5%에서 발견된다.[33] 항Scl-70 항체의 항원적 목표는 topoosomerase I이다.[34]
안티 조-1
항-Jo-1 항체가 ANA에 포함되는 경우가 많지만, 실제로는 히스티딘 로드 tRNA의 합성에 필수적인 아미노산성질-tRNA 합성효소인 세포질 단백질인 히스티딜-tRNA 합성효소는 히스티딘 로드 tRNA의 합성에 필수적이다.[14] 다면염, 피부염과 연관성이 높으며, 다른 결합조직 질환에서는 거의 발견되지 않는다. 다면염의 약 20-40%는 Jo-1 항체에 양성이며 대부분은 Jo-1 증후군으로 알려진 중간 폐질환, HLA-DR3 및 HLA-DRW52 인간 백혈구 항원(HLA) 표지를 갖게 된다.[25][35]
Anti-dsDNA
이중 좌초 방지 DNA(anti-dsDNA) 항체는 SLE와 연관성이 높다. 그들은 그 질병의 매우 구체적인 표식이며,[7] 일부 연구에서는 거의 100%를 인용하고 있다. 민감도에 대한 데이터의 범위는 25~85%이다. 십일조라고 알려진 항-dsDNA 항체 수준은 SLE의 질병 활동과 관련이 있다; 높은 수치는 더 활발한 루푸스를 나타낸다. 항 dsdna 항체의 존재는 루푸스 신염과도 연관되어 있으며 그들이 원인이라는 증거가 있다. 일부 항 dsDNA 항체는 헤파란 황산염, 콜라겐 IV, 피브로넥틴, 라미네인 등 신장의 글로머 지하막(GBM)에서 발견된 다른 항원과 교차반응한다. 신장 내 이러한 항원에 결합하면 염증을 유발하고 고정 작용을 보완하여 신장 손상을 초래할 수 있다. 높은 DNA 결합과 낮은 C3 레벨의 존재는 SLE 진단에 대한 예측 값(94%)이 매우 높은 것으로 나타났다.[36] 또한 항 dsDNA 항체가 막 항원을 결합한 후 세포 표면에 표시될 때 세포에 의해 내장이 되는 가능성도 있다. 이것은 신장 내 T세포에 의한 염증 반응을 촉진시킬 수 있다. 모든 항DSDNA 항체가 루푸스 신염과 연관되어 있는 것은 아니며, 다른 요인들이 없을 때 이 증상을 일으킬 수 있다는 점에 유의해야 한다. 항 dsdna 항체의 항원은 이중으로 좌초된 dna이다.[37][38]
항히스톤 항체
항히스톤 항체는 약물 유발 루푸스 환자의 최대 75~95%와 특발성 SLE의 75%의 혈청에서 발견된다. SLE의 항-dsDNA 항체와 달리 이들 항체는 보완을 고정하지 않는다. 약물 유발 루푸스에서 가장 흔하게 발견되지만 SLE, 슬러더마, 류마티스성 관절염, 미분화 결합조직 질환의 일부 사례에서도 발견된다. 많은 약물이 약물 유발 루푸스를 유발한다고 알려져 있으며, 여러 히스톤 단백질과 DNA로 교차 반응하는 핵소체 내에서 다양한 항원 표적을 생성한다. 프로파이나미드는 히스톤 H2A와 H2B 복합체에 항체를 생성하는 약물 유도 루푸스의 형태를 유발한다.[39][40]
Anti-gp210 및 Anti-p62
항글리코프로틴-210(anti-gp210) 항체와 항핵포폴린 62(anti-p62) 항체는 모두 핵막의 성분에 대한 항체로 1차 담도경화증(PBC)에서 발견된다. 각 항체는 PBC의 약 25~30%에 존재한다. 두 항체의 항원은 핵막의 성분이다. gp210은 핵공극의 성분을 핵막에 고정시키는 데 관여하는 200kDa 단백질이다. p62 항원은 60kDa 핵공기 복합체다.[41][42]
항중심항체

항중심항체는 제한된 경피적 전신 경화증후군, 일차 담도경화증, 근위 경화증이라고도 알려져 있다.[43] 6개의 알려진 항원이 있는데, 이들은 모두 센트롬과 관련이 있다; CENP-A에서 CENP-F까지. CENP-A는 17kDa 히스톤 H3와 같은 단백질이다. CENP-B는 헤테로크로마틴 접힘에 관여하는 80kDa DNA 결합 단백질이다. CENP-C는 키네토코어 조립체에 관여하는 140kDa 단백질이다. CENP-D는 알려지지 않은 기능의 50kDa 단백질이지만, 크로마틴 응축에 관련된 다른 단백질인 RCC1과 동질일 수 있다. CENP-E는 키네신 모터 단백질 계열의 312kDa 단백질이다. CENP-F는 핵 매트릭스에서 나온 367kDa 단백질로, 유사시 G2 후반 단계의 키네토코레와 연관된다. CENP-A, B, C 항체는 가장 흔하게 발견되며(시스템 경화증의 16~42%) 레이노 현상, 텔랑게릭타시아스, 폐 관여, 전신 경화증의 조기 발병과 관련이 있다.[32][44][45]
Anti-sp100
항 sp100 항체는 1차 담도경화증(PBC)의 약 20~30%에서 발견된다. 그들은 PBC가 없는 소수의 사람들에서 발견되며, 따라서 그 병의 매우 구체적인 표식이다. sp100 항원은 핵체 내에서 발견된다; 세포 성장과 분화에 역할을 할 수 있는 핵의 큰 단백질 복합체들.[46]
Anti-PM-Scl
항-PM-Scl 항체는 다면염/계통경화증(PM/SSC) 중복 증후군의 최대 50%에서 발견된다. 혈청 내에 항체가 있는 사람의 약 80%가 이 장애를 갖게 될 것이다. 항체의 존재는 PM/SSC 겹침 증후군의 제한된 피부 관여와 관련이 있다. 항체의 항원적 표적은 뉴클레오루스의 RNA 처리 엑소솜 콤플렉스의 성분이다.[32] There are ten proteins in this complex and antibodies to eight of them are found at varying frequencies; PM/Scl-100 (70–80%), PM/Scl-75 (46–80%), hRrp4 (50%), hRrp42 (21%), hRrp46 (18%), hCs14 (14%), hRrp41 (10%) and hRrp40 (7%).[47]
항DFS70 항체
항DFS70 항체는 간접면역결핍에서 촘촘한 미세한 점무늬를 생성하며 정상과 다양한 조건에서 발견되지만 전신 자가면역병리학과는 관련이 없다. 따라서, 그들은 ANA 양성자에서의 그러한 조건들을 배제하는데 도움을 주는 데 사용될 수 있다. 상당수의 환자들은 ANA 양성에 근거하여 전신 루푸스 홍반 또는 미분화 결합 조직 질환으로 진단된다. 정의된 자동항체(예: 항-ENA 항체)를 검출할 수 없는 경우, 진단 확인을 위해 항DFS70 항체의 검사를 권고한다. 항DFS70 항체 검사는 CE 마크 검사로 이용할 수 있다. 현재까지는 FDA가 허가한 검사를 받을 수 없다.[48]
ANA시험
혈액 속의 ANA의 존재는 선별 검사를 통해 확인할 수 있다. ANA 검출 테스트는 많지만 검사에 가장 많이 사용되는 테스트는 간접면역결핍과 효소연계면역결핍검사(ELISA)이다.[49] ANA 검출에 따라 다양한 아형이 결정된다.[7]
간접면역결핍증
간접면역결핍은 ANA에 가장 흔히 사용되는 검사 중 하나이다. 전형적으로 HEP-2 세포는 인간 혈청의 항체를 검출하는 기질로 사용된다. 현미경 슬라이드는 HEP-2 세포로 코팅되고 혈청은 세포와 함께 배양된다. 만약 언급된 항체들과 표적항체가 존재한다면 그들은 세포의 항원에 결합할 것이다; ANA의 경우, 항체는 핵에 결합할 것이다. 이들은 항체에 결합하는 형광 태그(일반적으로 FITC 또는 로도신 B) 항인간 항체를 추가하여 시각화할 수 있다. 이 분자는 특정한 파장의 빛이 그 파장에 비치면 형광 투과될 것이며, 이것은 현미경으로 볼 수 있다. 인간 혈청에 존재하는 항체와 세포 내 항원의 국소화에 따라 HEP-2 세포에서 뚜렷한 형광 패턴을 볼 수 있게 된다.[50][51] 혈청을 희석시켜 항체 수준을 분석한다. 1:40/1:80의 티트리에서 형광이 보이면 ANA 테스트는 양성으로 간주된다. 건강한 사람, 특히 노인에서 최대 20%까지 낮은 양수(양수 1:160)가 발견되기 때문에 높은 십이십자는 임상적으로 더 중요하다. 건강한 인구의 약 5%만이 1:160 이상의 ANA 십일조를 가지고 있다.[7][52]
HEP-2
HEP-2 세포가 도입된 1975년경까지는 동물 조직이 면역유동성의 표준 기질로 사용되었다.[10] HEP-2 세포는 현재 면역유로에 의한 ANA 검출에 가장 흔한 기질 중 하나이다.[53]
원래 후두암 변종이 시작되었는데, 세포 라인이 헤라 세포에 의해 오염되어 변위되었고, 현재는 실제 헤라 세포로 확인되었다.[54]
이들은 크기가 크고 세포 라인의 유사분열(세포분열) 발생률이 높아 기존에 사용하던 동물 조직보다 우수하다. 이것은 센트롬레 항체와 같은 유사분열 특이 항원에 대한 항체의 탐지를 가능하게 한다. 아세톤은 세포의 고정(다른 고정제는 항원을 씻어낼 수 있다)에 사용되기 때문에 항로 항체의 식별도 허용한다.[55]
HEP-2 세포에는 균질, 반점, 핵, 핵 막, 중심, 핵 점, 플롬폴릭 등 많은 핵 얼룩무늬가 있다. 균질 패턴은 응축된 염색체와 상간 염색체가 얼룩졌을 때 나타난다. 이 패턴은 항 dsDNA 항체, 핵성분 항체, 항히스톤 항체와 연관되어 있다. 두 가지 얼룩무늬가 있다: 미세한 무늬와 거친 무늬. 미세한 얼룩무늬는 미세한 핵 얼룩을 가지고 있고, 무균의 은유 크롬틴이 있는데, 이것은 항로 및 항라 항체와 관련이 있다. 거친 얼룩무늬는 반U1-RNP 항체와 항-Sm 항체에 의해 야기되는 거친 세밀한 핵 얼룩을 가지고 있다. 핵질 얼룩무늬는 항Scl-70, 항PM-Scl, 항피브릴라린, 항Th/To를 포함한 많은 항체와 연관되어 있다. 핵막 얼룩은 세포핵 주위의 형광 고리로 나타나며, 항 gp210 항체와 항 p62 항체에 의해 생성된다. 센트로메르 패턴은 세포 내 염색체 수에 해당하는 위상간 세포와 유사체 세포에서 여러 개의 핵 점을 보여준다. 핵 점 패턴은 위상간 세포에서 13~25개의 핵 점 사이를 나타내며 항-sp100 항체에 의해 생성된다. 플롬폴릭 패턴은 증식하는 세포핵 항원에 대한 항체에 의해 발생한다.[25][52][56][57] 간접면역결핍은 HEP-2 세포에서 ANA를 검출하는 데 있어 ELISA에 비해 약간 우월한 것으로 나타났다.[53]
크리티디아 루실리아과
크리티디아 루실리아는 단일 세포 원생이다. 그것들은 항-dsDNA 항체의 탐지를 위한 면역유동성의 기질로 사용된다. 그들은 서로 연결된 원형 dsDNA 분자의 네트워크를 가진 큰 미토콘드리온인 키네토플라스라고 알려진 오르가넬을 가지고 있다. 항 dsdNA 항체와 형광 라벨이 부착된 항인간 항체를 함유한 혈청으로 배양한 후 키네토플라스틱이 형광 투과된다. 이 오르가넬에 다른 핵 항원이 없다는 것은 C.luciliae를 기질로 사용하면 항-dsDNA 항체의 특정 검출이 가능하다는 것을 의미한다.[7][58][59]
엘리사
효소연계 면역항암제 검사(ELISA)는 ANA 검출에 항원 코팅 마이크로트리트레 판을 사용한다.[60] 마이크로타이어 판의 각 우물은 특정 항체를 검출하거나 ANA를 선별하기 위해 각각 단일 항원 또는 복수의 항원으로 코팅된다. 그 항원은 세포 추출물 또는 재조합물 중 하나이다. 혈청은 판의 우물에서 배양되어 씻겨 나간다. 항원과 결합하는 항체가 있으면 세척 후에도 그대로 남는다. 고추냉이 과산화효소와 같은 효소에 결합된 2차 항인간 항체가 첨가된다. 효소 반응은 항원에 묶인 항체의 양에 비례하는 용액의 색에 변화를 일으킬 것이다.[10][51][61] 면역유동성과 다른 ELISA 키트에 의한 ANA 검출에는 상당한 차이가 있으며, 이들 사이에는 한계적인 합의만 있을 뿐이다. 임상의사는 다양한 검사의 결과를 평가하기 위해 차이점을 숙지해야 한다.[60]
민감도
다음 표에는 다양한 질병에 대한 다양한 유형의 ANA의 민감도가 나열되어 있다.
| ANA형 | 표적항원 | 민감도(%) | ||||||
|---|---|---|---|---|---|---|---|---|
| 슬레 | 약물로 인한 LE | 확산 전신 경화증 | 제한적 전신성 경화증 | 쇠그렌 증후군 | 염증성 근병증 | MCTD | ||
| 모든 ANA (간접 IF에 의한) | 다양한 | 95[62] | 100[62] | 80[62] | 80[62] | 70[62] | 40–60 | 95[62] |
| Anti-dsDNA | DNA | 60[62] | –[62] | –[62] | –[62] | 30[62] | – | -[62] |
| Anti-Sm | snRNP의 핵심 단백질 | 40[62] | –[62] | –[62] | –[62] | –[62] | – | -[62] |
| 항히스토네 | 히스톤 | 60[62] | 90[62] | –[62] | –[62] | –[62] | – | -[62] |
| Anti Scl-70 | I형 topoisomerase | –[62] | –[62] | 20[62] | 10[62] | –[62] | – | -[62] |
| 반센트롬레 | 구심단백질 | –[62] | –[62] | 30[62] | 80[62] | –[62] | – | -[62] |
| SS-A(Ro) | RNPs | 40[62] | –[62] | –[62] | –[62] | 50[62] | 10 | -[62] |
| SS-B(La) | RNPs | 10–15 | – | – | – | 60–90 | – | |
| – = 5% 미만의 민감도 | ||||||||
일부 ANA는 몇 가지 유형의 질병에 나타나 검사 특이성이 낮아진다. 예를 들어 IgM-rhumatoid factor (IgM-RF)는 ANA와 교차반응하여 거짓 양성면역결핍증을 주는 것으로 나타났다.[63] 자가면역 갑상선 질환 환자에게서 항DNA 항체는 물론 ANA 양성 반응이 보고됐다.[64][65] ANA는 자가면역 갑상선 질환이나 류마티스성 관절염을 가진 사람의 최대 45%와 HIV나 C형 간염에 걸린 사람의 최대 15%를 양성반응으로 얻을 수 있다.[65][66][67][68] 미국 루푸스 재단(Lupus Foundation of America)에 따르면, "일반 인구의 약 5%가 ANA 양성 반응을 보일 것이다. 그러나, 적어도 95%의 ANA 양성 환자들은 루푸스를 가지고 있지 않다. ANA 양성 검사는 가족 구성원이 루푸스의 증거가 없더라도 가족 내에서 실시될 수 있다."[9] 반면 실제로 루푸스를 앓는 환자의 95%가 ANA 양성반응을 보였지만 "소수자만이 ANA 음성반응을 보이고, 그 중 상당수는 다른 항체(항인산염 항체, 항로, 항 SSA 등)나 ANA가 스테로이드, 세포독성 약물, 또는 우레미아(키)에서 음성으로 변환된 항체를 갖고 있다"고 한다.dney failure)."[9]
역사
LE 세포는 1948년 하그레이브스 외 연구원에 의해 골수에서 발견되었다.[69] 1957년 홀보로우 외 연구진은 간접 면역 결핍증을 이용하여 ANA를 처음 입증했다.[70] 이것은 세포핵에 영향을 미치는 과정이 SLE에 영향을 미친다는 첫 번째 징후였다. 1959년에 SLE를 가진 개개인의 혈청이 추출 가능한 핵항원(ENA)으로 알려진 핵의 식염수 추출물로 침전된 항체를 포함하고 있다는 것이 밝혀졌다. 이것은 ENA 항원과 각각의 항체의 특성화를 이끌었다. 따라서 1966년과 1971년에는 각각 항Sm 항체와 항RNP 항체가 발견되었다. 1970년대에 항로/항SS-A 항체와 항라/항SS-B 항체가 발견되었다. scl-70 항체는 1979년 scleroderma에 대한 특정 항체로 알려져 있었으나, 항원(topoisomerase-I)은 1986년까지 특성화되지 않았다. Jo-1 항원과 항체는 1980년에 특징지어졌다.[7][19]
참고 항목
참조
- ^ "Medical Subject Headings (MeSH)". National Library of Medicine. Retrieved 12 February 2013.
- ^ a b Reece, Jane; Campbell, Neil (2005). Biology (7th ed.). San Francisco: Pearson/Benjamin-Cummings. ISBN 978-0805371468.[페이지 필요]
- ^ Cervera, R; Font, J; Ramos-Casals, M; García-Carrasco, M; Rosas, J; Morlà, RM; Muñoz, FJ; Artigues, A; Pallarés, L; Ingelmo, M (2000). "Primary Sjögren's syndrome in men: clinical and immunological characteristics". Lupus. 9 (1): 61–4. doi:10.1177/096120330000900111. PMID 10713648. S2CID 39696993.
- ^ Barnett, AJ; McNeilage, LJ (May 1993). "Antinuclear antibodies in patients with scleroderma (systemic sclerosis) and in their blood relatives and spouses". Annals of the Rheumatic Diseases. 52 (5): 365–8. doi:10.1136/ard.52.5.365. PMC 1005051. PMID 8323384.
- ^ Burdt, Mark A.; Hoffman, Robert W.; Deutscher, Susan L.; Wang, Grace S.; Johnson, Jane C.; Sharp, Gordon C. (1 May 1999). "Long-term outcome in mixed connective tissue disease: Longitudinal clinical and serologic findings". Arthritis & Rheumatism. 42 (5): 899–909. doi:10.1002/1529-0131(199905)42:5<899::AID-ANR8>3.0.CO;2-L. PMID 10323445.
- ^ Obermayer-Straub, P; Strassburg, CP; Manns, MP (2000). "Autoimmune hepatitis". Journal of Hepatology. 32 (1 Suppl): 181–97. doi:10.1016/S0168-8278(00)80425-0. PMID 10728804.
- ^ a b c d e f g h i j Kavanaugh A, Tomar R, Reveille J, Solomon DH, Homburger HA (January 2000). "Guidelines for clinical use of the antinuclear antibody test and tests for specific autoantibodies to nuclear antigens. American College of Pathologists". Archives of Pathology & Laboratory Medicine. 124 (1): 71–81. doi:10.5858/2000-124-0071-GFCUOT. PMID 10629135.
- ^ Tan, EM; Feltkamp, TE; Smolen, JS; Butcher, B; Dawkins, R; Fritzler, MJ; Gordon, T; Hardin, JA; Kalden, JR; Lahita, RG; Maini, RN; McDougal, JS; Rothfield, NF; Smeenk, RJ; Takasaki, Y; Wiik, A; Wilson, MR; Koziol, JA (September 1997). "Range of antinuclear antibodies in "healthy" individuals". Arthritis and Rheumatism. 40 (9): 1601–11. doi:10.1002/art.1780400909. PMID 9324014.
- ^ a b c "The Antinuclear Antibody Test: What It Means". Lupus Foundation of America. Retrieved 7 June 2013.
- ^ a b c d Kumar, Y; Bhatia, A; Minz, RW (Jan 2, 2009). "Antinuclear antibodies and their detection methods in diagnosis of connective tissue diseases: a journey revisited". Diagnostic Pathology. 4: 1. doi:10.1186/1746-1596-4-1. PMC 2628865. PMID 19121207.
- ^ a b c d Yamamoto K (January 2003). "Pathogenesis of Sjögren's syndrome". Autoimmun Rev. 2 (1): 13–8. doi:10.1016/S1568-9972(02)00121-0. PMID 12848970.
- ^ Richardson, B; Epstein, WV (September 1981). "Utility of the fluorescent antinuclear antibody test in a single patient". Annals of Internal Medicine. 95 (3): 333–8. doi:10.7326/0003-4819-95-3-333. PMID 7023311.
- ^ Malleson PN, Mackinnon MJ, Sailer-Hoeck M, Spencer CH (2010). "Review for the generalist: The antinuclear antibody test in children – When to use it and what to do with a positive titer". Pediatr Rheumatol Online J. 8: 27. doi:10.1186/1546-0096-8-27. PMC 2987328. PMID 20961429.
- ^ a b Damoiseaux, JG; Tervaert, JW (January 2006). "From ANA to ENA: how to proceed?". Autoimmunity Reviews. 5 (1): 10–7. doi:10.1016/j.autrev.2005.05.007. PMID 16338206.
- ^ a b Wenzel, J; Gerdsen, R; Uerlich, M; Bauer, R; Bieber, T; Boehm, I (December 2001). "Antibodies targeting extractable nuclear antigens: historical development and current knowledge". The British Journal of Dermatology. 145 (6): 859–67. doi:10.1046/j.1365-2133.2001.04577.x. PMID 11899137. S2CID 45350044.
- ^ a b Hernández-Molina, G; Leal-Alegre, G; Michel-Peregrina, M (January 2011). "The meaning of anti-Ro and anti-La antibodies in primary Sjögren's syndrome". Autoimmunity Reviews. 10 (3): 123–5. doi:10.1016/j.autrev.2010.09.001. PMID 20833272.
- ^ Kassan, SS; Moutsopoulos, HM (June 2004). "Clinical manifestations and early diagnosis of Sjögren syndrome". Arch Intern Med. 164 (12): 1275–84. doi:10.1001/archinte.164.12.1275. PMID 15226160.
- ^ Defendenti, C; Atzeni, F; Spina, MF; Grosso, S; Cereda, A; Guercilena, G; Bollani, S; Saibeni, S; Puttini, PS (January 2011). "Clinical and laboratory aspects of Ro/SSA-52 autoantibodies". Autoimmunity Reviews. 10 (3): 150–4. doi:10.1016/j.autrev.2010.09.005. PMID 20854935.
- ^ a b c Venables, PJ (June 2004). "Sjögren's syndrome". Best Practice & Research. Clinical Rheumatology. 18 (3): 313–29. doi:10.1016/j.berh.2004.02.010. PMID 15158743.
- ^ Clowse, Megan E. B.; Eudy, Amanda M.; Kiernan, Elizabeth; Williams, Matthew R.; Bermas, Bonnie; Chakravarty, Eliza; Sammaritano, Lisa R.; Chambers, Christina D.; Buyon, Jill (1 July 2018). "The prevention, screening and treatment of congenital heart block from neonatal lupus: a survey of provider practices". Rheumatology (Oxford, England). 57 (suppl_5): v9–v17. doi:10.1093/rheumatology/key141. ISSN 1462-0332. PMC 6099126. PMID 30137589.
- ^ Sonesson, Sven-Erik; Hedlund, Malin; Ambrosi, Aurélie; Wahren-Herlenius, Marie (1 October 2017). "Factors influencing fetal cardiac conduction in anti-Ro/SSA-positive pregnancies". Rheumatology (Oxford, England). 56 (10): 1755–1762. doi:10.1093/rheumatology/kex263. ISSN 1462-0332. PMID 28957562. S2CID 3803597.
- ^ Scofield, RH (May 8, 2004). "Autoantibodies as predictors of disease". Lancet. 363 (9420): 1544–6. doi:10.1016/S0140-6736(04)16154-0. PMID 15135604. S2CID 13983923.
- ^ Deshmukh, US; Bagavant, H; Lewis, J; Gaskin, F; Fu, SM (November 2005). "Epitope spreading within lupus-associated ribonucleoprotein antigens". Clinical Immunology (Orlando, Fla.). 117 (2): 112–20. doi:10.1016/j.clim.2005.07.002. PMID 16095971.
- ^ Ben-Chetrit, E (May 1993). "The molecular basis of the SSA/Ro antigens and the clinical significance of their autoantibodies". British Journal of Rheumatology. 32 (5): 396–402. doi:10.1093/rheumatology/32.5.396. PMID 8495261.
- ^ a b c d von Mühlen, CA; Tan, EM (April 1995). "Autoantibodies in the diagnosis of systemic rheumatic diseases". Seminars in Arthritis and Rheumatism. 24 (5): 323–58. doi:10.1016/S0049-0172(95)80004-2. PMID 7604300.
- ^ Lyons, R; Narain, S; Nichols, C; Satoh, M; Reeves, WH (June 2005). "Effective use of autoantibody tests in the diagnosis of systemic autoimmune disease". Annals of the New York Academy of Sciences. 1050: 217–28. Bibcode:2005NYASA1050..217L. doi:10.1196/annals.1313.023. PMID 16014537. S2CID 7150107.
- ^ Zieve, GW; Khusial, PR (September 2003). "The anti-Sm immune response in autoimmunity and cell biology". Autoimmunity Reviews. 2 (5): 235–40. doi:10.1016/S1568-9972(03)00018-1. PMID 12965173.
- ^ Migliorini, P; Baldini, C; Rocchi, V; Bombardieri, S (February 2005). "Anti-Sm and anti-RNP antibodies". Autoimmunity. 38 (1): 47–54. doi:10.1080/08916930400022715. PMID 15804705. S2CID 1627719.
- ^ Benito-Garcia, E; Schur, PH; Lahita, R; American College of Rheumatology Ad Hoc Committee on Immunologic Testing, Guidelines (Dec 15, 2004). "Guidelines for immunologic laboratory testing in the rheumatic diseases: anti-Sm and anti-RNP antibody tests". Arthritis and Rheumatism. 51 (6): 1030–44. doi:10.1002/art.20836. PMID 15593352.
- ^ Venables PJ (2006). "Mixed connective tissue disease". Lupus. 15 (3): 132–7. doi:10.1191/0961203306lu2283rr. PMID 16634365. S2CID 25736411.
- ^ Jimenez, SA; Derk, CT (Jan 6, 2004). "Following the molecular pathways toward an understanding of the pathogenesis of systemic sclerosis". Annals of Internal Medicine. 140 (1): 37–50. doi:10.7326/0003-4819-140-2-200401200-00013. PMID 14706971.
- ^ a b c Ho, KT; Reveille, JD (2003). "The clinical relevance of autoantibodies in scleroderma". Arthritis Research & Therapy. 5 (2): 80–93. doi:10.1186/ar628. PMC 165038. PMID 12718748.
- ^ Mahler M, Silverman ED, Schulte-Pelkum J, Fritzler MJ (September 2010). "Anti-Scl-70 (topo-I) antibodies in SLE: Myth or reality?". Autoimmun Rev. 9 (11): 756–60. doi:10.1016/j.autrev.2010.06.005. PMID 20601198.
- ^ Guldner, HH; Szostecki, C; Vosberg, HP; Lakomek, HJ; Penner, E; Bautz, FA (1986). "Scl 70 autoantibodies from scleroderma patients recognize a 95 kDa protein identified as DNA topoisomerase I". Chromosoma. 94 (2): 132–8. doi:10.1007/BF00286991. PMID 2428564. S2CID 24851422.
- ^ Schmidt, WA; Wetzel, W; Friedländer, R; Lange, R; Sörensen, HF; Lichey, HJ; Genth, E; Mierau, R; Gromnica-Ihle, E (2000). "Clinical and serological aspects of patients with anti-Jo-1 antibodies—an evolving spectrum of disease manifestations". Clinical Rheumatology. 19 (5): 371–7. doi:10.1007/s100670070030. PMID 11055826. S2CID 3014699.
- ^ Weinstein, A; Bordwell, B; Stone, B; Tibbetts, C; Rothfield, NF (February 1983). "Antibodies to native DNA and serum complement (C3) levels. Application to diagnosis and classification of systemic lupus erythematosus". The American Journal of Medicine. 74 (2): 206–16. doi:10.1016/0002-9343(83)90613-7. PMID 6600582.
- ^ Mok, CC; Lau, CS (July 2003). "Pathogenesis of systemic lupus erythematosus". Journal of Clinical Pathology. 56 (7): 481–90. doi:10.1136/jcp.56.7.481. PMC 1769989. PMID 12835292.
- ^ Yung, S; Chan, TM (February 2008). "Anti-DNA antibodies in the pathogenesis of lupus nephritis—the emerging mechanisms". Autoimmunity Reviews. 7 (4): 317–21. doi:10.1016/j.autrev.2007.12.001. PMID 18295737.
- ^ Vasoo, S (2006). "Drug-induced lupus: an update". Lupus. 15 (11): 757–61. doi:10.1177/0961203306070000. PMID 17153847. S2CID 17593016.
- ^ Katz, U; Zandman-Goddard, G (November 2010). "Drug-induced lupus: an update". Autoimmunity Reviews. 10 (1): 46–50. doi:10.1016/j.autrev.2010.07.005. PMID 20656071.
- ^ Hu, T; Guan, T; Gerace, L (August 1996). "Molecular and functional characterization of the p62 complex, an assembly of nuclear pore complex glycoproteins". The Journal of Cell Biology. 134 (3): 589–601. doi:10.1083/jcb.134.3.589. PMC 2120945. PMID 8707840.
- ^ Mackay, IR; Whittingham, S; Fida, S; Myers, M; Ikuno, N; Gershwin, ME; Rowley, MJ (April 2000). "The peculiar autoimmunity of primary biliary cirrhosis". Immunological Reviews. 174: 226–37. doi:10.1034/j.1600-0528.2002.017410.x. PMID 10807519. S2CID 596338.
- ^ Kallenberg, CG (March 1990). "Anti-centromere antibodies (ACA)". Clinical Rheumatology. 9 (1 Suppl 1): 136–9. doi:10.1007/BF02205562. PMID 2203592. S2CID 43833409.
- ^ Rattner, JB; Mack, GJ; Fritzler, MJ (July 1998). "Autoantibodies to components of the mitotic apparatus". Molecular Biology Reports. 25 (3): 143–55. doi:10.1023/A:1016523013819. PMID 9700050. S2CID 8595680.
- ^ Renz, Harald (2012). Autoimmune diagnostics. Berlin: De Gruyter. ISBN 978-3-11-022864-9.
- ^ Worman, HJ; Courvalin, JC (June 2003). "Antinuclear antibodies specific for primary biliary cirrhosis". Autoimmunity Reviews. 2 (4): 211–7. doi:10.1016/S1568-9972(03)00013-2. PMID 12848948.
- ^ Mahler, M; Raijmakers, R (August 2007). "Novel aspects of autoantibodies to the PM/Scl complex: clinical, genetic and diagnostic insights". Autoimmunity Reviews. 6 (7): 432–7. doi:10.1016/j.autrev.2007.01.013. PMID 17643929.
- ^ Mahler, Michael; Meroni, Pier Luigi; Andrade, Luis E.; Khamashta, Munther; Bizzaro, Nicola; Casiano, Carlos A.; Fritzler, Marvin J. (2016). "Towards a better understanding of the clinical association of anti-DFS70 autoantibodies". Autoimmunity Reviews. 15 (2): 198–201. doi:10.1016/j.autrev.2015.11.006. PMID 26588998.
- ^ Granito A, Muratori P, Quarneti C, Pappas G, Cicola R, Muratori L (January 2012). "Antinuclear antibodies as ancillary markers in primary biliary cirrhosis". Expert Review of Molecular Diagnostics. 12 (1): 65–74. doi:10.1586/erm.11.82. PMID 22133120. S2CID 28444340.
- ^ Klein, Wulf B. Storch. Transl. by R. A. (2000). Immunofluorescence in clinical immunology : a primer and atlas. Basel [u.a.]: Birkhäuser. ISBN 978-3764361822.
- ^ a b González-Buitrago, JM; González, C (March 2006). "Present and future of the autoimmunity laboratory". Clinica Chimica Acta; International Journal of Clinical Chemistry. 365 (1–2): 50–7. doi:10.1016/j.cca.2005.07.023. PMID 16126186.
- ^ a b Tozzoli R, Bizzaro N, Tonutti E, Villalta D, Bassetti D, Manoni F, Piazza A, Pradella M, Rizzotti P (February 2002). Italian Society of Laboratory Medicine Study Group on the Diagnosis of Autoimmune Diseases. "Guidelines for the laboratory use of autoantibody tests in the diagnosis and monitoring of autoimmune rheumatic diseases". American Journal of Clinical Pathology. 117 (2): 316–24. doi:10.1309/Y5VF-C3DM-L8XV-U053. PMID 11863229.
- ^ a b Ulvestad, E (March 2001). "Performance characteristics and clinical utility of a hybrid ELISA for detection of ANA". APMIS. 109 (3): 217–22. doi:10.1034/j.1600-0463.2001.090305.x. PMID 11430499. S2CID 22229427.
- ^ Lacroix M (January 2008). "Persistent use of "false" cell lines". Int. J. Cancer. 122 (1): 1–4. doi:10.1002/ijc.23233. PMID 17960586. S2CID 27432788.
- ^ Keren, DF (June 2002). "Antinuclear antibody testing". Clinics in Laboratory Medicine. 22 (2): 447–74. doi:10.1016/S0272-2712(01)00012-9. PMID 12134471.
- ^ Nesher, G; Margalit, R; Ashkenazi, YJ (April 2001). "Anti-nuclear envelope antibodies: Clinical associations". Seminars in Arthritis and Rheumatism. 30 (5): 313–20. doi:10.1053/sarh.2001.20266. PMID 11303304.
- ^ Sack, U; Conrad, K; Csernok, E; Frank, I; Hiepe, F; Krieger, T; Kromminga, A; Landenberg, Pv; Messer, G; Witte, T; Mierau, R (June 2009). die deutsche EASI-Gruppe (European Autoimmunity Standardization, Initiative). "Autoantibody detection by indirect immunofluorescence on HEp-2 cells" (PDF). Deutsche Medizinische Wochenschrift. 134 (24): 1278–82. doi:10.1055/s-0029-1225278. PMID 19499499.
- ^ Slater, NG; Cameron, JS; Lessof, MH (September 1976). "The Crithidia luciliae kinetoplast immunofluorescence test in systemic lupus erythematosus". Clinical and Experimental Immunology. 25 (3): 480–6. PMC 1541410. PMID 786521.
- ^ Shapiro, TA; Englund, PT (1995). "The structure and replication of kinetoplast DNA". Annual Review of Microbiology. 49: 117–43. doi:10.1146/annurev.mi.49.100195.001001. PMID 8561456.
- ^ a b Emlen, W; O'Neill, L (September 1997). "Clinical significance of antinuclear antibodies: comparison of detection with immunofluorescence and enzyme-linked immunosorbent assays". Arthritis and Rheumatism. 40 (9): 1612–8. doi:10.1002/art.1780400910. PMID 9324015.
- ^ Deshpande, S. S. (1996). Enzyme immunoassays: from concept to product development. London: Chapman & Hall. ISBN 978-0-412-05601-7.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap 표 6-2인치:
- ^ Frokjaer, Vibe G.; Mortensen, Erik L.; Nielsen, Finn Å.; Haugbol, Steven; Pinborg, Lars H.; Adams, Karen H.; Svarer, Claus; Hasselbalch, Steen G.; Holm, Soeren; Paulson, Olaf B.; Knudsen, Gitte M. (29 February 2008). "Frontolimbic Serotonin 2A Receptor Binding in Healthy Subjects Is Associated with Personality Risk Factors for Affective Disorder". Biological Psychiatry. 63 (6): 569–576. doi:10.1016/j.biopsych.2007.07.009. PMID 17884017. S2CID 25979780.
- ^ Tektonidou, M G; Anapliotou, M; Vlachoyiannopoulos, P; Moutsopoulos, HM (1 September 2004). "Presence of systemic autoimmune disorders in patients with autoimmune thyroid diseases". Annals of the Rheumatic Diseases. 63 (9): 1159–1161. doi:10.1136/ard.2004.022624. PMC 1755126. PMID 15308528.
- ^ a b Petri, M; Karlson, EW; Cooper, DS; Ladenson, PW (October 1991). "Autoantibody tests in autoimmune thyroid disease: a case-control study". The Journal of Rheumatology. 18 (10): 1529–31. PMID 1765977.
- ^ Charles, P. J.; Smeenk, R. J. T.; De Jong, J.; Feldmann, M.; Maini, R. N. (1 November 2000). "Assessment of antibodies to double-stranded DNA induced in rheumatoid arthritis patients following treatment with infliximab, a monoclonal antibody to tumor necrosis factor α: Findings in open-label and randomized placebo-controlled trials". Arthritis & Rheumatism. 43 (11): 2383–2390. doi:10.1002/1529-0131(200011)43:11<2383::AID-ANR2>3.0.CO;2-D. PMID 11083258.
- ^ Cassani, F; Cataleta, M; Valentini, P; Muratori, P; Giostra, F; Francesconi, R; Muratori, L; Lenzi, M; Bianchi, G; Zauli, D; Bianchi, F B (1 September 1997). "Serum autoantibodies in chronic hepatitis C: Comparison with autoimmune hepatitis and impact on the disease profile". Hepatology. 26 (3): 561–566. doi:10.1002/hep.510260305. PMID 9303483. S2CID 3228360.
- ^ Medina-Rodriguez, F; Guzman, C; Jara, LJ; Hermida, C; Alboukrek, D; Cervera, H; Miranda, JM; Fraga, A (November 1993). "Rheumatic manifestations in human immunodeficiency virus positive and negative individuals: a study of 2 populations with similar risk factors". The Journal of Rheumatology. 20 (11): 1880–4. PMID 8308773.
- ^ 하그레이브스 M, 리치몬드 H, 모튼 R. 두 개의 골수 성분인 타르트 세포와 LE 세포의 표시. Mayo Cinal Proc;27:25–28.25–28.
- ^ Holborow, E. J.; Weir, D. M.; Johnson, G. D. (28 September 1957). "A Serum Factor in Lupus Erythematosus with Affinity for Tissue Nuclei". BMJ. 2 (5047): 732–734. doi:10.1136/bmj.2.5047.732. PMC 1962253. PMID 13460368.
외부 링크
- 자가면역성블로그 - HEP-2 ANA 요약
- 미국 국립 의학도서관의 반핵+항체 표제(MesH)
- Greidinger, Eric L.; Hoffman, DO; Robert W. (31 January 2003). "CE update [chemistry immunology]: Antinuclear Antibody Testing: Methods, Indications, and Interpretation". Laboratory Medicine. 34 (2): 113–117. doi:10.1309/VUB90VTPMEWV3W0F.








