카르바니온
Carbanion카르보니온은 탄소가 3가(3결합 형성)이며, 적어도 1개의 유의한 공명 형태에서 [1]형식적인 음전하를 갖는 음이온이다.
공식적으로 카르보니온은 탄소산의 결합염기이다.
- RCH3 + :B− → −RC3 : + HB
여기서 B는 베이스를 나타냅니다.알칸(sp3 탄소), 알케인(sp2 탄소), 아렌(sp2 탄소), 알킨(sp 탄소)의 탈양성자로 형성된 카르바니온은 각각 알킬, 알케닐(비닐), 아릴 및 알키닐(아세틸라이드) 음이온으로 알려져 있습니다.
카르보닐기, 이미닌/이미늄염, 할로겐화 시약(예를 들어 N-브로모수스키니드 및 디요딘), 양성자 공여체 등 다양한 강도의 다양한 전자 친유물과 효율적으로 반응하는 음전하 탄소에 전자 밀도가 있다.카르보니온은 유기화학에서 반응하는 여러 가지 중간체 중 하나이다.유기합성에서는 유기석 시약과 그리냐르 시약을 일반적으로 처리하여 "카르보니온"이라고 합니다.이러한 종은 일반적으로 극성이 높지만 진정한 카르바니온이 아닌 공유 결합 금속-탄소 결합δ+(M-Cδ−)을 포함하는 클러스터 또는 복합체이지만, 이는 편리한 근사치이다.
기하학.
δ탈국소화가 없을 경우 카르바니온의 음전하는 단일쌍으로서 탄소상의 sp하이브리드x 오비탈에 국재화된다.그 결과 국소적인 알킬, 알케닐/아릴 및 알키닐 카르바니온은 각각 삼각추형, 굴곡형 및 선형 형상을 가정한다.벤트의 법칙에 따라 알킬 및 알케닐 카르바니온의 피라미드화된 기하학적 구조를 설명하면서 카르바니온 단독전자를 유의한 s특성의 궤도상에 배치하는 것이 바람직하다.VSEPR(Valence Shell Electron Pair Refusion) 이론도 비슷한 예측을 한다.이는 순수한 원자 p 성질의 비점거 비결합 궤도에 대한 선호도를 갖는 카보케이션과 대비되며, 알킬과 알케닐 카보케이션에 대해 각각 평면 및 선형 기하학으로 이어진다.
단, 비국소화 카르바니온은 이러한 지오메트리에서 벗어날 수 있습니다.하이브리드 오비탈에 상주하는 대신, 카르바니온 론 쌍은 대신 p 오비탈(또는 높은 p 성질의 오비탈)을 차지할 수 있다.p 오비탈은 인접한 δ계와 겹치는 보다 적절한 형태와 방향을 가지며, 결과적으로 보다 효과적인 전하 비국재화를 가져온다.그 결과 인접한 결합기(예를 들어 알릴 음이온, 에놀레이트, 니트로네이트 등)를 가진 알킬 카르바니온은 일반적으로 피라미드화되지 않고 평면화된다.마찬가지로, 비국재화 알케닐 카르보니언은 구부러진 형상 대신 선형 형상을 선호합니다.선형 지오메트리가 약간 덜 안정적이긴 하지만, 더 자주, 치환된 알케닐 음이온에 대해 구부러진 지오메트리가 선호되며, 결과적으로 선형 전이 [2]상태를 통해 (E)와 (Z) 음이온의 이성질체 사이의 원활한 평행이 이루어진다.예를 들어, 계산는 동안이 음전하 비편재화에 의해 안정된다allenyl 음이온, H2C=C=−CH(↔ H2−C–C≡CH),, 단지 4kcal/mol(17적인 몰당 에너지 측정)의 자리 바꿈 장벽, 선형 전이 상태의 bette에 의해 안정을 반영하고 있는 부모 비닐 음이온, H2C=CH−, 27kcal/mol(110적인 몰당 에너지 측정)의 자리 바꿈 장벽 왔습니다.rπ디로컬라이제이션[3]
경향과 발생
탄소이온은 전형적으로 친핵성이며 염기성이다.탄소의 염기성과 친핵성은 탄소의 치환기에 의해 결정된다.여기에는 다음이 포함됩니다.
기하학은 또한 전하를 가진 카르바니온의 궤도 교배에도 영향을 미칩니다.전하 지지 원자의 s자가 클수록 음이온은 안정적입니다.
부틸리튬(16진수 클러스터, [BuLi])6 또는 메틸마그네슘 브롬화물(에테르 복합체, MeMgBr(2OEt))과 같은 유기 금속 시약은 적어도 역합성적인 의미에서 "카르바니온"으로 불린다.그러나 탄소 원자를 향해 전자 밀도가 심하게 편광되어 있음에도 불구하고, 실제로는 극성 공유 결합을 포함하는 클러스터 또는 복합체입니다.사실, 치환기를 안정화시키지 않는 진정한 카르보이온은 응축상에서는 이용할 수 없으며, 이러한 종들은 기체상에서는 연구되어야 한다.
한동안 단순한 알킬 음이온이 자유 종으로 존재할 수 있을지는 알려지지 않았다. 많은 이론적 연구들은 메타니드 음이온–
3 CH조차 결합되지 않은 종이어야 한다고 예측했다(즉, CH의 전자•
3 친화력은 음으로 예측되었다).그러한 종은 전자의 자발적인 방출에 의해 즉시 분해될 것이고, 따라서 질량 [4]분석으로 직접 관찰하기에는 너무 짧을 것이다.그러나 1978년 메탄화 음이온이 케텐을 방전시켜 모호하지 않게 합성되고 광전자 분광법에 의해 CH의•
3 전자친화성(EA)이 +1.8kcal/mol로 결정되어 결합종이 되었지만 거의 그렇지 않았다.CH의 구조는–
3 H-C-H 각도가 108°이고 반전 장벽이 1.3 kcal/mol인 피라미드형(C3v)이며•
3 CH는 평면형(D점군3h)[5]으로 판정되었다.
이어서 단순 1차, 2차 및 3차3 sp 카르바니온(예를 들어 에탄화 CHCH
3–
2, 이소프로파니드(CH
3)
2C−
및 t-부타니드(CH3)3C−•)가 결합하지 않은 종(CH3•
2, 2(CH33)3C의• EA는 - 6, 7 - 4 / kcal)으로 판정되었다.그러나 비교적 완만한 안정화 효과로 인해 구속될 수 있습니다.예를 들어 사이클로프로필 및 큐빌 음이온은 외쌍 오비탈의 s특성의 증가에 의해 결합되며, 네오펜틸 및 페네틸 음이온은 외쌍과 β-촉진물(n → δ*)C–C과의C 음의 과접합에 의해 결합된다.벤질 및 알릴 안정화 음이온도 마찬가지다.sp와 sp가 교배된 기상2 카르바니온은 훨씬 더 강하게 안정화되며 종종 기상 탈양성자에 [6]의해 직접 준비됩니다.
축합상에서는 탈국소화에 의해 충분히 안정화된 카르보니온만이 진정한 이온종으로 분리되었다.1984년 옴스테드와 파워는 트리페닐메탄, n-부틸리튬 및 12-크라운-4(리튬 양이온과 안정적인 복합체를 형성함)의 트리페닐메타니드 카르바니온의 리튬 크라운 에테르 소금을 [7]저온에서 제공하였다.
낮은 온도에서 THF의 트리페닐메탄(CHPh3 = 30.6의 DMSO 내a pK)에 n-부틸리튬을 첨가한 후 12-crown-4를 첨가하면 적색용액과 염착체[Li(12-crown-4)][+CPh3]−는 -20°C에서 침전된다.중심 C-C 결합 길이는 145pm이며, 페닐 링은 평균 31.2°로 추진된다.이 프로펠러 모양은 테트라메틸암모늄 대항 이온으로 덜 뚜렷하다.유사 디페닐메타니드 음이온([Li(12-crown-4)])+의 결정구조또한2 디페닐메탄(CHPh = 32.3의22 DMSO에서 pKa) 형태로 조제된 CHPh)−도 얻었다.그러나 형성된 음이온이 THF [8]용매와 빠르게 반응하여 벤질 음이온[CHPh2]− 착체를 톨루엔(CHPh 43 43의3 DMSO 내 pKa)에서 분리하려는 시도는 성공하지 못했다.유리 벤질 음이온은 또한 디벤질 [9]수은의 펄스 방사 분해에 의해 용액 단계에서 생성되었습니다.
1904년과 [11]1917년 초에[10] 슐렌크는 [NMe4][+로 제조된 두 개의 붉은색 소금을 준비했다.염화테트라메틸암모늄과 대응하는 유기나트륨 시약의 메타세제로서 CPh]−와 [NMe4][+CHPh2]−를 각각 사용한다3.테트라메틸암모늄 양이온이 카르바니온 중심부에 화학적 결합을 형성할 수 없기 때문에, 이 종들은 유리 카르바니온을 포함하고 있는 것으로 여겨진다.전자의 구조는 거의 한 세기 후에 [12]X선 결정학에 의해 검증되었지만, 후자의 불안정성은 지금까지 구조 검증을 가로막고 있다.추정치 "NMe4"[+CHPh2]"−와 물의 반응은 톨루엔과 수산화테트라메틸암모늄을 방출하는 것으로 보고되었으며, 이러한 제제의 간접 증거를 제공한다.
용액에서 카르보니온을 검출하기 위한 한 가지 도구는 [13]양성자 NMR이다. DMSO의 사이클로펜타디엔 스펙트럼은 6.5ppm에서 4개의 비닐 양성자와 3ppm에서 2개의 메틸렌 브리지 양성자를 보이는 반면, 사이클로펜타디엔닐 음이온은 5.50ppm에서 단일 공명을 갖는다.Li와 Li NMR의 사용은 다양한 유기석소 종에 대한 구조 및 반응도 데이터를 제공했다.
탄소산
수소를 포함한 화합물은 원칙적으로 탈양성자를 거쳐 켤레 염기를 형성할 수 있다.화합물은 탈양성자가 탄소원자로부터 양성자를 잃게 되면 탄소산이다.일반적으로 산으로 간주되는 화합물(예: 질산과 같은 미네랄산 또는 아세트산과 같은 카르본산)에 비해 탄소산은 예외가 존재하지만 일반적으로 훨씬 약하다(아래 참조).예를 들어 벤젠은 수용액이 중성이기 때문에 고전적인 아레니우스 의미에서 산이 아니다.그럼에도 불구하고, Rochmann-Schlosser 염기(n-부틸리튬 및 t-부톡시드칼륨)와 같은 슈퍼염기 존재 하에서 탈양성자를 겪을 수 있는 추정 pK는a 49로 매우 약한 Brönsted산이다.켤레산-염기쌍으로서, 카르바니온의 상대적 안정성을 결정하는 인자들은 또한 대응하는 탄소산의a pK 값의 순서를 결정한다.또한 pKa 값을 통해 양성자 전달 과정이 열역학적으로 유리한지 여부를 예측할 수 있습니다.염기가− B인 산성종 HA의 탈양성자가 열역학적으로 유리(K > 1)하기 위해서는 pKa(BH) > pKa(AH)의 관계가 유지되어야 한다.
아래 값은 디메틸설폭시드(DMSO)에서 측정된 pKa 값이며, 물(~0~~14)에서 측정된 값보다 유효범위(~0~35)가 넓고, 일반적인 유기용제에서 탄소이온의 염기성을 더 잘 반영한다.0보다 작거나 35보다 큰 값은 간접적으로 추정됩니다.따라서 이들 값의 수치적 정확도는 제한됩니다.수성 pKa 값은 문헌, 특히 생화학 및 효소학의 맥락에서 흔히 볼 수 있다.게다가, 용제의존성 문제는 종종 얼버무리지만, 교육학적 이유로 유기화학 교과서 입문서에 수성값이 종종 제시된다.일반적으로 음이온이 수소 결합을 할 수 있을 때 물과 유기 용제의 pKa 값은 크게 달라진다.예를 들어 물의 경우a, 물의 pK는 14.[14]0인 반면 물의 DMSO의a pK는 31.[15]4로 수산화 음이온을 안정화시키는 물과 DMSO의 차이점을 반영한다.한편, 사이클로펜타디엔의 경우, 수치적으로는 비슷합니다.물 속 pK는a 15, DMSO 속 pK는a [15]18입니다.
DMSO의 [16]pK에a 의한 탄소산도.
이러한 값은 수성 pKa 값과 크게 다를 수 있습니다.이름. 공식 구조식 DMSO에서의 pKa 사이클로헥산 C6H12 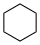
~60 메탄 CH4 
~56 벤젠 C6H6 
최대[17] 49 프로펜 C3H6 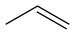
~44 톨루엔 CHH653 
~43 암모니아(N~H) NH3 
~41 디티안 C4H8S2 
~39 디메틸술폭시드 (CH3)2SO 
35.1 디페닐메탄 C13H12 
32.3 아세토니트릴 CH3CN 
31.3 아닐린(N-H) 채널652 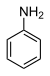
30.6 트리페닐메탄 C19H16 
30.6 형광체 CHF3 
30.5[18] 잔틴 C13H10O 
30.0 에탄올(O-H) 쵸우25 
29.8 페닐아세틸렌 C8H6 
28.8 티옥산텐 C13H10S 
28.6 아세톤 C3H6O 
26.5 클로로포름 채널3 
24.4[18] 벤조옥사졸 채널75 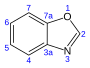
24.4 플루오렌 C13H10 
22.6 인디네 C9H8 
20.1 사이클로펜타디엔 C5H6 
18.0 니트로메탄 채널32 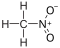
17.2 디에틸말론산염 C7H12O4 
16.4 아세틸아세톤 (H3CCO)2CH2 
13.3 시안화수소 HCN 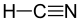
12.9 아세트산(O~H) 츄우3 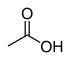
12.6 말로니트릴 채널322 
11.1 디메돈 C8H12O2 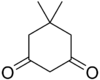
10.3 멜드럼산 C6H8O4 
7.3 헥사플루오로아세틸아세톤 (F3CCO)2CH2 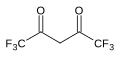
2.3 염화수소(Cl–H) HCL HCl(g) - 2.0[19] 트리플리드산 HC(SO2CF3)3 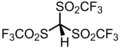
~ −16[a]
- 아세트산, 암모니아, 아닐린, 에탄올 및 염화수소는 탄소산이 아니라 비교를 위해 흔히 볼 수 있는 산이다.
위의 예에서 알 수 있듯이 음전하가 탈국소화되면 산도가 증가한다(pK가a 감소한다).이러한 효과는 카르바니온의 치환기가 불포화 및/또는 전기음성일 때 발생합니다.탄소산은 일반적으로 아세트산이나 페놀과 같은 "고전적" 브뢴스테드산보다 훨씬 약한 산으로 생각되지만, 여러 전자 수용 치환기의 누적(첨가적) 효과는 무기 미네랄산만큼 강하거나 강한 산을 초래할 수 있다.예를 들어 트리니트로메탄 HC(NO2),3 트리시아노메탄 HC(CN),3 펜타시아노시클로펜타디엔 C5(CN)5H 및 풀민산 HCNO는 모두 물에 대한 양성자 완전 또는 거의 완전한 전달을 나타내는 수성 PKa 값을 가진 강산이다.3개의 강한 전자 인출 트리플기를 가진 트리플산은 추정 pK가a -10보다 훨씬 낮다.저울의 다른 한쪽 끝에서는 알킬기만을 가진 탄화수소가 55~65 범위의 pKa 값을 갖는 것으로 생각됩니다.따라서 탄소산에 대한 산 해리 상수의 범위는 70개 이상의 크기에 이른다.
카르보닐 화합물에서 α-수소의 산도는 이들 화합물이 알돌 반응과 마이클 첨가를 포함한 합성적으로 중요한 C-C 결합 형성 반응에 참여할 수 있게 한다.
키랄 카르보니온
삼각 피라미드로 묘사된 카르바니온의 분자 기하학에서 문제는 카르바니온이 키라리티를 보여줄 수 있느냐 하는 것입니다. 왜냐하면 이 기하학의 반전을 위한 활성화 장벽이 너무 낮으면 키라리티를 도입하려는 어떠한 시도도 질소 반전과 유사하게 라세미화로 끝나기 때문입니다.하지만, 예를 들어 특정 유기석소 화합물로 수행된 연구에서 카르바니온이 실제로 키랄이 될 수 있다는 확실한 증거가 존재한다.
키랄 유기석소 화합물의 존재에 대한 최초의 증거는 1950년에 확보되었다.-70°C에서 석유 에테르에서 키랄 2-요오드옥탄과 s-부틸리튬을 반응시킨 후 드라이아이스와의 반응을 통해 대부분 라세미크 2-메틸낙탄산뿐만 아니라 광학 활성 2-메틸헥탄산도 생성되었으며, 이는 탄소 원자가 연결된 상태에서만 형성될 수 있었다.바니온:[22]
0°C로 가열하면 광학 활동이 손실됩니다.1960년대에는 더 많은 증거가 뒤따랐다.2-메틸시클로프로필브로미드의 시스 이성질체와 s-부틸리튬의 반응 후 카르복실화와 드라이아이스의 반응으로 시스-2-메틸시클로프로필카르본산이 생성되었다.트랜스 이성질체의 형성은 중간 카르보니온이 [23]불안정하다는 것을 나타낼 것이다.
같은 방식으로 (+)-(S)-l-브로모-l-메틸-2,2-디페닐시클로프로판과 n-부틸리튬의 반응 후 메탄올과 담금질한 결과 다음과 같이 구성이 [24]유지된 제품이 생성되었습니다.
최근 키랄 메틸리튬 화합물:[25]
인산염 1은 수소와 중수소 치환기를 가진 키랄기를 포함한다.스탠닐기는 리튬에 의해 중간체 2로 대체되며, 중간체 2는 인산염-포스포란 전위를 거쳐 아세트산과 반응하여 알코올 4를 생성한다.다시 -78 °C~0 °C의 범위에서 키랄리티는 이 반응 시퀀스로 보존된다.(반선택성은 Mosher's acid 유도체화 후 NMR 분광법에 의해 측정되었다.)
역사
1907년 [26]Clarke와 Arthur Lapworth가 정확하게 제안한 대로 카르바니온 구조가 벤조인 응축에 대한 반응 메커니즘에 처음 등장했다.1904년에 빌헬름 Schlenk Ph3C−을 준비했다.NMe+4 5가의 질소(tetramethylammonium 염소와 Ph3CNa에서)[10]과 1914년에 그는[27]라는 구절은 카르 바니 온 월리스와 아담스에 1933년은 카르보늄. ion[28][29]의를 상대로 소개되었다 어떻게triarylmethyl 급진 주의자들 carbanions에 알칼리 금속으로 줄어들 수 있다는 것을 증명을 목적으로.
「 」를 참조해 주세요.
레퍼런스
- ^ IUPAC, 화학 용어집, 제2판('골드북') (1997).온라인 수정판: (2006–) "carbanion" doi: 10.1351/goldbook.C00804
- ^ Caramella, Pierluigi; Houk, K. N. (1981-01-01). "The influence of electron-withdrawing substituents on the geometries and barriers to inversion of vinyl anions". Tetrahedron Letters. 22 (9): 819–822. doi:10.1016/0040-4039(81)80005-6. ISSN 0040-4039.
- ^ Alabugin, Igor V. (2016-09-19). Stereoelectronic Effects: A Bridge Between Structure and Reactivity. Chichester, UK: John Wiley & Sons, Ltd. doi:10.1002/9781118906378. ISBN 978-1-118-90637-8.
- ^ Marynick, Dennis S.; Dixon, David A. (1977). "Electron Affinity of the Methyl Radical: Structures of CH3 and CH−
3". Proceedings of the National Academy of Sciences of the United States of America. 74 (2): 410–413. Bibcode:1977PNAS...74..410M. doi:10.1073/pnas.74.2.410. JSTOR 66197. PMC 392297. PMID 16592384. - ^ Ellison, G. Barney; Engelking, P. C.; Lineberger, W. C. (April 1978). "An experimental determination of the geometry and electron affinity of methyl radical". Journal of the American Chemical Society. 100 (8): 2556–2558. doi:10.1021/ja00476a054. ISSN 0002-7863.
- ^ Blanksby, S. J.; Bowie, J. H. (2005). "Carbanions: formation, structure and thermochemistry". The encyclopedia of mass spectrometry. Gross, Michael L., Caprioli, R. M. (1st ed.). Amsterdam: Elsevier. ISBN 9780080438504. OCLC 55939535.
- ^ Olmstead, Marilyn M. (1985). "The isolation and X-ray structures of lithium crown ether salts of the free phenyl carbanions [CHPh2]− and [CPh3]−". Journal of the American Chemical Society. 107 (7): 2174–2175. doi:10.1021/ja00293a059.
- ^ Harder, S. (2002). "Schlenk's Early "Free" Carbanions". Chemistry: A European Journal. 8 (14): 3229–3232. doi:10.1002/1521-3765(20020715)8:14<3229::AID-CHEM3229>3.0.CO;2-3. PMID 12203352.
- ^ Bockrath, Bradley; Dorfman, Leon M. (2002-05-01). "Submicrosecond formation and observation of reactive carbanions". Journal of the American Chemical Society. 96 (18): 5708–5715. doi:10.1021/ja00825a005.
- ^ a b Schlenk, W.; Weickel, T.; Herzenstein, A. (1910). "Ueber Triphenylmethyl und Analoga des Triphenylmethyls in der Biphenylreihe" [On triphenylmethyl and analogues of triphenylmethyl in the biphenyl series]. Justus Liebig's Annalen der Chemie. 372: 1–20. doi:10.1002/jlac.19103720102.
- ^ Schlenk, W.; Holtz, Johanna (1917). "Über Benzyl-tetramethyl-ammonium" [On benzyl tetramethyl ammonium]. Berichte der Deutschen Chemischen Gesellschaft. 50 (1): 274–275. doi:10.1002/cber.19170500143. ISSN 1099-0682.
- ^ Harder, Sjoerd (2002-07-15). "Schlenk's Early "Free" Carbanions". Chemistry – A European Journal. 8 (14): 3229–3232. doi:10.1002/1521-3765(20020715)8:14<3229::AID-CHEM3229>3.0.CO;2-3. PMID 12203352.
- ^ Kasmai, Hamid S. (June 1999). "A Simple and Convenient Method for Generation and NMR Observation of Stable Carbanions". Journal of Chemical Education. 76 (6). doi:10.1021/ed076p830.
- ^ Silverstein, Todd P.; Heller, Stephen T. (2017-04-17). "pKa Values in the Undergraduate Curriculum: What is the Real pKa of Water?". Journal of Chemical Education. 94 (6): 690–695. Bibcode:2017JChEd..94..690S. doi:10.1021/acs.jchemed.6b00623.
- ^ a b Evans, D. A.; Ripin, D. H. (2005). "Chem 206 pKa Table" (PDF). Archived from the original (PDF) on 2019-07-02.
- ^ Bordwell, Frederick G. (1988). "Equilibrium acidities in dimethyl sulfoxide solution". Accounts of Chemical Research. 21 (12): 456–463. doi:10.1021/ar00156a004.
- ^ Bordwell, G. F.; Matthews, Walter S. (2002-05-01). "Equilibrium acidities of carbon acids. III. Carbon acids in the membrane series". Journal of the American Chemical Society. 96 (4): 1216–1217. doi:10.1021/ja00811a041.
- ^ a b Russell, Jamie; Roques, Nicolas (1998-11-05). "Effective nucleophilic trifluoromethylation with fluoroform and common base". Tetrahedron. 54 (45): 13771–13782. doi:10.1016/S0040-4020(98)00846-1. ISSN 0040-4020.
- ^ Trummal, Aleksander; Lipping, Lauri; Kaljurand, Ivari; Koppel, Ilmar A.; Leito, Ivo (2016-05-06). "Acidity of Strong Acids in Water and Dimethyl Sulfoxide". The Journal of Physical Chemistry A. 120 (20): 3663–3669. Bibcode:2016JPCA..120.3663T. doi:10.1021/acs.jpca.6b02253. PMID 27115918.
- ^ Kütt, Agnes; Rodima, Toomas; Saame, Jaan; Raamat, Elin; Mäemets, Vahur; Kaljurand, Ivari; Koppel, Ilmar A.; Garlyauskayte, Romute Yu.; Yagupolskii, Yurii L.; Yagupolskii, Lev M.; Bernhardt, Eduard; Willner, Helge; Leito, Ivo (2011). "Equilibrium Acidities of Superacids". The Journal of Organic Chemistry. 76 (2): 391–395. doi:10.1021/jo101409p. PMID 21166439.
- ^ Ding, Feizhi; Smith, Jeremy M.; Wang, Haobin (2009). "First-Principles Calculation of pKa Values for Organic Acids in Nonaqueous Solution". The Journal of Organic Chemistry. 74 (7): 2679–2691. doi:10.1021/jo802641r. PMID 19275192.
- ^ Letsinger, Robert L. (1950). "Formation of Optically Active 1-Methylheptyllithium". Journal of the American Chemical Society. 72 (10): 4842. doi:10.1021/ja01166a538.
- ^ Applequist, Douglas E. (1961). "The Configurational Stability of cis- and trans-2-Methylcyclopropyllithium and Some Observations on the Stereochemistry of their Reactions with Bromine and Carbon Dioxide". Journal of the American Chemical Society. 83 (4): 862–865. doi:10.1021/ja01465a030.
- ^ Walborsky, H. M. (1964). "Cyclopropanes. XV. The Optical Stability of 1-Methyl-2,2-diphenylcyclopropyllithium". Journal of the American Chemical Society. 86 (16): 3283–3288. doi:10.1021/ja01070a017.
- ^ Kapeller, Dagmar (2007). "Preparation of Chiral α-Oxy-[2H1]methyllithiums of 99% ee and Determination of Their Configurational Stability". Journal of the American Chemical Society. 129 (4): 914–923. doi:10.1021/ja066183s. PMID 17243828.
- ^ Clarke, R. W. L.; Lapworth, A. (1907). "LXV. An extension of the benzoin synthesis". Journal of the Chemical Society, Transactions. 91: 694–705. doi:10.1039/CT9079100694.
- ^ Schlenk, W.; Marcus, E. (1914). "Über Metalladditionen an freie organische Radikale. XII. Über Triarylmethyle" [On metal addition to free organic radicals. XII. Tryarylmethyls]. Berichte der Deutschen Chemischen Gesellschaft. 47 (2): 1664. doi:10.1002/cber.19140470256.
- ^ Wallis, E. S.; Adams, F. H. (1933). "The Spatial Configuration of the Valences in Tricovalent Carbon Compounds1". Journal of the American Chemical Society. 55 (9): 3838. doi:10.1021/ja01336a068.
- ^ Tidwell, T. T. (1997). "The first century of physical organic chemistry: A prologue". Pure and Applied Chemistry. 69 (2): 211–214. doi:10.1351/pac199769020211. S2CID 98171271.



























![Chiral oxy[2H1]methyllithiums. Bu stands for butyl, i-Pr stands for isopropyl.](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1d/PhosphatePhosphonateRearrangement.png/500px-PhosphatePhosphonateRearrangement.png)


