벤트의 법칙
Bent's rule
화학에서 Bent의 법칙은 궤도 혼성화와 치환기의 전기음성도 사이의 관계를 설명하고 설명합니다.[1][2] 이 규칙은 Henry A에 의해 명시되었습니다. 다음과 같이 구부러집니다.[2]
원자의 특성은 전기 양성 치환기를 향한 궤도에 집중됩니다.
원자가 결합 이론은 분자 구조에 대한 좋은 근사치를 제공합니다. 벤트의 법칙은 관측된 기하학과 이상화된 기하학 사이의 차이를 해결합니다.[3] 벤트의 법칙에 따르면 여러 그룹에 결합된 중심 원자는 다시 혼성화되어 더 많은 특성을 가진 오비탈은 전기 양성 그룹으로 향하고, 더 많은 p 특성을 가진 오비탈은 더 전기 음성 그룹으로 향합니다. 모든 하이브리드 오비탈이 동등하다는 가정을 제거함으로써, Bent의 규칙은 분자 기하학과 결합 강도의 향상된 예측으로 이어집니다.[4][5] 벤트의 법칙은 s와 궤도의 상대적인 에너지 수준을 통해 정당화될 수 있습니다. 벤트의 법칙은 이상적인 대칭보다 낮은 분자에 대한 VSEPR 이론의 수정을 나타냅니다.[6] 낮은 시기의 더 큰 원자와의 결합의 경우, 궤도 혼성화의 경향은 전기 음성도와 궤도 크기 모두에 크게 의존합니다.
역사
1930년대 초, 양자역학의 초기 개발의 많은 부분이 있은 직후, [7]폴링, [8]슬레이터, [9]콜슨 등에 의해 분자 구조에 적용되기 시작했습니다. 특히 폴링은 원자와 p궤도가 결합하여 혼성 sp, sp2, sp궤도를3 주는 혼성화 개념을 도입했습니다. 혼성 궤도는 네 개의 등가 C-H 결합 사이에 sp3 탄소 원자와 109.5°의 결합 각도를 가진 사면체인 메탄과 같은 단순 분자의 분자 기하학을 설명하는 데 강력한 것으로 증명되었습니다. 그러나, 이러한 이상적인 기하학으로부터 약간의 편차가 1940년대에 명백해졌습니다.[10] 특히 잘 알려진 예로는 물이 있는데, 두 O-H 결합 사이의 각도는 104.5°에 불과합니다. 그러한 불일치를 설명하기 위해, 혼성화는 비등식 및 p 특성을 갖는 궤도를 초래할 수 있다고 제안되었습니다. 1947년 A. D. Walsh는[10] 탄소에 결합된 그룹의 전기음성도와 탄소 원자의 혼성화 사이의 관계를 설명했습니다. 마침내 1961년에 Bent는 분자 구조, 중심 원자 혼성화 및 치환기 전기음성도와 관련된 문헌에 대한 주요 리뷰를 발표했으며 이 작업을 위해 Bent의 규칙이 그 이름을 따게 되었습니다.
Bent의 원래 논문은 메틸 치환이 포름산과 아세트산의 산 해리 상수를 감소시키기 때문에 메틸기의 그룹 전기음성도가 수소 원자의 그룹 전기음성도보다 낮은 것으로 간주합니다.[2]
비결합궤도
Bent의 법칙은 비결합 궤도의 혼성화를 합리화하기 위해서도 확장될 수 있습니다. 한편으로, 전자 밀도가 중심 원자를 향해 완전히 편광된, 단독 쌍(점유된 비결합 궤도)은 전기양성 치환기의 제한적인 경우로 생각될 수 있습니다. Bent의 법칙은 공유되지 않은 밀접하게 붙잡힌 비결합 전자를 안정화하기 위해서는 단독 쌍 궤도가 높은 특성을 가져야 한다고 예측합니다. 반면에, 전자 밀도가 리간드 쪽으로 완전히 편광되고 중심 원자에서 멀어지는, 비어 있는(빈) 비결합 오비탈은 전기 음성 치환기의 제한적인 경우로 생각될 수 있습니다. Bent의 법칙은 남은 점유 궤도에 가능한 많은 특성을 남기기 위해서는 점유되지 않은 비결합 궤도가 p 특성을 최대화해야 한다고 예측합니다.
실험적으로 첫 번째 결론은 메탄에 비해 물이나 암모니아 같은 단독 쌍을 가진 분자의 결합 각도가 줄어든 것과 일치하고, 두 번째 결론은 단량체 보란이나 카르베늄 이온과 같이 비어 있는 비결합 오비탈을 가진 분자의 평면 구조와 일치합니다.
결과들
Bent의 법칙은 분자 구조와 반응성의 경향을 설명하는 데 사용될 수 있습니다. 중심 원자의 혼성화가 특정 특성에 어떤 영향을 미치는지 결정한 후, 치환기의 전기음성도를 조사하여 Bent의 규칙이 유지되는지 확인할 수 있습니다.
결합각: VSEPR 이론과 Bent's Rule
원자가 결합 이론은 메탄이 사면체이고 에틸렌이 평면이라고 예측합니다. 물과 암모니아에서는 결합각이 각각 104.5°와 107°로 예상 사면체각 109.5°보다 작기 때문에 상황이 더 복잡합니다. 이러한 편차에 대한 한 가지 근거는 VSEPR 이론으로, 여기서 원자가 전자는 국부적인 영역에 위치하고 단독 쌍은 결합 쌍보다 서로 더 많이 밀어내는 것으로 가정됩니다. 벤트의 법칙은 대안적인 설명을 제공합니다.

원자가 쉘 전자쌍 반발(VSEPR) 이론은 분자 기하학을 예측합니다.[11][12] VSEPR은 분자기하학이 전자쌍을 가장 많이 띄울 수 있는 배열을 취할 것으로 예측합니다.[11][12] 이 전자 거리 최대화는 가장 안정적인 전자 분포를 달성하기 위해 발생합니다.[11][12] VSEPR 이론의 결과는 결합 각도를 정확하게 예측할 수 있다는 것입니다. VSEPR 이론에 따르면 분자의 기하학적 구조는 중심 원자에 연결된 전자쌍과 원자의 수를 세어 예측할 수 있습니다.[11][12] 벤트의 법칙은 "A]토믹의 특성은 전기 양성 치환기를 향한 궤도에 집중된다"[2]고 말합니다. 벤트의 법칙은 결합각이 VSEPR 이론에 의해 예측된 결합각에서 벗어날 것이라는 것을 암시하고, 중심 원자를 둘러싼 원자들의 상대적인 전기음성도는 분자 기하학에 영향을 미칠 것입니다.[5] VSEPR 이론은 간단한 규칙을 이용하여 분자 형태를 정확하게 예측하는 방법을 제시합니다.[13] 그러나 VSEPR 이론은 관측된 분자 결합 각도를 대략적으로만 예측합니다.[13][14] 반면에 벤트의 법칙이 더 정확합니다.[5] 또한 분자기하학을 설명할 때 Bent의 법칙이 양자역학적 계산을 확증한다는 것이 밝혀졌습니다.[15]
| 분자 | 치환기 사이의 결합 각도 | Bond Angle을 사용한 3D 영상 |
|---|---|---|
 | 111.5° ± 1.5°[16] |  |
 | 108.5° ± 2°[17] |  |
 | 104.5°[18] |  |
 | 104.2°[19] |  |
위의 표는 VSEPR 이론이 예측한 결합 각도와 실제 각도의 차이를 보여줍니다. VSEPR 이론에 따르면 디에틸에테르, 메탄올, 물, 이산화산소는 모두 109.5의o 결합각을 가져야 합니다.[12] VSEPR 이론을 이용하면, 이 모든 분자들은 같은 "굽은" 모양을 가지고 있기 때문에 같은 결합 각도를 가져야 합니다.[12] 그러나 분명히 이 모든 분자들 사이의 결합 각도는 다른 방식으로 이상적인 기하학적 구조에서 벗어납니다. 벤트의 법칙은 이러한 명백한 불일치를 설명하는 데 도움이 될 수 있습니다.[5][20][21] 전기 음성 치환기는 더 많은 p 특성을 가질 것입니다.[5][20] 결합 각도는 s 문자와 비례 관계를 가지며 p 문자와 역의 관계를 갖습니다.[5] 따라서 치환기가 더 전기적으로 음성이 될수록 분자의 결합 각도는 감소해야 합니다. 디메틸에테르, 메탄올, 물 및 디플루오르화 산소는 예상대로 이 추세를 따릅니다(위 표에 표시됨). 두 개의 메틸기는 디에틸에테르의 중심 산소에 붙어 있는 치환기입니다. 두 메틸기는 전기 양성이기 때문에 더 큰 특성이 관찰되고 실제 결합 각도는 이상적인 결합 각도인 109.5보다o 더 큽니다. 메탄올은 1개의 전기양성 메틸 치환기와 1개의 전기음성 수소 치환기를 가지고 있습니다. 따라서 디메틸에테르보다 특성이 덜 관찰됩니다. 수소 치환기가 2개일 경우 전기음성도와 p의 특성이 증가함에 따라 각도가 더욱 감소하게 됩니다. 마지막으로 두 수소 치환기를 모두 디플루오르화 산소에서 불소로 치환하면 결합 각도가 또 감소합니다. 불소는 전기적으로 매우 부정적이기 때문에 결합 각도가 크게 감소합니다.
물의 결합 각도를 예측할 때 Bent의 규칙은 더 많은 s 특성을 가진 하이브리드 오비탈이 단독 쌍을 향해야 하는 반면, 더 많은 p 특성을 가진 오비탈이 수소를 향하게 하여 25%의 s 특성과 75%의 p 특성을 가진 이상화된 O(sp3) 하이브리드 오비탈에서 벗어난다는 것을 시사합니다. 물의 경우 104.5° HOH 각도로 OH 결합 오비탈은 O4.0(~sp) 오비탈(~20%s, ~80%p)로 구성되는 반면, 단독 쌍은 O(~sp2.3) 오비탈(~30%s, ~70%p)로 구성됩니다. 위의 정당화에서 논의한 바와 같이, 단독 쌍은 매우 전기적인 양의 치환기로서 행동하고 과잉의 특성을 갖습니다. 그 결과 결합 전자가 p자성을 높였습니다. 이러한 오비탈의 증가된 p 문자는 그들 사이의 결합 각도를 사면체 109.5° 미만으로 감소시킵니다. 동일한 논리를 암모니아(107.0° HNH 결합 각도, 3개의 N(~sp3.4 또는 23% s) 결합 오비탈과 1개의 N(~sp2.1 또는 32% s) 단독 쌍)에도 적용할 수 있습니다.
질소 함유 화합물도 같은 추세입니다. VSEPR 이론의 예상과는 달리, Bent의 법칙과 일치하며 암모니아(NH3)와 삼불화질소(NF3)의 결합 각도는 각각 107°와 102°입니다.
이제 이론적 토대가 흔들리는 것처럼 보이는 VSEPR 이론과는 달리, 벤트의 법칙은 현대의 결합 치료에서 여전히 중요한 원리로 여겨집니다.[5][22] 예를 들어, HO의 단독 쌍이 대칭성으로 인해 동일하지 않다고 간주되더라도(즉, s만, 평면 내 p 및 p 산소 AO가 혼성화되어 두 O-H 결합 궤도 σ 및 단독 쌍 n을 형성하는 반면 p는 동일하지 않은 순수 p-문자 단독 쌍 n이 됨), 이 분석을 수정하는 것은 여전히 가능합니다. 자연적인 결합 궤도 방법에서 나온 고독한 쌍의 경우와 마찬가지로.
중심 원자에 결합된 두 종류의 원자를 갖는 디플루오로메탄과 같은 사면체 분자의 경우, 더 많은 전기 음성 치환기(F)에 대한 C-F 결합은 C-H 결합보다 더 적은 특성을 갖는 탄소 오비탈을 포함하므로, C-F 결합 사이의 각도는 109.5°[15][23]의 사면체 결합 각도보다 작습니다.
삼각형 바이피라미드 분자는 축과 적도 위치를 모두 가지고 있습니다. 두 종류의 치환기가 있는 경우, 두 개의 적도 치환기 사이의 결합 각도보다 축과 전기 음성 치환기 사이의 결합 각도가 작으므로 전기 음성 치환기가 축 위치를 더 선호할 것입니다.[23]
본드길이
결합 각도와 마찬가지로 원자의 혼성화는 원자가 형성하는 결합의 길이와 관련이 있을 수 있습니다.[2] 결합 궤도가 특성이 증가할수록 σ 결합 길이는 감소합니다.
| 분자 | 평균 탄소-탄소 결합 길이 |
|---|---|
 | 1.54Å |
 | 1.50Å |
 | 1.46Å |
전기 음성 치환기를 추가하고 중심 원자의 혼성화를 변경하여 결합 길이를 조작할 수 있습니다. 분자가 구조 X-A-Y를 포함하는 경우, 치환기 X를 더 전기적인 음의 원자로 대체하면 중심 원자 A의 혼성화가 변경되고 인접한 A-Y 결합이 짧아집니다.
| 분자 | 평균 탄소-불소 결합 길이 |
|---|---|
 플루오로메탄 | 1.388Å |
 디플루오로메탄 | 1.358Å |
 트리플루오로메탄 | 1.329Å |
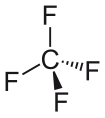 테트라플루오로메탄 | 1.323Å |
서로 다른 전기 음성도를 가진 원소들 사이의 결합은 극성을 띠고 이러한 결합의 전자 밀도는 더 많은 전기 음성 소자 쪽으로 이동할 것입니다. 이 개념을 플루오로메탄이라는 분자에 적용하면 벤트 법칙의 힘을 알 수 있습니다. 탄소가 수소보다 전기적으로 더 음이기 때문에 C-H 결합의 전자 밀도는 짧아지고 C-F 결합은 길어질 것입니다.
염소가 불소보다 전기적으로 덜 부정적이기 때문에 효과가 덜 극적이지만, 메탄의 염소화된 유사체도 같은 추세를 유지합니다.[2]
| 분자 | 평균 탄소-염소 결합 길이 |
|---|---|
 클로로메탄 | 1.783Å |
 디클로로메탄 | 1.772Å |
 트리클로로메탄 | 1.767 Å |
 테트라클로로메탄 | 1.766Å |
위의 사례들은 염소의 크기가 전기음성도보다 덜 중요하다는 것을 보여주는 것 같습니다. 입체 물질만을 기반으로 한 예측은 반대의 경향으로 이어질 것입니다. 큰 염소 치환기는 멀리 떨어져 있는 것이 더 유리하기 때문입니다. 입체적인 설명이 실험 결과와 모순되기 때문에, Bent의 법칙이 구조 결정에 주요한 역할을 할 것으로 보입니다.
JCH 커플링 상수
아마도 수소와 탄소 사이의 결합 궤도에서 s의 특성을 가장 직접적으로 측정하는 것은 NMR 스펙트럼에서 결정된13 H-C 결합 상수를 통한 것일 것입니다. 이론은CH J 값이 s 문자와 상관관계가 있다고 예측합니다.[24] 특히. 하나의 결합 C-H 결합 상수 J는 경험적 관계 J C- H = χ(i)displaystyle \ ^{1}J_{^{mathrm {C} -^{1}\mathrm {H} = (500\ \mathrm {Hz})\chi_{\mathrm {s}(i)}, 여기서χi) s}}(i)}는 s 문자입니다. (예를 들어 메탄의 C-H 결합에서 발견되는 순수한 sp 하이브리드 원자 궤도는 25%의 문자를 가지며, 실험적으로 결정된 값과 매우 일치하는 500Hz × 0.25 = 125Hz의 예상 결합 상수를 갖게 됩니다.)
| 분자 | JCH(메틸 양성자 중) |
|---|---|
 메탄 | 125Hz |
 아세트알데히드 | 127Hz |
 1,1,1–Trichloroethane | 134Hz |
 메탄올 | 141Hz |
 플루오로메탄 | 149Hz |
치환기의 전기음성도가 증가함에 따라 치환기를 향하는 p 문자의 양도 증가합니다. 이것은 메틸 양성자에 대한 결합에 더 많은 특성을 남겨 J 결합CH 상수를 증가시킵니다.
귀납효과
귀납적 효과는 Bent의 법칙으로 설명할 수 있습니다.[25] 유도 효과는 공유 결합을 통한 전하의 전달이며, Bent의 법칙은 혼성화의 차이를 통해 그러한 결과에 대한 메커니즘을 제공합니다. 아래 [26]표에서 중심 탄소에 결합된 그룹이 더 전기적으로 음수가 될수록 중심 탄소는 극성 치환기 상수로 측정하면 더 많은 전자 인출이 됩니다. 극치 치환 상수는 증가하는 값이 더 큰 전자 인출 능력에 해당하므로 원칙적으로 Hammett 방정식의 σ 값과 유사합니다. Bent의 법칙은 그룹의 전기 음성도가 증가함에 따라 더 많은 p개의 문자가 해당 그룹으로 전환되어 중심 탄소와 R 그룹 사이의 결합에 더 많은 문자가 남는다는 것을 시사합니다. 오비탈이 p 오비탈보다 핵에 가까운 전자 밀도를 가지므로 C-R 결합의 전자 밀도는 특성이 증가할수록 탄소 쪽으로 더 많이 이동합니다. 이렇게 하면 중심 탄소가 R기로 전자를 더 많이 인출할 수 있습니다.[10] 따라서, 유도 효과가 예측하는 바와 같이, 치환기의 전자 인출 능력은 인접한 탄소로 전달되었습니다.
| 치환기 | 극성 치환기 상수 (larger 값은 더 큼을 의미합니다. 전자 withdraw링 능력) |
|---|---|
 t–부틸 | −0.30 |
 메틸 | 0.00 |
 클로로메틸 | 1.05 |
 디클로로메틸 | 1.94 |
 트리클로로메틸 | 2.65 |
형식론
벤트의 법칙은 원자가 결합 이론에 추가적인 수준의 정확도를 제공합니다. 원자가 결합 이론은 공유 결합이 두 개의 결합 원자로부터 중첩된, 보통 혼성화된 원자 궤도에 놓여 있는 두 개의 전자로 구성된다고 제안합니다. 공유 결합이 단지 두 결합 원자의 원자 궤도의 선형 결합이라는 가정은 근사치입니다(분자 궤도 이론 참조). 그러나 원자가 결합 이론은 결합을 이해하는 방법에 큰 영향을 미쳤고 계속해서 영향을 미칠 정도로 정확합니다.[1]
원자가 결합 이론에서 두 개의 원자는 각각 원자 궤도를 기여하고 궤도 중첩에 있는 전자는 공유 결합을 형성합니다. 원자는 보통 순수한 수소와 같은 오비탈을 결합에 기여하지 않습니다.[7] 만약 원자가 수소와 같은 궤도에만 기여할 수 있다면, 실험적으로 확인된 메탄의 사면체 구조는 탄소의 2s와 2p 궤도가 그러한 기하학적 구조를 가지고 있지 않기 때문에 가능하지 않을 것입니다. 그와 다른 모순들이 궤도 교배의 제안으로 이어졌습니다. 그 틀에서 원자 궤도는 서로 다른 모양과 에너지를 가진 동일한 수의 궤도를 생성하기 위해 혼합될 수 있습니다. 앞서 언급한 메탄의 경우, 탄소의 2s와 3개의 2p 오비탈이 혼성화되어 4개의 동등한3 스비탈이 생성되며, 이는 구조 불일치를 해결합니다. 궤도 교잡은 원자가 결합 이론이 방대한 수의 분자의 기하학과 특성을 성공적으로 설명할 수 있게 해주었습니다.
전통적인 혼성화 이론에서, 혼성 궤도들은 모두 동등합니다.[12][27] 즉 원자와 p 오비탈을 결합하여 4개의 sp=1 ⁄√4(s + √3p) 오비탈, 3개의 sp=1 √3(s + ⁄√2p) 오비탈 또는 2개의 sp=1 ⁄√2(s + p) 오비탈을 제공합니다. 이들 조합은 두 가지 조건을 만족시키기 위해 선택됩니다. 첫째, s와 p 궤도 기여의 총량은 혼성화 전후에 동등해야 합니다. 둘째, 하이브리드 궤도는 서로 직교해야 합니다.[27][28] 두 개의 하이브리드 오비탈이 직교하지 않으면 정의에 따라 0이 아닌 오비탈 중첩이 발생합니다. 이러한 오비탈에 있는 전자들은 상호작용을 할 것이고, 만약 그 오비탈들 중 하나가 공유 결합에 관여한다면, 다른 오비탈들 또한 그 결합과 0이 아닌 상호작용을 할 것이고, 이것은 원자가 결합 이론의 결합 원리당 두 개의 전자를 위반하는 것입니다.
하이브리드와 p 오비탈을 구성하려면 첫 번째 하이브리드 오비탈을 s + √λp로 지정하고 여기서 p는 결합 그룹을 향하고 λ는 이 하이브리드 오비탈이 갖는 p 캐릭터의 양을 결정합니다. 이것은 파동 함수의 가중합입니다. 이제 두 번째 혼성 오비탈 + √λp를 선택합니다. 여기서 p는 어떤 식으로든 방향을 잡고 λ은 두 번째 오비탈의 p 문자의 양입니다. 결과 오비탈이 정규화될 수 있고 첫 번째 하이브리드 오비탈과 직교할 수 있도록 λ와 p의 방향의 값이 결정되어야 합니다. 하이브리드는 두 개의 정규화된 파동 함수의 합이므로 확실히 정규화될 수 있습니다. 두 개의 혼성 오비탈이 별개의 공유 결합에 관여할 수 있도록 직교성이 확립되어야 합니다. 직교 오비탈의 내적은 0이어야 하며, 구성된 하이브리드의 내적을 계산하면 다음과 같은 계산이 가능합니다.
s 오비탈은 정규화되므로 내부 곱 ⟨ s ⟩ = 1이 됩니다. 또한 s 오비탈은 p와 p 오비탈과 직교하므로 위의 동일한 0에서 두 항으로 이어집니다. 마지막 항은 정의에 따라 코스 ω을 부여하는 서로 ω의 각도에 있는 두 정규화 함수의 내적입니다. 그러나 결합 궤도의 직교성은 1 + √λλ cos ω = 0을 요구하므로 결과적으로 다음과 같은 쿨슨 정리를 얻을 수 있습니다.
이는 모든 계수 λ이 위의 조건을 쌍으로 만족시켜 결과 오비탈이 직교한다는 것을 보장한다면 4개의 원자 오비탈과 p개의 원자 오비탈이 임의의 방향으로 혼성화될 수 있음을 의미합니다.
중심 원자가 더 큰 p 특성의 오비탈을 더 많은 전기 음성 치환기로 향하게 한다는 벤트의 법칙은 λ 계수의 증가가 s + √λp 하이브리드 오비탈의 p 특성을 증가시킨다는 점에 주목함으로써 위에 쉽게 적용할 수 있습니다. 따라서 중심원자 A가 X와 Y의 두 그룹에 결합되어 있고 Y가 X보다 전기적으로 더 음이라면, A는 λ < λ이 되도록 혼성화될 것입니다. 첫 번째 원리로부터 분자기하학을 정확하게 예측하기 위해서는 벤트의 법칙을 넘어서는 좀 더 정교한 이론적, 계산적 기법이 필요합니다. 하지만 벤트의 법칙은 분자 구조를 설명하는 데 탁월한 휴리스틱을 제공합니다.
헨리 벤트는 1960년에 경험적 근거로 그의 법칙을 처음 제안했지만, 몇 년 후 러셀 드라고에 의해 분자 궤도 계산에 의해 뒷받침되었습니다.[23]
Bent's rule의 적용
벤트의 법칙은 분자 기하학을 정확하게 특성화할 수 있습니다.[11][5] 벤트의 법칙은 분자의 결합 각도를 예측하는 신뢰할 수 있고 강력한 프레임워크를 제공합니다. 실제 분자의 기하학적 구조를 예측하는 벤트의 규칙 정확성과 정확성은 계속해서 그 신뢰성을 증명하고 있습니다.[5][15] 결합각 예측을 넘어, 벤트의 법칙은 몇 가지 중요한 응용 분야가 있으며 화학자들에게 상당한 관심을 가지고 있습니다.[11][5][14][21][30] Bent의 법칙은 결합 상호작용과 분자 합성을 분석하는 데 적용될 수 있습니다.
Bent의 법칙은 출발 물질에 따라 유기 합성에서 어떤 제품이 선호되는지 예측하는 데 사용할 수 있습니다.[14][30] Wang et al. 는 치환기들이 실라벤젠의 평형에 어떤 영향을 미치는지를 고찰한 결과, Bent의 법칙이 결과에 중요한 역할을 한다는 것을 발견했습니다.[14] Wang et al.이 수행한 연구는 Bent의 법칙이 합성 경로와 제품의 안정성을 예측하는 데 어떻게 사용될 수 있는지를 보여줍니다.[14] Dubois et al. 이와 유사한 응용을 보여주면서, 그들이 반응이 되돌릴 수 없다는 것을 발견했을 때, Bent의 법칙을 사용하여 그들의 발견 중 일부를 정당화할 수 있었습니다.[30] 이 두 연구는 합성 화학을 돕기 위해 어떻게 Bent의 법칙을 사용할 수 있는지를 보여줍니다. Bent의 법칙으로 인해 분자 기하학이 정확히 어떻게 되는지 알면 합성 화학자들은 상대적인 제품 안정성을 예측할 수 있습니다.[14][30] 또한 벤트의 법칙은 화학자들이 특정 제품에 대한 반응을 유도하기 위해 출발 물질을 선택하는 데 도움을 줄 수 있습니다.[14] 따라서 Bent의 법칙은 합성 화학자들이 관심 있는 반응을 더 잘 통제할 수 있게 해줍니다.
참고 항목
참고문헌
- ^ a b Weinhold, F.; Landis, C. L. (2005), Valency and Bonding: A Natural Donor-Acceptor Perspective (1st ed.), Cambridge: Cambridge University Press, ISBN 978-0-521-83128-4
- ^ a b c d e f g Bent, H. A. (1961), "An appraisal of valence-bond structures and hybridization in compounds of the first-row elements", Chem. Rev., 61 (3): 275–311, doi:10.1021/cr60211a005
- ^ Foster, J. P.; Weinhold, F. (1980), "Natural hybrid orbitals", J. Am. Chem. Soc., 102 (24): 7211–7218, doi:10.1021/ja00544a007
- ^ Alabugin, I. V.; Bresch, S.; Gomes, G. P. (2015). "Orbital Hybridization: a Key Electronic Factor in Control of Structure and Reactivity". J. Phys. Org. Chem. 28 (2): 147–162. doi:10.1002/poc.3382.
- ^ a b c d e f g h i j Jonas, V.; Boehme, C.; Frenking, G. (1996-01-01). "Bent's Rule and the Structure of Transition Metal Compounds". Inorganic Chemistry. 35 (7): 2097–2099. doi:10.1021/ic951397o. ISSN 0020-1669.
- ^ Alabugin, I. V.; Bresch, S.; Manoharan, M. (2014). "Hybridization Trends for Main Group Elements and Expanding the Bent's Rule Beyond Carbon: More than Electronegativity". J. Phys. Chem. A. 118 (20): 3663–3677. Bibcode:2014JPCA..118.3663A. doi:10.1021/jp502472u. PMID 24773162.
- ^ a b Pauling, L. (1931), "The nature of the chemical bond. Application of results obtained from the quantum mechanics and from a theory of paramagnetic susceptibility to the structure of molecules", J. Am. Chem. Soc., 53 (4): 1367–1400, doi:10.1021/ja01355a027
- ^ Slater, J. C. (1931), "Directed Valence in Polyatomic Molecules", Phys. Rev., 37 (5): 481–489, Bibcode:1931PhRv...37..481S, doi:10.1103/PhysRev.37.481
- ^ Coulson, C. A. (1961), Valence (2nd ed.), Oxford: Clarendon Press
- ^ a b c Walsh, A. D. (1947), "The properties of bonds involving carbon", Discuss. Faraday Soc., 2: 18–25, doi:10.1039/DF9470200018
- ^ a b c d e f Ball, D. W.; Key, J. A. "Molecular Shapes and Polarity".
{{cite web}}: CS1 maint: 다중 이름: 저자 목록 (링크) - ^ a b c d e f g Esselman, Brian J.; Block, Stephen B. (2019-01-08). "VSEPR-Plus: Correct Molecular and Electronic Structures Can Lead to Better Student Conceptual Models". Journal of Chemical Education. 96 (1): 75–81. doi:10.1021/acs.jchemed.8b00316. ISSN 0021-9584.
- ^ a b Gillespie, R. J. (2008-07-01). "Fifty years of the VSEPR model". Coordination Chemistry Reviews. 252 (12): 1315–1327. doi:10.1016/j.ccr.2007.07.007. ISSN 0010-8545.
- ^ a b c d e f g Wang, Xuerui; Huang, Ying; An, Ke; Fan, Jinglan; Zhu, Jun (November 2014). "Theoretical study on the interconversion of silabenzenes and their monocyclic non-aromatic isomers via the [1,3]-substituent shift: Interplay of aromaticity and Bent's rule". Journal of Organometallic Chemistry. 770: 146–150. doi:10.1016/j.jorganchem.2014.08.018.
- ^ a b c Ghosh, Dulal C.; Bhattacharyya, Soma (January 2005). "Computation of quantum mechanical hybridization and dipole correlation of the electronic structure of the F 3 B–NH 3 supermolecule". International Journal of Quantum Chemistry. 105 (3): 270–279. doi:10.1002/qua.20690. ISSN 0020-7608.
- ^ Kimura, Katsumi; Kubo, Masaji (1959-01-01). "Structures of Dimethyl Ether and Methyl Alcohol". The Journal of Chemical Physics. 30 (1): 151–158. doi:10.1063/1.1729867. ISSN 0021-9606.
- ^ Venkateswarlu, Putcha; Gordy, Walter (1955-07-01). "Methyl Alcohol. II. Molecular Structure". The Journal of Chemical Physics. 23 (7): 1200–1202. doi:10.1063/1.1742240. ISSN 0021-9606.
- ^ Hankins, D.; Moskowitz, J. W.; Stillinger, F. H. (1970-12-15). "Water Molecule Interactions". The Journal of Chemical Physics. 53 (12): 4544–4554. doi:10.1063/1.1673986. ISSN 0021-9606.
- ^ Hilton, A. Ray; Jache, Albert W.; Beal, James B.; Henderson, William D.; Robinson, R. J. (1961-04-01). "Millimeter Wave Spectrum and Molecular Structure of Oxygen Difluoride". The Journal of Chemical Physics. 34 (4): 1137–1141. doi:10.1063/1.1731711. ISSN 0021-9606.
- ^ a b "1.2: VSEPR Theory and its Utility". Chemistry LibreTexts. 2019-08-15. Retrieved 2023-12-06.
- ^ a b Grabowski, Sławomir J. (2011-11-10). "Halogen Bond and Its Counterparts: Bent's Rule Explains the Formation of Nonbonding Interactions". The Journal of Physical Chemistry A. 115 (44): 12340–12347. doi:10.1021/jp205019s. ISSN 1089-5639.
- ^ Weinhold, F.; Landis, Clark R. (2012). Discovering Chemistry with Natural Bond Orbitals. Hoboken, N.J.: Wiley. pp. 67–68. ISBN 9781118119969.
- ^ a b c Huheey, James E. (1983). Inorganic Chemistry (3rd ed.). p. 230. ISBN 0-06-042987-9.
- ^ H. Friebolin (2008). Basic One- and Two- Dimensional NMR Spectroscopy (4 ed.). VCH. ISBN 978-3-527-31233-7.
- ^ Bent, H. A. (1960), "Distribution of atomic s character in molecules and its chemical implications", J. Chem. Educ., 37 (12): 616–624, Bibcode:1960JChEd..37..616B, doi:10.1021/ed037p616
- ^ Taft Jr., R. W. (1957), "Concerning the Electron—Withdrawing Power and Electronegativity of Groups", J. Chem. Phys., 26 (1): 93–96, Bibcode:1957JChPh..26...93T, doi:10.1063/1.1743270
- ^ a b c Coulson, C. A. (1961), Valence (2nd ed.), Oxford: Clarendon Press, pp. 203–5 Non–equivalent hybrids
- ^ Zhong, Ronglin; Zhang, Min; Xu, Hongliang; Su, Zhongmin (2016). "Latent harmony in dicarbon between VB and MO theories through orthogonal hybridization of 3σ g and 2σ u". Chemical Science. 7 (2): 1028–1032. doi:10.1039/C5SC03437J. ISSN 2041-6520. PMC 5954846. PMID 29896370.
- ^ Pfennig, Brian W. (2015). "10". Principles of Inorganic Chemistry. John Wiley and Sons. ISBN 9781118859018. Retrieved 11 August 2023.
Equation (10.11) is also known as Coulson's theorem
- ^ a b c d Dubois, Maryne A. J.; Rojas, Juan J.; Sterling, Alistair J.; Broderick, Hannah C.; Smith, Milo A.; White, Andrew J. P.; Miller, Philip W.; Choi, Chulho; Mousseau, James J.; Duarte, Fernanda; Bull, James A. (2023-05-19). "Visible Light Photoredox-Catalyzed Decarboxylative Alkylation of 3-Aryl-Oxetanes and Azetidines via Benzylic Tertiary Radicals and Implications of Benzylic Radical Stability". The Journal of Organic Chemistry. 88 (10): 6476–6488. doi:10.1021/acs.joc.3c00083. ISSN 0022-3263. PMC 10204094. PMID 36868184.
![{\displaystyle {\begin{aligned}\left\langle s+{\sqrt {\lambda _{i}}}p_{i}{\Big \vert }s+{\sqrt {\lambda _{j}}}p_{j}\right\rangle &=\langle s\mid s\rangle +{\sqrt {\lambda _{i}}}\langle s\mid p_{i}\rangle +{\sqrt {\lambda _{j}}}\langle s\mid p_{j}\rangle +{\sqrt {\lambda _{i}\lambda _{j}}}\langle p_{i}\mid p_{j}\rangle \\[4pt]&=1+0+0+{\sqrt {\lambda _{i}\lambda _{j}}}\cos \omega _{ij}=1+{\sqrt {\lambda _{i}\lambda _{j}}}\cos \omega _{ij}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a9a0eccf9438e2d82c4e98622999feded965adac)



