육불화 우라늄
Uranium hexafluoride
|
 | |
 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 육불화 우라늄 플루오르화 우라늄(VI) | |
| 식별자 | |
3D 모델(JSmol) | |
| 약어 | 16진수 |
| 체비 | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.029.116 |
| EC 번호 |
|
| 2923 | |
PubChem CID | |
| RTECS 번호 |
|
| 유니 | |
| UN 번호 | 2978 (1 % U 미만) 2977 (1 % U 이상) |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| UF6 | |
| 몰 질량 | 352.02 g/g |
| 외모 | 무색 고체 |
| 밀도 | 5.09 g/cm3, 솔리드 |
| 비등점 | 56.5 °C (133.7 °F, 329.6 K) (기압에서의 서브슬림) |
| 가수 분해 | |
| 용해성 | |
| 구조. | |
| 정형외과, oP28 | |
| Pnma, 제62호 | |
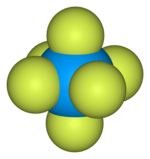
| 팔면체(Oh) | |
| 0 | |
| 열화학 | |
표준 어금니 엔트로피 (S | |
표준 엔탈피/ 형성 (δHf⦵298) | |
| 위험 요소 | |
| GHS 라벨링: | |
   | |
| 위험. | |
| H300, H330, H373, H411 | |
| NFPA 704(파이어 다이아몬드) | |
| 플래시 포인트 | 불연성 |
| 안전 데이터 시트(SDS) | ICSC 1250 |
| 관련 화합물 | |
기타 음이온 | 육염화 우라늄 |
기타 캐티온 | 육불화 넵투늄 육불화 플루토늄 |
관련 플루오르화 우라늄 | 플루오르화 우라늄(III) 우라늄(IV) 불소 플루오르화 우라늄(V) |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
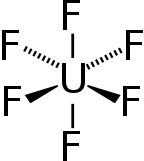
육불화우라늄(UF)은
6 UF라는 공식의6 무기 화합물이다.육불화우라늄은 물과 반응하여 부식성 불산을 방출하는 휘발성 백색 고체이다.화합물은 알루미늄과 약하게 반응하여 화합물로부터의 추가 반응에 저항하는 얇은 표면층을3 형성합니다.UF는6 원자로와 핵무기용 연료를 생산하는 우라늄 농축 과정에 사용된다.
준비
제분된 우라늄 광석-UO38 또는 "옐로우케이크"—질산에 용해되어 질산우라닐 UO2(NO3)2 용액을 생성합니다. 순수한 질산우라닐은 용매를 추출하여 암모니아로 처리하여 디우라늄산암모늄("ADU", (NH4)2U27)를 생성하며, 수소 UO는2 불산으로 변환됩니다.불소로 산화하면 UF가 생성됩니다6.
- U + 2 ClF3 → UF6 + Cl2
특성.
물리 속성

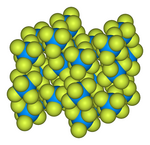
고체 구조는 77K와 293K에서 [4][5]중성자 회절에 의해 결정되었다.
육불화[7] 우라늄 가스의 결합 길이 및 각도
화학적 성질
육불화우라늄은 산화제이며[8] 불화물과 결합할 수 있는 루이스산이다. 예를 들어 구리의 반응이다.II) 아세토니트릴에 육불화우라늄이 포함된 플루오르화물은 구리를 형성하는 것으로 보고된다.헵타플루오로란산(VI), Cu(UF7).2[9]
유기 양이온을 포함한 고분자 우라늄(VI) 불화물이 분리되었으며 X선 [10]회절에 의해 특징지어졌습니다.
연료 사이클에 적용
UF는6 3중점이 64.05°C(147°F, 337K) 온도이고 정상 대기압보다 약간 높기 때문에 주요 우라늄 농축 방법인 가스 확산과 가스 원심 분리 방법 모두에 사용된다.불소는 자연발생적으로 안정된 동위원소가 1개밖에 없기 때문에 UF의6 동위원소는 존재하는 [11]우라늄 동위원소만을 기준으로 분자량이 다르다.
다른 모든 플루오르화 우라늄은 배위 고분자 비휘발성 고체이다.
UF("hex")에서6 "U mass"로의 변환 계수는 .676입니다.[12]
가스 확산은 가스 원심분리 공정의 약 60배에 달하는 에너지를 필요로 한다: 가스 확산 핵연료는 확산 과정에서 사용되는 에너지보다 25배나 많은 에너지를 생산하고 원심분리 공정에서 사용되는 에너지보다 1,500배나 더 많은 에너지를 생산한다.
육불화우라늄은 농축에 사용될 뿐만 아니라 체코에서 개발된 첨단 재처리법(불화물 휘발성)에도 사용되고 있다.이 과정에서 사용후핵연료를 불소가스로 처리해 산화물 또는 원소금속을 불소혼합물로 변환한다.그런 다음 이 혼합물을 증류하여 여러 종류의 물질을 분리합니다.일부 핵분열 생성물은 고체로 남아 있는 비휘발성 플루오르화물을 형성하여 핵폐기물로 저장하거나 용매화 기반 방법 또는 전기화학적으로 추가로 처리할 수 있다.
우라늄 농축은 폐기물로 대량의 열화우라늄 육불화우라늄(DUF6)을 생산한다.DUF의6 장기 보관은 화학적 불안정성 때문에 환경, 건강 및 안전상의 위험을 야기한다.UF는 습한 공기에 노출되면 공기6 중의 물과 반응하여 UOF(불화우라닐)와 HF(불화수소)를 생성하는데22, 모두 부식성이 강하고 독성이 강하다.2005년 686,500톤의 DUF가6 오하이오주 포츠머스, 테네시주 오크리지, [13][14]켄터키주 파두카 인근에 위치한 57,122개의 저장 실린더에 저장되었습니다.보관 실린더에 부식 및 누출 징후가 있는지 정기적으로 검사해야 합니다.강철 실린더의 예상 수명은 수십 [15]년 단위로 측정됩니다.
미국에서는 1986년 [16]세코야 연료 주식회사에서의 실린더 충전 사고와 물질 누출 사고 등 육불화 우라늄과 관련된 사고가 여러 번 있었다.미국 정부는 [17]폐기를6 위해 DUF를 고체 우라늄 산화물로 전환해 왔다.전체6 DUF 재고를 처분하는 데 1,500만 달러에서 4억 [18]5천만 달러가 소요될 수 있습니다.
레퍼런스
- ^ "Archived copy". Archived from the original on 2013-09-16. Retrieved 2013-08-08.
{{cite web}}: CS1 maint: 제목으로 아카이브된 복사(링크) - ^ a b c d Johnson, Gerald K. (1979). "The Enthalpy of Formation of Uranium Hexafluoride". The Journal of Chemical Thermodynamics. 11 (5): 483–490. doi:10.1016/0021-9614(79)90126-5.
- ^ Brickwedde, Ferdinand G.; Hoge, Harold J.; Scott, Russell B. (1948). "The Low Temperature Heat Capacities, Enthalpies, and Entropies of UF4 and UF6". J. Chem. Phys. 16 (5): 429–436. Bibcode:1948JChPh..16..429B. doi:10.1063/1.1746914.
- ^ J. H. Levy; John C. Taylor; Paul W. Wilson (1976). "Structure of Fluorides. Part XII. Single-Crystal Neutron Diffraction Study of Uranium Hexafluoride at 293 K". J. Chem. Soc., Dalton Trans. (3): 219–224. doi:10.1039/DT9760000219.
- ^ J. H. Levy, J. C. Taylor and A. B. Waugh (1983). "Neutron Powder Structural Studies of UF6, MoF6 and WF6 at 77 K". Journal of Fluorine Chemistry. 23: 29–36. doi:10.1016/S0022-1139(00)81276-2.
- ^ J. C. Taylor, P. W. W. W. 윌슨, J. W. Kelly: ①불소화물의 구조.I. 결정6 UF 구조의 이상적인 대칭으로부터의 편차: 중성자 회절 분석", Acta Crystalogr., 1973, B29, 페이지 7~12; doi:10.1107/S0567740873001895.
- ^ Kimura, Masao; Schomaker, Werner; Smith, Darwin W.; Bernard (1968). "Electron‐Diffraction Investigation of the Hexafluorides of Tungsten, Osmium, Iridium, Uranium, Neptunium, and Plutonium". J. Chem. Phys. 48 (8): 4001–4012. Bibcode:1968JChPh..48.4001K. doi:10.1063/1.1669727.
- ^ G. H. Olah; J. Welch (1978). "Synthetic methods and reactions. 46. Oxidation of organic compounds with uranium hexafluoride in haloalkane solutions". J. Am. Chem. Soc. 100 (17): 5396–5402. doi:10.1021/ja00485a024.
- ^ J. A. Berry; R. T. Poole; A. Prescott; D. W. A. Sharp; J. M. Winfield (1976). "The oxidising and fluoride ion acceptor properties of uranium hexafluoride in acetonitrile". J. Chem. Soc., Dalton Trans. (3): 272–274. doi:10.1039/DT9760000272.
- ^ S. M. Walker; P. S. Halasyamani; S. Allen; D. O'Hare (1999). "From Molecules to Frameworks: Variable Dimensionality in the UO2(CH3COO)2·2H2O/HF(aq)/Piperazine System. Syntheses, Structures, and Characterization of Zero-Dimensional (C4N2H12)UO2F4·3H2O, One-Dimensional (C4N2H12)2U2F12·H2O, Two-Dimensional (C4N2H12)2(U2O4F5)4·11H2O, and Three-Dimensional (C4N2H12)U2O4F6". J. Am. Chem. Soc. 121 (45): 10513–10521. doi:10.1021/ja992145f.
- ^ "Uranium Enrichment and the Gaseous Diffusion Process". USEC Inc. Archived from the original on 2007-10-19. Retrieved 2007-09-24.
- ^ TranslatorsCafé (1 February 2021). "Unit converter molar mass calculator". Mississauga, Ontario, Canada: ANVICA Software Development.
{{cite web}}:author=범용명(도움말)이 있습니다. - ^ "How much depleted uranium hexafluoride is stored in the United States?". Depleted UF6 FAQs. Argonne National Laboratory.
- ^ 문서.
- ^ "What is DUF6? Is it dangerous and what should we do with it?". Institute for Energy and Environmental Research. 2007-09-24.
- ^ "Have there been accidents involving uranium hexafluoride?". Depleted UF6 FAQs. Argonne National Laboratory. Archived from the original on 2017-06-09.
- ^ "What is going to happen to the uranium hexafluoride stored in the United States?". Depleted UF6 FAQs. Argonne National Laboratory.
- ^ "Are there any currently-operating disposal facilities that can accept all of the depleted uranium oxide that would be generated from conversion of DOE's depleted UF6 inventory?". Depleted UF6 FAQs. Argonne National Laboratory.
추가 정보
- Gmelins Handbuch der anorganischen Chemie, 시스템 번호 55, Uran, Teil A, 페이지 121–123.
- Gmelins Handbuch der anorganischen Chemie, 시스템 번호 55, Uran, Teil C 8, 페이지 71-163.
- R. DeWitt: 육불화 우라늄: 물리화학적 특성에 대한 조사, 기술 보고서, GAT-280; 오하이오 주 포츠머스, Goodyear Atomic Corporation; 12.1960년 8월, 도이:10.2172/4025868.
- 잉그마르 그렌테, 야누시 드로딘스키, 후지노 다케오, 에드가 C.벅, 토마스 E. 알브레히트 슈미트, 스티븐 F.우라늄, 레스터 R.모르스, 노먼 M.에델슈타인, 장 푸거(Hrsg):악티니드와 트랜잭션의 화학, Springer, Dordrecht 2006; ISBN 1-4020-355-1, 페이지 253-698; doi:10.1007/1-4020-3598-5.5 (p.530-531, 557-564).
- US-Patent 2535572: UF 준비6; 26.1950년 12월
- US-Patent 5723837: 6불화우라늄 정제; 3.1998년 3월
외부 링크
- Simon Cotton (Uppingham School, Rutland, Uppingham School, UK): 6불화우라늄.
- 육불화우라늄(UF6) – UF의 물리적6, 화학적 특성 및 우라늄 처리에 사용 – 육불화우라늄 및 그 특성
- 서방 열화 우라늄 육불화물(우라늄 꼬리)의 러시아 수입 [2017년 6월 30일 데드링크]
- www.webelements.com의 육불화우라늄

![Ball-and-stick model of the unit cell of uranium hexafluoride[6]](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c6/Uranium-hexafluoride-unit-cell-3D-balls.png/180px-Uranium-hexafluoride-unit-cell-3D-balls.png)
![Bond lengths and angles of gaseous uranium hexafluoride[7]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/4c/Uranium_hexafluoride_dimensions.svg/180px-Uranium_hexafluoride_dimensions.svg.png)