감수 재조합 검문소
Meiotic recombination checkpoint감수재조합 검문소는 감수분열 중 감수분열을 감시하고 재조합이 효율적으로 처리되지 않을 경우 은유효소 1로의 진입을 차단한다.
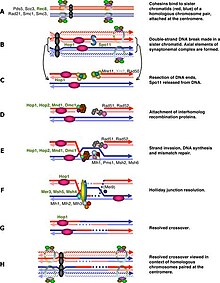
일반적으로 감수분열의 세포주기 조절은 유사분열과 유사하다.유사분열 사이클에서와 같이 이러한 전환은 다른 유전자 규제 요인인 사이클린-Cdk 복합체와 아나파제 촉진 복합체(APC)의 조합에 의해 조절된다.[1]첫 번째 주요 규제 전환은 G1 말기에 일어나는데, 이때 감수분열에서 Cln3/Cdk1이 아닌 Ime1에 의해 감수분열 사이클의 시작이 활성화된다.두 번째 주요한 전환은 은유효소 I의 진입에서 일어난다.이 단계의 주요 목적은 스핀들 폴 본체가 분리될 수 있도록 DNA 복제가 오류 없이 완료되었는지 확인하는 것이다.이 이벤트는 후기 프로 페이즈 I에서 M-Cdk의 활성화에 의해 촉발된다.그 다음 스핀들 조립체 검사점은 키네토코어의 마이크로튜브 부착을 검사한 후 APC에Cdc20 의한 은유효소 I를 개시한다.감수분열에서의 특수한 염색체 분리, 감수분열Ⅰ에서의 동질 염색체 분리, 감수분열Ⅱ에서의 크로마티스 분리는 미세관절 부착을 구별하기 위한 동질 크로마티드와 비동질 크로마티드 사이의 특별한 장력을 필요로 하며, 프로그래밍된 DNA 이중 스트랜드 파손(DSB)에 의존하고 프로 페이즈Ⅰ에서의 보수에 의존한다.따라서 감수 재조합 검문소는 특정 시점의 DNA 손상 대응의 한 종류일 수 있다.반면에 감수성 재조합 체크포인트는 감수성 재조합이 모든 쌍의 호몰로그램에서 일어나는 것을 확실히 한다.
DSB 종속 경로
후기 프로 페이즈 I에서 갑자기 M-Cdk가 시작된 것은 Ime2, Ndt80, Cdk/cyclin 콤플렉스로 구성된 양의 전사 규제 피드백 루프에 달려 있다.그러나 M-Cdk의 활성화는 일반 인산화 스위치 Wee1/Cdc25에 의해 제어된다.Wee1 활동은 초기 1단계에서 높으며, Cdc25 축적은 직접 인산화 및 We1의 성능 저하를 표시하여 M-Cdk를 활성화한다.감수성 재조합은 스포11 또는[2] 다른 내인성 또는 외인성 DNA 손상 원인에 의해 유도되는 이중 스트랜드 파단으로부터 시작할 수 있다.이 DNA파손은 은유효소 I보다 먼저 고쳐져야 하며, 이 DSB는 은유효소 I보다 먼저 고쳐져야 한다.셀은 DSB 병변이 감지될 때 Cdc25가 억제되는 ATM 경로를 통해 이러한 DSB를 모니터링한다.이 통로는 고전적인 DNA 손상 반응과 동일하며 감수재조합 검문소에서 우리가 가장 잘 알고 있는 부분이다.
DSB 독립 경로
DSB 독립 경로의 제안은 사람들이 일부 종에서 spo11 돌연변이 세포를 연구했을 때 제안되었고, 이 spo11 세포들이 DSB가 없어도 I을 은유하기 위해 처리할 수 없다는 것을 발견했을 때 제안되었다.[3]이러한 DSB의 직접적인 목적은 염색체의 결로를 돕는 것이다.초기 렙토텐에서 초기 호몰로겐 파싱은 무작위 상호작용에 불과하지만, 사전 시냅스 정렬로의 추가 진행은 이중 가닥 파단 및 단일 가닥 전달 복합체의 형성에 따라 달라진다.[1][4]따라서 스포11 세포의 비합성 염색체는 검문소의 대상이 될 수 있다.AAA-아데노신 삼인산효소(AA-ATPase)는 이 경로에서 필수적인 것으로 확인되었지만, 메커니즘은 아직 명확하지 않다.[5]일부 다른 연구들도 성체 형성을 주목으로 끌어냈으며, 그 신호는 감수성 성염색체 불활성화와 같은 구조 기반 또는 전사 규제일 수 있다.[6][7]이 계단식 아래에서, 시냅스 실패는 성 염색체로부터의 유전자 발현을 유지할 것이고, 어떤 생산물은 세포 주기 진행을 억제할 수도 있다.감수성 성염색체 불활성화는 남성에게만 일어나는데, 이는 부분적으로는 스포11 돌연변이 정조세포만이 프로상 1에서 은유체 1로 이행하지 못하는 이유일 수 있다.[3][8]그러나 비동기식은 성염색체 내에서만 발생하는 것이 아니며, 그러한 전사 규제는 비동기화되지 않은 염색체의 감수분해로서 모든 염색체들로 더욱 확대될 때까지 중단되었지만,[9] 아직 이펙터 유전자는 발견되지 않고 있다.
감수분포단백질키나제 CHEK1과 CHEK2
인간과 생쥐 CHEK1과 CHEK2의 감수 분열의 중심역할과 사카로마이오스 세레비시아아, 새너하브이염, 정신분열성체 폼베, 드로소필라 등의 직교체들은 맥퀸과 호크바겐[10], 수브라마니안과 호크바겐에 의해 검토되었다.[11]사람과 생쥐의 감수성 재조합 동안, CHEK1 단백질 키나제는 DNA 손상 수리와 세포 주기 구속을 통합하는데 중요하다.[12]CHEK1은 지고네마와 파치네마 단계 동안 감수성 시냅토네말 복합체에서 표현되고 관련된다.[12]CHEK1은 ATM 및 ATR 신호와 감수재조합 모니터링에 통합자 역할을 할 가능성이 높다.[12]생쥐 난모세포에서 CHEK1은 프로 페이즈 1을 체포하고 G2/M 검문소에서 기능하기 위해 필수불가결한 것으로 보인다.[13]
CHEK2는 생쥐 난모세포 성숙과 초기 배아 발달 동안 세포 주기 진행과 스핀들 조립을 조절한다.[14]CHEK2는 ATM 키나아제의 다운스트림 이펙터로서 이중 스트랜드 파손에 주로 반응하는 ATM 키나아제(ataxia-telangectasia and Rad3 관련) 키나아제로도 활성화할 수 있다.마우스에서 CHEK2는 여성의 감수분열에서 DNA 손상 감시를 위해 필수적이다.난모세포가 DNA 이중 가닥과 파괴 손상에 반응하는 경로 계층 구조는 ATR 키나아제가 CHEK2에 신호를 보내 p53과 p63 단백질을 활성화시키는 것이다.[15]
초파리 드로소필라에서는 세균선 세포의 조사로 이중 가닥이 끊어져 세포주기가 정지되고 세포사멸이 발생한다.드로소필라 CHEK2 정형외과적 mnk와 p53 정형외과적 dp53은 난모세포 선택과 감수재조합이 발생할 때 초기 난형 발생에서 관찰된 세포 사망의 상당 부분을 위해 필요하다.[16]
감수분해특정전사 인자 Ndt80
Ndt80은 감수분열과 포자 형성의 성공적인 완성을 위해 필요한 감수분열 특화 전사 계수다.[17]단백질은 중간 산포성분(MSE) 5'-C[AG]CAA[]를 인식하고 결합한다.감수분열과 산란을 통한 진행에 필요한 단계별 유전자의 발기인 부위에서 AT]-3'가 나타난다.[17][18][19]Ndt80의 DNA 결합 영역은 격리되어 있으며, 구조상 이 단백질이 이그폴드 전사 인자 계열의 일원임을 알 수 있다.[20]Ndt80은 MSE를 포함하는 프로모터들에 바인딩하기 위해 압류자 SUM1과 경쟁하기도 한다.[21]
효모 전환
돌연변이가 Ndt80을 싹트게 하는 효모에서 활성화하면 감수세포는 프로페상의 3단계인 늦은 파키테네에서 장기간 지연을 보인다.[22]세포들은 온전한 시냅토네말 콤플렉스를 보여주지만 결국 파키테네에 이어 확산되는 염색질 단계에서 체포된다.이 검문소 매개 체포는 이전의 사건들이 성공적으로 실행될 때까지 이후의 사건들을 방지하고 염색체 분리를 방지한다.[23][24]
세포 주기 진행에서의 역할
NDt80은 다량의 중간 감수분열 유전자의 발현을 자극하기 때문에 프로상 완성과 감수분열 1로의 진입에 결정적이다.Ndt80은 전사 및 변환 후 메커니즘(즉, 인산화)을 통해 조절된다.
Clb1과의 상호작용
ndt80은 감수분열 시 cdk1과 크게 상호작용하는 B형 사이클린 clb-1의 표현을 자극한다.[25]cdk1이 있는 clb-1의 활성 콤플렉스는 제1기 감수분열의 사건을 촉발하는 데 큰 역할을 하며, 이들의 활동은 감수분열 1로 제한된다.[26]
Ime2와의 상호작용
Ndt80은 단백질 kinase Ime2의 표현과 자기표현을 자극하는데, 둘 다 Ndt80을 더욱 자극하기 위한 피드백이다.이렇게 늘어난 Ndt80 단백질의 양은 표적 유전자의 전사를 더욱 강화시킨다.[24]감수분열 1 초기에는 Ime2 활동이 증가하며 Ndt80의 정상적인 축적과 활동에 필요하다.그러나 Ndt80을 섣불리 표현하면 처음에는 수정되지 않은 형태로 축적된다.이어 Ime2는 인지질인 Ndt80을 분해해 완전히 활성화된 Ndt80을 만드는 감수분해 특유 키나제 역할도 할 수 있다.[27]
PLK의 표현
Ndt80은 폴로 같은 키나아제인 Plk를 암호화하는 유전자의 발현을 자극한다.이 단백질은 늦은 파키테네에서 활성화되며 염색체 팔의 교차 형성과 부분적인 응집력 상실에 필요하다.Plk는 또한 파키테네 지점으로부터의 출구를 트리거하기에 충분하고 또한 충분하다.[28][29]
재조합모형
감수성 재결합 체크포인트는 감수성 재조합과 염색체 시냅스 결함에 대응하여 작동하며, 감수성 분열에 들어가기 전에 잠재적으로 세포를 체포한다.[30]게놈의 특정 영역에서 DSB(Double rooted break)에 의해 재결합이 시작되기 때문에 감수분열 1의 진입은 DSB가 수리될 때까지 지연되어야 한다.[31]감수분열 특이 키나제 Mek1이 여기에 중요한 역할을 하고 있으며 최근에는 Mek1이 IME2와 독립적으로 Ndt80을 인산화할 수 있다는 사실이 밝혀졌다.그러나 이러한 인산화 작용은 억제적이며 Ndt80이 DSB의 존재에서 MSE에 결합하는 것을 방지한다.[32]
셀 주기 진행 범위를 벗어난 역할
헤테로카리온 비호환성
헤테로카리온 비호환성(HI)은 곰팡이 면역체계에 비유되어 왔으며,[33] 곰팡이 왕국의 아소미코타 망상(Asomycota philum)의 필라멘트 구성원들 사이에서 어디서나 볼 수 있는 비자체 인식 메커니즘이다.[34]Vib-1은 Neurospora crassa에 있는 Ndt80 호몰로그로, 이 종에서 HI에 필요하다.vib1 locus에서의 돌연변이는 비자체 인식을 억제하며, VIB-1은 세포외 프로테아제 등 HI와 연관된 다운스트림 이펙터의 생산을 위해 필요한 것으로 밝혀졌다.[35][36]
여성성발달
연구는 Ndt80 동음이의어가 더 일반적으로 연구되는 성충류 세레비시아 외에 곰팡이종의 여성 성발달에도 역할을 한다는 것을 보여주었다.[35][37]vib-1의 돌연변이는 수정 전 여성 생식 구조의 시기와 발달에 영향을 미치는 것으로 밝혀졌다.[37]
암에서의 역할
비록 보통 효모와 다른 곰팡이에서 특징지어지지만, Ndt80의 DNA 결합 영역은 높은 진핵생물의 많은 단백질과 균질하며 결합에 사용되는 잔여물은 보존성이 높다.인간의 경우 Ndt80 호몰로뉴 C11orf9는 침습성 또는 전이성 종양 세포에 고도로 표현되어 있어 암 치료에서 표적 분자로의 잠재적인 사용을 암시한다.[38]그러나 최근 몇 년 동안 이 전선에서 별다른 진전이 없었다.
참고 항목
참조
- ^ a b Morgan DO (2007). "Chapter 9: Meitosis". The Cell Cycle: Principles of Control. London: New Science Press Ltd. ISBN 978-0-87893-508-6.
- ^ Malik SB, Pightling AW, Stefaniak LM, Schurko AM, Logsdon JM (August 2007). Hahn MW (ed.). "An expanded inventory of conserved meiotic genes provides evidence for sex in Trichomonas vaginalis". PLOS ONE. 3 (8): e2879. Bibcode:2008PLoSO...3.2879M. doi:10.1371/journal.pone.0002879. PMC 2488364. PMID 18663385.
- ^ a b Barchi M, Mahadevaiah S, Di Giacomo M, Baudat F, de Rooij DG, Burgoyne PS, et al. (August 2005). "Surveillance of different recombination defects in mouse spermatocytes yields distinct responses despite elimination at an identical developmental stage" (PDF). Molecular and Cellular Biology. 25 (16): 7203–15. doi:10.1128/MCB.25.16.7203-7215.2005. PMC 1190256. PMID 16055729.
- ^ Storlazzi A, Tessé S, Gargano S, James F, Kleckner N, Zickler D (November 2003). "Meiotic double-strand breaks at the interface of chromosome movement, chromosome remodeling, and reductional division". Genes & Development. 17 (21): 2675–87. doi:10.1101/gad.275203. PMC 280617. PMID 14563680.
- ^ Bhalla N, Dernburg AF (December 2005). "A conserved checkpoint monitors meiotic chromosome synapsis in Caenorhabditis elegans". Science. 310 (5754): 1683–6. Bibcode:2005Sci...310.1683B. doi:10.1126/science.1117468. PMID 16339446. S2CID 37038648.
- ^ Odorisio T, Rodriguez TA, Evans EP, Clarke AR, Burgoyne PS (March 1998). "The meiotic checkpoint monitoring synapsis eliminates spermatocytes via p53-independent apoptosis". Nature Genetics. 18 (3): 257–61. doi:10.1038/ng0398-257. PMID 9500548. S2CID 20536227.
- ^ Turner JM, Mahadevaiah SK, Elliott DJ, Garchon HJ, Pehrson JR, Jaenisch R, Burgoyne PS (November 2002). "Meiotic sex chromosome inactivation in male mice with targeted disruptions of Xist". Journal of Cell Science. 115 (Pt 21): 4097–105. doi:10.1242/jcs.00111. PMID 12356914.
- ^ Di Giacomo M, Barchi M, Baudat F, Edelmann W, Keeney S, Jasin M (January 2005). "Distinct DNA-damage-dependent and -independent responses drive the loss of oocytes in recombination-defective mouse mutants". Proceedings of the National Academy of Sciences of the United States of America. 102 (3): 737–42. Bibcode:2005PNAS..102..737D. doi:10.1073/pnas.0406212102. PMC 545532. PMID 15640358.
- ^ Manterola M, Page J, Vasco C, Berríos S, Parra MT, Viera A, et al. (August 2009). Hawley RS (ed.). "A high incidence of meiotic silencing of unsynapsed chromatin is not associated with substantial pachytene loss in heterozygous male mice carrying multiple simple robertsonian translocations". PLOS Genetics. 5 (8): e1000625. doi:10.1371/journal.pgen.1000625. PMC 2726437. PMID 19714216.
- ^ MacQueen AJ, Hochwagen A (July 2011). "Checkpoint mechanisms: the puppet masters of meiotic prophase". Trends in Cell Biology. 21 (7): 393–400. doi:10.1016/j.tcb.2011.03.004. PMID 21531561.
- ^ Subramanian VV, Hochwagen A (October 2014). "The meiotic checkpoint network: step-by-step through meiotic prophase". Cold Spring Harbor Perspectives in Biology. 6 (10): a016675. doi:10.1101/cshperspect.a016675. PMC 4176010. PMID 25274702.
- ^ a b c Flaggs G, Plug AW, Dunks KM, Mundt KE, Ford JC, Quiggle MR, et al. (December 1997). "Atm-dependent interactions of a mammalian chk1 homolog with meiotic chromosomes". Current Biology. 7 (12): 977–86. doi:10.1016/s0960-9822(06)00417-9. PMID 9382850.
- ^ Chen L, Chao SB, Wang ZB, Qi ST, Zhu XL, Yang SW, et al. (May 2012). "Checkpoint kinase 1 is essential for meiotic cell cycle regulation in mouse oocytes". Cell Cycle. 11 (10): 1948–55. doi:10.4161/cc.20279. PMID 22544319.
- ^ Dai XX, Duan X, Liu HL, Cui XS, Kim NH, Sun SC (February 2014). "Chk2 regulates cell cycle progression during mouse oocyte maturation and early embryo development". Molecules and Cells. 37 (2): 126–32. doi:10.14348/molcells.2014.2259. PMC 3935625. PMID 24598997.
- ^ Bolcun-Filas E, Rinaldi VD, White ME, Schimenti JC (January 2014). "Reversal of female infertility by Chk2 ablation reveals the oocyte DNA damage checkpoint pathway". Science. 343 (6170): 533–6. Bibcode:2014Sci...343..533B. doi:10.1126/science.1247671. PMC 4048839. PMID 24482479.
- ^ Shim HJ, Lee EM, Nguyen LD, Shim J, Song YH (2014). "High-dose irradiation induces cell cycle arrest, apoptosis, and developmental defects during Drosophila oogenesis". PLOS ONE. 9 (2): e89009. Bibcode:2014PLoSO...989009S. doi:10.1371/journal.pone.0089009. PMC 3923870. PMID 24551207.
- ^ a b Xu L, Ajimura M, Padmore R, Klein C, Kleckner N (December 1995). "NDT80, a meiosis-specific gene required for exit from pachytene in Saccharomyces cerevisiae". Molecular and Cellular Biology. 15 (12): 6572–81. doi:10.1128/MCB.15.12.6572. PMC 230910. PMID 8524222.
- ^ Chu S, Herskowitz I (April 1998). "Gametogenesis in yeast is regulated by a transcriptional cascade dependent on Ndt80". Molecular Cell. 1 (5): 685–96. doi:10.1016/S1097-2765(00)80068-4. PMID 9660952.
- ^ Ozsarac N, Straffon MJ, Dalton HE, Dawes IW (March 1997). "Regulation of gene expression during meiosis in Saccharomyces cerevisiae: SPR3 is controlled by both ABFI and a new sporulation control element". Molecular and Cellular Biology. 17 (3): 1152–9. doi:10.1128/MCB.17.3.1152. PMC 231840. PMID 9032242.
- ^ Lamoureux JS, Stuart D, Tsang R, Wu C, Glover JN (November 2002). "Structure of the sporulation-specific transcription factor Ndt80 bound to DNA". The EMBO Journal. 21 (21): 5721–32. doi:10.1093/emboj/cdf572. PMC 131069. PMID 12411490.
- ^ Hendrickson WA, Ward KB (October 1975). "Atomic models for the polypeptide backbones of myohemerythrin and hemerythrin". Biochemical and Biophysical Research Communications. 66 (4): 1349–56. doi:10.1016/0006-291x(75)90508-2. PMID 5.
- ^ Morgan DO (2007). The Cell Cycle: Principles of Control. New Science Press Ltd. p. 186.
- ^ Roeder GS, Bailis JM (September 2000). "The pachytene checkpoint". Trends in Genetics. 16 (9): 395–403. doi:10.1016/s0168-9525(00)02080-1. PMID 10973068.
- ^ a b Tung KS, Hong EJ, Roeder GS (October 2000). "The pachytene checkpoint prevents accumulation and phosphorylation of the meiosis-specific transcription factor Ndt80". Proceedings of the National Academy of Sciences of the United States of America. 97 (22): 12187–92. Bibcode:2000PNAS...9712187T. doi:10.1073/pnas.220464597. PMC 17316. PMID 11035815.
- ^ Tibbles KL, Sarkar S, Novak B, Arumugam P (2013-11-01). Wang Y (ed.). "CDK-dependent nuclear localization of B-cyclin Clb1 promotes FEAR activation during meiosis I in budding yeast". PLOS ONE. 8 (11): e79001. Bibcode:2013PLoSO...879001T. doi:10.1371/journal.pone.0079001. PMC 3815228. PMID 24223874.
- ^ Carlile TM, Amon A (April 2008). "Meiosis I is established through division-specific translational control of a cyclin". Cell. 133 (2): 280–91. doi:10.1016/j.cell.2008.02.032. PMC 2396536. PMID 18423199.
- ^ Sopko R, Raithatha S, Stuart D (October 2002). "Phosphorylation and maximal activity of Saccharomyces cerevisiae meiosis-specific transcription factor Ndt80 is dependent on Ime2". Molecular and Cellular Biology. 22 (20): 7024–40. doi:10.1128/MCB.22.20.7024-7040.2002. PMC 139797. PMID 12242283.
- ^ Clyne RK, Katis VL, Jessop L, Benjamin KR, Herskowitz I, Lichten M, Nasmyth K (May 2003). "Polo-like kinase Cdc5 promotes chiasmata formation and cosegregation of sister centromeres at meiosis I". Nature Cell Biology. 5 (5): 480–5. doi:10.1038/ncb977. PMID 12717442. S2CID 25721650.
- ^ Sourirajan A, Lichten M (October 2008). "Polo-like kinase Cdc5 drives exit from pachytene during budding yeast meiosis". Genes & Development. 22 (19): 2627–32. doi:10.1101/gad.1711408. PMC 2559907. PMID 18832066.
- ^ Pak J, Segall J (September 2002). "Role of Ndt80, Sum1, and Swe1 as targets of the meiotic recombination checkpoint that control exit from pachytene and spore formation in Saccharomyces cerevisiae". Molecular and Cellular Biology. 22 (18): 6430–40. doi:10.1128/MCB.22.18.6430-6440.2002. PMC 135635. PMID 12192042.
- ^ Keeney S, Lange J, Mohibullah N (2014-11-23). "Self-organization of meiotic recombination initiation: general principles and molecular pathways". Annual Review of Genetics. 48 (1): 187–214. doi:10.1146/annurev-genet-120213-092304. PMC 4291115. PMID 25421598.
- ^ Chen X, Gaglione R, Leong T, Bednor L, de Los Santos T, Luk E, et al. (November 2018). Lichten M (ed.). "Mek1 coordinates meiotic progression with DNA break repair by directly phosphorylating and inhibiting the yeast pachytene exit regulator Ndt80". PLOS Genetics. 14 (11): e1007832. doi:10.1371/journal.pgen.1007832. PMC 6289461. PMID 30496175.
- ^ Paoletti M, Saupe SJ (November 2009). "Fungal incompatibility: evolutionary origin in pathogen defense?". BioEssays. 31 (11): 1201–10. doi:10.1002/bies.200900085. PMID 19795412. S2CID 31228073.
- ^ Saupe SJ (September 2000). "Molecular genetics of heterokaryon incompatibility in filamentous ascomycetes". Microbiology and Molecular Biology Reviews. 64 (3): 489–502. doi:10.1128/MMBR.64.3.489-502.2000. PMC 99001. PMID 10974123.
- ^ a b Hutchison EA, Glass NL (August 2010). "Meiotic regulators Ndt80 and ime2 have different roles in Saccharomyces and Neurospora". Genetics. 185 (4): 1271–82. doi:10.1534/genetics.110.117184. PMC 2927755. PMID 20519745.
- ^ Dementhon K, Iyer G, Glass NL (December 2006). "VIB-1 is required for expression of genes necessary for programmed cell death in Neurospora crassa". Eukaryotic Cell. 5 (12): 2161–73. doi:10.1128/EC.00253-06. PMC 1694810. PMID 17012538.
- ^ a b Katz ME, Cooper S (October 2015). "Extreme Diversity in the Regulation of Ndt80-Like Transcription Factors in Fungi". G3. 5 (12): 2783–92. doi:10.1534/g3.115.021378. PMC 4683649. PMID 26497142.
- ^ Montano SP, Pierce M, Coté ML, Vershon AK, Georgiadis MM (December 2002). "Crystallographic studies of a novel DNA-binding domain from the yeast transcriptional activator Ndt80". Acta Crystallographica. Section D, Biological Crystallography. 58 (Pt 12): 2127–30. doi:10.2210/pdb1m6u/pdb. PMID 12454476.


