수소화
Hydrogenation
(1) 촉매 표면에 반응물을 흡착하여2 H해리를 실시한다.
(2) 하나의 C원자에 H원자가 결합한다.다른 C 원자는 아직 표면에 부착되어 있습니다.
(3) 제2의 C원자가 H원자에 결합한다.그 분자는 표면을 떠난다.
| 공정 유형 | 화학의 |
|---|---|
| 산업 부문 | 식품업, 석유화학업, 제약업, 농업 |
| 주요 기술 또는 하위 프로세스 | 다양한 전이 금속 촉매, 고압 기술 |
| 공급원료 | 불포화 기판 및 수소 또는 수소 공여체 |
| 제품 | 포화 탄화수소 및 유도체 |
| 발명가 | 폴 사바티에 |
| 발명의 연도 | 1897 |
수소화는 분자 수소(H2)와 다른 화합물 또는 원소 사이의 화학 반응으로, 보통 니켈, 팔라듐 또는 백금과 같은 촉매가 존재하는 경우입니다.이 과정은 유기화합물을 환원하거나 포화시키기 위해 일반적으로 사용된다.수소화는 일반적으로 분자, 종종 알켄에 수소 원자의 쌍을 추가하는 것을 구성합니다.반응을 사용하려면 촉매가 필요합니다. 비촉매 수소화는 매우 높은 온도에서만 발생합니다.수소화는 [1]탄화수소의 이중결합과 삼중결합을 감소시킨다.
과정
수소화에는 불포화 기질, 수소(또는 수소원) 및 촉매의 세 가지 성분이 있습니다.환원 반응은 기판 및 촉매의 활성에 따라 다른 온도 및 압력에서 수행됩니다.
관련 반응 또는 경쟁 반응
수소화 반응에 사용되는 촉매와 조건은 또한 시스에서 트랜스까지 알케인의 이성화를 초래할 수 있다.이 과정은 수소화 기술이 식품에서 트랜스 지방의 대부분을 발생시키기 때문에 매우 흥미롭다(아래 ② 식품 산업 참조).수소가 첨가되는 동안 결합이 끊어지는 반응을 수소 분해라고 하는데, 이것은 탄소-탄소 및 탄소-헤테로 원자(산소, 질소 또는 할로겐) 결합에 발생할 수 있는 반응이다.극성 결합의 일부 수소화는 수소 분해를 동반한다.
수소원
수소화의 경우, 수소의 확실한 공급원은 H 가스 그 자체이며2, 일반적으로 가압 실린더의 저장 매체 내에서 상업적으로 이용 가능하다.수소화 과정에서는 보통 실린더에서 운반되며 때로는 "부스터 펌프"에 의해 증강되는 2기압 이상의2 H를 사용하는 경우가 많습니다.수소가스는 증기 [2]개질이라고 알려진 과정에 의해 탄화수소로부터 산업적으로 생산된다.많은 응용 분야에서 수소는 포름산, 이소프로판올 및 디히드로안트라센과 [3]같은 공여 분자로부터 전달된다.이러한 수소 공여체는 각각 이산화탄소, 아세톤, 안트라센으로 탈수소된다.이러한 과정을 이동 수소화라고 합니다.
기판
알켄과 알킨 수소화의 중요한 특징은 균질 및 불균일하게 촉매된 버전 모두 수소 첨가가 "합성 첨가"와 함께 발생하며, 수소는 가장 장애가 적은 [4]쪽에서 유입된다는 것이다.이 반응은 다양한 기능 그룹에서 수행할 수 있습니다.
| 기판 | 제품. | 평. | 수소화 열 (kJ/mol)[5] |
|---|---|---|---|
| RC2=CR'2 (알킨) | RCHR2'2 (알칸) | 큰 응용은 마가린의 생산이다 | -90 ~ -130 |
| RCcrCR' (알킨) | RCHR22' (알칸) | 반수소화는 cis-RHC=CH'를 생성한다. | −300 (완전 수소화용) |
| RCHO (알데히드) | RCH2OH (1차 알코올) | 종종 이동 수소화를 이용한다 | -60 ~ -65 |
| R2CO (케톤) | R2CHOH (2차 알코올) | 종종 이동 수소화를 이용한다 | -60 ~ -65 |
| RCO2R' (에스터) | RCH2OH + R'OH (술 2잔) | 종종 지방 알코올 생산에 적용된다 | -25 ~ -105 |
| RCO2H (디옥실산) | RCH2OH (1차 알코올) | 지방 알코올에 적용할 수 있다 | -25 ~ -75 |
| RNO2 (프로) | RNH2 (아민) | 주요 용도는 아닐린이다[6][7] | −550 |
촉매
드문 예외를 제외하고, H는2 금속 촉매가 없을 때 유기 화합물에 대해 반응하지 않습니다.불포화 기질은 촉매에 화학 흡착되며, 대부분의 부위는 기질로 덮여 있습니다.이종촉매에서 수소는 표면수소화물(M-H)을 형성하고, 여기에서 수소는 화학흡착기판에 전달될 수 있다.백금, 팔라듐, 로듐 및 루테늄은 H의 낮은2 온도와 낮은 압력에서 작동하는 고활성 촉매를 형성합니다. 특히 니켈(라니켈 및 우루시바라 니켈 등)을 기반으로 하는 비정밀 금속 촉매도 경제적인 대안으로 개발되었지만 종종 더 느리거나 더 높은 온도를 필요로 합니다.단점은 활성(반응 속도) 대 촉매 비용 및 고압 사용에 필요한 장치 비용입니다.Raney-nickel 촉매 수소화에는 [8][9]고압이 필요합니다.
촉매는 일반적으로 균질 촉매와 이종 촉매의 두 가지 큰 클래스로 분류됩니다.균질 촉매는 불포화 기질을 포함하는 용매에 용해됩니다.이종 촉매는 기판과 동일한 용매에 부유하거나 기체 기질로 처리되는 고체이다.
균질 촉매
잘 알려진 균질 촉매는 다음과 같습니다.이들은 불포화 기질과 H를2 모두 활성화하는 배위착체이다.대부분의 복합체에는 백금족 금속, 특히 Rh와 Ir이 포함되어 있다.
- 균질 수소화 촉매 및 그 전구체
디클로로트리스(트리페닐포스핀)루테늄(II)는 루테늄에 기초한 전촉매이다.
크랩트리의 촉매는 이리듐을 특징으로 하는 고활성 촉매입니다.
(S)-iPr-PHOX는 비대칭 수소화에 사용되는 대표적인 킬레이트 포스핀 배위자이다.
프로키랄 기질의 수소화에 의한 비대칭 합성에도 균질 촉매가 사용된다.이 접근방식의 초기 입증은 약물 L-DOPA의 [10]전구물질로서 에나미드의 Rh 촉매 수소화였다.비대칭 환원을 달성하기 위해 이들 촉매는 키랄디포스핀배위자를 사용하여 키랄화된다.[11]로듐 촉매 수소화는 조시포스형 리간드(자일리포스)[12]를 사용하는 S-메톨라클로의 제초제 생산에도 사용되어 왔다.원칙적으로 비대칭 수소화는 키랄 이종 [13]촉매에 의해 촉매될 수 있지만, 이 접근법은 유용한 기술이라기보다는 호기심에 가깝다.
이종 촉매
수소화를 위한 이종 촉매는 산업적으로 더 흔하다.산업에서는 활성탄, 알루미나, 탄산칼슘 또는 [14]황산바륨 등의 값싸고 부피가 크고 다공성이며 통상 입상물질인 지지체 위에 귀금속 수소화촉매를 미분으로 용액에서 퇴적시킨다.예를 들어 카본상의 백금은 카본 중의 클로로플라틴산을 환원함으로써 생성된다.이러한 촉매의 예로는 활성탄에서 루테늄 5% 또는 알루미나에서 백금 1%가 있습니다.Raney 니켈과 같은 비금속 촉매는 일반적으로 훨씬 저렴하고 지원이 필요하지 않습니다.또한 실험실에서는 비용이 많이 들지만 백금 블랙과 같은 지지되지 않는(대형) 귀금속 촉매가 여전히 사용되고 있다.
균질 촉매와 마찬가지로 활성은 금속 주위의 환경 변화(즉, 배위구)를 통해 조절된다.예를 들어 결정성 이종 촉매의 다른 면은 다른 활성을 나타낸다.이는 금속을 혼합하거나 다른 준비 기법을 사용하여 수정할 수 있습니다.마찬가지로 이기종 촉매도 지지대의 영향을 받습니다.
많은 경우, 매우 경험적인 수정은 선택적 "독성"을 수반한다.따라서 방향족 고리를 건드리지 않고 알케인을 수소화하거나 린들라 촉매를 사용하여 알케인을 알케인으로 선택적으로 수소화시키는 등 일부 관능기를 다른 작용기에 영향을 미치지 않고 수소화하는데 신중하게 선택된 촉매를 사용할 수 있다.예를 들어 촉매 팔라듐을 황산바륨 위에 놓고 퀴놀린으로 처리하면 알케인만큼만 알케인을 환원한다.린들라 촉매는 페닐아세틸렌을 [15]스티렌으로 전환하는 데 적용되었습니다.
수소화 전달

이동수소화는 H분자2 외에 수소공여분자를 사용한다.이 "희생적인" 수소 공여체에는 히드라진, 포름산 [18]및 이소프로판올과 같은 알코올도 포함됩니다.
유기합성에 있어서 전이수소화는 키랄촉매를 이용하여 케톤, 알데히드, 이미인 등의 극성 불포화기판의 비대칭 수소화에 유용하다.
전해 수소화
아질산염과 같은 극성 기판은 전기화학적으로 수소화 될 수 있으며,[19] 프로톤 용제를 사용하여 수소의 공급원으로 환원할 수 있다.
열역학 및 메커니즘
탄화수소의 이중 또는 삼중 결합에 수소를 첨가하는 것은 열역학적으로 유리할 수 있는 산화환원 반응의 일종이다.예를 들어 에텐에 수소를 첨가하면 깁스 자유에너지 변화가 -101kJ·mol로−1 [11]발열성이 높다.예를 들어 식물성 기름과 지방산의 수소화에서 방출되는 열은 몰당 약 25kcal(105kJ/mol)로 요오드 수치 저하당 1.6–1.7°C까지 오일 온도를 올리기에 충분하다.
그러나 대부분의 수소화 반응의 반응 속도는 촉매가 없는 경우 무시할 수 있다.알켄과 알킨의 금속 촉매 수소화 메커니즘은 광범위하게 [20]연구되어 왔다.우선 중수소를 사용한 동위원소 표기는 첨가물의 위치 화학적 특성을 확인한다.
- RCH → CH2 + D2 → RCHDCHD2
이종 촉매 작용
고체에서 허용되는 메커니즘은 Horiuti-Polanyi [21][22]메커니즘입니다.
- 불포화 결합의 결합
- 촉매상의 H 해리2
- 수소 원자 1개 추가. 이 단계는 가역적입니다.
- 두 번째 원자의 추가, 사실상 되돌릴 수 없습니다.
세 번째 단계에서는 알킬기가 촉매에서 분리되는 알켄으로 되돌아갈 수 있다.따라서 수소화 촉매와의 접촉에 의해 시스 트랜스 이성화가 가능해진다.트랜스알켄은 표면에 재결합하여 수소화를 할 수 있다.회수된 알켄에는 종종 중수소가 포함되어 있기 때문에 이러한 세부 사항은 부분적으로 D2(중수소)를 사용하여 드러난다.
방향족 기판의 경우 첫 번째 수소화 속도가 가장 느리다.이 공정의 산물은 시클로헥사디엔으로 빠르게 수소화되어 거의 검출되지 않는다.마찬가지로 시클로헥센은 통상적으로 시클로헥산으로 환원된다.
균질 촉매 작용
많은 균질 수소화 [23]공정에서 금속은 두 성분 모두에 결합하여 중간 알켄-금속(H)2 착체를 생성한다.일반적인 반응 순서는 다음과 같거나 관련 단계의 순서인 것으로 가정한다.
- LMn + H2 → LMHn2
- 알켄 결합:
- LMn(δH22) + CH2=CH→CH→LMHn-12(CH2=CH) + L
- 금속에서 탄소로의 수소 원자 1개의 이동(잠금 삽입)
- LMHn-12(CH2=CHR) → LMn-1(H)(CH-CHR)22
- 알칸의 동시 해리와 함께 금속에서 알킬기로의 두 번째 수소 원자의 이동("흡수 제거")
- LMn-1(H)(CH-CHR)22 → LMn-1 + CH-CHR
무기질 기판
암모니아를 생성하기 위한 질소의 수소화는 Haber-Bosch 프로세스에 의해 광범위하게 수행되며, 전 세계 에너지 공급의 약 1%를 소비한다.
산소는 부분적으로 수소화되어 과산화수소를 만들 수 있지만, 이 과정은 상용화되지 않았다.한 가지 어려움은 촉매가 [24][25]물을 형성하기 위해 과산화수소의 분해를 유발하는 것을 막는 것이다.
산업용 응용 프로그램
촉매 수소화는 다양한 산업 용도를 가지고 있다.가장 빈번하게 산업용 수소화는 [2]이종 촉매에 의존합니다.
식품 산업
식품 산업은 식물성 기름을 수소를 첨가하여 스프레드, 사탕, 구운 제품, 마가린과 같은 다른 제품에 사용될 수 있는 고체 또는 반고체 지방으로 변환시킨다.식물성 기름은 다불포화 지방산으로 만들어진다.수소화는 이러한 이중 [26]결합의 일부를 제거한다.
석유화학공업
석유화학 공정에서 수소화는 알케인과 방향족 물질을 포화 알칸(파라핀)과 사이클로알칸(나프텐)으로 변환하는 데 사용되며, 이들은 독성이 적고 반응성이 낮다.포화 탄화수소는 때때로 공기 중에 장기간 보관되는 액체 연료와 관련하여 뛰어난 보관 특성을 보입니다.반면, 알케인은 연료 취급 장비를 방해하는 잇몸을 형성할 수 있는 하이드로페록시드를 형성하는 경향이 있다.예를 들어, 미네랄 테레빈유는 보통 수소화된다.무거운 잔류물을 디젤로 수소 분해하는 것도 또 다른 응용 분야입니다.이성질화 및 촉매개질공정에서는 촉매상에 형성된 코크스를 수소분해하여 축적을 방지하기 위해 수소압을 일정량 유지한다.
유기화학
수소화는 불포화합물을 포화유도체로 전환하는데 유용한 수단이다.기질에는 알켄 및 알킨뿐만 아니라 알데히드, 이미인 및 [27]질화합물(알코올 및 아민)로 변환되는 질화합물도 포함된다.따라서 일산화탄소와 알켄에서 옥소프로세스로 합성할 수 있는 알킬알데히드를 알코올로 변환할 수 있다.예: 1-프로판올은 에텐과 일산화탄소에서 생성되는 프로페오날데히드로부터 생성됩니다.폴리올인 자일리톨은 알데히드인 자일로스의 수소화에 의해 생산된다.1차 아민은 질화물의 수소화에 의해 합성될 수 있는 반면, 질화물은 시안화물과 적절한 전자 친필로부터 쉽게 합성된다.예를 들어 폴리우레탄 모노머인 이소포론 디이소시아네이트의 전구체인 이소포론 디아민은 암모니아에 의한 탠덤 니트릴 수소화 환원 아민에 의해 이소포론 니트릴로부터 제조되며, 수소화는 이 니트릴을 아민으로, 암모니아에 의해 형성된 이소포론 니트릴을 다른 아민으로 변환한다.
석탄의 수소화
역사
이종 촉매 수소화
최초의 수소화는 1823년에 상용화된 장치인 도베라이너 램프의 산소에 수소를 첨가하는 백금 촉매 작용이다.프랑스의 화학자 폴 사바티에는 수소화 과정의 아버지로 여겨진다.1897년, 비누 제품 제조에 종사하는 미국인 화학자 제임스 보이스의 초기 연구를 바탕으로, 그는 니켈의 흔적이 현재 사바티에 공정으로 알려진 가스 탄화수소 분자에 수소를 첨가하는 촉매 작용을 한다는 것을 발견했다.이 공로로, 사바티에는 1912년 노벨 화학상을 공동 수상했다.Wilhelm Normann은 1902년 독일에서, 1903년 영국에서 액체 기름의 수소화에 대한 특허를 받았으며, 이것이 현재 세계적인 산업의 시작이었다.1905년에 처음 기술된 상업적으로 중요한 Haber-Bosch 공정은 질소의 수소화를 수반한다.1922년에 보고된 피셔-트롭슈 공정에서는 석탄에서 쉽게 얻어지는 일산화탄소가 액체 연료로 수소화된다.
1922년, Voorhees와 Adams는 한 [28]대기 위의 압력에서 수소화를 수행하는 장치를 설명했습니다.높은 압력과 온도를 이용해 수소화를 가능하게 하는 최초의 제품인 파르 셰이커는 1926년 부아즈와 애덤스의 연구를 바탕으로 상용화 되어 현재 널리 사용되고 있다.1924년 Murray Raney는 니켈의 미세 분말을 개발했는데, 니켈은 아민으로의 질화 반응이나 마가린의 생산과 같은 수소화 반응을 촉진하는 데 널리 사용됩니다.
균질 촉매 수소화
1930년대에 칼빈은 구리를 발견했다.II) 착화체 산화2 H.1960년대는 전이 금속 착체를 이용한 잘 정의된 균질 촉매(예: 윌킨슨의 촉매(RhCl(PPH3)))3의 개발을 목격했다.곧 카티온성 Rh와 Ir은 알케인과 카르보닐의 [29]수소화를 촉매하는 것으로 밝혀졌다.1970년대에는 L-DOPA의 합성에서 비대칭 수소화가 실증되었고, 1990년대에는 노요리 비대칭 수소화가 [30]발명되었다.균질 수소화의 발달은 1930년대와 1940년대에 시작된 옥소 공정과 지글러-나타 중합에 의해 영향을 받았다.
무금속 수소화
대부분의 실용적인 목적을 위해 수소화에는 금속 촉매가 필요합니다.그러나 수소화는 촉매 없이 일부 수소 공여체로부터 진행될 수 있으며, 수소 공여체는 다이미드와 이소프로옥사이드이며, 수소 공여체는 Meerwein-Ponndorf-Verley 감소로 설명된다.일부 무금속 촉매 시스템은 학술 연구에서 조사되었습니다.케톤 환원을 위한 그러한 시스템 중 하나는 tert-부탄올과 tert-부톡시드 칼륨으로 구성되며 매우 높은 [31]온도로 구성된다.아래 반응은 벤조페논의 수소화를 설명한다.
화학역학 연구에[32] 따르면 이 반응은 주기적인 6원 전이 상태를 나타내는 세 가지 반응 물질 모두에서 1차 반응으로 밝혀졌다.
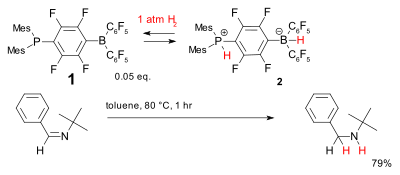
금속이 없는 수소화를 위한 또 다른 시스템은 포스핀-보란 화합물인 화합물 1을 기반으로 하는데, 이것은 좌절된 루이스 쌍이라고 불려왔다.그것은 비교적 낮은 온도에서 이수소를 가역적으로 받아들여 단순한 방해 [33]이민을 줄일 수 있는 포스포늄 붕산염 2를 형성한다.
니트로벤젠의 아닐린으로의 환원은 플라렌, 그 모노 음이온, 대기 중의 수소 [34]및 자외선에 의해 촉매되는 것으로 보고되었다.
수소화에 사용하는 기기
오늘날의 벤치 화학자는 세 가지 주요 수소화 장비를 선택할 수 있습니다.
- 대기 조건에서의 일괄 수소화
- 고온 및/또는[35] 압력 상승 시 수소화 배치
- 흐름 수소화
대기 조건에서의 일괄 수소화
교수 실험실에서 여전히 일반적으로 사용되는 수소화의 원형 형태인 이 프로세스는 질소 또는 아르곤 가스를 사용하여 배출한 용해된 반응물의 원형 바닥 플라스크에 고체 촉매를 추가하고 혼합물을 관통성 고무 씰로 밀봉함으로써 영향을 받습니다.수소 가스는 H가2 채워진 풍선으로부터 공급된다.결과적으로 발생하는 3상 혼합물은 혼합을 촉진하기 위해 교반됩니다.수소 흡수를 감시할 수 있어 수소화 진행 상황을 감시하는 데 유용하다.이는 유색 액체(일반적으로 황산동 수성)가 들어 있는 눈금이 있는 튜브를 사용하거나 각 반응 용기에 대한 게이지를 사용하여 이루어집니다.
고온 및/또는 압력 상승 시 수소화 배치
보호기의 수소 분해 및 방향족 시스템의 감소와 같은 많은 수소화 반응이 대기 온도 및 압력에서 매우 느리게 진행되기 때문에 가압 시스템이 인기입니다.이 때 압력용기 내의 불활성 분위기 하에서 반응물 용액에 촉매를 첨가한다.실린더 또는 실험용 수소원에서 직접 수소를 첨가하여 가압된 슬러리를 기계적으로 요동시켜 교반시키거나 방적바구니를 사용한다.[35]최근 전기분해 기술의 발전은 물에서 최대 100bar(1400PSI)의 수소를 생성하는 고압 수소 발생기의 개발로 이어졌다.압력은 가스 용해성의 감소를 보상하기 때문에 열을 사용할 수도 있다.
흐름 수소화
플로우 수소화는 벤치에서 널리 사용되는 기법이 되었고 프로세스 규모도 점점 커지고 있습니다.이 기술은 수소가 존재하는 상태에서 용해된 반응물의 희박한 흐름을 고정층 촉매 위로 지속적으로 흘려보내는 것을 포함합니다.확립된 HPLC 기술을 사용하여 대기압을 1,450psi(100bar)까지 적용할 수 있습니다.높은 온도를 사용할 수도 있습니다.벤치 스케일에서는 시스템이 다양한 사전 충전 촉매를 사용하므로 발열성 촉매를 측정하고 필터링할 필요가 없습니다.
산업용 원자로
촉매 수소화는 지지 촉매가 충전된 관상 플러그 플로우 리액터(PFR)에서 이루어집니다.압력과 온도는 보통 높지만 이는 촉매에 따라 다릅니다.촉매 부하는 일반적으로 실험실 배치 수소화보다 훨씬 낮으며, 활성, 선택성 및 촉매 안정성을 개선하기 위해 다양한 프로모터가 금속에 첨가되거나 혼합 금속이 사용됩니다.니켈은 귀금속에 비해 가격이 저렴하기 때문에 활성이 낮음에도 불구하고 사용이 일반적이다.
가스 액체 유도 [36]반응기(Hydrogenator)는 촉매 수소화 수행에도 사용됩니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Hudlický, Miloš (1996). Reductions in Organic Chemistry. Washington, D.C.: American Chemical Society. p. 429. ISBN 978-0-8412-3344-7.
- ^ a b Paul N. Rylander, Wiley-VCH, Wellmann's Encyclopedia of Industrial Chemistry, 2005.doi:10.1002/14356007.a13_487.
- ^ 벡, 셰이유기 금속 화학영국, EDTECH, 2019.
- ^ 고급 유기화학 제리 3월 2일호[full citation needed]
- ^ 스콧 D.James A가 편집한 산업화학 및 생명공학 핸드북의 Barnicki "합성유기화학"뉴욕 켄트: 스프링거, 2012년ISBN 978-1-4614-4259-2.
- ^ "Hydrogenation of nitrobenzene using polymer bound Ru(III) complexes as catalyst". Ind. Jr. Of Chem. Tech. 7: 280. 2000.
- ^ Patel, D. R. (1998). "Hydrogenation of nitrobenzene using polymer anchored Pd(II) complexes as catalyst". Journal of Molecular Catalysis. 130 (1–2): 57. doi:10.1016/s1381-1169(97)00197-0.
- ^ C. F. H. Allen and James VanAllan (1955). "m-Toylybenzylamine". Organic Syntheses.; Collective Volume, vol. 3, p. 827
- ^ A. B. Mekler, S. Ramachandran, S. Swaminathan, and Melvin S. Newman (1973). "2-Methyl-1,3-Cyclohexanedione". Organic Syntheses.
{{cite journal}}: CS1 유지: 여러 이름: 작성자 목록(링크); - ^ Knowles, W. S. (March 1986). "Application of organometallic catalysis to the commercial production of L-DOPA". Journal of Chemical Education. 63 (3): 222. Bibcode:1986JChEd..63..222K. doi:10.1021/ed063p222.
- ^ a b Atkins, Peter W. (2010). Shriver & Atkins' inorganic chemistry (5th ed.). New York: W. H. Freeman and Co. p. 696. ISBN 978-1-4292-1820-7.
- ^ Blaser, Hans-Ulrich; Pugin, Benoît; Spindler, Felix; Thommen, Marc (December 2007). "From a Chiral Switch to a Ligand Portfolio for Asymmetric Catalysis". Accounts of Chemical Research. 40 (12): 1240–1250. doi:10.1021/ar7001057. PMID 17715990.
- ^ Mallat, T.; Orglmeister, E.; Baiker, A. (2007). "Asymmetric Catalysis at Chiral Metal Surfaces". Chemical Reviews. 107 (11): 4863–90. doi:10.1021/cr0683663. PMID 17927256.
- ^ "Platinum Heterogeneous Catalysts - Alfa Aesar". www.alfa.com. Archived from the original on 18 January 2018. Retrieved 28 April 2018.
- ^ H. Lindlar and R. Dubuis (1973). "Palladium Catalyst for Partial Reduction of Acetylenes". Organic Syntheses.; Collective Volume, vol. 5, p. 880
- ^ S. Robert E. Ireland and P. Bey (1988). "Homogeneous Catalytic Hydrogenation: Dihydrocarvone". Organic Syntheses.; Collective Volume, vol. 6, p. 459
- ^ Amoa, Kwesi (2007). "Catalytic Hydrogenation of Maleic Acid at Moderate Pressures A Laboratory Demonstration". Journal of Chemical Education. 84 (12): 1948. Bibcode:2007JChEd..84.1948A. doi:10.1021/ed084p1948.
- ^ Wang, Dong; Astruc, Didier (2015). "The Golden Age of Transfer Hydrogenation". Chem. Rev. 115 (13): 6621–6686. doi:10.1021/acs.chemrev.5b00203. ISSN 0009-2665.
- ^ Navarro, Daniela Maria do Amaral Ferraz; Navarro, Marcelo (2004). "Catalytic Hydrogenation of Organic Compounds without H2 Supply: An Electrochemical System". Journal of Chemical Education. 81 (9): 1350. Bibcode:2004JChEd..81.1350N. doi:10.1021/ed081p1350. S2CID 93416392.
- ^ Kubas, G. J., "금속 이수소 및 γ-본드 복합체", Kluwer Academic/Pleum Publishers: New York, 2001
- ^ 갈레조, 피에르촉매 백과사전 제4권, ed.의 "수소화 - 이종"Horvath, IT, John Wiley & Sons, 2003.
- ^ Horiuti, Iurô; Polanyi, M. (1934). "Exchange reactions of hydrogen on metallic catalysts". Transactions of the Faraday Society. 30: 1164. doi:10.1039/TF9343001164.
- ^ 요하네스 G. 드 브리스, 코넬리스 J. 엘세비어, eds균질 수소화 Wiley-VCH 핸드북, 웨인하임, 2007.ISBN 978-3-527-3161-3
- ^ Noritaka Mizuno Gabrile Centi, Siglinda Perathoner, Salvatore Abate "과산화수소 직접 합성:현대 이기종 산화 촉매의 최근 발전: 디자인, 반응 및 특성 2009, Wiley-VCH. doi: 10.1002/9783527627547.ch8
- ^ Edwards, Jennifer K.; Solsona, Benjamin; N, Edwin Ntainjua; Carley, Albert F.; Herzing, Andrew A.; Kiely, Christopher J.; Hutchings, Graham J. (20 February 2009). "Switching Off Hydrogen Peroxide Hydrogenation in the Direct Synthesis Process". Science. 323 (5917): 1037–1041. Bibcode:2009Sci...323.1037E. doi:10.1126/science.1168980. PMID 19229032. S2CID 1828874.
- ^ Ian P. Freeman "Margarines and Shortenings" (이안 프리먼, 2005년, Wiley-VCH, Weinheim의 Ulmann's Encyclopedia of Industrial Chemistry, Weinheim).doi: 10.1002/14356007.a16_timeout
- ^ Werkmeister, Svenja; Junge, Kathrin; Beller, Matthias (2 February 2014). "Catalytic Hydrogenation of Carboxylic Acid Esters, Amides, and Nitriles with Homogeneous Catalysts". Organic Process Research & Development. 18 (2): 289–302. doi:10.1021/op4003278.

- ^ "Archived copy" (PDF). Archived (PDF) from the original on 2008-09-10. Retrieved 2008-08-05.
{{cite web}}: CS1 maint: 제목으로 아카이브된 복사(링크) - ^ Schrock, Richard R.; Osborn, John A. (April 1976). "Catalytic hydrogenation using cationic rhodium complexes. I. Evolution of the catalytic system and the hydrogenation of olefins". Journal of the American Chemical Society. 98 (8): 2134–2143. doi:10.1021/ja00424a020.
- ^ C. 페티나리, F.마르케티, D.마티니 "수소화 촉매로서의 금속 복합체" 포괄적 배위 화학 II, 2004, 9권 75-139. doi:10.1016/B0-08-043748-6/09125-8
- ^ Walling, Cheves.; Bollyky, Laszlo. (1964). "Homogeneous Hydrogenation in the Absence of Transition-Metal Catalysts". Journal of the American Chemical Society. 86 (18): 3750. doi:10.1021/ja01072a028.
- ^ Berkessel, Albrecht; Schubert, Thomas J. S.; Müller, Thomas N. (2002). "Hydrogenation without a Transition-Metal Catalyst: On the Mechanism of the Base-Catalyzed Hydrogenation of Ketones". Journal of the American Chemical Society. 124 (29): 8693–8. doi:10.1021/ja016152r. PMID 12121113.
- ^ Chase, Preston A.; Welch, Gregory C.; Jurca, Titel; Stephan, Douglas W. (2007). "Metal-Free Catalytic Hydrogenation". Angewandte Chemie International Edition. 46 (42): 8050–3. doi:10.1002/anie.200702908. PMID 17696181.
- ^ Li, Baojun; Xu, Zheng (2009). "A Nonmetal Catalyst for Molecular Hydrogen Activation with Comparable Catalytic Hydrogenation Capability to Noble Metal Catalyst". Journal of the American Chemical Society. 131 (45): 16380–2. doi:10.1021/ja9061097. PMID 19845383.
- ^ a b Adams, Roger; Voorhees, V. (1928). "Apparatus for catalytic reduction". Organic Syntheses. 8: 10. doi:10.15227/orgsyn.008.0010.
- ^ Joshi, J.B.; Pandit, A.B.; Sharma, M.M. (1982). "Mechanically agitated gas–liquid reactors". Chemical Engineering Science. 37 (6): 813. doi:10.1016/0009-2509(82)80171-1.
추가 정보
- Jang ES, Jung MY, Min DB (2005). "Hydrogenation for Low Trans and High Conjugated Fatty Acids" (PDF). Comprehensive Reviews in Food Science and Food Safety. 1. Archived from the original (PDF) on 2008-12-17.
- 유기 합성물의 수소화 예시:
- 전달 수소화에 대한 초기 작업:
- Davies, R. R.; Hodgson, H. H. (1943). "76. Catalytic reduction by formic acid under pressure. Part II. A comparison of copper and nickel as catalysts". J. Chem. Soc.: 281. doi:10.1039/jr9430000281.
- Leggether, B. E.; Brown, R. K. (1960). "Reduction of Monohalogenated Nitrobenzenes with Hydrazine and Raney Nickel. A Convenient Preparation of Halogenated Anilines". Can. J. Chem. 38 (12): 2363. doi:10.1139/v60-320.
- Kuhn, L. P. (1951). "Catalytic Reduction with Hydrazine". J. Am. Chem. Soc. 73 (4): 1510. doi:10.1021/ja01148a029.





![Selective hydrogenation of the less hindered alkene group in carvone using a homogeneous catalyst (Wilkinson's catalyst).[16]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d3/CarvoneH2.png/162px-CarvoneH2.png)
![Hydrogenation of nitrogen {\displaystyle {\ce {{\underset {nitrogen}{N{\equiv }N}}+{\underset {hydrogen \atop (200atm)}{3H2}}->[{\ce {Fe\ catalyst}}][350-550^{\circ }{\ce {C}}]{\underset {ammonia}{2NH3}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2dd5645111a3ad991987a7b9e10599029c287e98)