VPS35
VPS35Vacuolar 단백질 ortholog 35(VPS35)분류하고 있는 단백질 autophagy에 파킨슨 병(PD)과 치매 질병 다공질 구조 사이(e.g., 화물 단백질 수송에 책임을 지고 있는 단지가 retromer 불리는(AD)[1][2][3][4][5]VPS35은 부분 같은 신경 변성 질환,에 연루되어 있다.endosomes, lysosome, vacuoles) 및 골지 기구.[1][6][7][8][9] VPS35유전자(VPS35)의 돌연변이는 화물 단백질이 운반되지 못하고 기능장애나 불필요한 단백질이 저하되지 않는 이상 자가포장을 유발한다.[5][7] 변화된 VPS35 수준과 활동에 의해 영향을 받는 수많은 경로가 있으며, 이는 신경퇴행 발생에서 임상적으로 중요한 의미를 갖는다.[1][2][3][4][5] VPS35 기능을 교정하기 위한 개입이 추측에 있기 때문에 VPS35에는 치료적 관련성이 있다.[5][10][11]
유전자
인간의 경우, VPS35는 약 29.6 킬로바이트에 이르는 16q11.2 염색체에 기록되며 17 exon을 포함하고 있다.[10][11][16][17] 쥐의 녹아웃 연구가 배아적 치사성을 증명했기 때문에 이것은 진화적으로 보존되고 생존을 위해 요구된다.[2][3][6][8][9][10][11] VPS35 레벨은 산후 10-15일에 최고조에 달한 후 성인기 동안 낮고 안정적인 수준으로 감소한다.[3] VPS35의 RNA 발현상은 전신에 어디서나 볼 수 있지만 뇌, 심장, 생식선, 비장, 골격근에서는 더 높고 폐, 간, 신장, 혈액 백혈구에서는 더 낮다.[16][17]
단백질
VPS35는 리소솜과 같은 변연체의 형성과 변연 단백질의 분류에 관한 연구로부터 사카로마이오스 세레비시아아에서 처음 확인되었다.[4][5][17] 단백질은 796개의 아미노산 잔류물을 함유하고 있으며, 분자 질량은 92kDa, 등전점은 5.32이다.[11][16][17]
구조
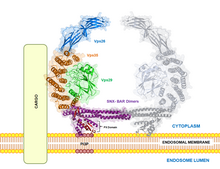
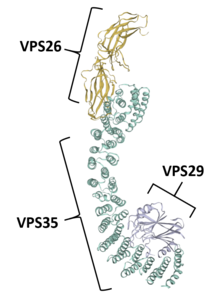
VPS35는 레트로머를 형성하기 위해 다른 단백질과 결합한다. 레트로머는 진화적으로 보존된 복합체로서 엔도솜에서 TGN(Trans-Golgi Network)으로 전달 단백질의 재활용에 큰 역할을 한다.[1][6][7][8][9] VPS35 자체는 34 α-헬리컬 솔레노이드를 나타내는 2차 구조로 접힌다. 34 α-헬리컬럼스 반복이 반복된다.[17]
리트로머의 일부로 VPS35는 다른 vacuolar 단백질 정렬 정형화, VPS26 및 VPS29와 함께 트리머화되며, 덜 일반적인 상황에서는 VPS35가 VPS26과 VPS29를 단독으로 바인딩하여 헤테로마이저를 생성할 수 있다.[5] VPS26은 보존된 PRLYL 모티브(리소스 1-172)에서 VPS35의 N-단자를 결합하는 반면, C-단자 α-솔레노이드 폴드(리소스 307-796)는 VPS29를 결합한다.[1][16][17] 이러한 VPS 직교는 레트로머 내에서 서로를 안정화시킨다. VPS35 녹다운은 VPS29의 성능 저하를 초래할 수 있으며, 그 반대의 경우도 마찬가지다.[5][7] VPS35, VPS26, VPS29 트리머는 화물 인식 콤플렉스를 형성하는데, 이는 레트로머의 배변 분류 조절 능력에 필요한 구성 요소다.[1][2][3][5][6][7][8][9][10][18] 이는 특히 레트로머를 내시경 및 기타 배시관 구조에 고정시키는 정렬 넥신(즉, SNX1, SNX2, SNX5, SNX6, SNX32)을 대상으로 하여 달성된다.[3][11][17][18]
함수
번역 후, VPS35는 엔도솜에 국소화되며, 여기서 레트로머와 함께 다양한 혈소판 세포 과정으로 연구되어 왔다.[4][10][17] Sortilin과 cation 독립 만노세-6-인산염 수용체(CI-MPR)는 리소솜 매개 변질을 조절하며 VPS35 화물 단백질로 알려져 있다.[10] VPS35에 의해 직접 모집된 Wiskott Aldrich Syndrome과 WASH(Wash) 콤플렉스는 매크로 오토포자극(macroofogosome engulfs)을 조절하며, 여기서 자가포자극 engulfs는 라이소솜 분해에 대한 단백질과 전체 유기농을 선택한다.[10][19] 또한 VPS35는 리소솜 관련 멤브레인 단백질 2a(LAMP2a)를 채용하여 보호자 매개 자가포기 시작을 돕는다. 여기서 열충격 단백질 70kDa 단백질 8(HSPA8) 함유 복합체는 KFERQ 신호가 포함된 단백질의 저하를 용이하게 한다.[10][19]
VPS35의 돌연변이는 복막의 확대와 핵 주위의 격리 같은 일반화된 내측 결함으로 이어진다.[5] 이러한 돌연변이는 또한 망상밀매, 혈장막 수용체 재활용, 단백질 집적, 미토콘드리아 기능, 도파민 신호 등 레트로머 콤플렉스에 의해 감독되는 많은 세포 과정에도 영향을 미친다.[7] 이 과정들은 신경퇴행성 질환에서 역할을 한다.[1][2][3][4][5]
임상적 유의성
파킨슨병
PD는 두 번째로 흔한 신경퇴행성 질환으로 자신을 내세우는 임상적 도전이다.[11][20] 실체아 니그라파스 콤팩타에서 도파민성 뉴런이 손실되고, α-시뉴클레인 단백질이 르위바디에 독성물질로 집적된 것이 특징인데, 이 모두가 PD 환자의 운동 이상과 도파민 결핍을 유발한다.[11][20] VPS35 돌연변이와 기능부전 리트로머 매개 단백질 분류 및 재활용은 PD와 관련된 신경퇴행성 프로세스에 관련되어 있다.[8]
유전자 변형
2011년에는 한 스위스 가정에서 6명 전원이 라떼온셋, 자가 지배적인 PD를 개발한 엑소메 시퀀싱이 수행되었다.[3][5][9][11][20][21][22] 그 순서는 아스파라긴산의 아미노산잔기 620(D620N)에서 VPS35 orthologs의 호모 사피엔스, 팬, 혈거인 Mus musculus, Rattus norvegicus, 소속은 돈, 개 자리 familiaris, 갈루스:Cybele의 신관으로서 gallus, 제노 laevis, Danio rerio, 염색체 melanogaster, 사카로미세스 ce사이에 VPS35.[8][9]순서 정렬에 asparagine에 돌연변이를 밝혔다.revisiae는 620의 위치가 진화 과정 내내 아스파라긴으로 아스파라긴산을 대체하는 경향이 있는 높은 돌연변이 유발성을 보여왔다.[8] 지리적으로 VPS35-D620N 변종은 스위스, 오스트리아, 미국, 튀니지, 이스라엘, 영국, 프랑스, 독일, 일본의 백인 후손과 가족들 사이에서 가장 널리 퍼져 있다.[2][9][10][22] Other VPS35 variants (e.g., P316S, R32S, R524W, I560T, H599R, M607V) have been identified among some PD patients; however, the VPS35-D620N variant has been the most extensively characterized and is currently the only mutated form of VPS35 confirmed to be pathogenic.[1][7][9] D620N 돌연변이가 일반 인구에서 얼마나 자주 나타나는지는 현재 알 수 없다.[17]
환자 특성
VPS35 유도 PD와 특발성 PD 사이의 신경화학 및 임상적 표현은 크게 다르지 않다.[9][11][21] VPS35 돌연변이를 가진 PD환자들은 대표적인 PD증상을 경험하는데, 브래디키네시아(91.4%), 경직성(80%), 떨림(77.1%), 자세불안정(60%)[9][11][16][21]이다. VPS35-D620N 변종 환자의 경우 평균 발병 연령은 50~52세(기존 PD 시작 65~85세 이전)로, 일반적으로 백인이며(82.9%), 가족력이 높다(91.4%)[8][10][11][16][21]로 나타났다. VPS35-D620N 돌연변이는 산발적인 PD(0.3%)[11]보다 가족 PD(~1.3%)에서 더 자주 발생한다. VPS35-D620N 돌연변이를 숨기고 있는 PD 환자들은 느린 질병 진행을 따른다; 인지적 또는 신경정신학적 측면은 일반적으로 면제된다.[23] 모든 환자들은 PD 증상 완화를 위한 주요 치료법 중 하나인 레보도파 치료에 잘 반응한다.[9][11] 전반적으로, VPS35-D620N 돌연변이는 상대적으로 PD에서 드물며, 전 세계적으로 약 22,000명의 PD 환자로 구성된 12개 이상의 사례 연구에서 0.115%의 유병률로 추정된다.[9][17] 한 가지 임상적으로 주의해야 할 점은 VPS35-D620N 변종을 숨기고 있는 단 한 명의 PD 환자만이 부검을 받았기 때문에 VPS35가 유도하는 PD의 맥락에서 르위 몸의 병리학이 완전히 이해되지 않았다는 점이다.[9] 그러나 산발적인 PD 환자들의 뇌에서는 르위 신체에 잘못 국산화된 VPS35가 있는 것으로 알려져 있다.[10]
VPS35와 PD 연계 유전자의 상호작용
VPS35의 변화는 인산화 Rab 단백질에 의한 배액 밀매를 돕는 PD에 관여하는 후보 유전자인 류신이 풍부한 반복키나제2(LRRK2)의 수준에 영향을 미친다.[5][10][17][24] VPS35 녹다운 또는 VPS35-D620N 변종의 과도한 압착은 LRRK2의 자기인산화를 강화하여 전체적인 활동을 증가시킬 수 있다.[17] VPS35-D620N 변종을 숨기고 있는 유전자변형 생쥐는 LRRK2에 의한 변화된 Rab 인산화를 입증했다.[10] 드로소필라에서는 VPS35의 과도한 억압이 돌연변이 LRRK2 유도 PD 표현형을 구할 수 있다.[9][17] LRRK2 돌연변이 G2019S도 마우스 N2A 신경블라스토마 세포에서 VPS35 수치를 감소시키는 것으로 밝혀져 이들 요인 사이의 감정적 메커니즘을 나타낸다.[10]
Parkin E3유비퀴틴 연결 효소 단백질 분해에 연루된 일반적으로 상염색체성 열성 청소년 parkinsonism에 염색체에 VPS35.[17]VPS35 overexpression과의 상호 작용 ParkinParkin-deficient 표현형, 증가하는 장수, 등반 능력, 그리고 paraquat에 감소하고 민감도는 독성 herbi에 반대하는 것이 부족한 볼 수 있다.살균력 인간 내 PD 발작과 관련이 있는 것으로 알려져 있다.[17] Parkin은 VPS35의 편재성을 증가시키는 것으로 알려져 있다.[17] 반직관적으로 이것은 VPS35의 단백질 저하로 이어지지 않는다. 기능적 역할은 여전히 조사되고 있다.[24] Parkin 녹아웃 생쥐에서 VPS35-D620N의 과도한 압착이 도파민성 뉴런 손실을 구제하는 것으로 나타나지 않았기 때문에 VPS35는 Parkin 하류에 작용하는 것이 제안되었다.[17]
알츠하이머병
AD는 치매의 가장 두드러진 원인(60~80%)으로 단어 검색, 기억 회수, 기본적인 자기 관리에 필요한 기타 일반 임원 기능 등 환자의 많은 인지 능력에 영향을 미친다.[25] AD 병리학은 일반적으로 뇌에 아밀로이드 베타(Aβ) 플라크가 형성되면서 시작되는데, 이는 미세 글로리아에 의한 염증 반응을 유발하고 타우 축적과 확산의 폭포화를 일으킨다.[26] 이러한 변화는 뉴런의 퇴화를 초래하여 시냅스 연결과 신경전달물질 신호의 상실을 초래한다.[25][26]
임상적으로, AD 병리학에서 높은 부위의 VPS35 활성도가 낮은 것으로 알려져 있기 때문에, 뇌에서 VPS35의 낮은 발현이 AD의 위험 요인이다.[5][6][7][27] 특히, 건강한 환자에 비해 사후에 AD환자의 해마에서는 VPS35의 수치가 감소하였다.[2][7][8][16] 이것은 특정 AD형 마우스인 Tg2576에서 모델링될 수 있는데, 여기서 VPS35의 이질성 삭제를 통해 해마와 피질에서 AD 표현형을 강화한다.[9] VPS35 유전적 변종을 가진 인간도 AD 발생 위험을 증가시킨다.[8] 따라서 AD 병리학은 일탈 리트로머 기능과 연계된다.[11]
VPS35 녹다운 연구는 AD의 특징인 아밀로이드 전구 단백질(APP)과 Aβ 플라크 레벨 증가를 입증했다.[3] VPS35 부족은 APP를 포함하는 엔도솜의 전송을 감소시켜 궁극적으로 APP 집계 및 Aβ 격자 형성을 촉진한다.[1][5][11] 소트릴린 관련 수용체는 VPS35와 상호작용하는 화물 단백질로 APP를 결합해 리소솜 시스템에 APP를 전달해 열화를 일으킨다.[6] VPS35 돌연변이에 의한 레트로머 활성의 손상은 베타-시크레타아제 1(BACE1) 활동도 증가시켜 더 큰 APP를 분해하고 Aβ 플라그 독성을 강화한다.[2][3] 이는 VPS35가 부족한 이질 생쥐에서 관찰되며, 이 생쥐는 대조군에 비해 Aβ40과 Aβ42의 양이 더 많다.[1] Drosophila AD 모델에서 VPS35의 발현 감소는 Aβ 플라그 형성, BACE1 활동, 기억력 결핍, 시냅스 기능 장애의 증가를 더욱 보여준다.[6][7][16]
AD의 포유류 모델에서 VPS35를 삭제하는 것은 이상 미글리아 기능 및 해마 발달 장애와 관련이 있지만, 인과 변형은 아직 밝혀지지 않았다.[7] 아마도, VPS35 기능 상실은 AD의 염증과 관련된 미세 광인자인 골수세포 2(TREM2)에 발현된 촉발 수용체가 레트로머와 VPS35의 화물 단백질이기 때문에 AD의 염증 반응을 손상시킬 수 있다.[17] 타우병리학은 VPS35-D620N 노크인 마우스의 뇌에서도 관찰된다.[10][11]
병태생리학
일탈 자포자기
WASH 콤플렉스는 자가포장 및 내시경 기능에서 중요한 구성요소다.[10] 그것은 TGN으로의 이동을 용이하게 하기 위해 내막막에 액틴 패치를 형성하는 것을 돕는다.[9] VPS35의 C-단자는 WASH 콤플렉스를 결합시킨다. 이 상호작용은 TGN에서 어떤 단백질이 회수되는지 구별하는데 도움이 된다.[2][9][17] VPS35-D620N 변종은 비혼합 VPS35에 비해 WASH 콤플렉스의 성분인 시퀀스 유사성 210 멤버 A(FAM21)로 패밀리에 대한 결합 친화력이 약해 자가성 기능장애로 이어진다.[9][11] WASH 복합 결합이 손상된 또 다른 결과는 3 LC와 자동파고솜 사이의 상호작용을 용이하게 하는 투과성 단백질인 자기포화 단백질 9a(ATG9A)의 부적절한 밀거래다.[1][11] VPS35-D620N 돌연변이에 의한 ATG9A 인신매매의 중단은 또한 내포솜에 대한 WASH 복합 로컬리제이션도 감소시켜 변이된 VPS35와 ATG9A 오지역화 사이의 주기적인 피드백을 시사한다.[3][10][11] WASH 복합 결합이 손상된 또 다른 결과는 Cl-MPR 및 포도당 전달체 1, 글루트1을 잘못 정렬하여 TGN 기능과 에너지 이용에 영향을 미친다는 것이다.[9]
특히 PD에서는 철 축적이 자동포화에서 레트로머의 기능을 변화시킬 수 있다. 건강한 환자에 비해, 더 많은 양의 철분이 PD 환자들의 실체형 니그라뿐만 아니라 세포에서 철을 분리하는 리트로머 관련 단백질인 디벌런트 금속 트랜스포터 1(DMT1)에도 존재한다.[16][17] 철분 농도 상승과 DMT1 활성의 조합은 α-시뉴클레인 축적을 증가시킴으로써 PD의 뉴런 사망으로 이어진다고 생각된다.[16] VPS35-D620N 돌연변이를 표현하는 SH-SY5Y 셀은 DMT1 축적을 표시한다.[17] RNAi에 의한 VPS35 다운규정을 통해 DMT1은 LAMP2 양성 구조와 더욱 밀접하게 연관되어 라이소솜의 철분 농도를 증가시키고 자가포장을 손상시킨다.[16] 이 효과 VPS35.[16]Holistically의 복원이 거꾸로 되어 있,chaperone-mediated autophagy 손상된 WASH 복잡한 함수를 포함한 VPS35-D620N 돌연변이를 지닌heterozygous-VPS35하는 쥐와 쥐LAMP2a 거래에서 α-synuclein 축적으로 뇌에서 그리고 중요한 기능 장난 꾸러기 포즈를 취하고 있는 감축이 교란된다.licPD의 [9][11]아티온
α-시뉴클레인 축적과 도파민성 뉴런 손실
VPS35 표현이 부족하거나 VPS35-D620N 변종이 있으면 α-시뉴클레인 집적과 도파민성 뉴런 손실이 발생하는 것으로 알려져 있는데, PD에 관련 특성이 있다.[3][7][10][11][17][20] 이는 VPS35 결핍으로 리소솜에 α-시뉴클레인이 축적되고 CI-MPR과 그 리간드, 카테핀 D가 α-시뉴클레인 처리에 중요한 리고솜 프로테아제인 부적절한 밀거래로 이어지는 드로소필라에서 연구되어 왔다.[9][11][20] 짧은 머리핀 RNA를 이용한 VPS35 녹다운은 시냅스 막에서의 도파민 전달체 국산화 및 재활용을 감소시킨다.[7][8][11] VPS35의 생쥐 이질성 녹아웃은 α-시뉴클레인 집적, 운동 장애, 실체성 니그라와 선조체에서 도파민 활성의 상실을 포함하여 성인기에 PD와 같은 표현형을 나타낸다.[9][11] 유전자이전 생쥐가 과도하게 압박하는 야생형 인간 α-시뉴클레인은 VPS35 수치가 낮으며, 돌연변이 VPS35가 아닌 야생형 VPS35의 바이러스 과다압박은 해마 신경손실을 회복시키고 아스트로겐증을 감소시킬 수 있다.[9][11]
동물 연구에서는 VPS35-D620N 변종이 PD 병리학을 일으키기에 충분한지 불분명하다. 랫드에서 인간 VPS35-D620N의 아데노 관련 바이러스(AAV)에 의한 과다압박은 실체니아 니그라에서 도파민성 뉴런의 α-시뉴클레인 수치, 인산화 또는 PD병리학 수준을 바꾸지 않는다.[9] 그러나, 쥐를 이용한 다른 연구에서는 VPS35-D620N 변종을 도입하면 실체성 니그라의 도파민성 뉴런 퇴화가 나타난다는 것을 보여주었다.[1] 생후 5개월 전후의 선조체 도파민 감소는 있지만, VPS35-D620N의 마우스 노크인 모델은 뇌내 종괴소솜, 자토파기, 미토콘드리아 또는 α-시뉴클레인과 관련된 레트로머 조립과 안정성 또는 단백질 수치의 차이를 보이지 않는다.[9][11] 드로소필라에서 인간 VPS35-D620N 또는 VPS35-P316S 변종의 과다압박은 인간 와일드형 VPS35에 비해 도파민성 뉴런 손실, 기관차 손상 및 전반적인 생존 감소를 나타낸다.[9]
Wnt/β-catenin (또는 Wnt-PCP) 경로로는 중간 뇌에서 도파민성 뉴런의 변성에 참여할 수 있다.[16] VPS35 돌연변이를 통한 리트로머 콤플렉스의 비활성은 세포에서 Wnt 분비를 조절하는 막 단백질인 Wntless를 저하시키는 것으로 생각된다.[16] 이것은 Wnt 신호를 하향 조절하여 도파민성 뉴런의 취약성과 열화를 증가시킨다.[16]
손상된 글루타마테라메틱 신호
VPS35 활동의 상실은 흥분성 신경전달물질인 글루탐산염의 신호 효율을 감소시킨다.[17] 이는 또한 VPS35-D620N의 뉴런 고유 돌연변이를 사용하여 밝혀졌다.[17] 기계학적으로, 이것은 리트로머에 의해 매개될 수 있다. 여기서 리트로머는 덴드리트리트의 척추에 국소화하고 글루마테라메테라믹 AMPA 수용체 GluR1의 이전을 중재하는 것으로 나타났다.[9][17] VPS35-D620N 돌연변이를 통한 WASH 복합 결합이 손상되었기 때문에 GluR1은 잘못 해석될 수 있다.[11] 생쥐 해마와 피질 뉴런을 VPS35 소 간섭 RNA로 치료하면 덴드리트막으로의 AMPA 수용체 밀매를 억제한다.[7] VPS35-heteriogous knockout 생쥐도 유사한 효과를 보이며, 손상된 척추 발달에 대한 추가적인 관찰이 있다.[9] VPS35-D620N 돌연변이를 가진 인간 유도 만능줄기세포에서 유래된 도파민성 뉴런도 글루R1 국소화를 덴드리트성 가시에서 벗어나 글루R1 국소화를 변화시켜 글루타마테라믹 시냅스 전달을 변화시킨다.[9]
해마에서 VPS35의 녹다운이 장기적 전위력을 차단하기 때문에 시냅스 가소성에 AMPA 수용체 국산화(localization)가 중요하다.[3] 그러나 전체적인 시냅스 전송은 크게 영향을 받지 않는다.[3] 현재의 지식은 억제 GABA 수용체가 VPS35 또는 레트로머 손상에 영향을 받지 않는 것으로 보이기 때문에 VPS35 수준의 변화는 흥분성 뉴런 신호에만 영향을 미친다는 것을 시사한다.[3]
교란된 미토콘드리아 원상회복
미토콘드리아는 아데노신 3인산염(ATP)을 생성하기 위해 산화인산화를 거치는 오르간젤로 세포가 필요한 대사 작용과 항원 작용을 수행할 수 있도록 에너지를 공급한다.[10] VPS35와 레트로머는 미토콘드리아에서 유래된 베시클(MDV)을 만들고, 필요에 따라 분해 쪽으로 미토콘드리아 단백질을 유도하며, 베시클과 페록시솜 또는 라이소솜 사이의 교차 대화를 용이하게 한다.[9][17] 질병에서 부족하거나 변형된 VPS35는 미토콘드리아의 형태학적, 기능적 이상을 유발한다.[10] 돌연변이를 일으킨 VPS35는 세라마이드 축적에 의해 미토콘드리아 막이 불안정해져 활성 산소종의 생성을 촉진할 수 있다.[10] 이것은 미토콘드리아 막의 잠재력을 낮추고, ATP의 생산을 감소시키며, 바이오에너지를 손상시킨다.[9] 또한 일부 MDV는 산화를 위해 리트로머가 MDV를 페록시솜으로 운반하는 데 도움을 주는 미토콘드리아-앵커 단백질 리게아제(MAPL)에 양성이 될 수 있다.[20] VPS35의 녹다운은 이 수송을 방해한다.[20]
VPS35와 레트로머는 또한 미토콘드리아 핵융합과 핵분열을 조절하는 것을 돕는다.[10][11][17] 건강한 조건에서 VPS35는 외부 미토콘드리아 막에서 미토콘드리아 E3 유비퀴틴 단백질 리게아제 1(MUL1)을 제거하고 미토폰드리아 2(Mfn2)의 열화를 방지하여 미토콘드리아 융합을 조절하는데 도움을 준다.[10] VPS35 기능 상실은 도파민성 뉴런에서 MUL1을 증가시켜 Mfn2의 편재 및 저하를 초래한다.[10] VPS35-D620N 돌연변이는 아니지만 와일드타입 VPS35로 VPS35-D620N 결핍 뉴런을 치료하여 MUL1 수준을 회복시키고 미토콘드리아 조각화를 감소시킨다.[9] 인간의 VPS35-D620N 돌연변이의 교양 있는 쥐는 피질의 뉴런 M17 세포는 인간의 섬유 아세포, vivo에 마우스 물질nigral 뉴런, 대신에, overexpression 미토콘드리아 분열 막을 뉴런 상실, 보다 다른 VPS35, R524W 변형에 대한 상대적인 원인이 된다.[9]VPS35 loss-of-function도retent을 통해 미토콘드리아 분열을 촉진한다.외부 미토콘드리아 막에 있는 비활성 다이너민 관련 단백질 1(Drp1)의 이온.[10]
치료적용
티오펜 티우레아 파생상품 R33과 R55는 VPS35 수준을 규제하고,[10] 레트로머 복합체를 안정화하며, AD에서 내측 기능을 재설정하는 것으로 나타났다. 라파마이신 치료법도 PD와 AD에서 핵심 역할을 하는 단백질 골재에 대해 자폐기능을 강화하고 간극을 개선하는 것으로 나타났다.[11]
바이러스 벡터나 CRISPR/Cas9와 같은 게놈 편집 기술을 사용하여 VPS35를 변조할 수 있는 잠재력이 있지만, VPS35가 많은 동역학적 프로세스에서 유비쿼터스한 역할을 감안할 때, 안전하고 치료적인 효과를 얻기 위해서는 엄격한 선량 제어와 지역 특수성이 필요할 것이다.[10] AAV2 벡터는 임상시험에서 안전성과 유효성을 입증했으며 신경퇴행성질환 환자에게 비혼합성 VPS35의 높은 수율을 도입하도록 설계될 수 있다.[11]
VPS35에 대한 추측성 치료 애플리케이션에는 PD 또는 AD 환자에서 낮은 수준의 VPS35를 검출하는 바이오마커 측정법을 개발하고 VPS35 결핍을 되돌리기 위한 마이크로RNA 치료용 VPS35 유전자 내에서 시스 규제 요소를 식별하는 것이 포함된다.[5]
참조
- ^ a b c d e f g h i j k l Reitz C (April 2015). "The role of the retromer complex in aging-related neurodegeneration: a molecular and genomic review". Molecular Genetics and Genomics. 290 (2): 413–27. doi:10.1007/s00438-014-0939-9. PMC 4363161. PMID 25332075.
- ^ a b c d e f g h i Reitz C (May 2018). "Retromer Dysfunction and Neurodegenerative Disease". Current Genomics. 19 (4): 279–288. doi:10.2174/1389202919666171024122809. PMC 5930449. PMID 29755290.
- ^ a b c d e f g h i j k l m n o Brodin L, Shupliakov O (2018). "Retromer in Synaptic Function and Pathology". Frontiers in Synaptic Neuroscience. 10: 37. doi:10.3389/fnsyn.2018.00037. PMC 6207580. PMID 30405388.
- ^ a b c d e Follett J, Bugarcic A, Collins BM, Teasdale RD (2017-07-01). "Retromer's Role in Endosomal Trafficking and Impaired Function in Neurodegenerative Diseases". Current Protein & Peptide Science. 18 (7): 687–701. doi:10.2174/1389203717666160311121246. PMID 26965691.
- ^ a b c d e f g h i j k l m n o Trousdale C, Kim K (November 2015). "Retromer: Structure, function, and roles in mammalian disease". European Journal of Cell Biology. 94 (11): 513–21. doi:10.1016/j.ejcb.2015.07.002. PMID 26220253.
- ^ a b c d e f g Vagnozzi AN, Li JG, Chiu J, Razmpour R, Warfield R, Ramirez SH, Praticò D (July 2019). "VPS35 regulates tau phosphorylation and neuropathology in tauopathy". Molecular Psychiatry. doi:10.1038/s41380-019-0453-x. PMC 6949432. PMID 31289348.
- ^ a b c d e f g h i j k l m n Rahman AA, Morrison BE (March 2019). "Contributions of VPS35 Mutations to Parkinson's Disease". Neuroscience. 401: 1–10. doi:10.1016/j.neuroscience.2019.01.006. PMC 6422337. PMID 30660673.
- ^ a b c d e f g h i j k Vilariño-Güell C, Wider C, Ross OA, Dachsel JC, Kachergus JM, Lincoln SJ, et al. (July 2011). "VPS35 mutations in Parkinson disease". American Journal of Human Genetics. 89 (1): 162–7. doi:10.1016/j.ajhg.2011.06.001. PMC 3135796. PMID 21763482.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag Williams ET, Chen X, Moore DJ (2017-01-01). "VPS35, the Retromer Complex and Parkinson's Disease". Journal of Parkinson's Disease. 7 (2): 219–233. doi:10.3233/JPD-161020. PMC 5438477. PMID 28222538.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa Cutillo G, Simon DK, Eleuteri S (November 2020). "VPS35 and the mitochondria: Connecting the dots in Parkinson's disease pathophysiology". Neurobiology of Disease. 145: 105056. doi:10.1016/j.nbd.2020.105056. PMID 32853677. S2CID 221277514.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad Eleuteri S, Albanese A (2019-12-17). "VPS35-Based Approach: A Potential Innovative Treatment in Parkinson's Disease". Frontiers in Neurology. 10: 1272. doi:10.3389/fneur.2019.01272. PMC 6928206. PMID 31920908.
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG000069329 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000031696 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b c d e f g h i j k l m n o Deng H, Gao K, Jankovic J (May 2013). "The VPS35 gene and Parkinson's disease". Movement Disorders. 28 (5): 569–75. doi:10.1002/mds.25430. PMID 23536430. S2CID 16641707.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa Sassone J, Reale C, Dati G, Regoni M, Pellecchia MT, Garavaglia B (April 2020). "The Role of VPS35 in the Pathobiology of Parkinson's Disease". Cellular and Molecular Neurobiology. doi:10.1007/s10571-020-00849-8. PMID 32323152. S2CID 216076582.
- ^ a b Vergés M (2016-01-01). Jeon KW (ed.). "Retromer in Polarized Protein Transport". International Review of Cell and Molecular Biology. Academic Press. 323: 129–79. doi:10.1016/bs.ircmb.2015.12.005. ISBN 9780128048085. PMID 26944621.
- ^ a b Ghosh R, Pattison JS (2018). "Macroautophagy and Chaperone-Mediated Autophagy in Heart Failure: The Known and the Unknown". Oxidative Medicine and Cellular Longevity. 2018: 8602041. doi:10.1155/2018/8602041. PMC 5822756. PMID 29576856.
- ^ a b c d e f g Bose A, Beal MF (October 2016). "Mitochondrial dysfunction in Parkinson's disease". Journal of Neurochemistry. 139 (S1): 216–231. doi:10.1111/jnc.13731. PMID 27546335. S2CID 32612919.
- ^ a b c d Weissbach A, Wittke C, Kasten M, Klein C (2019-01-01). Stamelou M, Höglinger GU (eds.). "'Atypical' Parkinson's disease - genetic". International Review of Neurobiology. Academic Press. 149: 207–235. doi:10.1016/bs.irn.2019.10.011. ISBN 9780128177303. PMID 31779813.
- ^ a b Kim CY, Alcalay RN (April 2017). "Genetic Forms of Parkinson's Disease". Seminars in Neurology. 37 (2): 135–146. doi:10.1055/s-0037-1601567. PMID 28511254. S2CID 635105.
- ^ Lunati A, Lesage S, Brice A (November 2018). "The genetic landscape of Parkinson's disease". Revue Neurologique. International SFN/SOMFA Meeting 2018. 174 (9): 628–643. doi:10.1016/j.neurol.2018.08.004. PMID 30245141.
- ^ a b Nguyen M, Wong YC, Ysselstein D, Severino A, Krainc D (February 2019). "Synaptic, Mitochondrial, and Lysosomal Dysfunction in Parkinson's Disease". Trends in Neurosciences. 42 (2): 140–149. doi:10.1016/j.tins.2018.11.001. PMC 6452863. PMID 30509690.
- ^ a b Abeysinghe AA, Deshapriya RD, Udawatte C (September 2020). "Alzheimer's disease; a review of the pathophysiological basis and therapeutic interventions". Life Sciences. 256: 117996. doi:10.1016/j.lfs.2020.117996. PMID 32585249.
- ^ a b Boche D, Nicoll JA (December 2020). "Invited Review - Understanding cause and effect in Alzheimer's pathophysiology: Implications for clinical trials". Neuropathology and Applied Neurobiology. 46 (7): 623–640. doi:10.1111/nan.12642. PMID 32643143. S2CID 220429715.
- ^ Qureshi YH, Baez P, Reitz C (September 2020). "Endosomal Trafficking in Alzheimer's Disease, Parkinson's Disease, and Neuronal Ceroid Lipofuscinosis". Molecular and Cellular Biology. 40 (19). doi:10.1128/MCB.00262-20. PMC 7491951. PMID 32690545.
추가 읽기
- Maruyama K, Sugano S (January 1994). "Oligo-capping: a simple method to replace the cap structure of eukaryotic mRNAs with oligoribonucleotides". Gene. 138 (1–2): 171–4. doi:10.1016/0378-1119(94)90802-8. PMID 8125298.
- Andersson B, Wentland MA, Ricafrente JY, Liu W, Gibbs RA (April 1996). "A "double adaptor" method for improved shotgun library construction". Analytical Biochemistry. 236 (1): 107–13. doi:10.1006/abio.1996.0138. PMID 8619474.
- Bonaldo MF, Lennon G, Soares MB (September 1996). "Normalization and subtraction: two approaches to facilitate gene discovery". Genome Research. 6 (9): 791–806. doi:10.1101/gr.6.9.791. PMID 8889548.
- Yu W, Andersson B, Worley KC, Muzny DM, Ding Y, Liu W, et al. (April 1997). "Large-scale concatenation cDNA sequencing". Genome Research. 7 (4): 353–8. doi:10.1101/gr.7.4.353. PMC 139146. PMID 9110174.
- Suzuki Y, Yoshitomo-Nakagawa K, Maruyama K, Suyama A, Sugano S (October 1997). "Construction and characterization of a full length-enriched and a 5'-end-enriched cDNA library". Gene. 200 (1–2): 149–56. doi:10.1016/S0378-1119(97)00411-3. PMID 9373149.
- Edgar AJ, Polak JM (November 2000). "Human homologues of yeast vacuolar protein sorting 29 and 35". Biochemical and Biophysical Research Communications. 277 (3): 622–30. doi:10.1006/bbrc.2000.3727. PMID 11062004.
- Hartley JL, Temple GF, Brasch MA (November 2000). "DNA cloning using in vitro site-specific recombination". Genome Research. 10 (11): 1788–95. doi:10.1101/gr.143000. PMC 310948. PMID 11076863.
- Haft CR, de la Luz Sierra M, Bafford R, Lesniak MA, Barr VA, Taylor SI (December 2000). "Human orthologs of yeast vacuolar protein sorting proteins Vps26, 29, and 35: assembly into multimeric complexes". Molecular Biology of the Cell. 11 (12): 4105–16. doi:10.1091/mbc.11.12.4105. PMC 15060. PMID 11102511.
- Vergés M, Luton F, Gruber C, Tiemann F, Reinders LG, Huang L, et al. (August 2004). "The mammalian retromer regulates transcytosis of the polymeric immunoglobulin receptor". Nature Cell Biology. 6 (8): 763–9. doi:10.1038/ncb1153. PMID 15247922. S2CID 22296469.
- Mingot JM, Bohnsack MT, Jäkle U, Görlich D (August 2004). "Exportin 7 defines a novel general nuclear export pathway". The EMBO Journal. 23 (16): 3227–36. doi:10.1038/sj.emboj.7600338. PMC 514512. PMID 15282546.