스트리골락톤
Strigolactone스트리골락톤은 식물의 뿌리에 의해 생성된 화학 화합물의 그룹이다.[1]이 분자들은 작용 메커니즘 때문에 식물 호르몬이나 피토호르몬으로 분류되어 왔다.[1]지금까지 스트리골락톤은 세 가지 다른 생리적 과정에 책임이 있는 것으로 확인되었다.첫째, 그들은 스트리가 루테아나 스트리가 속 식물들의 다른 식물들과 같이 숙주 식물의 뿌리에서 자라는 기생 생물의 발아를 촉진한다.[1]둘째, 스트리골락톤은 이들 식물과 상호작용을 맺고 인산염과 그 밖의 토양 영양분을 공급하기 때문에 특히 분자근종균을 공생시켜 식물을 인식하는 데 근본이 된다.[1]셋째, 스트리골락톤은 식물에서 분지 억제 호르몬으로 확인되었다. 이러한 화합물이 존재할 경우, 스템 단자에서 잉여 싹이 자라 식물에서 분지 메커니즘을 멈추게 한다.[1]
스트리골락톤은 다양한 집단을 구성하지만, 오른쪽의 이미지에서 [1]볼 수 있듯이 모두 핵심 공통의 화학 구조를 가지고 있다.이 구조는 히드록시메틸 부테놀라이드와 연결된 삼순환 락톤에 기초하고 있다. 전자는 A-B-C 부분으로 그림에서 표현되는 반면 후자는 분자의 D 부분이다.[1]대부분의 스트리골락톤은 ABC 부분의 변형을 나타내지만 D 링은 다른 종에 걸쳐 상당히 일정하게 존재하기 때문에 연구자들은 생물학적 활동이 분자의 이 부분에 의존하고 있다고 의심하게 되었다.[1]분자의 C-D 부분이 변형될 때 분자의 활성도가 손실된다는 것이 여러 연구에서 입증되었다.[1]
스트리골락톤은 기생종의 발아에 필요한 신호 경로(스트리가 sp 등)에 관여하기 때문에, 이들 기생생물의 병충해와 과충성장을 억제하기 위한 제안 대상이 되어 왔다.[2]스트리골락톤과 유사한 분자를 사용하는 것은 기생식물에 의한 아본식물의 뿌리 개척을 막기 위한 화학적 생물학적 메커니즘을 설계하는 열쇠가 될 수 있다.[2]
디스커버리
기생식물의 발아
스트리고락톤은 1966년에 처음으로 면화 식물, 특히 뿌리로부터 격리되었다.그러나 다른 유기체의 발아에서 그것의 역할은 나중에야 결정되었다.[3]이전의 스트리가 루테아 연구에서는 기생 씨앗이 발아하기 시작하려면 숙주 식물에서 추출한 뿌리 추출물이 필요하다는 것을 이미 밝혀냈는데, 이것은 뿌리에서 생산되는 물질이 이 과정을 자극하고 있다는 것을 분명히 했다.[3]스트리골락톤의 고립은 이 화합물이 스트리가 종의 발아를 유도하는 데 필요한 분자임을 증명하는 일련의 실험으로 이어진다.[3]이후 비슷한 화합물이 동일한 효과를 내는 것으로 입증되었는데, 소르골락톤과 아렉트롤은 둘 다 특징적인 락톤군을 나타냈기 때문에 스트리골락톤으로 분류되었다.[4]기생식물의 발아를 유도하기 위해 스트리고락톤은 미량, 즉 백만분의 5의 순서로만 존재하면 되었다.[3]
분지호르몬억제술
가지를 억제하는 호르몬으로서의 스트리골락톤의 역할은 새로운 돌연변이 식물의 사용 때문에 발견되었다.[5]이 돌연변이들은 축출봉에서 과도한 성장을 보여 그들의 말단 줄기가 비정상적으로 가지를 치기 시작하도록 유도했다.[5]이전에 사이토키닌은 줄기 가지 조절에 관여하는 유일한 분자로 생각되었지만, 이들 돌연변이는 사이토키닌의 정상적인 생산과 신호를 제시하여, 또 다른 물질이 도끼눈에 작용하고 있다는 결론을 이끌어냈다.[5]돌연변이 식물의 일부를 야생 표본에 삽입하는 것으로 구성된 다른 실험(그리고 그 반대)은 돌연변이들이 그 식물의 뿌리와 하부로부터 오는 신호 분자를 인식할 수 없거나 분자를 분자 분자로 만들어 가지 못하게 하는 것을 증명할 수 있었다.[5]분자 조절에 관여했던 이 분자는 나중에 스트리골락톤으로 확인되었다.[5]결론은 스트리골락톤이 있으면 식물이 지나치게 성장하여 과도한 가지를 발생시키는 것을 방지하지만, 존재하지 않을 때는 도축봉이 비정상적인 가지를 유도하기 시작할 것이라는 것이었다.[5]
화학
특성.
비록 스트리골락톤은 일부 기능 그룹에서 다르지만, 그들의 녹는점은 보통 섭씨 200도에서 202도 사이에 발견된다.[3]분자의 분해는 195 °C에 도달한 후에 일어난다.[3]그것들은 아세톤과 같은 극성 용매에 매우 용해되며 벤젠에 용해되며 헥산에서는 거의 용해되지 않는다.[3]
화학구조
스트리골락톤의 일부 예는 다음과 같다.
 | 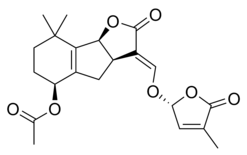 |
| (+-Strigol) | (+-Strigyl 아세테이트) |
 |  |
| (+--Orobanchol) | (+--Orobanchyl 아세테이트) |
 |  |
| (+--5-Deoxystrigol) | 소르골락톤 |
생합성
칼락톤을 통한 카로티노이드 통로
스트리골락톤의 생합성 경로에 대해서는 완전히 해명되지 않았으나, 화학적 변환을 수행하는 데 필요한 효소 등 다른 단계가 확인되었다.[6]첫 번째 단계는 -carotene의 9번째 화학 결합의 이소머라이징으로, 트랜스 구성에서 cis로 변화한다.[6]이 첫 단계는 효소 -carotene isomerase에 의해 수행되며, 이를 약칭 DAMP27 또는 D27이라고도 하며, 이 효소는 공동 인자로서 철이 필요했다.[6]두 번째 단계는 9-cis- -carotene을 두 개의 다른 화합물로 분리하는 것이다. 첫 번째 화합물은 9-cis-aldedhide이고 두 번째 화합물은 -ionone이다.[6]이 두 번째 단계는 카로티노이드 갈라짐 디옥시제 7(CD7)에 의해 촉매된다.[6]세 번째 단계에서는 CCD8(CCD7과 동일 계열)이라고 불리는 또 다른 카로티노이드 클리어베이지 산소효소가 이전 단계에서 생성된 알데히드의 9-cis- -apo-10으로 변환 및 재배열을 촉진하고 이후 칼락톤을 생산한다.[6]
칼락톤이 지금까지 확인된 서로 다른 스트리골락톤으로 정확히 어떻게 변형되는지는 아직 확실하지 않지만, 여러 연구에서 칼락톤이 확실히 스트리골락톤의 전구라는 것이 증명되었다.[7]이 생합성의 마지막 단계에는 간단한 스트리골락톤인 5데옥시스트릭톨에 칼락톤을 변환하기 위해 최소 두 개의 산소 분자를 추가해야 하며, 다른 더 복잡한 스트리골락톤을 생산하기 위해서는 더 많은 산화가 요구되어야 한다.단백질 MAX1은 식물에서 산화 대사 작용으로 인해 스트리골락톤 생합성의 마지막 단계를 촉진하기 위해 제안되었다.[7]
생합성에 있어서 ABA의 역할
두 가지 모두 압시산(ABA)과 스트리골락톤은 두 화합물의 합성을 수행하는 공통의 효소군을 가지고 있는데, 이전에는 두 생합성 경로의 상관관계의 존재를 증명해 보였으며, 다른 연구에 의해 뒷받침되어 왔다.[8][9]ABA 생합성은 9-cis-epoxycarotnode dyoxygenase(NCED)라고 불리는 효소 세트에 의존한다.[9]하지만, NCED 효소의 생산에 결함이 있돌연변이 식물, 단지, 차라리 또한, 명확하게 뿌리에 strigolactones의 낮은 수준 이 호르몬은 대부분 합성된다 존재하는 ABA의 낮은 수치를 제출하지 못, 이 발견은 흔한 효소 machinery,[9] 다른 experimen의 존재를 위한 기반을 조성하였다.이익NCED 효소를 차단하고 ABA 변화를 감지할 수 없는 돌연변이를 사용하는 것이 이 이론을 뒷받침하기 위해 사용되었다.[8]지금까지 두 합성의 명확한 상관관계가 존재하며 이는 양쪽 생합성에서 NCED 효소의 사용과 관련이 있지만, 그것들이 연결되는 정확한 메커니즘은 여전히 불분명하다.[8]
분자지각
식물에서 스트리골락톤은 α/β 하이드롤라제 슈퍼 패밀리의 멤버인 이중 수용체/수소효소 단백질 DAMP14(D14)에 의해 인식된다.기질 회전율이 낮은 수화물로 여겨지지만, 단백질의 생물학적 기능을 위해서는 온전한 촉매 삼합체가 필요하다.[10]분자역학 연구는 리간드 결합 주머니가 유연하고 촉매 삼합체가 리간드 결합과 위치 결정에 중요한 역할을 한다는 것을 시사했다.[11][12]다음과 같은 여러 (부분적으로 경쟁하는) 모델이 리간드 지각에 촉매 3중창의 관여를 위해 제안되었다.
- 스트리골락톤의 가수분해로 인해 D-링이 활성 사이트 세린에 공동 부착됨.[13]
- 스트리골락톤의 가수분해로 수용체 입구에서 분자 접착제 역할을 하는 자유 D링이 발생하여 다른 단백질과의 상호작용을 매개한다.[14]
- 변형된 DAMP14 단백질 표면을 생성하는 무수화물 온전한 스트리골락톤의 결합,[15] 다른 단백질과의 상호작용을 매개한다.
- 스트리골락톤의 가수분해로 인해 D 링이 활성 사이트 히스티딘에 공동 부착됨.[16][17][18][19]
- 스트리골락톤의 가수분해로 D-링이 활성 부위 세린과 히스티딘에 동시에 공칭적으로 부착되어 난쟁이14의 순응적 변화를 유도하여 다른 단백질과의 상호작용을 유도한다.[20]
운동 결과는 온전한 스트리골락톤이 신호 캐스케이드를 촉발하고 그 후에 스트리골락톤 분자를 불활성화하는 마지막 단계로 가수분해를 수행한다는 것을 시사했다.[21]
작용기전
분자형 근막염의 발아
스트리골락톤은 분자형 근막염 포자의 발아를 자극하는 것으로 알려져 있다.[22]그들은 극도로 낮은 농도에서 이러한 효과를 발생시키기 때문에, 활성화의 메커니즘은 신호 경로여야 한다고 제안되었다.[22]다양한 종류의 곰팡이를 가진 다른 연구들은 스트리골락톤으로 자극한 후에, 곰팡이 세포들은 더 많은 양의 미토콘드리아와 그들의 산화 활성의 증가를 보인다는 것을 발견했다.[22]마크롱utrients의 산화대사에서의 미토콘드리아의 역할 때문에 숙주식물을 찾기 전에 포자가 비활성 상태로 남아 있다가 스트리골락톤으로 자극을 받으면 미토콘드리온의 산화기계가 활성화되어 포자와 곰팡이브라 발아에 필요한 에너지와 영양분을 생산하게 된다.nching.[22] 뿌리 추출물을 사용한 연구는 이 가설을 지지하고 있으며, 지금까지 스트리고락톤은 미토콘드리아 활동에서 증가된 이것을 더 잘 설명하는 후보 분자들이다.[22]
보조 매개 2차 성장
식물에서의 2차 성장은 주로 피토호르몬 보조에 의해 조절된다는 것이 확립되었다.[23]그러나 보조 분비 메커니즘은 동시에 스트리골락톤에 의해 조절되기 때문에 후자는 보조를 통해 2차 성장을 조절할 수 있다.[23]줄기의 말단 싹에 스트리고락톤을 바르면 싹을 가로질러 보조를 이동하는데 필요한 운반 단백질의 발현을 차단할 수 있는데, 이 단백질들은 PIN1로 표시된다.[23]따라서, 스트리고락톤 결핍 돌연변이를 분석했을 때, 그것들이 말기 싹에서 보조의 이동을 용이하게 하는 PIN1 단백질의 과발현상을 보인다는 것이 발견되었다는 것은 놀라운 일이 아니었다; 보조인은 이러한 싹의 유사 활동을 방지하여 식물이 2차 성장을 시작하고 분기를 시작하는 것을 막았다.[23]결론적으로 식물은 2차 성장 개시나 억제를 위해 보조 운송에 의존하지만, 이러한 운송 메커니즘은 생산 현장(뿌리)에서 자일름을 통해 줄기의 말단 싹까지 쉽게 이동할 수 있는 스트리고락톤의 생산에 의존한다.[23]
생태학
식물-풍기 상호작용
스트리골락톤은 식물과 퐁기의 상호작용에 근본적인 역할을 한다.[24]Lotus japonicus에서 만들어진 첫 연구 중 하나는 이미 그 뿌리에서 추출한 화합물이 그 뿌리와 공생 관계를 맺을 아르부근 균류의 개발에 필요하다는 것을 증명했다.[24]이러한 동일한 발견은 옥수수와 수수와 같은 다른 식물에서도 사실이었다.[24]이후 분지 균의 분지를 담당하는 화합물이 격리되어 5데옥시스트리골, 스트리골, 소르골락톤 등이 모두 스트리골락톤 화합물군에 속한다.[25][24]분기의 과정은 공생을 확립하는 데 매우 중요하다.[24]이 가지질은 포자의 발아 및 히파의 초기 성장 후에만 생기기 때문에 발아에 필요한 스트리골락톤은 식물에 의해 분비되어 곰팡이에 도달해야 하는데, 스트리골락톤도 곰팡이에 의한 인식 과정의 일부라는 것을 의미한다.[24]
아르부스쿨라 미초리자는 대다수의 혈관종과 공생적 연관성을 형성할 수 있고, 많은 체조종과 공생적 연관성을 형성할 수 있기 때문에 다양한 식물에서 서로 다른 스트리골락톤 화합물이 분포되어 있는 것을 발견할 수 있을 것으로 기대된다.[25]불행히도, 스트리골락톤은 대부분의 식물에서 발견될 것으로 추측되지만, 지금까지 스트리골락톤과 AM 균류로 행해진 연구는 주로 이러한 화합물을 추출하기 어렵고 용액에서 분해되기 쉽기 때문에 매우 제한된 범위의 식물 종만을 연구해왔다.[25]
스트리골락톤은 곰팡이에 의한 식물의 인식에 필요할 뿐만 아니라, 식물에 의한 곰팡이의 인식에 의해서도 필요하다.[26]곰팡이 인식의 메커니즘은 Rhizobia sp와 같은 박테리아에 대한 인식과 비슷한 방식으로 일어난다.[26]실제로 박테리아에 대한 인식 메커니즘이 곰팡이를 인식하는 메커니즘으로부터 진화했다는 제안이 제기되었는데, 이는 후자가 더 원시적이고 고대의 것으로 알려져 있기 때문이다.[26]박테리아가 Nod 인자를 사용하는 것처럼, 균류는 Myc 인자로 표시된 분자 세트를 사용한다.[26]이 곰팡이 제품들은 다른 식물들에 의해 인식될 수 있고 식물마다 다르도록 설계되지 않았다.[26]이러한 Myc 요인들이 식물의 뿌리에 의해 인식되면 공생조합의 시작에 관여하는 서로 다른 유전자의 발현을 자극한다.[26]그러나 곰팡이균에 의한 마이크 인자의 분비는 이전에 식물로부터 스트리골락톤에 의해 자극을 받은 후에야 발생하며, 이러한 화합물의 (균류로부터) 양쪽 인식에 필요한 역할을 모두 증명한다.[26]스트리골락톤은 또한 세포내 칼슘의 농도의 증가와 LCO의 증가와 같은 곰팡이 세포에 다른 변화를 일으키는 것으로 보고되었고, 후자는 곰팡이가 식물에 의해 인식하기 위해 균에 의해 생산되는 마이크 요인 중 하나라는 것이 증명되었다.[26]
식물과의 공생관계에 포함된 분자균류의 주요 역할 중 하나는 식물, 특히 인산염에 토양 영양분을 공급하는 것이다.[27]따라서 고갈지대의 인산염이 정말 낮아지면 식물은 주로 AM 균류에 의존하여 인산염 수요를 충족시킨다.[27]토마토 식물을 이용한 연구는 식물이 인산염에 결손을 겪을 때 더 많은 양의 스트리골락톤을 생산하고, 이는 결국 AM 균류의 분지를 증가시킨다는 것을 보여주었다.[27]이 곰팡이의 과도한 발육은 이 곰팡이가 이제 더 많은 토양 지역으로 퍼질 수 있기 때문에 식물에 필요한 추가적인 인산염을 제공할 것으로 예상된다.[27]그러나 스트리고락톤은 기생식물의 발아도 자극하기 때문에 이 인산염 결핍 식물들은 스트리가 sp와 같은 기생종의 침입도 더 높게 나타난다.[27]토양 비료를 통해 적절한 인산염을 제공하는 것은 발아에 스트리골락톤이 필요하기 때문에 이러한 기생충의 증식을 감소시키는 것으로 증명되었다.[27]
참고 항목
참조
- ^ a b c d e f g h i Umehara M, Cao M, Akiyama K, Akatsu T, Seto Y, Hanada A, et al. (June 2015). "Structural Requirements of Strigolactones for Shoot Branching Inhibition in Rice and Arabidopsis". Plant & Cell Physiology. 56 (6): 1059–72. doi:10.1093/pcp/pcv028. PMID 25713176.
- ^ a b Waters MT, Gutjahr C, Bennett T, Nelson DC (April 2017). "Strigolactone Signaling and Evolution". Annual Review of Plant Biology. 68 (1): 291–322. doi:10.1146/annurev-arplant-042916-040925. PMID 28125281.
- ^ a b c d e f g Cook CE, Whichard LP, Turner B, Wall ME, Egley GH (December 1966). "Germination of Witchweed (Striga lutea Lour.): Isolation and Properties of a Potent Stimulant". Science. 154 (3753): 1189–90. Bibcode:1966Sci...154.1189C. doi:10.1126/science.154.3753.1189. PMID 17780042. S2CID 24395663.
- ^ Xie X, Yoneyama K, Yoneyama K (2010-07-01). "The strigolactone story". Annual Review of Phytopathology. 48 (1): 93–117. doi:10.1146/annurev-phyto-073009-114453. PMID 20687831. S2CID 27305711.
- ^ a b c d e f Dun EA, Brewer PB, Beveridge CA (July 2009). "Strigolactones: discovery of the elusive shoot branching hormone". Trends in Plant Science. 14 (7): 364–72. doi:10.1016/j.tplants.2009.04.003. PMID 19540149.
- ^ a b c d e f Alder A, Jamil M, Marzorati M, Bruno M, Vermathen M, Bigler P, et al. (March 2012). "The path from β-carotene to carlactone, a strigolactone-like plant hormone". Science. 335 (6074): 1348–51. Bibcode:2012Sci...335.1348A. doi:10.1126/science.1218094. PMID 22422982. S2CID 29137583.
- ^ a b Seto Y, Yamaguchi S (October 2014). "Strigolactone biosynthesis and perception". Current Opinion in Plant Biology. 21: 1–6. doi:10.1016/j.pbi.2014.06.001. PMID 24981923.
- ^ a b c Liu J, He H, Vitali M, Visentin I, Charnikhova T, Haider I, et al. (June 2015). "Osmotic stress represses strigolactone biosynthesis in Lotus japonicus roots: exploring the interaction between strigolactones and ABA under abiotic stress" (PDF). Planta. 241 (6): 1435–51. doi:10.1007/s00425-015-2266-8. hdl:2318/1508108. PMID 25716094. S2CID 16529179.
- ^ a b c López-Ráez JA, Kohlen W, Charnikhova T, Mulder P, Undas AK, Sergeant MJ, et al. (July 2010). "Does abscisic acid affect strigolactone biosynthesis?" (PDF). The New Phytologist. 187 (2): 343–54. doi:10.1111/j.1469-8137.2010.03291.x. PMID 20487312.
- ^ Hamiaux C, Drummond RS, Janssen BJ, Ledger SE, Cooney JM, Newcomb RD, Snowden KC (November 2012). "DAD2 is an α/β hydrolase likely to be involved in the perception of the plant branching hormone, strigolactone". Current Biology. 22 (21): 2032–6. doi:10.1016/j.cub.2012.08.007. PMID 22959345.
- ^ Chen, Jiming; White, Alexandra; Nelson, David C.; Shukla, Diwakar (2020-07-29). "Role of substrate recognition in modulating strigolactone receptor selectivity in witchweed". bioRxiv. 297 (4): 2020.07.28.225722. doi:10.1101/2020.07.28.225722. PMC 8487064. PMID 34437903. S2CID 220885195.
- ^ Bürger, Marco; Chory, Joanne (2020-10-15). "In-silico analysis of the strigolactone ligand-receptor system". Plant Direct. 4 (9): e00263. doi:10.1002/pld3.263. ISSN 2475-4455. PMC 7507525. PMID 32995702.
- ^ Zhao LH, Zhou XE, Wu ZS, Yi W, Xu Y, Li S, et al. (March 2013). "Crystal structures of two phytohormone signal-transducing α/β hydrolases: karrikin-signaling KAI2 and strigolactone-signaling DWARF14". Cell Research. 23 (3): 436–9. doi:10.1038/cr.2013.19. PMC 3587710. PMID 23381136.
- ^ Kagiyama M, Hirano Y, Mori T, Kim SY, Kyozuka J, Seto Y, et al. (February 2013). "Structures of D14 and D14L in the strigolactone and karrikin signaling pathways". Genes to Cells. 18 (2): 147–60. doi:10.1111/gtc.12025. PMID 23301669.
- ^ Zhao LH, Zhou XE, Yi W, Wu Z, Liu Y, Kang Y, et al. (November 2015). "Destabilization of strigolactone receptor DWARF14 by binding of ligand and E3-ligase signaling effector DWARF3". Cell Research. 25 (11): 1219–36. doi:10.1038/cr.2015.122. PMC 4650425. PMID 26470846.
- ^ Yao, Ruifeng; Ming, Zhenhua; Yan, Liming; Li, Suhua; Wang, Fei; Ma, Sui; Yu, Caiting; Yang, Mai; Chen, Li; Chen, Linhai; Li, Yuwen (25 August 2016). "DWARF14 is a non-canonical hormone receptor for strigolactone". Nature. 536 (7617): 469–473. Bibcode:2016Natur.536..469Y. doi:10.1038/nature19073. ISSN 1476-4687. PMID 27479325. S2CID 4469412.
- ^ de Saint Germain A, Clavé G, Badet-Denisot MA, Pillot JP, Cornu D, Le Caer JP, et al. (October 2016). "An histidine covalent receptor and butenolide complex mediates strigolactone perception". Nature Chemical Biology. 12 (10): 787–794. doi:10.1038/nchembio.2147. PMC 5030144. PMID 27479744.
- ^ Bürger M, Mashiguchi K, Lee HJ, Nakano M, Takemoto K, Seto Y, et al. (January 2019). "Structural Basis of Karrikin and Non-natural Strigolactone Perception in Physcomitrella patens". Cell Reports. 26 (4): 855–865.e5. doi:10.1016/j.celrep.2019.01.003. PMC 7233462. PMID 30673608.
- ^ Bürger, Marco; Chory, Joanne (April 2020). "The Many Models of Strigolactone Signaling". Trends in Plant Science. 25 (4): 395–405. doi:10.1016/j.tplants.2019.12.009. ISSN 1878-4372. PMC 7184880. PMID 31948791.
- ^ Yao R, Ming Z, Yan L, Li S, Wang F, Ma S, et al. (August 2016). "DWARF14 is a non-canonical hormone receptor for strigolactone". Nature. 536 (7617): 469–73. Bibcode:2016Natur.536..469Y. doi:10.1038/nature19073. PMID 27479325. S2CID 4469412.
- ^ Seto Y, Yasui R, Kameoka H, Tamiru M, Cao M, Terauchi R, et al. (January 2019). "Strigolactone perception and deactivation by a hydrolase receptor DWARF14". Nature Communications. 10 (1): 191. Bibcode:2019NatCo..10..191S. doi:10.1038/s41467-018-08124-7. PMC 6331613. PMID 30643123.
- ^ a b c d e Besserer A, Puech-Pagès V, Kiefer P, Gomez-Roldan V, Jauneau A, Roy S, et al. (July 2006). "Strigolactones stimulate arbuscular mycorrhizal fungi by activating mitochondria". PLOS Biology. 4 (7): e226. doi:10.1371/journal.pbio.0040226. PMC 1481526. PMID 16787107.
- ^ a b c d e Shinohara N, Taylor C, Leyser O (2013-01-29). "Strigolactone can promote or inhibit shoot branching by triggering rapid depletion of the auxin efflux protein PIN1 from the plasma membrane". PLOS Biology. 11 (1): e1001474. doi:10.1371/journal.pbio.1001474. PMC 3558495. PMID 23382651.
- ^ a b c d e f López-Ráez JA, Charnikhova T, Gómez-Roldán V, Matusova R, Kohlen W, De Vos R, et al. (2008-06-01). "Tomato strigolactones are derived from carotenoids and their biosynthesis is promoted by phosphate starvation". The New Phytologist. 178 (4): 863–74. doi:10.1111/j.1469-8137.2008.02406.x. hdl:10261/159227. PMID 18346111.
- ^ a b c Yoneyama K, Xie X, Sekimoto H, Takeuchi Y, Ogasawara S, Akiyama K, Hayashi H, Yoneyama K (July 2008). "Strigolactones, host recognition signals for root parasitic plants and arbuscular mycorrhizal fungi, from Fabaceae plants". The New Phytologist. 179 (2): 484–94. doi:10.1111/j.1469-8137.2008.02462.x. PMID 19086293.
- ^ a b c d e f g h Genre A, Chabaud M, Balzergue C, Puech-Pagès V, Novero M, Rey T, et al. (April 2013). "Short-chain chitin oligomers from arbuscular mycorrhizal fungi trigger nuclear Ca2+ spiking in Medicago truncatula roots and their production is enhanced by strigolactone". The New Phytologist. 198 (1): 190–202. doi:10.1111/nph.12146. hdl:2318/134858. PMID 23384011.
- ^ a b c d e f Bouwmeester HJ, Roux C, Lopez-Raez JA, Bécard G (May 2007). "Rhizosphere communication of plants, parasitic plants and AM fungi". Trends in Plant Science. 12 (5): 224–30. doi:10.1016/j.tplants.2007.03.009. PMID 17416544.






