배아 이식
Embryo transfer| 배아 이식 123 | |
|---|---|
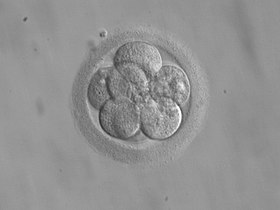 수정 후 3일 후 이식용 8세포 배아 | |
| 메쉬 | D004624 |
배아 이식이란 여성의 자궁에 배아를 넣어 임신을 확립하는 보조 생식 과정을 말한다.시험관내 수정(IVF)과 관련하여 종종 사용되는 이 기술은 목표가 달라질 수 있는 상황에서 사람이나 동물에게 사용될 수 있다.
배아는 1984년에 [1]처음 수행된 배반포 단계에서 2일째 또는 3일째에 이루어질 수 있다.
배아 이식 성공에 영향을 미칠 수 있는 요소로는 자궁내막 수용성, 배아 품질 및 배아 이식 기술이 있습니다.
신선도 대 냉동도
배아는 같은 생리 주기의 수정란 세포로부터 "신선한" 것이거나 "동결"될 수 있다. 즉, 그들은 이전 주기에서 생성되어 배아 저온 보존을 거쳤으며, 이동 직전에 해동되어 "동결 배아 이동" (FET)이라고 불린다.저온 보존 배아를 사용한 결과는 선천적 기형이나 발육 [2]이상 증가 없이 균등하게 긍정적이었다. 또한 세포질 내 [3]정자 주입에 사용되는 신선한 난자와 냉동 난자 사이에서도 마찬가지였다.실제로 FET에 따라 임신률이 증가하며, 난소 과민 자극이 [4]수행된 것과 같은 사이클의 배아 전이보다 주산기 결과가 덜 영향을 받는다.자궁내막은 난소 과민 자극에 따른 이식을 위해 최적으로 준비되지 않은 것으로 믿어지며, 따라서 냉동 배아 이식은 성공적인 [4]이식을 위한 기회를 최적화하는데 초점을 맞추기 위해 별도의 주기를 위해 이용된다.유리화 배반포에서 태어난 아이들은 냉동되지 않은 [5]배반포에서 태어난 아이들보다 훨씬 더 높은 출생 체중을 가지고 있다.냉동톱 난모세포를 이식할 때, 자연주기에서 전이되든 배란유도를 [6]통해 전이되든 임신 가능성은 근본적으로 동일하다.
정상 출산율과 진행 중인 임신률 측면에서 FET와 신선 배아 이식 사이에 차이가 거의 없거나 전혀 없으며 "모두 동결"[7] 전략을 사용하면 난소 과자극 증후군의 위험이 적을 수 있다.임신의 모성 고혈압 장애와 더불어 임신 연령에 비해 큰 아이를 낳고 높은 출산율을 가질 위험은 "모두 동결"[7] 전략을 사용하여 증가할 수 있다.
자궁제제
인간의 경우, 자궁 내벽(내막)이 적절하게 준비되어야 배아가 이식될 수 있다.자연 사이클에서 배아의 이행은 현재의 루테니징 호르몬의 상태에 대해 라이닝이 적절히 발달하지 않은 시점에서 황체 단계에서 이루어진다."동결" 배아가 옮겨지는 자극이나 사이클에서, 수용된 여성은 먼저 에스트로겐 제제를 투여받을 수 있고, 그 다음 에스트로겐과 프로게스테론의 조합을 투여받아 배아를 수용하게 된다.수용하는 시간은 이식 창구입니다.2013년의 과학적 검토는 냉동배아 이식에서의 자궁내막 준비의 한 방법이 다른 [8]방법보다 더 효과적이라는 것을 확인하는 것은 불가능하다는 결론에 도달했다.
제한된 증거는 또한 [9]이송 전에 자궁경부 점액을 제거하는 것을 뒷받침한다.
타이밍.
배아 전이는 배아 배양의 다양한 기간 후에 수행될 수 있으며, 배아 발생의 다른 단계를 제공한다.배아 전이가 이루어지는 주요 단계는 분열 단계(공동 삽관 후 2일 ~ 4일) 또는 배반포 단계(공동 [10]삽관 후 5일 또는 6일)이다.
체내에는 난할기 배아가 아직 나팔관에 존재하고 자궁의 영양환경이 튜브와 다르다는 것이 알려져 있기 때문에 3일차에 이송되면 태아에 스트레스를 주어 착상 잠재력이 저하될 수 있다고 가정한다.배반포 단계 배아는 자궁 환경에 가장 적합하므로 이러한 문제가 없습니다 [1].
3번째 세포 단계에 도달한 배아는 이식 전 유전자 진단(PGD)에 의해 가능한 이식 전에 염색체 또는 특정 유전적 결함을 검사할 수 있습니다. 배반포 단계에서 이식하는 것은 이식당 실제 출산율을 크게 증가시키지만 또한 이전과 배아를 위해 사용할 수 있는 배아의 수를 감소시킵니다.저온 보존, 그래서 누적 임상 임신율은 분할 단계 [6][needs update]전이와 함께 증가한다.정상 출산율이 수정 후 [11]2일째와 3일째 사이에 차이가 있는지는 미지수다.
배반포 전이 [12]후 단접합 쌍둥이화는 분열기 배아 전이보다 증가하지 않는다.
분열 [10]단계에 비해 배반포 단계에 도달한 출생아 중 조산(ods 비율 1.3)과 선천성 이상(ods 비율 1.3)의 확률이 유의미하게 높다.확장된 [13]배양에 의해 유발되는 후생유전학적 변형으로 인한 여성 배아 사망률 증가 때문에, 배반포 전이(lastocy transfer)는 2일 또는 3일 전이(정상 성비 51.5%)에 비해 더 많은 남성 출산(남성 56.1%)으로 이어진다.
배아선택
연구소는 난모세포와 배아의 질을 판단하기 위한 채점법을 개발했다.임신률을 최적화하기 위해,[14] 형태학적 점수 부여 시스템이 배아 선택을 위한 최선의 전략이라는 중요한 증거가 있다.체외수정을 위한 첫 번째 시간 경과 현미경 검사 시스템이 임상 [15]사용을 위해 승인된 2009년 이후, 형태동태학적 점수 시스템은 임신률로 [16]더욱 개선되는 것으로 나타났다.그러나 형태동태학적 스코어링 시스템 유무에 관계없이 모든 다른 유형의 시간 경과 배아 영상 장치를 체외수정(IVF)에 대한 기존 배아 평가와 비교할 때,[17] 둘 중 하나를 선택할 수 있는 실제 출산, 임신, 사산 또는 유산의 차이가 있다는 증거는 불충분하다.2016년에 실시된 소규모 무작위화 연구는 기존의 배아학에 [18]비해 자동화된 시간 경과 배아 이미징 장치에서 낮은 배아 품질과 더 많은 직원 시간을 보고했다.인공지능과 딥러닝을 기반으로 한 보다 정확한 배아 선택 분석을 개발하기 위한 적극적인 노력이 진행 중이다.배아 랭킹 인텔리전트 분류 알고리즘(ERCA)[19]이 명확한 예입니다.이 딥 러닝 소프트웨어는 수동 분류를 비침습적 [20]방식으로 개별 배아의 예측 유전자 상태에 기초한 순위 시스템으로 대체합니다.이 분야에 대한 연구는 아직 진행 중이며 현재 타당성 연구는 그 가능성을 [21]뒷받침한다.
절차.
자궁경부를 시각화하기 위해 질에 검경을 넣어 식염수나 배지로 세척하는 것부터 시작한다.이송 카테터는 배아를 탑재하고 환자의 신원 확인 후 임상의에게 건네진다.카테터는 경추관을 통해 삽입되고 [22]자궁강으로 진행됩니다.이 과정에는 여러 유형의 카테터가 사용되지만, 부드러운 전달 카테터와 딱딱한 전달 카테터를 사용하면 임상 [23]임신 가능성을 높일 수 있다는 좋은 증거가 있다.
초음파 [9]지침에서 유익하다는 우수하고 일관된 증거가 있다. 즉, 자궁 [24]바닥에서 1~2cm 떨어진 정확한 배치를 보장하기 위해 복부 초음파를 만드는 것이다.초음파 지침을 사용하는 임상 임신이 "임상 접촉"[25]에 비해 유의미한 증가의 증거가 있다.일반적으로 마취는 필요하지 않습니다.특히 단일 배아를 이식하려면 자궁강 내에서의 정확성과 정확성이 요구됩니다.최대 임플란트 퍼텐셜(MIP) 포인트로 알려진 배아 배치의 최적 대상은 3D/4D [26]초음파를 사용하여 식별된다.그러나 자궁의 중간 [9][25]비율에 배아가 퇴적되는 것을 뒷받침하는 증거는 제한적이다.
카테터 삽입 후 내용물을 배출하고 배아를 퇴적시킨다.배아를 [9]가지고 시술을 하기 전에 시험적인 이전을 하는 것을 뒷받침하는 증거는 한정되어 있다.배출 후 카테터가 자궁 안에 남아 있는 기간은 임신율에 [27]영향을 주지 않습니다.제한된 증거에 따르면 [9]배출 후 카테터로부터의 음압을 피할 수 있습니다.카테터를 빼낸 후, 카테터는 배아학자에게 전달되고, 배아학자는 카테터를 통해 남아 있는 배아를 검사합니다.
접합자 난자내이식(ZIFT) 과정에서 난자를 여성에게서 떼어내 수정한 뒤 자궁이 아닌 여성의 난관에 넣는다.
배아번호
주요 쟁점은 얼마나 많은 배아를 옮겨야 하는가이다. 왜냐하면 여러 배아를 두는 것은 다임신의 위험을 수반하기 때문이다.과거의 의사들은 임신 가능성을 높이기 위해 여러 개의 배아를 배치했지만, 이 접근법은 인기가 없었다.전문 사회와 많은 나라의 입법부는 이러한 [28]관행을 줄이기 위한 지침이나 법을 발표했다.한 주기 동안 이중 배아를 이식하는 것이 단일 배아를 이식하는 것보다 더 높은 정상 출산율을 달성한다는 증거는 낮거나 중간 정도이지만, 두 주기에 두 번의 단일 배아를 이식하는 것은 정상 출산율이 동일하고 다중 [29]임신을 피할 수 있다.
옮겨질 배아의 적절한 수는 여성의 나이, 첫 번째, 두 번째 또는 세 번째 완전한 체외수정 시도인지 그리고 이용 가능한 최고 품질의 배아가 있는지 여부에 따라 달라집니다.2013년 국립보건관리 우수연구소(NICE)의 지침에 따라, 한 주기에 전달되는 배아의 수는 다음 [30]표와 같이 선택되어야 한다.
| 나이 | Attempt No. | 이식된 배아 |
|---|---|---|
| 37년 미만 | 첫 번째 | 1 |
| 두 번째 | 1(최고 품질의 경우 | |
| 세 번째 | 2개 이하 | |
| 37~39세 | 첫 번째와 두 번째 | 1(최고 품질의 경우 |
| 2(최고품질이 없는 경우) | ||
| 세 번째 | 2개 이하 | |
| 40~42세 | 2 |
전자 설정
여성에게 전달할 배아를 하나만 선택하는 기술을 선택-단일배아 전이(e-SET)라고 부르거나, 배아가 배반포 단계에 있을 때 선택 단일 배반포 전이(eSBT)[31]라고도 부를 수 있다.다발성 임신의 위험을 현저하게 낮춥니다.이중 배아 이동(DET) 또는 이중 배반포 이동(2BT)으로,[32] DET의 약 38% 또는 2BT의 [31]약 25%에 비해 sET에서 약 3.5%의 쌍둥이 발생률을 보였다.동시에 임신률은 eSBT가 [31]2BT보다 유의하게 낮지 않다.즉, 단일 신선 배아 전이 후 단일 냉동 및 해동 배아 전이 후 연관된 누적 정상 출산율은 이중 신선 배아 [11]전이 후 한 사이클 후의 출산율과 유사하다.또한, SET는 분만 단계에서 [32]DET-e-SET배아보다 분만 시 평균 임신 연령, 분만 모드, 출산 체중 및 신생아 중환자실 필요 위험 면에서 더 나은 결과를 보인다.[33]무작위화되고 통제된 시험의 증거는 e-SET 시도(신선 및/또는 동결) 횟수를 증가시키면 DET와 [33]유사한 누적 정상 출산율이 발생한다는 것을 시사한다.
단일 배아의 사용은 스웨덴(69.4%)에서 가장 높지만 미국에서는 2.8%로 낮다. ART에 대한 공적 자금의 접근, 양호한 저온 보존 시설의 이용, 다발성 임신의 위험에 대한 효과적인 교육 및 법률은 단일 [34]배아의 지역 사용에 있어 가장 중요한 요소인 것으로 보인다.또한, 많은 난임 부부들이 [34]쌍둥이에 대한 강한 선호도를 가지고 있기 때문에 개인의 선택은 중요한 역할을 한다.
부가 절차
배아 이식 후 경추관의 기계적 폐쇄 사용이 영향을 미치는지 [35]여부는 불확실하다.
배아 이식 후 침대 휴식을 연장한다는 상당한 증거가 임상 [36]임신의 감소와 관련이 있다.
히알루론산을 배아의 부착 매개체로 사용하는 것은 정상 [35]출산율을 높일 수 있다.배아를 [35]이식할 때 방광이 가득 차거나 자궁경부 점액을 제거하거나 자궁내막강이나 자궁내경강에서 홍조를 일으키는 것은 거의 또는 이점이 없을 수 있습니다.아목시실린과 클라불란산 형태의 보조 항생제는 항생제가 없는 [35]것에 비해 임상 임신률을 증가시키지 않을 것이다.배아 이식 시기에 아토시반, G-CSF, hCG를 사용한 결과 임상 임신률이 [37]증가하는 추세를 보였다.
냉동발톱배아를 이식하거나 난자기증에서 배아를 이식하는 경우, 이식 전에 수용자에게 이전 난소과민증이 필요하지 않으며, 이는 자발적 배란주기 동안 수행될 수 있다.여전히 냉동톱 배아 이송을 위한 다양한 프로토콜이 존재한다. 예를 들어, 난소 과자극을 포함한 프로토콜, 에스트로겐 및/또는 프로게스테론에 의해 자궁 내막이 인공적으로 준비되는 프로토콜이다.자궁내막이 에스트로겐이나 프로게스테론에 의해 인공적으로 준비되는 주기에는 고나도트로핀 방출 호르몬 작용제(GnRHA)[38]의 지속적인 투여와 같은 난소에 의한 호르몬 생성을 억제하는 추가 약물을 투여하는 것이 유익할 수 있다는 몇 가지 증거가 있다.난자 기증은 난모세포 회수 개시일 또는 그 [6]다음날에 비해 기증자로부터 난모세포 회수 전에 수용체 프로게스테론 보충이 개시되었을 때 임신률이 낮고 주기 취소율이 높다는 증거가 있다.
정액은 자궁경부 및 자궁의 상피세포와 상호작용하는 몇 가지 단백질을 포함하고 있어 능동적인 임신 면역 내성을 유발한다.여성이 배아 전이 무렵에 임상 임신에 통계적으로 유의한 정족 혈장에 노출되었을 때 유의하게 개선된 결과가 있지만,[39] 이용 가능한 데이터가 제한된 현재 임신이나 정상 출산율에는 해당되지 않는다.
폴로업
환자들은 보통 난자를 건진 후에 프로게스테론 약물을 복용하기 시작한다.PIO(Progesterone-in-Oil)의 매일 근육 내 주입이 표준 투여 경로였지만, PIO 주입은 임신 중 사용을 FDA에서 승인하지 않았습니다.최근 메타 분석 결과 적절한 용량과 투여 빈도를 갖는 질 내 경로가 매일 근육 내 [40]주입과 동등하다는 것이 밝혀졌다.또한 질 프로게스테론과 PIO 주사를 비교한 최근의 사례 일치 연구는 정상 출산율이 두 [41]방법 모두 거의 동일하다는 것을 보여주었다.프로게스테론을 11일 동안 투여하면 더 긴 [42]기간과 거의 같은 출생률을 얻을 수 있다.
환자들은 또한 배아 이식 후에 에스트로겐 약물을 투여받는다.임신 검사는 보통 난자 회수 후 2주 후에 이루어집니다.
서드파티제 복제
난자를 제공한 암컷에게 배아 이식 수술을 할 필요는 없다.따라서 자궁이 적절하게 준비된 다른 암컷은 배아를 받아 임신을 할 수 있다.배아 이식은 난자가 있지만 자궁이 없고 생물학적 아기를 갖고 싶어하는 여성이 사용할 수 있다; 그녀는 임신을 하기 위해 임신 보균자나 대리인의 도움을 필요로 할 것이다.또한, 난자가 없고 자궁이 있는 여성은 난자 기증자 체외수정을 이용할 수 있으며, 이 경우 다른 여성이 수정하기 위해 난자를 제공하고 그 결과 얻은 배아는 환자의 자궁에 삽입된다.수정은 여성의 파트너의 정자를 사용하거나 기증자의 정자를 사용하여 수행될 수 있다.체외수정을 받고 있는 다른 부부들을 위해 만들어졌지만 그 부부들의 필요에 따라 잉여인 '스페어' 배아도 옮겨질 수 있다.배아는 기증자의 난자와 정자를 사용하여 특별히 만들어질 수 있으며, 이것은 다른 여성의 자궁으로 옮겨질 수 있다.대리인은 자신과 '임무' 커플이 아이와 생물학적으로 관련이 없음에도 불구하고 다른 커플을 위해 배아 이식에 의해 태어난 아기를 낳을 수 있다.제삼자 복제는 많은 국가에서 논란이 되고 규제되고 있습니다.임신 대리모 계약에 참여하는 사람들은 우리가 관계를 친족, 우정, 로맨틱한 동반자 [43]관계 또는 시장 관계로 분류하기 위해 사용하는 전통적인 대본에 맞지 않는 완전히 새로운 유형의 관계를 이해해야 한다.대리모들은 자신의 친척이 아니라고 생각하는 아기를 임신한 경험이 있는 반면, 의도된 엄마들은 임신 9개월 동안 기다렸다가 임신한 몸 밖에서 모성으로 이행한 경험이 있다.이것은 몸과 자신에 [43]대한 새로운 개념화로 이어질 수 있다.
역사
한 인간에서 다른 인간으로의 태아의 첫 번째 이전은 1983년 7월에 보고되었고,[44] 이후 1984년 2월 3일에 첫 번째 인간 탄생을 발표했다.이 시술은 존 버스터 박사와 로스앤젤레스 의대 캘리포니아 대학의 지시로 하버 UCLA 메디컬 센터에서 실시되었습니다.
이 과정에서 막 발육하기 시작한 배아는 인공수정으로 임신한 한 여성에게서 38주 후 아기를 출산한 다른 여성으로 옮겨졌다.인공수정에 사용된 정자는 아기를 [46][47]낳은 여성의 남편으로부터 나왔다.
이 과학적 비약적인 발전은 기준을 확립했고 불임 여성들과 그들의 아이들에게 유전적인 장애를 물려주고 싶지 않은 여성들에게 변화의 매개체가 되었다.기증자의 배아 이식은 여성들이 임신을 하고 남편의 유전자 구성을 포함할 아이를 낳는 메커니즘을 제공해 왔다.오늘날 시행되고 있는 기증자 배아의 이전은 원래의 비수술적 방법에서 발전했지만, 현재는 시험관내 수정 기록 출산의 약 5%를 차지한다.
그 이전에는 불임이었던 수천 명의 여성들이 부모가 되는 유일한 방법으로 입양되었다.이는 배아 기증과 이식에 대해 개방적이고 솔직한 논의를 할 수 있는 장을 마련했다.이러한 돌파구는 혈액이나 주요 장기 기증과 같은 다른 기증과 유사한 일반적인 관행으로 인간 배아를 기증하는 데 자리를 내주었다.이 발표 당시, 이 행사는 주요 뉴스 캐리어에 의해 포착되었고, 여성의 건강 증진을 위한 발판을 마련함으로써 생식 의학의 미래에 영향을 미친 이 관행에 대한 건전한 토론과 토론을 촉발시켰다.
이 연구는 지난 25년간 [46][47]진화된 주류 임상 관행인 인간 난모세포와 배아 기증을 둘러싼 기술적 기반과 법적 윤리적 프레임워크를 확립했다.
효과
2012년에 업데이트된 Cochrane 체계적 검토에 따르면 보조 생식 기술에서 배반포 단계 이행이 절단(2일 또는 3일째) 단계 이행보다 더 효과적인 것으로 나타났다.그것은 배반포 이식에 대한 부부당 정상 출산율에서 약간의 향상을 보였다.이는 초기 분열 주기를 사용하는 클리닉의 전형적인 비율이 31%인 경우, 클리닉이 [48]배반포 이전을 사용하면 정상 출산율이 32%에서 42%로 증가한다는 것을 의미한다.최근의 체계적 검토에 따르면 배아 선택과 함께, 이송 절차 동안 따르는 기법이 성공적인 임신 결과를 초래할 수 있다.임신률을 개선하기 위한 문헌에서는 다음과 같은 개입이 뒷받침된다.
• 배아 이식을 위한 복부 초음파 지침
• 자궁경부 점액 제거
• 부드러운 배아 전달 카테터 사용
• 배아를 배출하기 위해 안저에서 1cm 이상 자궁강 상부 또는 중간(중앙) 영역에 배아 이송 팁 배치
• 배아 이식 절차 완료[49] 후 즉시 암벽화
동물의 배아 이식
배아 이식 기술은 인공수정이 우수한 [50]종아리를 더 많이 사용하는 것과 같은 방식으로 최고 품질의 암컷 가축이 무리나 무리들의 유전적 발달에 더 큰 영향을 미칠 수 있게 해준다.ET는 또한 경쟁 암말과 같은 동물을 계속 사용하여 새끼를 생산하면서 훈련과 쇼를 계속할 수 있도록 합니다.배아 이식의 일반적인 역학적인 측면은 배아의 이식이 전염병의 위험을 크게 줄이면서 가축의 개체군에 유전 물질을 도입할 수 있는 기회를 제공한다는 것을 보여준다.이전과 착상 전 배아의 성별에 관한 최근의 발전은 유제품과 다른 축산업에 [51]큰 잠재력을 가지고 있다.
배아 이식은 실험용 쥐에게도 사용된다.예를 들어, 번식하기 어렵거나 유지비가 많이 드는 유전자 변형 균주의 배아는 냉동 보관될 수 있으며, 필요할 때만 해동되어 가짜 임신 댐에 이식될 수 있다.
2020년 2월 19일 오하이오 [52]주 콜럼버스 동물원에서 대리 치타 어미로부터 배아 이식을 통해 태어난 첫 번째 치타 아기 한 쌍이 태어났다.
동물의 냉동 배아 이식
소[53][54] 배아의 다양한 저온 보존 방법의 개발은 더 이상 적절한 공급자의 즉각적인 준비에 의존하지 않고, 상당히 효율적인 배아 전달 기술을 향상시켰다.임신율은 갓 태어난 [55]배아를 통해 달성된 것보다 약간 낮다.최근, 에틸렌 글리콜과 같은 냉동 보호제의 사용은 소 [56][57]배아의 직접적인 이동을 허용하고 있다.에틸렌 글리콜 동결 배지에 냉동된 배아의 직접 전달(DT)에 의해 열대 조건 하에서 생산된 세계 최초의 교잡종 소 송아지가 1996년 6월 23일에 태어났다.케랄라 축산개발위원회의 비노이 세바스티안 베티칼 박사는 에틸렌 글리콜 동결매체에 냉동 보관된 배아를 느린 프로그램 가능 동결(SPF) 기술로 생산하고, 이 송아지의 탄생을 위해 냉동 빨대를 물에 녹인 후 바로 이식받았다.한 연구에서, 에틸렌 글리콜 동결 배지에 냉동 보관된 체내 교잡종 소 배아는 열대 조건 하의 수용자에게 직접 전달되어 50%의 [58]임신률을 달성했습니다.북미 배아이식업계를 대상으로 한 조사에서 배아 직접이식 성공률은 [59]글리세롤에 의한 성공률에 못지 않았다.또한 2011년에는 냉동톱 배아의 95% 이상이 직접 [60]이송에 의해 옮겨졌다.
레퍼런스
- ^ Cohen J, Simons RF, Fehilly CB, Fishel SB, Edwards RG, Hewitt J, Rowlant GF, Steptoe PC, Webster JM (March 1985). "Birth after replacement of hatching blastocyst cryopreserved at expanded blastocyst stage". Lancet. 1 (8429): 647. doi:10.1016/s0140-6736(85)92194-4. PMID 2857991. S2CID 32746730.
- ^ "Genetics & IVF Institute". Givf.com. Archived from the original on 6 December 2012. Retrieved 22 September 2016.
- ^ Wennerholm UB, Söderström-Anttila V, Bergh C, Aittomäki K, Hazekamp J, Nygren KG, Selbing A, Loft A (September 2009). "Children born after cryopreservation of embryos or oocytes: a systematic review of outcome data". Human Reproduction. 24 (9): 2158–72. doi:10.1093/humrep/dep125. PMID 19458318.
- ^ a b Evans J, Hannan NJ, Edgell TA, Vollenhoven BJ, Lutjen PJ, Osianlis T, Salamonsen LA, Rombauts LJ (2014). "Fresh versus frozen embryo transfer: backing clinical decisions with scientific and clinical evidence". Human Reproduction Update. 20 (6): 808–21. doi:10.1093/humupd/dmu027. PMID 24916455.
- ^ Wikland M, Hardarson T, Hillensjö T, Westin C, Westlander G, Wood M, Wennerholm UB (July 2010). "Obstetric outcomes after transfer of vitrified blastocysts". Human Reproduction. 25 (7): 1699–707. doi:10.1093/humrep/deq117. PMID 20472913.
- ^ a b c Farquhar C, Rishworth JR, Brown J, Nelen WL, Marjoribanks J (December 2014). Brown J (ed.). "Assisted reproductive technology: an overview of Cochrane reviews". The Cochrane Database of Systematic Reviews (12): CD010537. doi:10.1002/14651858.CD010537.pub3. PMID 25532533.
- ^ a b Zaat, Tjitske; Zagers, Miriam; Mol, Femke; Goddijn, Mariëtte; van Wely, Madelon; Mastenbroek, Sebastiaan (4 February 2021). "Fresh versus frozen embryo transfers in assisted reproduction". The Cochrane Database of Systematic Reviews. 2021 (2): CD011184. doi:10.1002/14651858.CD011184.pub3. ISSN 1469-493X. PMC 8095009. PMID 33539543.
- ^ Groenewoud ER, Cantineau AE, Kollen BJ, Macklon NS, Cohlen BJ (2013). "What is the optimal means of preparing the endometrium in frozen-thawed embryo transfer cycles? A systematic review and meta-analysis". Human Reproduction Update. 19 (5): 458–70. doi:10.1093/humupd/dmt030. PMID 23820515.
- ^ a b c d e Mains L, Van Voorhis BJ (August 2010). "Optimizing the technique of embryo transfer". Fertility and Sterility. 94 (3): 785–90. doi:10.1016/j.fertnstert.2010.03.030. PMID 20409543.
- ^ a b Dar S, Lazer T, Shah PS, Librach CL (2014). "Neonatal outcomes among singleton births after blastocyst versus cleavage stage embryo transfer: a systematic review and meta-analysis". Human Reproduction Update. 20 (3): 439–48. doi:10.1093/humupd/dmu001. PMID 24480786.
- ^ a b Farquhar, C; Marjoribanks, J (17 August 2018). "Assisted reproductive technology: an overview of Cochrane Reviews". Cochrane Database of Systematic Reviews. 2018 (8): CD010537. doi:10.1002/14651858.CD010537.pub5. PMC 6953328. PMID 30117155.
- ^ Papanikolaou EG, Fatemi H, Venetis C, Donoso P, Kolibianakis E, Tournaye H, Tarlatzis B, Devroey P (February 2010). "Monozygotic twinning is not increased after single blastocyst transfer compared with single cleavage-stage embryo transfer". Fertility and Sterility. 93 (2): 592–7. doi:10.1016/j.fertnstert.2008.12.088. PMID 19243755.
- ^ Tan, Kun; An, Lei; Miao, Kai; Ren, Likun; Hou, Zhuocheng; Tao, Li; Zhang, Zhenni; Wang, Xiaodong; Xia, Wei; Liu, Jinghao; Wang, Zhuqing; Xi, Guangyin; Gao, Shuai; Sui, Linlin; Zhu, De-Sheng; Wang, Shumin; Wu, Zhonghong; Bach, Ingolf; Chen, Dong-bao; Tian, Jianhui (2016). "Impaired imprinted X chromosome inactivation is responsible for the skewed sex ratio following in vitro fertilization". Proceedings of the National Academy of Sciences. 113 (12): 3197–3202. Bibcode:2016PNAS..113.3197T. doi:10.1073/pnas.1523538113. PMC 4812732. PMID 26951653.
- ^ Rebmann V, Switala M, Eue I, Grosse-Wilde H (July 2010). "Soluble HLA-G is an independent factor for the prediction of pregnancy outcome after ART: a German multi-centre study". Human Reproduction. 25 (7): 1691–8. doi:10.1093/humrep/deq120. PMID 20488801.
- ^ "Unisense FertiliTech A/S Receives CE Mark of Approval for EmbryoScope(TM) Embryo Monitoring System".
- ^ Meseguer M, Rubio I, Cruz M, Basile N, Marcos J, Requena A (December 2012). "Embryo incubation and selection in a time-lapse monitoring system improves pregnancy outcome compared with a standard incubator: a retrospective cohort study". Fertility and Sterility. 98 (6): 1481–9.e10. doi:10.1016/j.fertnstert.2012.08.016. PMID 22975113.
- ^ Armstrong, S; Bhide, P; Jordan, V; Pacey, A; Marjoribanks, J; Farquhar, C (29 May 2019). "Time-lapse systems for embryo incubation and assessment in assisted reproduction". The Cochrane Database of Systematic Reviews. 5: CD011320. doi:10.1002/14651858.CD011320.pub4. PMC 6539473. PMID 31140578.
- ^ Wu YG, Lazzaroni-Tealdi E, Wang Q, Zhang L, Barad DH, Kushnir VA, Darmon SK, Albertini DF, Gleicher N (August 2016). "Different effectiveness of closed embryo culture system with time-lapse imaging (EmbryoScope(TM)) in comparison to standard manual embryology in good and poor prognosis patients: a prospectively randomized pilot study". Reproductive Biology and Endocrinology. 14 (1): 49. doi:10.1186/s12958-016-0181-x. PMC 4995783. PMID 27553622.
- ^ "ERICA Embryo Ranking Artificial Intelligence for Assisted Reproduction".
- ^ Chavez-Badiola, Alejandro; Flores-Saiffe Farias, Adolfo; Mendizabal-Ruiz, Gerardo; Drakeley, Andrew J.; Garcia-Sánchez, Rodolfo; Zhang, John J. (2019). "Artificial vision and machine learning designed to predict PGT-A results". Fertility and Sterility. 112 (3): e231. doi:10.1016/j.fertnstert.2019.07.715.
- ^ Chavez-Badiola, Alejandro; Flores-Saiffe Farias, Adolfo; Mendizabal-Ruiz, Gerardo; Garcia-Sanchez, Rodolfo; Drakeley, Andrew J.; Garcia-Sandoval, Juan Paulo (10 March 2020). "Predicting pregnancy test results after embryo transfer by image feature extraction and analysis using machine learning". Scientific Reports. 10 (1): 4394. Bibcode:2020NatSR..10.4394C. doi:10.1038/s41598-020-61357-9. PMC 7064494. PMID 32157183.
- ^ Jain, John (25 March 2015). "Embryo Transfer". Dr. John Jain on Youtube. Archived from the original on 13 December 2021. Retrieved 17 December 2015.
- ^ Tayler, Bede (2022). "Interventions to optimize embryo transfer in women undergoing assisted conception: a comprehensive systematic review and meta-analyses". Human Reproduction Update. 28 (4): 480–500. doi:10.1093/humupd/dmac009. PMID 35325124. Retrieved 24 March 2022.
- ^ Tyler, B.; Walford, H.; Tamblyn, J.; Keay, S. D.; Mavrelos, D.; Yasmin, E.; Al Wattar, B. H. (2022). "Validate User". Human Reproduction Update. doi:10.1093/humupd/dmac009. PMID 35325124. Retrieved 24 March 2022.
- ^ a b Tyler, B.; Walford, H.; Tamblyn, J.; Keay, S. D.; Mavrelos, D.; Yasmin, E.; Al Wattar, B. H. (2022). "OUP accepted manuscript". Human Reproduction Update. doi:10.1093/humupd/dmac009. ISSN 1355-4786. PMID 35325124.
- ^ 를 클릭합니다Gergely RZ, DeUgarte CM, Danzer H, Surrey M, Hill D, DeCherney AH (August 2005). "Three dimensional/four dimensional ultrasound-guided embryo transfer using the maximal implantation potential point". Fertility and Sterility. 84 (2): 500–3. doi:10.1016/j.fertnstert.2005.01.141. PMID 16084896..
- ^ Sroga JM, Montville CP, Aubuchon M, Williams DB, Thomas MA (April 2010). "Effect of delayed versus immediate embryo transfer catheter removal on pregnancy outcomes during fresh cycles". Fertility and Sterility. 93 (6): 2088–90. doi:10.1016/j.fertnstert.2009.07.1664. PMID 20116786.
- ^ "New Law regarding the number of embryos transferred in Greece". newlife-ivf.co.uk. 22 December 2014.
- ^ Kamath MS, Mascarenhas M, Kirubakaran R, Bhattacharya S (2020). "Number of embryos for transfer following in vitro fertilisation or intra-cytoplasmic sperm injection". Cochrane Database of Systematic Reviews. Cochrane Database Syst Rev. (published 21 August 2020). 8: CD003416. doi:10.1002/14651858.CD003416.pub5. PMC 8094586. PMID 32827168.
- ^ 불임: 불임 문제가 있는 사람들을 위한 평가와 치료.NICE 임상 가이드라인 CG156 –발행일 :2013년 2월
- ^ a b c Mullin CM, Fino ME, Talebian S, Krey LC, Licciardi F, Grifo JA (April 2010). "Comparison of pregnancy outcomes in elective single blastocyst transfer versus double blastocyst transfer stratified by age". Fertility and Sterility. 93 (6): 1837–43. doi:10.1016/j.fertnstert.2008.12.137. PMID 19249756.
- ^ a b Fauque P, Jouannet P, Davy C, Guibert J, Viallon V, Epelboin S, Kunstmann JM, Patrat C (August 2010). "Cumulative results including obstetrical and neonatal outcome of fresh and frozen-thawed cycles in elective single versus double fresh embryo transfers". Fertility and Sterility. 94 (3): 927–35. doi:10.1016/j.fertnstert.2009.03.105. PMID 19446806.
- ^ a b Gelbaya TA, Tsoumpou I, Nardo LG (August 2010). "The likelihood of live birth and multiple birth after single versus double embryo transfer at the cleavage stage: a systematic review and meta-analysis". Fertility and Sterility. 94 (3): 936–45. doi:10.1016/j.fertnstert.2009.04.003. PMID 19446809.
- ^ a b Maheshwari A, Griffiths S, Bhattacharya S (2010). "Global variations in the uptake of single embryo transfer". Human Reproduction Update. 17 (1): 107–20. doi:10.1093/humupd/dmq028. PMID 20634207.
- ^ a b c d Farquhar, C; Marjoribanks, J (17 August 2018). "Assisted reproductive technology: an overview of Cochrane Reviews". The Cochrane Database of Systematic Reviews. 2018 (8): CD010537. doi:10.1002/14651858.CD010537.pub5. PMC 6953328. PMID 30117155.
- ^ Tyler, Bede (2022). "Interventions to optimize embryo transfer in women undergoing assisted conception: a comprehensive systematic review and meta-analyses". Human Reproduction Update. 28 (4): 480–500. doi:10.1093/humupd/dmac009. PMID 35325124. Retrieved 24 March 2022.
- ^ Tyler, Bede (2022). "Interventions to optimize embryo transfer in women undergoing assisted conception: a comprehensive systematic review and meta-analyses". Human Reproduction Update. 28 (4): 480–500. doi:10.1093/humupd/dmac009. PMID 35325124. Retrieved 24 March 2022.
- ^ Ghobara, T; Gelbaya, TA; Ayeleke, RO (5 July 2017). "Cycle regimens for frozen-thawed embryo transfer". The Cochrane Database of Systematic Reviews. 2017 (7): CD003414. doi:10.1002/14651858.CD003414.pub3. PMC 6483463. PMID 28675921.
- ^ Crawford G, Ray A, Gudi A, Shah A, Homburg R (2014). "The role of seminal plasma for improved outcomes during in vitro fertilization treatment: review of the literature and meta-analysis". Human Reproduction Update. 21 (2): 275–84. doi:10.1093/humupd/dmu052. PMID 25281684.
- ^ Zarutskiea PW, Phillips JA (2007). "Re-analysis of vaginal progesterone as luteal phase support (LPS) in assisted reproduction (ART) cycles". Fertility and Sterility. 88 (supplement 1): S113. doi:10.1016/j.fertnstert.2007.07.365.
- ^ 칸 N, 리히터 KS, 블레이크 EJ 등체외수정 및 배아 이식 후 황체상 지원을 위한 근육내 프로게스테론과 질내 프로게스테론의 케이스 매칭 비교.제55회 태평양 연안 생식학회 연차총회, 2007년 4월 18일~22일, 캘리포니아주 랜초 미라주.
- ^ Goudge CS, Nagel TC, Damario MA (August 2010). "Duration of progesterone-in-oil support after in vitro fertilization and embryo transfer: a randomized, controlled trial". Fertility and Sterility. 94 (3): 946–51. doi:10.1016/j.fertnstert.2009.05.003. PMID 19523613.
- ^ a b 테만, 엘리, 2010년산모 출산: 대리 몸과 임신한 자신.버클리:캘리포니아 대학 출판부
- ^ Blakeslee, Sandra (4 February 1984). "Infertile Woman Has Baby Through Embryo Transfer". The New York Times. Retrieved 1 May 2010.
- ^ "HUMC – Celebrating 50 Years of Caring". humc.edu. Archived from the original on 3 March 2016. Retrieved 18 January 2009.
- ^ a b Friedrich, Otto; Constable, Anne; Samghabadi, Raji (10 September 1984). "Medicine: A Legal, Moral, Social Nightmare". Time. Archived from the original on 16 February 2009. Retrieved 1 May 2010.
- ^ a b "The New Origins of Life". Time. 10 September 1984. Archived from the original on 14 January 2005. Retrieved 1 May 2010.
- ^ Glujovsky D, Blake D, Farquhar C, Bardach A (2012). Glujovsky, Demián (ed.). "Cleavage stage versus blastocyst stage embryo transfer in assisted reproductive technology". Cochrane Database of Systematic Reviews (7): CD002118. doi:10.1002/14651858.CD002118.pub4. PMID 22786480.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Author links open overlay panel Practice Committee of the American Society for Reproductive Medicine (2017). "Performing the embryo transfer: a guideline". Fertil Steril. 107 (4): 882–896. doi:10.1016/j.fertnstert.2017.01.025. PMID 28366416.
{{cite journal}}:author=범용명(도움말)이 있습니다. - ^ 2008년 5월 14일 Wayback Machine에 보관된 소의 배아 이전.2008년 10월 21일 취득.
- ^ 배아 섹싱 테크놀로지 2009년 3월 2일 Wayback Machine에 아카이브.2008년 10월 21일 취득.
- ^ "First Cheetah Cubs Born as Result of Embryo Transfer". Smithsonian's National Zoo. 24 February 2020. Retrieved 25 February 2020.
- ^ Wilmut I, Rowson LE (1973). "Experiments on the low-temperature preservation of cow embryos". Vet Rec. 92 (26): 686–690. doi:10.1136/vr.92.26.686. PMID 4730118. S2CID 46005842.
- ^ 레이보 SP, 마주르 P. 1978.포유류의 배아를 냉동 보존하는 방법.입력: 메이플토프트.역사와 소의 태아 이식.애니메이션, Repd., v.10, n.3, 페이지 168-173, 2013년 7월/9월 173
- ^ 레이보 SP, 메이플토프트 RJ 1998년북미에서 냉동 보존된 소의 배아를 직접 옮깁니다.인: 텍사스 주 샌안토니오, 1998년 제17회 AETA 연차총회 의사록.텍사스 주 샌안토니오: AETA. 페이지 91-98.
- ^ Voelkel SA, Hu YX (1992). "Direct transfer of frozen-thawed bovine embryos". Theriogenology. 37 (3): 23–37. doi:10.1016/0093-691x(92)90245-m. PMID 16727070.
- ^ Hasler JF, Hurtgen PG, Jin ZQ, Stokes JE (1997). "Survival of IVF-derived bovine embryos frozen in glycerol or ethylene glycol". Theriogenology. 48 (4): 563–579. doi:10.1016/s0093-691x(97)00274-4. PMID 16728153.
- ^ Binoy Sebastian Vetic, Kuruvilla Varghese, K.무랄리다란에틸렌 글리콜 동결 배지의 배아 동결 보존과 열대 교배 소의 직접 이동, 개요: 제9회 동물 번식 생명공학 국제대회
- ^ 레이보 SP, 메이플토프트 RJ 1998년북미에서 냉동 보존된 소의 배아를 직접 옮깁니다.인: 텍사스 주 샌안토니오, 1998년 제17회 AETA 연차총회 의사록.텍사스 주 샌안토니오: AETA. 페이지 91-98.
- ^ Stroud B (2012). "The year 2011 worldwide statistics of embryo transfer in domestic farm animals". IETS Newslet. 50: 16–25.



