체외 성숙
In vitro maturation시험관내 성숙(IVM)은 난포와 내부 난모세포의 내용물을 시험관내 성숙시키는 기술이다.체외수정(IVF)과 결합해 난소 자극 없이 임신할 수 있다.
역사
1935년 핀커스 앤 엔즈만은 미성숙한 토끼 난모세포에 대한 첫 번째 실험을 실시하여 체외 자연 성숙과 [1]수정을 보여주었다.그들은 정상적인 모낭 환경과 격리된 [1]상태에서 성숙이 일어난다는 것을 보여주었다.1965년 에드워즈는 쥐, 양, 소, 돼지, 붉은털 원숭이와 인간에 [2][3]대한 IVM 연구를 계속했다.1991년까지 IVM에 이어 IVM을 사용하여 첫 번째 [4]임신을 기록했고 1994년에는 다낭포성 난소증후군 환자의 IVM 난모세포를 사용하여 첫 번째 출산을 기록하여 PCOS 환자의 난모세포가 [5]성숙할 수 있음을 강조하였다.
배경
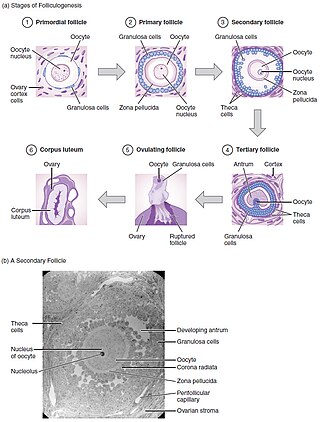
태아기 동안 발현이 일어나는데, 태아기 동안 태아기 세포는 태어나기 몇 주 전까지 유사분열을 거치며 발육을 형성한다.그리고 나서 이것들은 원시 난포 안에서 [6]난모세포를 형성하기 위해 감수분열을 시작한다.이 모낭은 편평한 과립전세포로 둘러싸인 난모세포로 구성되어 있다.아기들은 1백만에서 2백만 개의 원시 모낭을 가지고 태어나고, 사춘기가 되면 약 30만 [6]개의 모낭을 갖게 된다.이러한 원시 난포 중 약 400개의 성숙한 난모세포만이 방출되어 잠재적으로 수정될 수 있으며, 나머지는 폐쇄가 [7]진행 중이다.
난모세포의 '숙성'은 '난모세포가 수정될 능력을 획득하여 배아 발생'[8]을 겪는 과정이다.
모낭형성은 난포가 성숙하는 메커니즘이다.이것은 생체 내에서 수개월이 걸릴 수 있으며 원시 난포 성장과 [8]분화를 수반한다.
감수분열 [8]I의 전기에 멈춘 1차 난모를 포함한 원시 난포는 입방체형 과립상 세포를 포함한 1차 난포로 발전한다.2차 난포는 소수의 과립세포층 및 테카층으로 형성된다.마지막으로 배란 전에 모낭액으로 채워진 [6]항낭을 포함한 제3의 모낭을 형성한다.이 작은 전모낭들 중, 1은 지배적이고 배란할 것입니다(단일배란종).배란기 동안, 1차 난모세포는 신호에 반응하여 감수분열을 재개할 것이고,[3] 중생기 감수분열 II에서 멈춰 수정 준비가 될 것이다.우성 난포는 성숙한 난모세포를 포함하고 있다.모낭발달은 성선도트로핀, LH 및 FSH의 직접 통제 하에 있다.이들은 세포 내 보조 전달자로 cAMP를 사용하며, 성장 인자와 사이토카인 또한 생체 [7]내 발달에 영향을 미친다.
시험관내 성숙을 통해 모낭형성과 발아 후기는 난소 밖에서 모방되어 이러한 과정을 위한 조건을 재현하려고 한다.
기술
모낭이 초기 제3단계 또는 전엽단계에 도달한 경우 [9]IVM을 수행할 수 있습니다.
첫째, 난모세포는 피험자로부터 얻을 필요가 있다.이 타이밍은 환자가 속한 주기의 단계에 따라 달라지며, 일반적으로 초음파 [10]검사를 사용하여 모니터링됩니다.프라이밍을 사용하지 않을 경우 가장 큰 모낭의 [9]크기가 약 10mm일 때 난모세포를 얻는다.
사람의 경우 정확성을 높이기 위해 초음파를 사용하여 흡인 바늘로 이를 수행할 수 있습니다.성숙한 모낭을 흡입하는지 미성숙한 모낭을 흡입하는지에 따라 프로토콜이 약간 다릅니다.두 절차 모두 흡인 압력이 감소하지만 정도는 다양합니다.또한,[10] 추출액에서 엽이 훨씬 작고 잘 보이지 않기 때문에 미성숙한 엽을 회수할 때 흡인물을 여과하는 것이 더 중요하다.
프라이밍은 난모세포가 회복되기 전에 모낭자극호르몬(FSH) 또는 인간 융모막성 성선호르몬(hCG)으로 프라이밍되는 과정이다.hCG는 다낭포성 난소증후군을 가진 여성들에게 중요하다.이것은 난자 세포 주위에 적운의 팽창 또는 분산 패턴을 초래하여 모낭액 내에서 식별을 용이하게 합니다.이는 난모세포의 [7]성숙과 품질 향상으로 이어진다.그러나 hCG 프라이밍의 임상적 효과에 대한 증거는 여전히 부족하다.[11]IVM이 처음 도입되었을 때 성공적인 임신은 낮았고, 이는 난소 프라이밍의 [10]사용으로 이어졌다.
이 기술은 양,[12] 돼지[13] 그리고 다른 동물들에게도 사용된다."동물"을 참조하십시오.
난모세포 분류
난모세포는 적혈구 수 등 상태에 따라 분류된다.최상의 난모세포는 시험관내 수정기법을 [12]사용하여 이식되기를 바라며 성숙하도록 선택된다.
배지에서 배양
난모세포는 고나도트로핀, 성장인자 및 [10]스테로이드와 같은 난모세포 생존에 중요한 영양소를 포함한 배지에서 배양된다.이것들은 클리닉과 연구소에 따라 다르다.McLaughlin 등은 인간의 난소조직을 생체검사하여 다단계 배양 [14]시스템을 통해 단층 난포에서 메타기 II로 10%의 성숙률을 달성하였다.
시험관내 수정
난모세포가 충분히 성숙하면 시험관내 수정(IVF)으로 알려진 시험관내 수정이 가능하다.또한 세포질 내 정자 주입(ICSI)과 같은 기술을 사용하여 수정 성공 가능성을 개선할 수 있으며, 첫 번째 극체 압출 [15]후 최소 1시간(및 최적으로 2-4시간) 후에 수정이 수행되어야 한다.체외 성숙 난모세포 중 ICSI로 수정한 난모세포는 성공률이 25-40%[16]인 IVF에 비해 60-80%이다.
몇몇 정상출산은 이미 작은 초기 3차 모낭을 채취하여 체외에서 성숙하게 한 후 수정함으로써 이루어졌다.그러나 아직 초기 3단계에 이르지 못한 모낭의 경우 IVM은 아직 개발 중입니다.난모세포와 모낭의 나머지 세포에는 많은 세포 변화가 있기 때문에 매우 민감합니다.단, 난소조직의 슬라이스에서 성장시킴으로써 원순모낭을 체외의 2차 모낭으로 성숙시킬 수 있다.그 후 2차에서 초기 3차 단계로 이어지는 성숙도는 [16]시험관에서 지지될 수 있다.과립세포와 난모세포의 광선조사가 [17]IVM을 촉진할 수 있다고 제안되었다.
임상 응용 프로그램
체외 성숙은 다낭성 난소 증후군(PCOS), 높은 전모낭 수 및 난소 [18][19]과민반응을 포함한 불임 문제를 가진 환자에게 전형적으로 사용되는 보조 생식 기술이다.그러나 최근에는 성선독성 [18]치료와 관련된 치료를 받은 암 환자의 생식력 보존과 같은 분야에서도 IVM이 널리 사용되고 있다.IVM을 [19]사용하는 산모들로부터 기록된 1000명 이상의 정상 출산이 있었다.
다낭성 난소 증후군
PCOS는 여성 번식과 관련된 내분비계 기능 장애와 관련된 흔한 질환이다.PCOS는 호르몬 기능 장애, 안드로겐 과잉(테스토스테론 등) 및 잦은 무배란 생리 [20]주기를 초래할 수 있는 자궁 내분비축의 불일치를 포함한다.그러므로, PCOS를 앓고 있는 여성들이 [20][21][22]임신을 하기 위해 도움을 필요로 하는 것은 흔한 일이다.이러한 환자에게서 IVM은 난모세포를 성숙시키고 [20][21]수태를 돕는 데 사용될 수 있다.PCOS 환자에게 IVM을 대체하면 OHSS의 위험이 제거되고 치료 비용이 절감된다는 연구 결과는 거의 없다.같은 그룹은 PCOS 환자의 IVM과 IVM의 치료 결과를 비교하기 위해 소급 분석 연구를 수행했다.그들은 또한 IVM 그룹에서 [23]임신율, 이식율, 그리고 이식된 배아의 수가 상당히 증가했다는 결론을 내렸다.
난소 과민 자극의 대안
보조 생식에 체외 성숙을 사용하는 것은 표준 ART 시술보다 장점이 있다.전형적인 체외수정 관행에서는 제어된 난소과잉자극이 수행되며, 이 경우 환자에게 성선도트로핀의 초생리학적 레벨이 투여되어 정상적인 생리학적 [19]능력 이상의 속도로 난모세포가 중기II로 성숙하도록 유도한다.이 방법은 여러 가지 면에서 불리할 수 있습니다.그것은 매우 비용이 많이 들고, 복잡해질 수 있으며, 또한 난소과자극증후군(OHSS)[19][21]과 같은 바람직하지 않은 부작용을 일으킬 수 있다.난소 과민 자극은 2%의 경우에 심각한 OHS를 일으킬 수 있다.OHSS는 호흡기 질환, 신장 장애, 심지어 [19]뇌졸중까지 포함한 심각한 결과를 초래할 수 있다.PCOS 환자들과 젊은 여성들은 OHSS에 [21]걸릴 위험이 높다.이러한 여성들에게는 기존의 체외수정을 [19][21]사용하는 것보다 체외수정을 사용하는 것이 훨씬 더 유익할 수 있다.
IVM에서는 여성의 전모낭에서 미성숙 난모세포를 제거한 후 고나도트로핀이 [19]풍부한 배양액에서 체외 성숙시킨다.따라서 이것은 고나도트로핀 [21]자극의 필요성을 부정(또는 현저하게 감소)한다.
IVM은 완전히 완벽한 기술은 아닙니다.임신율은 표준 체외수축률보다 체외수축률이 낮다.IVM을 받은 산모에게서 태어난 아기가 나중에 [19]건강상의 문제(예: 발달상의 문제)가 있는지 여부에 대한 연구도 필요하다.
에스트로겐 관련 혈전 또는 심각한 심혈관 질환의 개인 또는 가족력이 있는 여성도 IVM의 혜택을 받을 수 있다.기존의 체외수정은 난소의 과잉자극을 통해 과립세포 에스트로겐 [19]생성의 자극을 통해 에스트로겐의 대량합성을 촉진할 가능성이 있기 때문이다.
난소 조직 동결 보존
난소조직 저온보존은 여성 불임의 원인이 될 수 있는 화학요법을 받기 전과 같은 불임 보존 방법이나 난모세포가 고령에 기능을 정지하는 경우의 미래 자원으로 사용할 수 있다.따라서 난소조직 저온보존은 난소과잉자극을 사전에 통제해야 하는 난소세포 저온보존의 대안이다.체외 성숙은 난소 조직의 난모세포를 [14]체내에 외과적으로 재삽입하는 대안으로 체외 수정을 위해 직접 사용할 수 있게 한다.
빈 모낭 증후군
IVM은 또한 빈 모낭 증후군(EFS)으로 진단된 여성 환자들에게 중요한 고려사항이 될 수 있다.EFS에서 성숙한 난포에서 난모세포가 추출되지 않는다. 고나도트로핀의 초생리학 수준 적용에도 불구하고 말이다.여성은 각 [21]라운드에서 전체(또는 거의 전체) 기능 상실이 있는 여러 라운드의 체외수정을 거친 후 EFS로 진단할 수 있다.
구조.
Rescue IVM은 표준 체외 성숙의 변형으로, 표준 체외 과민 자극에 2차적으로 환자에게서 제거된 미성숙 난모세포를 성숙시키는 시도를 포함한다.따라서, 더 많은 난모세포가 발달적으로 생존할 수 있는 발달 단계로 성숙하도록 허용한다.그러나 구조 IVM은 난모세포가 상당한 수준의 고나도트로핀에 노출되었음에도 불구하고 생체 내에서 충분히 성숙하지 않은 경우 성숙장애와 발달상 [19]제한적인 가능성을 나타낼 수 있다.
동물에서
IVM은 또한 버팔로,[34] 들소,[35] 물고기,[36] 사자,[37] 호랑이[37],[37] 표범과 같은 야생 종뿐만 아니라 생쥐,[24] 고양이,[25][26] 개,[27][28] 돼지,[29] 양,[30] 말[31], 소를[32][33] 포함한 가축들에게도 사용되어 왔다.동물의 난모세포를 원래 난소폐쇄증으로 복구하는 능력은 연구자, 환경보호론자 및 농업에 의해 학술적 목적이나 번식 시스템 개선을 위해 사용될 수 있다.
연구에서 IVM은 특정 조건 하에서 난모세포의 발달능력을 이해하거나 그 발달기간의 특정 생식생물학을 이해하기 위해 동물에 대해 수행될 수 있다.다른 종의 IVM도 일부 동물이 인간과 관련된 생식 [38]생물학을 연구하기 위한 모델로 사용되기 때문에 수행된다.이 연구는 종종 체외 시스템의 성공률을 향상시키고/또는 체내 생식력 향상을 목표로 수행된다.
또한 생물의학 연구를 위한 CRISPR/Cas9, TALENs 및 ZFNs와 같은 혁신적인 유전자 편집 기술을 사용하여 트랜스제닉 동물의 생성과 같은 후속 생명공학 응용 분야에도 사용될 수 있습니다.CD163 및 CD1D 유전자가 녹아웃된 유전자 [39]조작 돼지를 예로 들 수 있다.이러한 돼지가 만들어진 방법 중 하나는 체외에서 숙성된 수정 난모세포에 CRISPR/Cas9 시스템을 주입하는 것이었다.
농업에서 IVM은 보통 IVM 또는 인공수정 전에 군집 내 특정 동물의 바람직한 특성을 보존하고 계절적 교배의 결과로 생산량이 감소하는 것을 방지하기 위한 수단으로 행해진다.소 등의 축산종에서는 배아를 [40]시험관내 생산하기 전에 살아있는 암수의 난소에서 경질 난모세포 회복을 반복할 수 있다.
가축이 아닌 동물에서 IVM은 유전적 [41]다양성을 유지하면서 멸종위기에 처한 종들의 보존에도 사용될 수 있다.그러나 제한된 자원과 보조 생식 기술의 특정 종 특성으로 인해, IVM과 같은 기술의 적용은 아직 가축화되지 않은 [41]동물에게 드물다.
성공률 및 향후 사용
Segers I et al. (2015)의 실험에서, 실험실 난소 절제 검체에서 회수된 난모세포의 IVM 후 전체 성숙률은 36%였다.성숙률은 환자의 나이와 IVM의 지속 시간과 관련이 있다.배아 저온 보존을 가진 8쌍의 경우, 65%의 수정률이 있었다.7/8 커플에서 적어도 하나의 양질의 3일째 배아가 저온 보존되었습니다.이 실험은 극저온 보존 전 난소 피질 처리 과정에서 얻은 난모세포의 IVM이 생식력 [42]손실 위험에 있는 환자에게 유망한 솔루션임을 보여준다.
시험관내 배아 생산의 성공은 효율적인 난모세포 회수 기술의 사용에 달려 있으며, 최상의 결과는 복강경 [43]흡인에 의해 얻어졌다.
제한 사항
IVM 사이클에서 출생한 산부인과 및 신생아 주기의 결과는 ICSI [44]치료와 유사하다.하지만, IVM은 침습적 기술의 사용을 수반하며, 이것은 산모에게 해를 끼칠 수 있다.또한 IVM의 발생학적 결과는 [45]확인되지 않았다.IVM 아동의 건강 상태에 대한 보다 포괄적인 평가는 더 큰 규모의 선행 [44]연구를 요구할 것이다.암 환자의 저온 보존 IVM 난모세포의 잠재성은 아직 알려지지 않았다.불임 보존(FP) 후보에서 동결된 IVM 난모세포의 최적 수는 알려지지 않았다.불임 PCOS 여성의 FP 난모세포는 난소 자극 후 회복된 난모세포에 비해 능력이 저하되었다.IVM 후 난모세포의 저온 보존 FP 전략은 난소 자극이 불가능한 [46]경우에만 고려되어야 한다.
정상배란성 여성의 경우 IVM 성공률이 기존 난소자극요법보다 낮으며 이식 및 임신률이 낮다.IVM은 차선이므로 여러 요인에 의해 영향을 받습니다.그러나 IVM은 보조 생식 치료에 대한 보다 온화한 접근법이며 특정 조건에 대한 대체 절차입니다.정확한 환자 선택을 통해 IVM [44]임상 결과를 개선할 수 있습니다.
개선점
저온 보존 난모세포의 IVM은 암환자의 긴급한 출산력 보존에 도움을 줄 수 있다.그러나 이 결과에 대한 데이터는 불충분합니다.배양 조건을 개선하면 IVM 난모세포의 [47]성숙 속도와 잠재력이 증가할 수 있다.
이 밖에도 마우스 난모세포에서는 생식낭(GV)의 유리화 중 I-카르니틴(LC) 보충과 그에 따른 IVM이 핵 성숙을 향상시키고 MII 난모세포의 감수성 방추 집합체 및 미토콘드리아 분포도 개선하였다.하지만, 태아의 발달과 태아가 대리 암컷으로 옮겨간 후 건강한 자손의 탄생에서 이러한 이점을 증명하는 자료는 현재까지 없다.그러나 이 프로토콜은 [48]IVM 중에 유리화된 인간 난모세포와 배아의 품질을 잠재적으로 개선할 수 있다.왕 X 외 연구진(2014)의 연구에 따르면, 고나도트로핀은 난모세포 성숙, 수정 및 체외 발달 능력에 영향을 미친다.시험관내 고나도트로핀에 대한 소 난모세포의 반응성은 최적의 난모세포 발달 능력을 위한 상대농도(FSH/LH)에 따라 달라진다.최적의 FSH/LH 농도는 치료용 임상 자극 프로토콜과 IVF 성공률을 [49]개선할 수 있다.
레퍼런스
- ^ a b Pincus G, Enzmann EV (October 1935). "The Comparative Behavior of Mammalian Eggs in Vivo and in Vitro: I. The Activation of Ovarian Eggs". The Journal of Experimental Medicine. 62 (5): 665–75. doi:10.1084/jem.62.5.665. PMC 2133299. PMID 19870440.
- ^ Edwards RG (October 1965). "Maturation in vitro of mouse, sheep, cow, pig, rhesus monkey and human ovarian oocytes". Nature. 208 (5008): 349–51. Bibcode:1965Natur.208..349E. doi:10.1038/208349a0. PMID 4957259. S2CID 4285338.
- ^ a b Edwards RG (November 1965). "Maturation in vitro of human ovarian oöcytes". Lancet. 2 (7419): 926–9. doi:10.1016/s0140-6736(65)92903-x. PMID 4165802.
- ^ Cha KY, Koo JJ, Ko JJ, Choi DH, Han SY, Yoon TK (January 1991). "Pregnancy after in vitro fertilization of human follicular oocytes collected from nonstimulated cycles, their culture in vitro and their transfer in a donor oocyte program". Fertility and Sterility. 55 (1): 109–13. doi:10.1016/s0015-0282(16)54068-0. PMID 1986950.
- ^ Trounson A, Wood C, Kausche A (August 1994). "In vitro maturation and the fertilization and developmental competence of oocytes recovered from untreated polycystic ovarian patients". Fertility and Sterility. 62 (2): 353–62. doi:10.1016/S0015-0282(16)56891-5. PMID 8034085.
- ^ a b c Dunlop CE, Anderson RA (2014-08-01). "The regulation and assessment of follicular growth". Scandinavian Journal of Clinical and Laboratory Investigation. Supplementum. 244 (sup244): 13–7, discussion 17. doi:10.3109/00365513.2014.936674. PMID 25083887. S2CID 13731131.
- ^ a b c Chian RC, Lim JH, Tan SL (June 2004). "State of the art in in-vitro oocyte maturation". Current Opinion in Obstetrics & Gynecology. 16 (3): 211–9. doi:10.1097/00001703-200406000-00003. PMID 15129050. S2CID 46231802.
- ^ a b c Hardy K, Wright CS, Franks S, Winston RM (2000). "In vitro maturation of oocytes". British Medical Bulletin. 56 (3): 588–602. doi:10.1258/0007142001903391. PMID 11255547.
- ^ a b Chang EM, Song HS, Lee DR, Lee WS, Yoon TK (June 2014). "In vitro maturation of human oocytes: Its role in infertility treatment and new possibilities". Clinical and Experimental Reproductive Medicine. 41 (2): 41–6. doi:10.5653/cerm.2014.41.2.41. PMC 4102689. PMID 25045627.
- ^ a b c d "IVF Worldwide". In Vitro Maturation. Retrieved 2016-09-27.
- ^ Son WY, Tan SL (2010). "Laboratory and embryological aspects of hCG-primed in vitro maturation cycles for patients with polycystic ovaries". Human Reproduction Update. 16 (6): 675–89. doi:10.1093/humupd/dmq014. PMID 20504873.
- ^ a b Wani NA, Wani GM, Khan MZ, Salahudin S (2000). "Effect of oocyte harvesting techniques on in vitro maturation and in vitro fertilization in sheep". Small Ruminant Research. 36 (1): 63–67. doi:10.1016/s0921-4488(99)00097-8.
- ^ Niwa K (1993). "Effectiveness of in vitro maturation and in vitro fertilization techniques in pigs". Journal of Reproduction and Fertility. Supplement. 48: 49–59. PMID 8145214.
- ^ a b
- McLaughlin M, Albertini DF, Wallace WH, Anderson RA, Telfer EE (March 2018). "Metaphase II oocytes from human unilaminar follicles grown in a multi-step culture system". Molecular Human Reproduction. 24 (3): 135–142. doi:10.1093/molehr/gay002. PMID 29390119.
- BBC 뉴스의 기타 기사 댓글:
- ^ Hyun CS, Cha JH, Son WY, Yoon SH, Kim KA, Lim JH (July 2007). "Optimal ICSI timing after the first polar body extrusion in in vitro matured human oocytes". Human Reproduction. 22 (7): 1991–5. doi:10.1093/humrep/dem124. PMID 17513319.
- ^ a b Hardy K, Wright CS, Franks S, Winston RM (2000-01-01). "In vitro maturation of oocytes". British Medical Bulletin. 56 (3): 588–602. doi:10.1258/0007142001903391. PMID 11255547.
- ^ Kannan S, Mehta A, Simha V, Reddy OK, Kaur BP, Onteru SK, Singh D (2014). "Photoinduction of granulosa cell and oocyte co-culture to influence in vitro maturation and fertilisation". Hypothesis. 12 (1): e7.
- ^ a b Khalili MA, Dehghan M, Nazari S, Agha-Rahimi A (March 2014). "Assessment of ovarian tissues autografted to various body sites followed by IVM in mouse". Iranian Journal of Reproductive Medicine. 12 (3): 199–204. PMC 4009574. PMID 24799880.
- ^ a b c d e f g h i j Vitek W, Robins JC (2013-10-01). "In vitro maturation". The Obstetrician & Gynaecologist. 15 (4): 215–219. doi:10.1111/tog.12050. ISSN 1744-4667.
- ^ a b c Ouandaogo ZG, Assou S, Haouzi D, Anahory T, Dechaud H, Hamamah S (2010). "Gene expression profile in human cumulus cells of immature and mature oocyte under in vivo maturation: clinical applications". Fertility and Sterility. 94 (4): S88. doi:10.1016/j.fertnstert.2010.07.338.
- ^ a b c d e f g Lee JE, Kim SD, Jee BC, Suh CS, Kim SH (December 2011). "Oocyte maturity in repeated ovarian stimulation". Clinical and Experimental Reproductive Medicine. 38 (4): 234–7. doi:10.5653/cerm.2011.38.4.234. PMC 3283078. PMID 22384448.
- ^ Dunaif A (December 1997). "Insulin resistance and the polycystic ovary syndrome: mechanism and implications for pathogenesis". Endocrine Reviews. 18 (6): 774–800. doi:10.1210/edrv.18.6.0318. PMID 9408743.
- ^ Shalom-Paz E, Holzer H, Son W, Levin I, Tan SL, Almog B (November 2012). "PCOS patients can benefit from in vitro maturation (IVM) of oocytes". European Journal of Obstetrics, Gynecology, and Reproductive Biology. 165 (1): 53–6. doi:10.1016/j.ejogrb.2012.07.001. PMID 22819571.
- ^ Martín-Coello J, González R, Crespo C, Gomendio M, Roldan ER (October 2008). "Superovulation and in vitro oocyte maturation in three species of mice (Mus musculus, Mus spretus and Mus spicilegus)". Theriogenology. 70 (6): 1004–13. doi:10.1016/j.theriogenology.2008.06.002. PMID 18640710.
- ^ Johnston LA, O'Brien SJ, Wildt DE (November 1989). "In vitro maturation and fertilization of domestic cat follicular oocytes". Gamete Research. 24 (3): 343–56. doi:10.1002/mrd.1120240310. PMID 2599509.
- ^ Goodrowe KL, Hay M, King WA (September 1991). "Nuclear maturation of domestic cat ovarian oocytes in vitro". Biology of Reproduction. 45 (3): 466–70. doi:10.1095/biolreprod45.3.466. PMID 1782295.
- ^ Mahi CA, Yanagimachi R (May 1976). "Maturation and sperm penetration of canine ovarian oocytes in vitro". The Journal of Experimental Zoology. 196 (2): 189–96. doi:10.1002/jez.1401960206. PMID 1271036.
- ^ Nickson DA, Boyd JS, Eckersall PD, Ferguson JM, Harvey MJ, Renton JP (1993-01-01). "Molecular biological methods for monitoring oocyte maturation and in vitro fertilization in bitches". Journal of Reproduction and Fertility. Supplement. 47: 231–40. PMID 8229931.
- ^ Motlik J, Crozet N, Fulka J (November 1984). "Meiotic competence in vitro of pig oocytes isolated from early antral follicles". Journal of Reproduction and Fertility. 72 (2): 323–8. doi:10.1530/jrf.0.0720323. PMID 6392543.
- ^ Szöllösi D, Desmedt V, Crozet N, Brender C (1988-01-01). "In vitro maturation of sheep ovarian oocytes". Reproduction, Nutrition, Development. 28 (4B): 1047–80. doi:10.1051/rnd:19880705. PMID 3244901.
- ^ Squires EL (April 1996). "Maturation and fertilization of equine oocytes". The Veterinary Clinics of North America. Equine Practice. 12 (1): 31–45. doi:10.1016/S0749-0739(17)30293-6. PMID 8726448.
- ^ Hensleigh HC, Hunter AG (June 1985). "In vitro maturation of bovine cumulus enclosed primary oocytes and their subsequent in vitro fertilization and cleavage". Journal of Dairy Science. 68 (6): 1456–62. doi:10.3168/jds.S0022-0302(85)80983-8. PMID 3926843.
- ^ Barile VL, Dell'Aquila ME, Cinone M, Minoia P (September 1990). "In vitro maturation and fertilization of follicular oocytes in cattle". Bollettino della Societa Italiana di Biologia Sperimentale. 66 (9): 899–906. PMID 2073391.
- ^ Totey SM, Singh G, Taneja M, Pawshe CH, Talwar GP (July 1992). "In vitro maturation, fertilization and development of follicular oocytes from buffalo (Bubalus bubalis)". Journal of Reproduction and Fertility. 95 (2): 597–607. doi:10.1530/jrf.0.0950597. PMID 1518014.
- ^ Cervantes MP, Palomino JM, Anzar M, Mapletoft RJ, Adams GP (October 2016). "In vivo and in vitro maturation of oocytes collected from superstimulated wood bison (Bison bison athabascae) during the anovulatory and ovulatory seasons". Animal Reproduction Science. 173: 87–96. doi:10.1016/j.anireprosci.2016.09.001. PMID 27601321.
- ^ Young G, Kagawa H, Nagahama Y (December 1982). "Oocyte maturation in the amago salmon (Oncorhynchus rhodurus): in vitro effects of salmon gonadotropin, steroids, and cyanoketone (an inhibitor of 3 beta-hydroxy-delta 5-steroid dehydrogenase)". The Journal of Experimental Zoology. 224 (2): 265–75. doi:10.1002/jez.1402240217. PMID 6961189.
- ^ a b c Rao BS, Mahesh YU, Suman K, Charan KV, Nath R, Rao KR (January 2015). "Meiotic maturation of oocytes recovered from the ovaries of Indian big cats at postmortem". In Vitro Cellular & Developmental Biology. Animal. 51 (1): 19–25. doi:10.1007/s11626-014-9802-x. PMID 25124872. S2CID 16289775.
- ^ Nikmard F, Hosseini E, Bakhtiyari M, Ashrafi M, Amidi F, Aflatoonian R (April 2017). "Effects of melatonin on oocyte maturation in PCOS mouse model". Animal Science Journal. 88 (4): 586–592. doi:10.1111/asj.12675. PMID 27530294.
- ^ Whitworth KM, Lee K, Benne JA, Beaton BP, Spate LD, Murphy SL, et al. (September 2014). "Use of the CRISPR/Cas9 system to produce genetically engineered pigs from in vitro-derived oocytes and embryos". Biology of Reproduction. 91 (3): 78. doi:10.1095/biolreprod.114.121723. PMC 4435063. PMID 25100712.
- ^ Lonergan P, Fair T (2016-01-01). "Maturation of Oocytes in Vitro". Annual Review of Animal Biosciences. 4: 255–68. doi:10.1146/annurev-animal-022114-110822. PMID 26566159.
- ^ a b Andrabi SM, Maxwell WM (June 2007). "A review on reproductive biotechnologies for conservation of endangered mammalian species". Animal Reproduction Science. 99 (3–4): 223–43. doi:10.1016/j.anireprosci.2006.07.002. PMID 16919407.
- ^ Segers I, Mateizel I, Van Moer E, Smitz J, Tournaye H, Verheyen G, De Vos M (August 2015). "In vitro maturation (IVM) of oocytes recovered from ovariectomy specimens in the laboratory: a promising "ex vivo" method of oocyte cryopreservation resulting in the first report of an ongoing pregnancy in Europe". Journal of Assisted Reproduction and Genetics. 32 (8): 1221–31. doi:10.1007/s10815-015-0528-9. PMC 4554385. PMID 26253691.
- ^ Padilha LC, Teixeira PP, Pires-Buttler EA, Apparício M, Motheo TF, Savi PA, et al. (April 2014). "In vitro maturation of oocytes from Santa Ines ewes subjected to consecutive sessions of follicular aspiration by laparoscopy". Reproduction in Domestic Animals = Zuchthygiene. 49 (2): 243–8. doi:10.1111/rda.12261. PMID 24313350.
- ^ a b c Fadini R, Mignini Renzini M, Guarnieri T, Dal Canto M, De Ponti E, Sutcliffe A, et al. (December 2012). "Comparison of the obstetric and perinatal outcomes of children conceived from in vitro or in vivo matured oocytes in in vitro maturation treatments with births from conventional ICSI cycles". Human Reproduction. 27 (12): 3601–8. doi:10.1093/humrep/des359. PMID 23042796.
- ^ Sánchez F, Romero S, De Vos M, Verheyen G, Smitz J (June 2015). "Human cumulus-enclosed germinal vesicle oocytes from early antral follicles reveal heterogeneous cellular and molecular features associated with in vitro maturation capacity". Human Reproduction. 30 (6): 1396–409. doi:10.1093/humrep/dev083. PMID 25904637.
- ^ Sonigo C, Simon C, Boubaya M, Benoit A, Sifer C, Sermondade N, Grynberg M (July 2016). "What threshold values of antral follicle count and serum AMH levels should be considered for oocyte cryopreservation after in vitro maturation?". Human Reproduction. 31 (7): 1493–500. doi:10.1093/humrep/dew102. PMID 27165625.
- ^ Grynberg M, Poulain M, le Parco S, Sifer C, Fanchin R, Frydman N (March 2016). "Similar in vitro maturation rates of oocytes retrieved during the follicular or luteal phase offer flexible options for urgent fertility preservation in breast cancer patients". Human Reproduction. 31 (3): 623–9. doi:10.1093/humrep/dev325. PMID 26759139.
- ^ Moawad AR, Xu B, Tan SL, Taketo T (October 2014). "l-carnitine supplementation during vitrification of mouse germinal vesicle stage-oocytes and their subsequent in vitro maturation improves meiotic spindle configuration and mitochondrial distribution in metaphase II oocytes". Human Reproduction. 29 (10): 2256–68. doi:10.1093/humrep/deu201. PMID 25113843.
- ^ Wang X, Tsai T, Qiao J, Zhang Z, Feng HL (June 2014). "Impact of gonadotropins on oocyte maturation, fertilisation and developmental competence in vitro". Reproduction, Fertility, and Development. 26 (5): 752–7. doi:10.1071/RD13024. PMID 23726536.