성소수자 재생산
LGBT reproduction
| 시리즈의 일부 |
| 성소수자 주제 |
|---|
| |
LGBT 생식은 레즈비언, 게이, 양성애자, 트랜스젠더(LGBT) 사람들이 보조생식술을 통해 생물학적 자녀를 갖는 것을 말합니다. 그것은 LGBT 입양을 포함한 더 넓은 문화적 현상인 LGBT 육아와 구별됩니다. 최근 수십 년 동안, 발달 생물학자들은 동성 생식을 촉진하기 위한 기술을 연구하고 개발해 왔습니다.[1][2]
증가하는 활동의 대상이 되는 명백한 접근법은 여성 정자와 남성 난자입니다. 2004년, 각인과 관련된 몇몇 유전자의 기능을 변경함으로써, 다른 일본 과학자들은 두 마리의 쥐 알을 결합하여 딸 쥐를[3] 생산했고, 2018년 중국 과학자들은 두 마리의 암컷 쥐 어미로부터 29마리의 암컷 쥐를 생산했지만, 두 마리의 아빠 쥐로부터 생존 가능한 자손을 생산할 수 없었습니다.[4][5] 가능성 중 하나는 피부 줄기세포에서 정자와 난자를 얻는 것입니다.[6]
보조 생식 기술에 대한 접근 부족은 LGBT 사람들이 경험하는 의료 불평등의 한 형태로 여겨져 왔습니다.[7]
냉동란
성소수자 여성들과 트랜스 남성들은 체외 수정을 통해 번식하기 위해 난자를 기증하기로 선택할 수 있습니다. 특히 트랜스 남성은 전환하기 전에 난자를 동결시키고, 때가 되면 여성 대리인이 난자와 파트너의 정자를 이용하여 아이를 낳도록 선택할 수 있습니다. 이것은 그들이 임신의 잠재적인 장애 유발 경험이나 더 나이가 많은 계란 수집을 위한 HRT의 중단을 피할 수 있게 해줍니다.[8][9]
에그뱅킹
난모세포(난자)의 동결보존은 체외수정 치료와 같이 호르몬 자극과 난모세포 회수를 필요로 하며, 그 후 난모세포는 유리화됩니다.[10] 난모세포의 유리화는 느린 냉동 난모세포보다 더 성공적인 것으로 밝혀졌습니다.[11] 난모세포 은행의 성공은 생식[12] 연령이 증가함에 따라 크게 감소합니다 난소 자극은 트랜스젠더 남성의 혈청 에스트라디올 수치를 증가시킬 것이며, 이에 대응하여 질 초음파 모니터링이 필요할 수 있으며, 에스트라디올 상승을 최소화하기 위한 전략에는 자극 중 아로마타제 억제제의 동시 사용이 포함됩니다.[13] 이전에 사춘기였던 트랜스젠더 남성의 난소 자극이 GnRH 작용제로 중단된 후 테스토스테론을 직접 투여하는 데 성공했다는 데이터는 없습니다.[13] 회수된 난모세포의 수나 테스토스테론의 시간별로 층화된 생식력 보존 후의 산아율을 비교한 데이터도 없습니다.[14]
난소조직은행
조직 샘플을 수집하기 위해 수술 절차가 필요하며, 자궁 절제술 및/또는 난소 절제술을 받는 경우 추가 수술 절차를 피하기 위해 일부 조직을 동시에 동결 보존하도록 선택할 수 있습니다.[10] 난소조직 동결보존은 성공적이었지만 지금까지 이 조직의 해동과 체외 성숙(IVM) 후 기록된 임신은 없었고, 성공적인 임신은 자가 이식 후에만 기록되었습니다.[15][10] 이 방법은 83명의 트랜스젠더 남성을 대상으로 한 한 연구에서 208개의 성숙한 난모세포 중 2개가 해동된 난소 조직에서 회수되어 "양질의" 배반포가 생성되었기 때문에 배반포 발달의 성공률이 매우 낮습니다.[14]
동결정자
시험관 내 수정이나 인공 수정의 목적으로 동성애자와 성전환 여성은 정자 기증을 선택할 수 있습니다. 마찬가지로, 여성들과 트랜스 남성들은 그들의 난자를 기증하기로 선택할 수도 있습니다.
트랜스 여성은 HRT 이전에 정자의 질이 낮을 수 있으며, 이는 동결할 생존 가능한 정자 샘플을 생성하는 데 문제가 될 수 있습니다.[16]
에스트로겐은 테스토스테론 수치를 억제하고 고용량일 경우 성욕과 기능, 생식력을 스스로 현저하게 방해할 수 있습니다.[17][18][19][20] 더욱이, 에스트로겐에 의한 생식선 기능의 파괴와 생식력은 장기간 노출된 후 영구적일 수 있습니다.[19][20][21]
비카루타미드와 같은 비스테로이드성 항안드로겐은 테스토스테론 수치를 억제하고 시프로테론 아세테이트 및 GnRH 조절제와 같은 이러한 기능을 크게 방해할 수 있는 항안드로겐에 비해 성욕, 성기능 및/또는 생식력을 보존하기를 원하는 트랜스젠더 여성에게 선택 사항이 될 수 있습니다.[22][23][24] 그러나 에스트로겐은 테스토스테론 수치를 억제하고 고용량일 경우 그 자체로 성욕과 기능 및 생식력을 현저하게 방해할 수 있습니다.[25][26][27][28] 더욱이, 에스트로겐에 의한 생식선 기능의 파괴와 생식력은 장기간 노출된 후 영구적일 수 있습니다.[27][28]
정액은 자위를 통해 채취할 수 있지만, 자위나 사정이 괴로웠거나 저안드로겐증에 이차적으로 발기부전이나 사정장애가 있을 수 있는 사람들을 위한 대안이 있습니다. 기능 장애가 있는 사람들을 위한 옵션은 음경 진동 자극과 전기 사정입니다.[13] 사정을 하고 싶지 않거나 올리고정맥 또는 아조정맥이 있는 사람은 더 침습적이지만 고환 정자 흡인 또는 미세 수술 정자 추출을 추구할 수 있습니다.[13] 현재 트랜스젠더 여성을 대상으로 다양한 정자 수집 옵션의 허용 가능성이나 성공률을 평가한 연구는 없습니다.[13] 또한 에스트라디올 및/또는 항안드로겐을 복용하는 트랜스젠더 여성의 경우 정상적인 정자 형성이 재개되기 전(발생하는 경우) 호르몬 치료 약물을 중단하는 데 필요한 기간이 불분명하며, 이 기간 동안 테스토스테론 생산이 재개되어 원치 않는 남성화 효과를 일으킬 수 있습니다.[13]
정자 저장 및 선택
예비 성소수자 부모들은 아기를 키우기 위해 정자 은행에서 정자를 골라야 할 수도 있습니다. 정자는 한 파트너로부터 나올 수 있는데, 그들의 전환 전에 냉동되었거나, 남성 장기가 기능하는 파트너의 경우 최근에 생긴 것일 수 있습니다. 다른 경우에는 개인 정자 기증자에게서 나올 수 있습니다. LGBT는 기증자의 정자를 어디서 얻는지 신중하게 고려해야 합니다. 각 주의 법은 다르지만, 많은 미국의 주들은 획일적인 부모법(UPA)의 형태를 채택하고 있습니다.[29] 대부분, 그러나 모든 주는 받는 사람이 결혼한 여성이고 의사가 관련되어 있는 한 익명의 정자 기증자로부터 의도된 부모에게 친권을 이전하지는 않습니다.[29] 이러한 법을 준수하지 않으면 정자 기증자의 친권을 종료하지 못할 수 있습니다. 민간에서 직접 기증한 것으로 알려진 정자 기증자들에게 양육비 지급을 요구한 법정 사례가 있었습니다.[29][30][31][32] 예를 들어, 이러한 법률 중 캘리포니아 보조생식법을 참조하십시오. 호주에서는 정자 기증자가 자녀의 생명에 관여하는 것이 그들에게 친권을 부여한다는 법적 선례가 있었습니다(Masson v Parsons).[33]
직접적인 민간 기부 대신에 정자 은행에서 정자를 구입하여 불임 치료에 개인적으로 사용하는 것이 가능합니다. 정자은행은 가격뿐만 아니라 실무적인 측면에서도 매우 다양할 수 있으며(즉, 정자를 기증할 수 있는 사람, 횟수 등) 다양한 서비스를 제공할 수 있습니다. 미국의 주요 정자 은행으로는 페어팩스 크라이오뱅크, 캘리포니아 사이로뱅크, 크라이오스 인터내셔널, 시애틀 정자 은행, 엑스텍스 등이 있습니다.
인공수정
다양한 성 정체성과 성적 지향을 수용하기 위해 기증된 정자에서 LGBT 임신을 인공 수정을 통해 할 수 있습니다. 기증받은 정자를 임신 중인 자궁의 몸 안에 넣는 것입니다.
이러한 시술의 시기는 성공적인 수정을 위해 매우 중요합니다.[34] 왜냐하면 수정이 가능한 창은 배란 전 5일, 그리고 배란 후 5일이기 때문입니다.[35] 성공 확률을 높이기 위해 종종 배란 키트, 초음파 또는 혈액 검사를 사용하여 기본 체온 검사, 질 점액의 색과 질감, 자궁경부의 코의 부드러움에 주목하여 생리 주기를 면밀히 관찰합니다.[35] 인공수정의 성공률을 높이기 위해 난소자극(OS)이라 불리는 자극적인 주기를 만드는 약물을 사용할 수 있습니다.
자궁내수정(IUI)
배란 전에 황체 형성 호르몬(LH)이 급증하여 IUI 시술 시간을 측정할 수 있습니다. 데이터에 따르면 LH 서지 감지 후 1일 후 IUI를 수행해야 합니다.[34] 미국의 대부분 진료소는 소변에서 LH를 검출하는 배란 예측 키트 검사 양성 후 아침에 IUI를 시행합니다.[34] LH 모니터링의 대안은 난소 난포 크기의 초음파 모니터링에 이어 신체의 LH 서지를 모방하고 최종 난포 성숙 및 파열(36-48시간 후)을 유발하는 외인성 인간 융모막 성선 자극 호르몬(hCG)을 사용한 트리거 샷입니다. 트리거 샷은 일반적으로 우세 난포가 18-20mm에 도달할 때 투여됩니다.[34] hCG 투여 후 IUI의 권장 시점은 24-40시간입니다.[34] 고전적인 용량의 FSH로 자극된 IUI 사이클은 10-40%[36] 범위의 높은 비율로 다태 임신을 하는 비율을 가지고 있습니다. 메타 분석에서는 가정 내 LH 모니터링과 시간 IUI 사이에 임신 결과에 차이가 없음을 보여주었습니다.[34]
약물을 사용하지 않고 IUI를 수행할 수 있습니다. IUI는 임신한 사람이 자궁경부 폐쇄증, 자궁경부염, 자궁내막염 또는 양측관 폐색이 있거나 정자 기증자가 무월경 또는 심각한 과립증이 있는 경우 권장되지 않습니다.[36] IUI 전에 정자는 "세척"되는데, 이는 프로스타글란딘으로 인한 자궁 수축을 피하기 위해 정액 혈장을 제거하는 데 필요합니다.[36] 가공되지 않은 정액으로 수정하는 것도 골반 감염과 관련이 있습니다.[36]
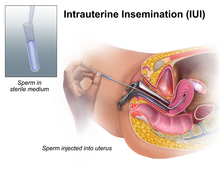
자궁 내 수정(IUI)은 수정체를 이용하여 질을 열고 카테터로 세척된 정자를 자궁에 직접 주입하는 것을 포함합니다.[37] 이런 방식으로 수정한다는 것은 정자가 점액층으로 덮인 자궁경부를 헤엄칠 필요가 없다는 것을 의미합니다. 이 점액층은 정자의 이동 속도를 늦출 수 있고 자궁으로 들어가기 전에 많은 정자가 소멸될 수 있습니다.[38] 기증자 정자가 ICI 수정에 사용될 경우 점액 투과 능력을 검사하는 경우가 있는데, 정자가 자궁경부를 통과할 가능성이 낮으면 IUI가[citation needed] ICI보다 더 효율적으로 정자를 전달할 수 있기 때문입니다. IUI 수정은 성교 후에 일어나는 것과 같은 방식으로 나팔관의 외부 부분에서 자연적으로 이루어집니다.
이중 IUI의 이점은 레즈비언이나 독신 여성과 같이 기증자 정자를 사용하는 문서화되지 않은 불임 환자에게서는 발견되지 않았습니다.[39] 일반적으로 IUI 주기당 임신 성공률은 약 12.4%[40]입니다. 2021년 연구에 따르면 IUI를 받는 레즈비언 여성의 임상 임신률은 13.2%, 평균 임신 횟수가 3.6회인 경우 성공률은 42.2%였습니다.[40] IUI는 ICI보다[41][42] 더 효과적인 것으로 보고되었지만, 이것은 두 절차의 출산율 사이에 유의미한 차이를 확인할 수 있는 강력한 증거가 없다는 일부의 이유로 이의를 제기했습니다.[43] IUI는 동결 및 해동 후 정자 운동성 감소를 보상할 수 있는 ICI보다 정자를 난모세포에 가깝게 만들기 때문에 IUI가 더 효과적이라고 추측됩니다.[42] IUI에는 자궁내막염, 경련, 출혈 및 아나필락시스(거의 없음)의 위험이 포함됩니다.[41] 체계적인 검토와 메타 분석으로는 자궁 내 수정 후 침상 안정이 임신율을 효과적으로 증가시킨다는 것을 입증하지 못했습니다.[44]
자궁내수정(ICI)
IUI와 매우 유사한 자궁내수정(ICI)은 성관계 시 음경에 의해 질로 들어가는 정액의 자연 사정을 가장 가깝게 모방하는 인공수정의 방법입니다. ICI는 인공 수정의 가장 간단한 방법이며 개인 실습 대신 가정에서 개인적으로 수행할 수도 있습니다. ICI는 자궁경부 입구에서 [45]보통 바늘 없는 주사기를 통해 질로 정액을 유입하는 과정입니다. ICI 수정에 사용되는 정자는 개인 기증자의 생 정액을 사용할 수 있도록 정액을 제거하기 위해 '세척'할 필요가 없습니다. ICI나 IUI용으로 준비된 정자은행에서 공급하는 정액도 ICI용으로 적합합니다. 후향적 코호트 연구에 따르면 해동 후 총 운동성과 총 운동성 수(TMC)는 지속적인 임신율과 관련이 있으며, 해동 후 총 운동성에서 최고의 ICI 결과는 ≥20%, 총 운동성 수(TMC)는 ≥8 × 106입니다.
ICI 중에는 바늘 없는 주사기에서 공기가 배출되고, 이 주사기는 정액으로 채워집니다. 이를 위해 더 넓고 끝이 더 둥근 특수 제작된 주사기를 사용할 수 있습니다. 플런저를 앞으로 부드럽게 누르면 더 이상의 밀폐된 공기가 제거됩니다. 받는 사람은 등을 대고 누워 주사기를 질 안으로 삽입하여 끝이 자궁경부 입구에 최대한 가까이 가도록 합니다. 이를 위해 질경구를 사용할 수 있으며 자궁경부 입구에 최대한 가깝게 정액이 전달되도록 주사기 끝에 카테터를 부착할 수 있습니다. 그런 다음 플런저를 천천히 앞으로 밀어내고 주사기 안의 정액을 질 속으로 부드럽게 비웁니다. 안전과 최상의 결과를 위해 주사기를 천천히 비우는 것이 중요합니다. 시술의 목적은 질[citation needed] 내 정액의 자연적인 침전물을 최대한 가깝게 복제하는 것입니다. 제거하기 전에 주사기(및 카테터를 사용하는 경우)를 몇 분 동안 제자리에 놔둘 수 있습니다. 수정 후 수정된 정자는 자궁 경부를 통해 자궁으로, 그리고 그곳에서 나팔관으로 마치 정자가 성교를 통해 질에 침착된 것처럼 자연스러운 방식으로 헤엄치게 됩니다. 주사기 대신 잉태 캡도 사용할 수 있습니다.


체외수정
일부 성소수자들은 번식을 위해 인공 수정 대신 시험관 내 수정을 사용하는 것을 선택할 수 있습니다. 접합체는 기증된 난자와 기증된 정자로 실험실에서 만들어지는데, 둘 다 정자 은행, 난자 은행 또는 한 파트너와 같은 다른 출처에서 나올 수 있습니다. 그런 다음 접합체를 자궁에 이식합니다. 자궁을 운반하는 것은 대리(게이 남성 또는 다른 불임 부부) 또는 한 명의 파트너(여성 또는 트랜스 남성)일 수 있습니다.
표준 IVF
표준 체외수정은 난자를 난소에서 떼어내 체외 수정한 뒤 자궁에 착상하는 과정입니다.[47] 이 과정이 난소 자극, 난자 수집, 수정 및 배아 이식을 포함하여 효과가 있는지 확인하는 많은 단계가 있습니다. 난소가 평소보다 더 많은 난자를 생산하도록 자극하려면 의사가 처방한 특정 호르몬을 복용해야 합니다.[47] 그런 다음 초음파 유도 흡인 바늘을 사용하여 알을 수집합니다. 일단 알이 몸 밖으로 나오면, 수정의 희망으로 배양 접시에 정자와 섞입니다. 사용된 정자는 모든 정자 기증자(정자 은행 또는 파트너와 같은 알려진 기증자)로부터 얻을 수 있습니다. 배아가 형성되면 배양기에 2~5일 동안 남아 계속 성장하고 분열합니다. 이 단계에서 배아 전단계는 종종 건강한 아기로 발전할 수 있도록 유전자 검사를 받습니다. 배아가 건강하다고 판단되면 다음 단계는 착상입니다.[47] 배아는 자궁으로 옮겨지는데, 자궁경부를 통해 자궁강으로 카테터를 안내하는 초음파를 사용합니다.[47]
역IVF
동반자 생식 또는 co-IVF는 여성 생식 기관을 소유한 부부가 함께 사용하는 가족 구성 방법입니다. 이 방법은 난자를 난소에서 제거하고 실험실에서 수정한 후 자궁에 하나 이상의 배아를 넣어 희망적으로 임신을 만들어내는 방법인 체외수정(IVF)을 사용합니다. 상호 체외수정은 두 명의 여성이 관련되어 있다는 점에서 표준 체외수정과 다릅니다: 한 파트너로부터 난자를 채취하고 다른 파트너는 임신을 합니다.[48] 이런 식으로 난자를 기증한 체외수정과 기계적으로 과정이 동일합니다.[49][50] 이 과정을 이용하면 각 파트너가 아이의 친모임을 보장할 수 있지만,[51] 엄밀한 의미에서 한 명의 엄마만이 유전적 관점에서 친모이고 다른 한 명은 대리모입니다. 그러나 이 관행은 LGBT 입양보다 상징적인 비중이 크고 입양보다 모자 사이에 더 강한 유대감을 형성할 수 있습니다.
2019년 연구에서는 체외수정 가족과 비교하여 난자 공여 가족 간의 영아-부모 관계의 질을 조사했습니다.[52] 유아들은 6개월에서 18개월 사이였습니다. 본 연구는 부모발달면접(PDI)과 관찰평가를 통해 대표성 수준에서는 가족유형 간에 거의 차이가 없는 반면 관찰 수준에서는 가족유형 간에 유의한 차이를 발견하였습니다.[52] 난자 기증 산모는 체외수정 산모에 비해 민감도와 구조화 정도가 낮았고, 난자 기증 영아는 체외수정 영아에 비해 정서적으로 덜 반응하고 참여하는 것으로 나타났습니다.[52] [53] 그리고 나서 난자는 기증자의 정자로 수정되어 배아를 만들고, 그 중 하나는 두 번째 사람의 자궁으로 옮겨질 수 있습니다. 이와 같이 한 파트너는 유전물질에 기여하고 두 번째 파트너는 모성환경에 기여하여 두 파트너 모두 태아와 아이의 발달에 지대한 영향을 미칠 수 있습니다.[53] 양쪽 파트너가 유전물질을 기여하지 않을 때 부모가 되는 것을 둘러싼 법은 복잡하고 주별로 다르기 때문에 절차를 시작하기 전에 연구를 하는 것이 필수적입니다.[53]
임신
임신은 성소수자 번식의 마지막 단계입니다. 성소수자들은 출산력과 도덕적 가치에 따라 임신을 위한 대리인이나 그들의 파트너를 선택할 수 있습니다. LGBT 임신은 다음 중 하나로 인해 발생할 수 있습니다.
- 여성이나 남성 자궁에 인공 수정을 하는 것입니다.
- 여성 또는 트랜스 남성 자궁에 이식된 체외 수정에서 얻은 배아
- 자연스러운 성적 활동(성적 성향이 일치하는 가임 부부의 경우 또는 대리인과 함께 있는 경우).
- 자궁 이식(아직 트랜스여성의 경우 실질적으로 달성되지는 않았지만 여성의 경우 달성되었습니다).
대리모
어떤 게이나 성전환 커플들은 대리 임신을 하기로 결정합니다. 대리인은 남성 중 한 명의 정자에 의해 수정된 난자를 운반하는 여성입니다. 어떤 여성들은 돈 때문에 대리인이 되기도 하고, 다른 여성들은 인도주의적인 이유 때문에 혹은 둘 다가 되기도 합니다.[54] 이것은 남자들 중 한 명이 생물학적 아버지가 될 수 있고 다른 한 명은 입양된 아버지가 될 수 있습니다.
대리모를 이용해 아빠가 된 동성애자 남성들은 아이와 대리모 모두의 관계를 포함해 대리모를 이용한 다른 부부들과 비슷한 경험을 보고했습니다.[55]
영국의 배리와 토니 드류잇 바로우는 1999년 대리 출산을 통해 태어난 아빠 쌍둥이를 낳은 국내 최초의 게이 남성이 되었습니다.[56][57]

대리 출산은 여성이 부부나 개인을 위해 아이를 안고 출산하는 과정입니다. 이는 대리인이 보상을 받을 수도 있고 받지 않을 수도 있는 법적 합의에 의해 뒷받침되는 합의일 수 있습니다. 대리 출산은 부모와 자녀 사이의 생물학적 연관성으로 인해 덜 복잡하기 때문에 부모로 접근하는 가장 일반적인 형태입니다. LGBTQ+ 개인은 자신의 생물학적 아이의 임신 보균자 역할을 할 다른 사람이 필요할 때 대리 출산을 할 수 있습니다. 최근 미국 밖에서 대리 출산을 위한 부부 여행이 증가하고 있습니다. 일반적으로 이러한 상업적 서비스는 백인의 부유한 예비 부모만을 대상으로 합니다. 일부 국가에서는 대리모에게 급여를 지급하는 것이 불법이지만, 무급 대리모가 발생할 수 있다는 것이 논쟁입니다.
누가 생물학적 부모가 될 것인지 선택하는 것은 커플마다 다를 수 있습니다. 왜냐하면 커플들은 어디서 게임이 나올 수 있는지 결정할 수 있기 때문입니다. 게임은 상업적 자원을 통해 구매할 수 있고, 부모님 모두에게 유전적으로 연결된 계약을 통해 구매할 수도 있고, 친구 기부를 통해 구매할 수도 있습니다.
인도에서 대리모를 찾는 게이 부모들이 사용하는 초국가적 대리모는 오랜 역사를 가지고 있습니다. 이들은 대리점을 통해 고용된 지역 여성을 수정하기 위해 부모 중 한 명 또는 양쪽이 수정한 게임을 사용합니다. 급여에 대한 투명성과 관련 당사자에 대한 결과로 인해 전 세계적인 비판이 있습니다. 인도의 대리모 서비스 때문에 동성애 부모들은 임신 업데이트에 대한 접근이 제한되어 있기 때문에 이 서비스를 회수하고 있습니다. 의사소통을 할 수 없는 것은 동성애자 부모들에게 감정적 거리를 둘 수 있고 임신은 동성애자 부모들에게 스트레스를 줄 수 있습니다. 게이 부모들이 대리모를 통해 아기와 정서적인 교감을 할 수 있고 그들이 겪는 경험을 할 수 있는 대신에, 대리모 서비스를 받는 것은 스트레스가 많은 여정이 될 수 있습니다.
초국적 대리 출산은 아이가 태어나면 법적 문제를 제기할 수 있습니다. 부모에 대한 국가의 법적 규칙에 대해 갈등이 있고 이는 시민권을 복잡하게 하므로 종종 아이가 어떤 나라에서도 법적 부모나 시민권을 갖지 못하는 결과를 초래할 수 있습니다.
세계 트랜스젠더 건강 전문가 협회(WPATH)는 모든 트랜스젠더 환자가 의료 전문가를 위한 표준(2012) 가이드북에서 호르몬 치료를 시작하기 전에 임신력에 대한 결정을 내릴 것을 권고합니다.[12]
트랜스젠더 남성
임신은 기능하는 질, 난소, 자궁을 유지하는 트랜스젠더 남성에게 가능합니다.[58][59] 호르몬 테스토스테론 치료에 노출된다고 해서 반드시 산아 가능성이 배제되는 것은 아닙니다.[14] 테스토스테론 치료는 그 자체로 피임법으로는 충분하지 않으며, 특히 트랜스 남성은 복용량을 놓치면 의도하지 않은 임신을[60][61] 경험할 수 있습니다.[60] 임신한 많은 트랜스 남성들은 테스토스테론을 중단한 지 6개월 만에 그렇게 할 수 있었습니다.[60] 2019년에 수행된 또 다른 연구에 따르면 난모세포 냉동 보존, 배아 냉동 보존 또는 체외 수정을 위해 난모세포 회수를 원하는 트랜스젠더 남성 환자는 테스토스테론 치료를 중단한 지 평균 4개월 후에 치료를 받을 수 있었습니다.[59] 트랜스젠더 남성이 테스토스테론 이후 임신을 시도하거나 테스토스테론에 노출된 난모세포에서 임신한 자손의 건강에 대한 연구는 아직 없어 정확한 출산율을 알 수 없습니다.[13][58]
트랜스 남성에서 호르몬 치료를 남성화하면 되돌릴 수 없는 무월경이 발생하지만 안드로겐 치료는 원시 난포를 고갈시키거나 난포의 발달 능력에 영향을 미치지 않지만 조직학적으로 난소 피질과 기질의 증식이 발견되었습니다.[10] 이것이 생리학적으로 다낭성 난소 증후군과 유사한지에 대해서는 논란이 되어 왔습니다.[10] 난소 절제술은 (난자가 보관되지 않은 경우) 비가역적인 생식력 종결로 이어지지만, ART로 임신하는 것을 배제하지는 않습니다.[10][58] 자궁절제술을 받으면 임신할 수 있는 옵션이 없어집니다.[58]
트랜스젠더 여성
성전환자 여성과 가임적인 파트너가 있는 이성애자 남성은 자연스러운 성행위를 통해 아이를 갖기로 선택할 수 있습니다. 일부 트랜스젠더 여성들은 호르몬 치료에 대한 성욕이 낮아졌다고 보고했습니다.[62] 여성화 호르몬 치료를 받고 있는 트랜스젠더 환자들은 비정상적인 정액 매개변수를 가지고 있는 것으로 밝혀졌습니다.[63][64] 지속적인 호르몬 치료는 결국 저 정자 형성으로 이어지고 결국에는 알 수 없는 시점에 되돌릴 수 없는 무정자증으로 이어집니다.[10][65][66] 2015년 연구에서는 장기 에스트로겐 치료 환자의 정상적인 정자 형성을 입증했습니다.[12] 고환을 외과적으로 제거하면 되돌릴 수 없는 불임도 초래합니다.[10][66] 이러한 옵션을 추구하고 생식력을 보존하는 데 관심이 있는 사람들은 치료를 시작하기 전에 정자를 냉동 보관하는 것이 좋습니다.[10]
출산관리의 장벽
경제의
불임 치료와 보존은 비용이 많이 듭니다. 체외수정 주기는 평균 12,000~17,000달러(약물 포함)의 비용이 들 수 있으며, 약을 사용하면 최대 25,000~30,000달러까지 비용이 들 수 있으며, 가격은 종종 규정과 함께 제공되는 보험에 포함됩니다. IUI의 비용은 사이클당 500~4,000달러입니다.[69] 유전물질의 동결보존 또한 아래 표에서 볼 수 있듯이 비용이 많이 들고, 장소에 따라, 상태에 따라 크게 다를 수 있습니다.[70]
| 출산력 보존 옵션 | 서비스 비용 범위($) | 연간 스토리지 비용 범위($) |
|---|---|---|
| 에그 프리징 | 7,000-15,000 | 300-1000[70][71] |
| 배아동결 | 11,000-15,000 | 350-600[68] |
| 난소 조직 동결 | 10,000-12,000 | 300-500 |
| 정자은행 | 250-1,000[72] | 100-500[73] |
| 고환 정자 추출법 | 7,500-10,000 | 300-500 |
| 전기 사정 | 10,000-12,000 | 300-500 |
또 다른 장벽은 지식입니다. 이러한 절차는 잘 알려져 있지 않고 생식력 보존에 대한 논의는 흔하지 않습니다. 133명의 트랜스젠더 여성을 대상으로 한 연구에서 61%는 호르몬 치료나 수술 전에 정자 은행에 대해 논의한 의료 제공자가 없다고 말했습니다.[74] 또 다른 연구에서 70명의 트랜스젠더 남성은 인지된 치료 비용(36%), 호르몬 치료 중단 또는 지연 필요성(19%), 치료와 임신으로 인한 성교통 악화(11%)[14] 등의 장벽을 꼽았습니다.
물리적.
트랜스젠더의 3%만이 전환기에[75] 생식력을 보존하기 위해 노력하고 있습니다. 트랜스여성의 51%는 생식력을 보존하지 못한 것에 대해 유감을 표하며,[76] 트랜스젠더 성인의 97%는 전환 전에 논의되어야 한다고 생각합니다.[77]
테스토스테론 치료는 생식력에 영향을 주지만, 임신한 많은 트랜스 남성들은 테스토스테론을 중단한 지 6개월 만에 치료를 할 수 있었습니다.[78] 2019년에 수행된 또 다른 연구에 따르면 난모세포 냉동 보존, 배아 냉동 보존 또는 체외 수정을 위해 난모세포 회수를 원하는 트랜스젠더 남성 환자는 테스토스테론 치료를 중단한 지 평균 4개월 후에 치료를 받을 수 있었습니다.[79] 모든 환자는 테스토스테론을 제거한 후 긴장과 정상 AMH, FSH 및 E 수치2 및 전포낭 수를 경험하여 성공적인 난모세포 회수를 가능하게 했습니다.[79] 안드로겐 치료가 생식력에 미치는 장기적인 영향은 아직 널리 알려져 있지 않지만, 난모세포 회수는 영향을 받지 않는 것으로 보입니다. 미래의 임신은 우피테 은행에 의해 달성될 수 있지만, 그 과정은 성별 장애를 증가시키거나 보험 적용 범위가 부족하여 접근할 수 없을 수 있습니다.[78] 테스토스테론 치료는 피임의 충분한 방법이 아니며,[78][80] 특히 복용량을 놓치는 경우 트랜스 남성은 의도하지 않은 임신을 경험할 수 있습니다.[78]
일부 연구에서는 테스토스테론을 복용하기 전에 트랜스젠더 남성들 사이에서 다낭성 난소 증후군 (PCOS)의 발병률이 더 높다고 보고합니다.[81][82][83][84] 이 질병은 불임을 유발하고 트랜스 남성들이 난자를 얼리는 것을 더 어렵게 만들 수 있지만 모두 트랜스 남성과 PCOS의 동일한 연관성을 발견하지는 못했습니다.[85] 보도에 따르면 일반적으로 PCOS를 가진 사람들은 또한 자신을 "성적으로 차별화되지 않은" 또는 "남성적인" 그리고 "여성의 성별 계획과 동일시할 가능성이 적은" 것으로 생각할 가능성이 더 높습니다.[86][85]
미래기술
두 남성 모두 생물학적 아버지가 될 수 있는 두 남성의 접합체를 만드는 이론적인 작업이 진행되고 있지만 아직 실질적으로 실행되지는 않았습니다.[87]
줄기세포를 이용한 동성 생식은 생물학적으로 관련된 아이들을 생산하기 위해 배우자를 유도할 수 있는 이론적 잠재력이 있지만,[88] 이것은 논쟁의[89] 여지가 있고 "불가능하다"고 여겨져 왔습니다.[88] 하지만, 과학자들은 수컷 쥐로부터 생물학적으로 수컷인 유전자 기증자 2명과 함께 자손을 생산하기 위해 성공적으로 난자를 만들어냈고, 인간의 적용이 향후 10년 이내에 이루어질 수 있을 것이라고 낙관해 왔습니다.[90][91]
사춘기 이전의 트랜스젠더 소녀의 경우, 고환 조직 동결 보존(TTC)이 현재 유일한 생식력 보존 옵션입니다.[13] 정자줄기세포가 정자로 성숙될 수 있는 추후의 날짜를 위해 고환조직을 제거하고 동결보존하는 실험적 수술방법. 현재까지 보고된 정자 생성 회복은 없으며 이를 가능하게 하는 TTC 기술은 현재 동물 모델에서만[13] 연구되고 있습니다.
두 여성 모두 친모가 될 수 있는 두 여성의 접합체를 만드는 이론적인 작업이 진행되고 있지만 아직 실질적으로 실행되지는 않았습니다.[87] 난자에서 정자를 만들어 다른 난자를 수정하는 데 사용하면 이 문제를 해결할 수 있고,[6] 두 개의 난자가 융합되는 체세포 핵 전달과 유사한 과정이 가능합니다.[92]
2004년과 2018년에 과학자들은 난자 핵융합을 통해 두 어미를 가진 쥐를 만들 수 있었습니다.[3][4][5] 건강한 쌍태아 쥐를 만들기 위해서는 유전체 각인의 변형이 필요한 반면 살아있는 쌍태아 쥐는 만들어졌지만 유전체 각인으로 인해 건강에 해로울 가능성이 있었습니다.[5]
만약 만들어진다면, "여성 정자" 세포는 난자 세포를 수정시킬 수 있는데, 이 과정은 다른 잠재적인 응용들 중에서도 여성 동성 커플들이 그들의 두 어머니의 생물학적 자손이 될 아이를 낳을 수 있게 할 수도 있습니다. 또한 여성 정자의 생산은 여성이 자신의 정자에 의해 생산된 자손의 어머니와 아버지가 되도록 자극할 수 있다고 주장합니다. 윤리적으로나 도덕적으로나 많은 의문들이 이러한 논쟁들을 둘러싸고 발생합니다.[93][94][95][96]
자궁이식
일부 트랜스젠더 여성은 선천적으로 배아와 태아 발달에 필요한 해부학적 구조를 가지고 있지 않기 때문에 극복해야 할 일련의 문제가 있는 트랜스젠더 임신을 통해 자신의 아이를 낳고 싶어합니다. 2008년 현재 성전환자 여성에 대한 자궁이식 성공사례는 없었습니다.[97]
트랜스젠더 여성들에게 또 다른 가능성은 성공적인 자궁 이식에서 오는 것입니다. 트랜스젠더 여성들에게 임신과 임신 기간을 보낼 수 있습니다.[98] cis-여성에서 자궁 이식으로 성공적인 출산이 있었지만, 현재 트랜스젠더 여성에서 자궁 이식이 성공적으로 이루어지지 않았기 때문에 현재 트랜스 여성에서는[98] 그렇지 않습니다.[99] 인간 골반의 성적 이형성, 약물 레짐 위험(이식 후 면역 억제 및 임신을 지속하기 위한 호르몬 치료), 신생아 질 문합 위험 등에서 이론적 문제가 발생합니다.[98][99][100] 이러한 위험을 확인한 동일한 연구에서도 자궁 이식이 시스 여성에만 국한되어서는 안 된다는 결론에 도달했으며,[98][99][100] 한 저널 기사에서는 시스 여성에 비해 이론적인 절차적 위험이 증가하는 것을 발견할 수 없었습니다.[100] 트랜스여성이 신질관을 통해 출산할 것이라는 기대는 전혀 없습니다.[101]
2019년 현재, 시스젠더 여성의 경우, 42건 이상의 UTX 시술이 시행되었으며, 12건의 살아있는 출생이 이식된 자궁으로 인해 출판되었습니다.[102] 국제 자궁이식학회(ISUTx)는 2016년 국제적으로 70명의 임상 의사와 과학자들이 참여한 가운데 설립됐으며, 현재 140명의 대륙간 대표단이 활동하고 있습니다.[103] 목표는 "과학적 혁신을 통해 자궁 이식 분야에서 의료를 발전시키는 것"입니다.[104]
2012년 맥길 대학은 '이식 국제'에 자궁이식을 시행하기 위한 기준으로 제시된 '자궁이식의 윤리적 타당성에 대한 몬트리올 기준'을 발표했습니다.[105] 이러한 기준 하에서, 시스젠더 여성만이 윤리적으로 이식 수혜자로 간주될 수 있었습니다. 트랜스여성을 후보에서 배제하는 것은 명분이 부족할 수 있습니다.[106]
게다가, 트랜스 여성이 생물학적인 남성 파트너와 임신하기를 원한다면, 그들은 시스젠더 게이 커플들이 접합체를 만드는 데 있어 가지고 있는 것과 같은 문제에 직면합니다.
대중문화에서는
오메가버스에서는 LGBT 재생산이라는 주제가 일반적입니다.[107][108][109][110] 알파 암컷은 암수 모두를 임신시킬 수 있고,[107] 오메가 수컷은 암수 모두를 임신시킬 수 있습니다.[108][109][110]
알파스와 베타스 사이에서는 암컷만이 임신을 할 수 있지만, 수컷 오메가스는 직장과 연결된 자궁을 통해 임신이 가능한 것으로 간주되는 경우가 많으며,[108][109][110] 알파스는 주요 성별에 관계없이 임신이 가능합니다.[107] 침투와 함침을 쉽게 하기 위해 수컷 오메가스는 자가 윤활 항문을 가지고 있는 경우가 많습니다.[111]
참고 항목
참고문헌
- ^ Quick D (9 December 2010). "Breakthrough raises possibility of genetic children for same-sex couples". Retrieved 26 July 2015.
- ^ "Timeline of same-sex procreation scientific developments". samesexprocreation.com.
- ^ a b "Japanese scientists produce mice without using sperm". The Washington Post. Sarasota Herald-Tribune. April 22, 2004.
- ^ a b Blakely R (2018-10-12). "No father necessary as mice are created with two mothers". The Times. ISSN 0140-0460. Retrieved 2018-10-12.
- ^ a b c Li ZK, Wang LY, Wang LB, Feng GH, Yuan XW, Liu C, et al. (November 2018). "Generation of Bimaternal and Bipaternal Mice from Hypomethylated Haploid ESCs with Imprinting Region Deletions". Cell Stem Cell. 23 (5): 665–676.e4. doi:10.1016/j.stem.2018.09.004. PMID 30318303.
- ^ a b Murray I (2021). "Stem Cells and Same Sex Reproduction". Retrieved 26 July 2015.
- ^ Tam MW (August 2021). "Queering reproductive access: reproductive justice in assisted reproductive technologies". Reproductive Health. 18 (1): 164. doi:10.1186/s12978-021-01214-8. PMC 8327458. PMID 34340704.
- ^ Compton J (5 March 2019). "Transgender men, eager to have biological kids, are freezing their eggs". NBC News. Retrieved 2021-07-05.
- ^ "The T-Male: IVF and Surrogacy". www.thetransitionalmale.com. Retrieved 2021-07-05.
- ^ a b c d e f g h i T'Sjoen, Guy; Van Caenegem, Eva; Wierckx, Katrien (December 2013). "Transgenderism and reproduction". Current Opinion in Endocrinology, Diabetes & Obesity. 20 (6): 575–579. doi:10.1097/01.med.0000436184.42554.b7. ISSN 1752-296X. PMID 24468761. S2CID 205398449.
- ^ Herrero, Leyre; Martínez, Mónica; Garcia-Velasco, Juan A. (August 2011). "Current status of human oocyte and embryo cryopreservation". Current Opinion in Obstetrics and Gynecology. 23 (4): 245–250. doi:10.1097/GCO.0b013e32834874e2. ISSN 1040-872X. PMID 21734500. S2CID 32837692.
- ^ a b c Jones, C. A.; Reiter, L.; Greenblatt, E. (2016-04-02). "Fertility preservation in transgender patients". International Journal of Transgenderism. 17 (2): 76–82. doi:10.1080/15532739.2016.1153992. ISSN 1553-2739. S2CID 58849546.
- ^ a b c d e f g h i Moravek, Molly B. (June 2019). "Fertility preservation options for transgender and gender-nonconforming individuals". Current Opinion in Obstetrics and Gynecology. 31 (3): 170–176. doi:10.1097/GCO.0000000000000537. ISSN 1040-872X. PMID 30870185. S2CID 78091839.
- ^ a b c d Douglas, Christopher R.; Phillips, Destiny; Sokalska, Anna; Aghajanova, Lusine (2022-05-02). "Fertility Preservation for Transgender Males". Obstetrics & Gynecology. 139 (6): 1012–1017. doi:10.1097/aog.0000000000004751. ISSN 0029-7844. PMID 35675598. S2CID 249332982.
- ^ Donnez, J; Dolmans, MM; Demylle, D; Jadoul, P; Pirard, C; Squifflet, J; Martinez-Madrid, B; Van Langendonckt, A (October 2004). "Livebirth after orthotopic transplantation of cryopreserved ovarian tissue". The Lancet. 364 (9443): 1405–1410. doi:10.1016/s0140-6736(04)17222-x. ISSN 0140-6736. PMID 15488215. S2CID 21448970.
- ^ Li K, Rodriguez D, Gabrielsen JS, Centola GM, Tanrikut C (November 2018). "Sperm cryopreservation of transgender individuals: trends and findings in the past decade". Andrology. 6 (6): 860–864. doi:10.1111/andr.12527. PMC 6301129. PMID 30094956.
- ^ Jones CA, Reiter L, Greenblatt E (2016). "Fertility preservation in transgender patients". International Journal of Transgenderism. 17 (2): 76–82. doi:10.1080/15532739.2016.1153992. ISSN 1553-2739. S2CID 58849546.
Traditionally, patients have been advised to cryopreserve sperm prior to starting cross-sex hormone therapy as there is a potential for a decline in sperm motility with high-dose estrogen therapy over time (Lubbert et al., 1992). However, this decline in fertility due to estrogen therapy is controversial due to limited studies.
- ^ Payne AH, Hardy MP (28 October 2007). The Leydig Cell in Health and Disease. Springer Science & Business Media. pp. 422–431. ISBN 978-1-59745-453-7.
Estrogens are highly efficient inhibitors of the hypothalamic-hypophyseal-testicular axis (212–214). Aside from their negative feedback action at the level of the hypothalamus and pituitary, direct inhibitory effects on the testis are likely (215,216). [...] The histology of the testes [with estrogen treatment] showed disorganization of the seminiferous tubules, vacuolization and absence of lumen, and compartmentalization of spermatogenesis.
- ^ a b Salam MA (2003). Principles & Practice of Urology: A Comprehensive Text. Universal-Publishers. pp. 684–. ISBN 978-1-58112-412-5.
Estrogens act primarily through negative feedback at the hypothalamic-pituitary level to reduce LH secretion and testicular androgen synthesis. [...] Interestingly, if the treatment with estrogens is discontinued after 3 yr. of uninterrupted exposure, serum testosterone may remain at castration levels for up to another 3 yr. This prolonged suppression is thought to result from a direct effect of estrogens on the Leydig cells.
- ^ a b Cox RL, Crawford ED (December 1995). "Estrogens in the treatment of prostate cancer". The Journal of Urology. 154 (6): 1991–8. doi:10.1016/S0022-5347(01)66670-9. PMID 7500443.
- ^ Adeleye AJ, Reid G, Kao CN, Mok-Lin E, Smith JF (February 2019). "Semen Parameters Among Transgender Women With a History of Hormonal Treatment". Urology. 124: 136–141. doi:10.1016/j.urology.2018.10.005. PMID 30312673. S2CID 52973277.
- ^ Gao Y, Maurer T, Mirmirani P (August 2018). "Understanding and Addressing Hair Disorders in Transgender Individuals". American Journal of Clinical Dermatology. 19 (4): 517–527. doi:10.1007/s40257-018-0343-z. PMID 29352423. S2CID 6467968.
Non-steroidal antiandrogens include flutamide, nilutamide, and bicalutamide, which do not lower androgen levels and may be favorable for individuals who want to preserve sex drive and fertility [9].
- ^ Iversen P, Melezinek I, Schmidt A (January 2001). "Nonsteroidal antiandrogens: a therapeutic option for patients with advanced prostate cancer who wish to retain sexual interest and function". BJU International. 87 (1): 47–56. doi:10.1046/j.1464-410x.2001.00988.x. PMID 11121992. S2CID 28215804.
- ^ Morgante E, Gradini R, Realacci M, Sale P, D'Eramo G, Perrone GA, et al. (March 2001). "Effects of long-term treatment with the anti-androgen bicalutamide on human testis: an ultrastructural and morphometric study". Histopathology. 38 (3): 195–201. doi:10.1046/j.1365-2559.2001.01077.x. hdl:11573/387981. PMID 11260298. S2CID 36892099.
- ^ Jones CA, Reiter L, Greenblatt E (2016). "Fertility preservation in transgender patients". International Journal of Transgenderism. 17 (2): 76–82. doi:10.1080/15532739.2016.1153992. ISSN 1553-2739. S2CID 58849546.
Traditionally, patients have been advised to cryopreserve sperm prior to starting cross-sex hormone therapy as there is a potential for a decline in sperm motility with high-dose estrogen therapy over time (Lubbert et al., 1992). However, this decline in fertility due to estrogen therapy is controversial due to limited studies.
- ^ Payne AH, Hardy MP (28 October 2007). The Leydig Cell in Health and Disease. Springer Science & Business Media. pp. 422–431. ISBN 978-1-59745-453-7.
Estrogens are highly efficient inhibitors of the hypothalamic-hypophyseal-testicular axis (212–214). Aside from their negative feedback action at the level of the hypothalamus and pituitary, direct inhibitory effects on the testis are likely (215,216). [...] The histology of the testes [with estrogen treatment] showed disorganization of the seminiferous tubules, vacuolization and absence of lumen, and compartmentalization of spermatogenesis.
- ^ a b Salam MA (2003). Principles & Practice of Urology: A Comprehensive Text. Universal-Publishers. pp. 684–. ISBN 978-1-58112-412-5.
Estrogens act primarily through negative feedback at the hypothalamic-pituitary level to reduce LH secretion and testicular androgen synthesis. [...] Interestingly, if the treatment with estrogens is discontinued after 3 yr. of uninterrupted exposure, serum testosterone may remain at castration levels for up to another 3 yr. This prolonged suppression is thought to result from a direct effect of estrogens on the Leydig cells.
- ^ a b Cox RL, Crawford ED (December 1995). "Estrogens in the treatment of prostate cancer". The Journal of Urology. 154 (6): 1991–1998. doi:10.1016/S0022-5347(01)66670-9. PMID 7500443.
- ^ a b c Luetkemeyer, Lisa; West, Kimela (2015). "Paternity Law: Sperm Donors, Surrogate Mothers and Child Custody". Missouri Medicine. 112 (3): 162–165. ISSN 0026-6620. PMC 6170122. PMID 26168582.
- ^ Narayan, Chandrika (2014-01-23). "Kansas court says sperm donor must pay child support". CNN. Retrieved 2023-11-16.
- ^ "Court voids ruling that sperm donor must pay child support". AP News. 2021-06-16. Retrieved 2023-11-16.
- ^ "Do Sperm Donors Pay Child Support?". Boyd Law. 2018-07-16. Retrieved 2023-11-16.
- ^ Seery, Cassandra (2019-06-19). "Can a sperm donor be a legal parent? In landmark decision, the High Court says yes". The Conversation. Retrieved 2023-11-16.
- ^ a b c d e f Potapragada, Nivedita R.; Babayev, Elnur; Strom, Danielle; Beestrum, Molly; Schauer, Jacob M.; Jungheim, Emily S. (2023-06-07). "Intrauterine Insemination After Human Chorionic Gonadotropin Trigger or Luteinizing Hormone Surge". Obstetrics & Gynecology. 142 (1): 61–70. doi:10.1097/aog.0000000000005222. ISSN 0029-7844. S2CID 259118454.
- ^ a b "Calculating Your Monthly Fertility Window". www.hopkinsmedicine.org. 2022-03-10. Retrieved 2023-12-04.
- ^ a b c d The ESHRE Capri Workshop Group (2009-01-16). "Intrauterine insemination". Human Reproduction Update. 15 (3): 265–277. doi:10.1093/humupd/dmp003. ISSN 1355-4786. PMID 19240042.
- ^ "Intrauterine insemination (IUI) - Mayo Clinic". www.mayoclinic.org. Retrieved 2023-11-26.
- ^ "IUI (Intrauterine Insemination): What It Is & What To Expect". Cleveland Clinic. Retrieved 2023-11-26.
- ^ Monseur, Brent C.; Franasiak, Jason M.; Sun, Li; Scott, Richard T.; Kaser, Daniel J. (2019-10-01). "Double intrauterine insemination (IUI) of no benefit over single IUI among lesbian and single women seeking to conceive". Journal of Assisted Reproduction and Genetics. 36 (10): 2095–2101. doi:10.1007/s10815-019-01561-3. ISSN 1573-7330. PMC 6823402. PMID 31410635.
- ^ a b Johal, Jasmyn K.; Gardner, Rebecca M.; Vaughn, Sara J.; Jaswa, Eleni G.; Hedlin, Haley; Aghajanova, Lusine (2021-04-28). "Pregnancy success rates for lesbian women undergoing intrauterine insemination". F&S Reports. 2 (3): 275–281. doi:10.1016/j.xfre.2021.04.007. ISSN 2666-3341. PMC 8441558. PMID 34553151.
- ^ a b Chen, Xiao-Jun; Wu, Li-Ping; Lan, Hai-Lian; Zhang, Li; Zhu, Yi-Min (2012). "Clinical Variables Affecting The Pregnancy Rate of Intracervical Insemination Using Cryopreserved Donor Spermatozoa: A Retrospective Study in China". International Journal of Fertility & Sterility. 6 (3): 179–184. ISSN 2008-076X. PMC 3850307. PMID 24520436.
- ^ a b Kop, P A L; van Wely, M; Nap, A; Soufan, A T; de Melker, A A; Mol, B W J; Bernardus, R E; De Brucker, M; Janssens, P M W; Pieters, J J P M; Repping, S; van der Veen, F; Mochtar, M H (2022-04-23). "Intracervical insemination versus intrauterine insemination with cryopreserved donor sperm in the natural cycle: a randomized controlled trial". Human Reproduction. 37 (6): 1175–1182. doi:10.1093/humrep/deac071. ISSN 0268-1161. PMC 9789751. PMID 35459949.
- ^ Kop, Petronella AL; Mochtar, Monique H; O'Brien, Paul A; Van der Veen, Fulco; van Wely, Madelon (2018-01-25). "Intrauterine insemination versus intracervical insemination in donor sperm treatment". Cochrane Database of Systematic Reviews. 2018 (2): CD000317. doi:10.1002/14651858.cd000317.pub4. ISSN 1465-1858. PMC 6491301. PMID 29368795.
- ^ Cordary, D.; Braconier, A.; Guillet-May, F.; Morel, O.; Agopiantz, M.; Callec, R. (2017-12-01). "Immobilization versus immediate mobilization after intrauterine insemination: A systematic review and meta-analysis". Journal of Gynecology Obstetrics and Human Reproduction. 46 (10): 747–751. doi:10.1016/j.jogoh.2017.09.005. ISSN 2468-7847. PMID 28964965.
- ^ "Intracervical insemination (ICI) -". 2022-10-08. Retrieved 2023-11-28.
- ^ Kop, Petronella; van Wely, Madelon; de Melker, Annemieke; van der Veen, Fulco; Mochtar, Monique (2022-02-04). "Donor sperm treatment: the role of semen parameters in intracervical insemination, a retrospective cohort study". Human Fertility. 26 (5): 964–970. doi:10.1080/14647273.2022.2032407. ISSN 1464-7273. PMID 35114884. S2CID 246529633.
- ^ a b c d MarketingInsights. "Standard IVF". The IVF Center Assisted Reproduction and Endocrinology. Retrieved 2023-12-04.
- ^ Gilmour P (6 June 2018). "Shared motherhood: The amazing way lesbian couples are having babies". Cosmopolitan. Retrieved 21 March 2018.
- ^ Klatsky P (22 June 2017). "Co-Maternity And Reciprocal IVF: Empowering lesbian parents with options". Huffington Post. Retrieved 21 March 2018.
- ^ Marina S, Marina D, Marina F, Fosas N, Galiana N, Jové I (April 2010). "Sharing motherhood: biological lesbian co-mothers, a new IVF indication". Human Reproduction. 25 (4): 938–41. doi:10.1093/humrep/deq008. PMID 20145005.
- ^ Schenker JG (2011). Ethical dilemmas in assisted reproductive technologies. Berlin: De Gruyter. ISBN 978-3-11-024021-4. OCLC 763156926.
- ^ a b c Imrie S, Jadva V, Fishel S, Golombok S (July 2019). "Families Created by Egg Donation: Parent-Child Relationship Quality in Infancy". Child Development. 90 (4): 1333–1349. doi:10.1111/cdev.13124. PMC 6640047. PMID 30015989.
- ^ a b c "Reciprocal IVF UCSF Center for Reproductive Health". UCSF. Retrieved 2023-12-04.
- ^ "For Gay Men: Becoming a Parent through Surrogacy". Internet Health Resources. Retrieved 26 July 2015.
- ^ Blake L, Carone N, Slutsky J, Raffanello E, Ehrhardt AA, Golombok S (November 2016). "Gay father surrogacy families: relationships with surrogates and egg donors and parental disclosure of children's origins". Fertility and Sterility. 106 (6): 1503–1509. doi:10.1016/j.fertnstert.2016.08.013. PMC 5090043. PMID 27565261.
- ^ Woodward W (13 December 1999). "Gay couple celebrate birth of twins Aspen and Saffron". The Guardian.
- ^ Wakefield L (13 December 2021). "Britain's 'first gay dads' expecting triplets with daughter's ex-boyfriend". PinkNews.
- ^ a b c d Obedin-Maliver, Juno; Makadon, Harvey J (March 2016). "Transgender men and pregnancy". Obstetric Medicine. 9 (1): 4–8. doi:10.1177/1753495X15612658. ISSN 1753-495X. PMC 4790470. PMID 27030799.
- ^ a b Leung, Angela; Sakkas, Denny; Pang, Samuel; Thornton, Kim; Resetkova, Nina (2019-11-01). "Assisted reproductive technology outcomes in female-to-male transgender patients compared with cisgender patients: a new frontier in reproductive medicine". Fertility and Sterility. 112 (5): 858–865. doi:10.1016/j.fertnstert.2019.07.014. ISSN 0015-0282. PMID 31594633.
- ^ a b c Berger, Anthony P.; Potter, Elizabeth M.; Shutters, Christina M.; Imborek, Katherine L. (2015-09-01). "Pregnant transmen and barriers to high quality healthcare". Proceedings in Obstetrics and Gynecology. 5 (2): 1–12. doi:10.17077/2154-4751.1285. ISSN 2154-4751.
- ^ Light, Alexis; Wang, Lin-Fan; Zeymo, Alexander; Gomez-Lobo, Veronica (2018-10-01). "Family planning and contraception use in transgender men". Contraception. 98 (4): 266–269. doi:10.1016/j.contraception.2018.06.006. ISSN 0010-7824. PMID 29944875. S2CID 49434157.
- ^ Wierckx, Katrien; Van Caenegem, Eva; Schreiner, Thomas; Haraldsen, Ira; Fisher, Alessandra; Toye, Kaatje; Kaufman, Jean Marc; T'Sjoen, Guy (August 2014). "Cross-Sex Hormone Therapy in Trans Persons Is Safe and Effective at Short-Time Follow-Up: Results from the European Network for the Investigation of Gender Incongruence". The Journal of Sexual Medicine. 11 (8): 1999–2011. doi:10.1111/jsm.12571. hdl:2158/1060207. ISSN 1743-6095. PMID 24828032.
- ^ Li, Kai; Rodriguez, Dayron; Gabrielsen, J. Scott; Centola, Grace M.; Tanrikut, Cigdem (November 2018). "Sperm Cryopreservation of Transgender Individuals: Trends and Findings in the Past Decade". Andrology. 6 (6): 860–864. doi:10.1111/andr.12527. ISSN 2047-2919. PMC 6301129. PMID 30094956.
- ^ Adeleye, Amanda J.; Reid, Garrett; Kao, Chia-Ning; Mok-Lin, Evelyn; Smith, James F. (2019-02-01). "Semen Parameters Among Transgender Women With a History of Hormonal Treatment". Urology. 124: 136–141. doi:10.1016/j.urology.2018.10.005. ISSN 0090-4295. PMID 30312673. S2CID 52973277.
- ^ Rowlands, Sam; Amy, Jean-Jacques (2018-01-02). "Preserving the reproductive potential of transgender and intersex people". The European Journal of Contraception & Reproductive Health Care. 23 (1): 58–63. doi:10.1080/13625187.2017.1422240. ISSN 1362-5187. PMID 29323576. S2CID 3784307.
- ^ a b Amir, Hadar; Yaish, Iris; Oren, Asaf; Groutz, Asnat; Greenman, Yona; Azem, Foad (2020-09-01). "Fertility preservation rates among transgender women compared with transgender men receiving comprehensive fertility counselling". Reproductive BioMedicine Online. 41 (3): 546–554. doi:10.1016/j.rbmo.2020.05.003. ISSN 1472-6483. PMID 32651108. S2CID 219435735.
- ^ Klein, Amy (2020-04-18). "I.V.F. is Expensive. Here's How to Bring Down the Cost". The New York Times. ISSN 0362-4331. Retrieved 2023-12-04.
- ^ a b "How Much Does IVF Cost?". Forbes Health. 2021-09-28. Retrieved 2023-12-04.
- ^ Snider, Susannah (September 29, 2020). ""How Much Does IUI Cost and How Do I Pay for It?"". U.S. News.
- ^ a b "Paying For Treatments". Alliance for Fertility Preservation. Retrieved 2023-12-04.
- ^ PFCLA. "Cost of Egg & Embryo Freezing in the U.S. PFCLA". www.pfcla.com. Retrieved 2023-12-04.
- ^ "How Much Does It Cost To Freeze Sperm?". Forbes Health. 2022-12-01. Retrieved 2023-12-04.
- ^ "Sperm Banking". www.hopkinsmedicine.org. 2021-11-02. Retrieved 2023-12-04.
- ^ Asafu-Adjei*, Denise; Caputo, Joseph M.; Bockting, Walter O.; Diah, Jonathan; Alukal, Joseph; Stahl, Peter J. (April 2020). "MP26-16 Mismatch Between Attitudes Towards Fertility and Clinical Care for Fertility Preservation in Transgender Women: Data From Project Affirm". Journal of Urology. 203 (Supplement 4). doi:10.1097/ju.0000000000000865.016. ISSN 0022-5347.
- ^ Nahata L, Tishelman AC, Caltabellotta NM, Quinn GP (July 2017). "Low Fertility Preservation Utilization Among Transgender Youth". The Journal of Adolescent Health. 61 (1): 40–44. doi:10.1016/j.jadohealth.2016.12.012. PMID 28161526.
- ^ "IJ TRANSGENDER - The Desire to have Children and the Preservation of Fertility in Transsexual Women: A Survey". 2021-06-30. Archived from the original on 2021-06-30. Retrieved 2022-02-23.
- ^ "Many transgender individuals consider their fertility important, survey shows". www.endocrine.org. Retrieved 2022-02-23.
- ^ a b c d Berger AP, Potter EM, Shutters CM, Imborek KL (2015). "Pregnant transmen and barriers to high quality healthcare". Proceedings in Obstetrics and Gynecology. 5 (2): 1–12. doi:10.17077/2154-4751.1285.
- ^ a b 오류 인용: 명명된 참조
leung-2019a호출되었지만 정의되지 않았습니다(도움말 페이지 참조). - ^ Light A, Wang LF, Zeymo A, Gomez-Lobo V (October 2018). "Family planning and contraception use in transgender men". Contraception. 98 (4): 266–269. doi:10.1016/j.contraception.2018.06.006. PMID 29944875. S2CID 49434157.
- ^ Baba T, Endo T, Honnma H, Kitajima Y, Hayashi T, Ikeda H, et al. (April 2007). "Association between polycystic ovary syndrome and female-to-male transsexuality". Human Reproduction. 22 (4): 1011–1016. CiteSeerX 10.1.1.519.7356. doi:10.1093/humrep/del474. PMID 17166864.
- ^ Becerra-Fernández A, Pérez-López G, Román MM, Martín-Lazaro JF, Lucio Pérez MJ, Asenjo Araque N, et al. (August 2014). "Prevalence of hyperandrogenism and polycystic ovary syndrome in female to male transsexuals" [Prevalence of hyperandrogenism and polycystic ovary syndrome in female to male transsexuals]. Endocrinologia y Nutricion (in Spanish). 61 (7): 351–358. doi:10.1016/j.endonu.2014.01.010. PMID 24680383. S2CID 162299777.
- ^ Balen AH, Schachter ME, Montgomery D, Reid RW, Jacobs HS (March 1993). "Polycystic ovaries are a common finding in untreated female to male transsexuals". Clinical Endocrinology. 38 (3): 325–329. doi:10.1111/j.1365-2265.1993.tb01013.x. PMID 8458105. S2CID 72741370.
- ^ "What are the symptoms of PCOS?". Eunice Kennedy Shriver National Institute of Child Health and Human Development.
- ^ a b Cesta CE, Månsson M, Palm C, Lichtenstein P, Iliadou AN, Landén M (November 2016). "Polycystic ovary syndrome and psychiatric disorders: Co-morbidity and heritability in a nationwide Swedish cohort". Psychoneuroendocrinology. 73: 196–203. doi:10.1016/j.psyneuen.2016.08.005. hdl:10616/45608. PMID 27513883. S2CID 207460386.
- ^ Kowalczyk R, Skrzypulec V, Lew-Starowicz Z, Nowosielski K, Grabski B, Merk W (June 2012). "Psychological gender of patients with polycystic ovary syndrome". Acta Obstetricia et Gynecologica Scandinavica. 91 (6): 710–714. doi:10.1111/j.1600-0412.2012.01408.x. PMID 22443151. S2CID 25055401.
- ^ a b Ringler G (18 March 2015). "Get Ready for Embryos From Two Men or Two Women". Retrieved 4 July 2021.
- ^ a b Segers, Seppe; Mertes, Heidi; Pennings, Guido; de Wert, Guido; Dondorp, Wybo (2017-01-25). "Using stem cell-derived gametes for same-sex reproduction: an alternative scenario". Journal of Medical Ethics. 43 (10): 688–691. doi:10.1136/medethics-2016-103863. ISSN 0306-6800. PMID 28122990. S2CID 35387886.
- ^ Adashi, Eli Y.; Cohen, I. Glenn (2020-11-15). "Assisted Same-Sex Reproduction: The Promise of Haploid Stem Cells?". Stem Cells and Development. 29 (22): 1417–1419. doi:10.1089/scd.2020.0146. ISSN 1547-3287. PMID 32967574. S2CID 221888407.
- ^ Devlin, Hannah; correspondent, Hannah Devlin Science (2023-03-08). "Scientists create mice with two fathers after making eggs from male cells". The Guardian. ISSN 0261-3077. Retrieved 2023-11-30.
- ^ Hunt, Katie (2023-03-24). "Scientists create mice from two dads after making eggs from skin cells". CNN. Retrieved 2023-11-30.
- ^ Foster H (2013-08-16). "Mommy 1 and Mommy 2: Could science end the age of Mom and Dad?". Science in the News. Retrieved 2021-07-05.
- ^ "Early-stage sperm cells created". Newcastle University. 2007-04-13. Archived from the original on 2013-11-09.
- ^ Highfield R (2007-04-14). "Women may be able to grow own sperm". London: Daily Telegraph. Retrieved 2010-05-02.
- ^ Connor S (2007-04-13). "The prospect of all-female conception". The Independent. London. Archived from the original on 2011-01-06. Retrieved 2010-05-02.
- ^ "Bone stem cells turned into primitive sperm cells". New Scientist. 2007-04-13.
- ^ Leith W (2008-04-10). "Pregnant men: hard to stomach?". Telegraph. London.
- ^ a b c d Jones, BP; Williams, NJ; Saso, S; Thum, M-Y; Quiroga, I; Yazbek, J; Wilkinson, S; Ghaem-Maghami, S; Thomas, P; Smith, JR (January 2019). "Uterine transplantation in transgender women". BJOG. 126 (2): 152–156. doi:10.1111/1471-0528.15438. ISSN 1470-0328. PMC 6492192. PMID 30125449.
- ^ a b c Richards, Elliott G.; Ferrando, Cecile A.; Farrell, Ruth M.; Flyckt, Rebecca L. (March 2023). "A "first" on the horizon: the expansion of uterus transplantation to transgender women". Fertility and Sterility. 119 (3): 390–391. doi:10.1016/j.fertnstert.2023.01.017. ISSN 0015-0282. PMID 36669554. S2CID 256057677.
- ^ a b c Mookerjee, Vikram G.; Kwan, Daniel (2019-04-25). "Uterus transplantation as a fertility option in transgender healthcare". International Journal of Transgender Health. 21 (2): 122–124. doi:10.1080/15532739.2019.1599764. ISSN 2689-5269. PMC 7430417. PMID 33005906.
- ^ Balayla, Jacques; Pounds, Pauline; Lasry, Ariane; Volodarsky-Perel, Alexander; Gil, Yaron (May 2021). "The Montreal Criteria and uterine transplants in transgender women". Bioethics. 35 (4): 326–330. doi:10.1111/bioe.12832. ISSN 0269-9702. PMID 33550647. S2CID 231862917.
- ^ Jones BP, Williams NJ, Saso S, Thum MY, Quiroga I, Yazbek J, et al. (January 2019). "Uterine transplantation in transgender women". BJOG. 126 (2): 152–156. doi:10.1111/1471-0528.15438. PMC 6492192. PMID 30125449.
- ^ "History of ISUTx". International Society for Uterus Transplantation (ISUTx). Archived from the original on 2021-11-23. Retrieved 2021-07-26.
- ^ "About - 'Vision'". International Society for Uterus Transplantation (ISUTx). Archived from the original on 2021-11-23. Retrieved 2021-07-26.
- ^ Lefkowitz A, Edwards M, Balayla J (April 2012). "The Montreal Criteria for the Ethical Feasibility of Uterine Transplantation". Transplant International. 25 (4): 439–47. doi:10.1111/j.1432-2277.2012.01438.x. PMID 22356169. S2CID 39516819.
- ^ Lefkowitz A, Edwards M, Balayla J (October 2013). "Ethical considerations in the era of the uterine transplant: an update of the Montreal Criteria for the Ethical Feasibility of Uterine Transplantation". Fertility and Sterility. 100 (4): 924–6. doi:10.1016/j.fertnstert.2013.05.026. PMID 23768985.
However, it certainly bears mentioning that there does not seem to be a prima facie ethical reason to reject the idea of performing uterine transplant on a male or trans patient. A male or trans patient wishing to gestate a child does not have a lesser claim to that desire than their female counterparts. The principle of autonomy is not sex-specific. This right is not absolute, but it is not the business of medicine to decide what is unreasonable to request for a person of sound mind, except as it relates to medical and surgical risk, as well as to distribution of resources. A male who identifies as a woman, for example, arguably has UFI, no functionally different from a woman who is born female with UFI. Irrespective of the surgical challenges involved, such a person's right to self-governance of her reproductive potential ought to be equal to her genetically female peers and should be respected.
- ^ a b c Sung M (26 April 2021). "What The Hell Is The Omegaverse, And Why Is It All Over TikTok?". Mashable India. Retrieved 5 April 2022.
- ^ a b c Shrayber M (18 June 2014). "'Knotting' Is the Weird Fanfic Sex Trend That Cannot Be Unseen". Jezebel. Retrieved 25 May 2020.
- ^ a b c "男も妊娠する世界...BLの人気設定「オメガバース」ってご存知ですか" (in Japanese). 10 July 2018. Retrieved 5 April 2022.
- ^ a b c "2ページ目:BLにおける「オメガバースの事情」【アニメイト編集部BL塾・応用編】 アニメイトタイムズ". Animate Times (in Japanese). Retrieved 7 April 2022.
- ^ Fazekas A (2020). "Alpha/Beta/Omega: Racialized Narratives and Fandom's Investment in Whiteness". In Pande R (ed.). Fandom, Now in Color: A Collection of Voices. University of Iowa Press. p. 98. ISBN 9781609387297 – via Project MUSE.