시데로포어
Siderophore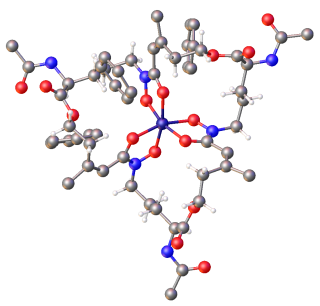
시데로포어(그리스어: "철 운반체")는 박테리아와 곰팡이와 같은 미생물에 의해 분비되는 작고 높은 선호도의 철껍질 화합물이다.그것들은 유기체가 [2][3][4][5]철분을 축적하는 것을 돕는다.비록 더 넓은 범위의 시데로포어 기능이 [6]현재 인식되고 있다.시데로포어는 알려진 가장 강한(가장 높은 친화력3+) Fe 결합제 중 하나입니다.피토시데로포어는 식물에 의해 생성된 시데로포어이다.
수용성 철의 부족
지구 지각에서 가장 풍부한 원소 중 하나임에도 불구하고, 철분은 쉽게 생물학적으로 이용할 수 없다.토양이나 바다와 같은 대부분의 호기성 환경에서 철은 철3+(Fe) 상태로 존재하며, 철은 녹슬지 않은 고형물을 형성하는 경향이 있습니다.효과가 있으려면 영양소가 있어야 할 뿐만 아니라 [7]용해성이 있어야 합니다.미생물은 활성 수송 메커니즘에 의해 흡수될 수 있는 용해성3+ Fe 복합체를 형성함으로써 이러한 광물 단계로부터 철분을 제거하기 위해 시데로포어를 방출합니다.많은 시데로포어는 비리보솜 [3][8]펩타이드이지만,[9] 일부는 독립적으로 생합성된다.
시데로포어는 또한 [3][4][10]철분 획득을 위해 일부 병원성 박테리아에게 중요하다.포유류의 숙주에서 철분은 헤모글로빈, 트랜스페린, 락토페린, 페리틴과 같은 단백질에 단단히 결합되어 있습니다.철의 엄격한 항상성은 약 10−24 mol−1 [11]L의 자유 농도로 이어지며, 따라서 이 금속을 얻기 위해 병원성 박테리아에 가해지는 엄청난 진화 압력이 있다.예를 들어 탄저균 안트라시스는 2개의 시데로포어인 바실리박틴과 페트로박틴을 방출하여 철분을 포함한 단백질로부터 철이온을 소거한다.바실리박틴이 면역계 단백질인 [12]시데로칼린과 결합하는 것으로 나타난 반면, 페트로박틴은 면역계를 회피하는 것으로 추정되며 [13]생쥐의 독성에 중요한 것으로 나타났다.
시데로포어는 알려진 Fe와 가장 강한3+ 결합체 중 하나이며, 엔테로박틴은 이것들 [11]중 가장 강한 결합체 중 하나입니다.이러한 특성 때문에 금속 킬레이트 치료에 대한 의학계의 관심을 끌었으며, 시데로포어 데스페리오옥사민 B는 철중독 및 시상혈증 [14]치료에 널리 사용되고 있다.
시데로포어 외에도 일부 병원성 박테리아는 혈구(헴 결합 스캐빙 단백질)를 생성하거나 철/[15]헴 단백질에 직접 결합하는 수용체를 가지고 있다.진핵생물에서 철의 용해성과 흡수를 높이기 위한 다른 전략은 주변의 산성화(예를 들어 식물 뿌리에 의해 사용됨) 또는 Fe가3+2+ 더 용해성 Fe 이온으로 환원되는 것이다.
구조.
시데로포어는 일반적으로 Fe와 함께3+ 안정적이고, 육면체형, 팔면체형 복합체를 형성하지만, 다른 자연 발생 풍부한 금속 이온에 비해 물은 또한 조정할 수 있다.가장 효과적인 시데로포어는 분자당 3개의 이원배위자를 가지며, 헥사덴테이트 복합체를 형성하고 별도의 배위자를 [16]가진 단일 철 이온 킬레이트 때문에 발생하는 것보다 작은 엔트로픽 변화를 일으킨다.Fe는3+ 강력한 루이스산으로 음이온성 또는 중성 산소 원자와 같은 강력한 루이스 염기를 선호합니다.미생물은 보통 철분을 이 배위자들과 친화력이 거의 없는 Fe로2+ 환원시킴으로써 시데로포어에서 방출합니다.[8][2]
시데로포어는 보통 철 킬레이트 시 사용되는 배위자에 의해 분류된다.시데로포어의 주요 그룹에는 카테콜레이트(페놀레이트), 하이드록사메이트 및 카르복실레이트(예:[3] 구연산 유도체)가 포함된다.구연산은 또한 시데로포어 [17]역할을 할 수 있다.다양한 시데로포어는 구조적으로 다른 시데로포어를 생성하기 위해 미생물에 가해진 진화 압력 때문일 수 있으며, 다른 미생물의 특정 활성 수송 시스템에 의해 운반될 수 없거나 숙주 [3][10]유기체에 의해 비활성화된 병원체의 경우입니다.
다양성
다양한 박테리아와 곰팡이에 의해 생성되는 시데로포어의 예:


히드록사메이트 시데로포어
| 시데로포어 | 유기체 |
|---|---|
| 페리크롬 | 우스티라고스파이로게나 |
| 데스페리옥사민B (디페록사민) | 스트렙토미세스필로수스 |
| 데스페리옥사민E | 스트렙토미세스실색소 |
| 푸사리나인C | 후사리움로즈움 |
| 오르니박틴 | 부르크홀데리아 세파시아 |
| 로도토룰산 | 로도토룰라필리마나과 |
카테콜라트 시데로포어
| 시데로포어 | 유기체 |
|---|---|
| 엔테로박틴 | 대장균 장내 세균 |
| 바실리박틴 | 서브틸리스균 |
| 비브리오박틴 | 비브리오콜레라 |
혼합 배위자
| 시데로포어 | 유기체 |
|---|---|
| 아조토박틴 | 아조토박터비란디 |
| 피오버딘 | 히가시모나스아루기노사 |
| 예르시아박틴 | 예르시니아페스티스 |
아미노카르본산염배위자
| 시데로포어 | 유기체 |
|---|---|
| 무긴산 | 호데움 벌가레 보리 |
| 니코티아나민 | 밥 |
시데로포 구조(250개 이상)의 포괄적인 목록은 부록 1에 [3]참조로 제시된다.
생물학적 기능
세균 및 곰팡이
환경에서의 철분 제한에 대응하여 마이크로베 시데로포 생성 및 흡수에 관여하는 유전자가 억제되어 시데로포 및 적절한 흡수단백질의 제조로 이어진다.박테리아에서 Fe 의존성2+ 억제제는 높은 세포 내 철분 농도로 시데로포어 생성에 관여하는 유전자에 상류의 DNA에 결합한다.낮은 농도에서 Fe는2+ 억제제로부터 분리되고, 다시 DNA로부터 분리되어 유전자의 전사를 이끈다.그램 음성과 AT가 풍부한 그램 양성 박테리아에서 이것은 보통 Fur(철흡수 조절기) 억제기에 의해 조절되는 반면, GC가 풍부한 그램 양성 박테리아(예: Actinomycetota)에서는 DtxR(디프테리아 독소 억제기), 이른바 디프테리아에 의한 위험한 디프테리아 독소의 생성이다.시스템입니다.[8]
그 후 시데로포는 세포외 환경으로 배설되며, 시데로포는 [3][18][19][20]철을 격리하고 가용화하는 역할을 한다.시데로포어는 세포 [2][3][21]외막의 세포 특이 수용체에 의해 인식된다.곰팡이류 및 기타 진핵생물에서는 Fe-사이더로포 복합체가 세포막을 통해 활발하게 운반되는 동안 Fe-사이더로포 복합체는 세포외적으로 Fe로2+ 환원될 수 있다.그람음성세균은 TonB의존성 수용체를 통해 periplasm으로 운반되고 ABC전달체에 [3][8][16][22]의해 세포질로 전달된다.
일단 세포의 세포질에 들어가면, Fe-시데로포3+ 복합체는 철을 방출하기 위해 보통 Fe로2+ 환원되며, 특히 하이드록사메이트 및 카르복실산염과 같은 "위커" 시데로포 리간드의 경우에는 철을 방출한다.시데로포어 분해 또는 다른 생물학적 메커니즘도 [16]철을 방출할 수 있으며, 특히 환원전위가 플라빈 아데닌 디뉴클레오티드 등의 환원제에 비해 너무 낮은 카테콜레이트인 경우에는 [11]철을 방출하기 위해 효소적 분해가 필요하다.
식물
대부분의 토양에는 식물이 자라기에 충분한 철분이 있지만 수산화철(II)의 낮은 용해성으로 인해 석회질 토양에서는 식물 철분 결핍이 문제입니다.석회질 토양은 세계 농지의 30%를 차지한다.이러한 조건하에서, 식물(곡물, 곡물, 쌀)은 [23]토양에 피토시데로포어를 분비하는데, 대표적인 예가 디옥시무진산이다.피토시데로포어는 단일 α-히드록시카르본산염 단위와 함께 2개의 α-아미노카르본산염 결합 중심을 가진 균류 및 세균성 시데로포어와 다른 구조를 가진다.이 후자의 2등분 함수는 철(II)에 대한 높은 선택성을 가진 피토시데로포어를 제공한다.철분이 부족한 토양에서 자라게 되면, 석화과 식물의 뿌리는 시데로포어를 뿌리권에 분비한다.철(II)을 소거할 때 철-피토시데로포 복합체는 양성자 기호 메커니즘을 [24]사용하여 세포질막을 가로질러 운반된다.철(II) 복합체는 철(II)로 분해된다.II) 그리고 철분은 니코티아나민으로 이행된다.이것은 피토시데로포어와 매우 유사하지만 철분은 선택적이다.II) [25]뿌리에서 분비되지 않는다.니코티아닌은 모든 식물 부위에 인두 속의 철분을 전이시킨다.
녹농균 킬레이트
철분은 박테리아 Pseudomonas aeruginosa의 중요한 영양소이지만, 환경에서는 철분을 쉽게 구할 수 없습니다.이 문제를 극복하기 위해, [26]P. aeruginosa는 철을 결합하고 운반하는 시데로포어를 생산합니다.그러나 시데로포어를 만든 박테리아가 반드시 철분 섭취의 직접적인 혜택을 받는 것은 아니다.오히려 세포 집단의 모든 구성원들이 철-사이데로포 복합체에 동등하게 접근할 가능성이 있다.시데로포어의 생산은 또한 박테리아가 에너지를 소비하도록 요구한다.따라서, 시데로포어 생산은 지역 그룹에게는 유익하지만 개인에게는 비용이 많이 들기 때문에 이타적인 특성으로 볼 수 있다.이 이타적인 역학은 세포 집단의 모든 구성원이 사이더포어 생산에 동등하게 기여할 것을 요구한다.그러나 때때로 돌연변이가 일어나 일부 박테리아가 더 적은 양의 시데로포어를 생산하게 될 수 있다.이러한 돌연변이는 박테리아가 에너지 비용을 겪지 않고 시데로포어 생산으로부터 이익을 얻을 수 있기 때문에 진화상의 이점을 준다.따라서, 더 많은 에너지가 성장에 할당될 수 있습니다.이러한 시데로포어를 효율적으로 생산할 수 있는 세포 집단의 구성원은 일반적으로 협력자라고 불리며, 시데로포어를 거의 또는 전혀 생산하지 않는 구성원은 종종 [27]부정행위자라고 불립니다.연구에 따르면 협동조합과 부정행위자가 함께 성장하면 협동조합의 체력은 떨어지는 반면 부정행위자는 체력이 증가하는 것으로 나타났다.철 [28]제한이 증가함에 따라 적합성 변화의 크기가 증가하는 것으로 관찰된다.피트니스가 증가하면 부정행위자는 협력자를 능가할 수 있습니다. 이는 충분한 사이드로포어 생산 부족으로 인해 그룹의 피트니스가 전반적으로 감소합니다.
생태학
철분은 거의 모든 호기성 미생물의 중요한 성장 제한 요소 중 하나이며 철분은 낮은 철 가용성으로 정의된 생태학적 틈새에서 중요해진다.4개의 주요 생태 서식지가 있습니다: 토양과 지표수, 해수, 식물 조직, 그리고 동물 조직.
토양 및 지표수
토양은 세균과 곰팡이속의 풍부한 원천이다.일반적인 그램 양성종은 방선균류에 속하는 종과 바실러스, 아트로박터, 노카디아속 종이다.이들 유기체의 대부분은 페리오옥사민을 생산하고 분비하며, 이는 생산 유기체뿐만 아니라 외인성 시데로포어를 이용할 수 있는 다른 미생물군의 성장을 촉진시킨다.토양 곰팡이에는 아스페르길루스와 페니실륨이 주로 페리크롬을 생성한다.이 시데로포어 그룹은 고리형 헥사펩타이드로 구성되며, 결과적으로 부식질 [29]토양에 존재하는 광범위한 가수 분해 효소와 관련된 환경 열화에 매우 내성이 있습니다.부패 식물 물질을 포함하는 토양은 3-4의 낮은 pH 값을 가진다.이러한 조건에서 히드록사메이트 시데로포어를 생성하는 유기체는 이러한 분자의 극도의 산 안정성 때문에 유리하다.민물의 미생물 개체수는 토양과 유사하며, 실제로 많은 박테리아가 토양에서 밀려나온다.또한 담수호에는 슈도모나스, 아조모나스, 아에로모노스, 알칼리제네스 종의 개체수는 Pseudomonas, Azomonas, Aeromonos,[30] Alcaligenes입니다.
해수
대부분의 담수원과 달리 해수 표면 철분 수위는 매우 낮고(200m 상단에서 1nM~1μM), V, Cr, Co, Ni, Cu 및 Zn보다 훨씬 낮다.이 철은 거의 모두 철(III) 상태로 유기 [31]배위자와 복합되어 있다.이러한 낮은 철분 수치는 식물성 플랑크톤의 1차 생산을 제한하고 철분 유입이 식물성 플랑크톤의 성장을 촉진하고 그에 따라 대기2 중 CO를 감소시킬 것이라는[32] 철 가설로 이어졌다.이 가설은 10개 이상의 다른 경우에 걸쳐 시험되었고 모든 경우에서 대규모 꽃피우는 결과를 낳았다.하지만, 꽃은 다양한 기간 동안 지속되었다.이러한 연구들 중 일부에서 이루어진 흥미로운 관찰은 첨가된 철의 농도와 일치하기 위해 유기 배위자의 농도가 짧은 기간에 걸쳐 증가했다는 것이다. 따라서 생물학적 기원을 암시하고 철에 대한 친화력이 아마도 사이더포어나 사이더포어 유사 [33]성질의 것일 수 있다.철분유기성 꽃에서 유의하게 이종영양세균도 증가하였다.따라서 식물성 플랑크톤과 이종영양세균 사이에는 상승요소가 존재한다.식물성 플랑크톤은 철분(세균성 시데로포어)을 필요로 하며, 이종영양성 박테리아는 비 CO 탄소원(식물성 플랑크톤)을2 필요로 한다.
원양 해양 환경의 희박한 성질은 대규모 확산 손실을 촉진하고 일반적인 시데로포어 기반 철 흡수 전략의 효율성에 문제를 일으킵니다.그러나 많은 이종영양 해양박테리아는 육지 생물에 의해 생성된 것과 다른 특성을 가지고 있음에도 불구하고 시데로포어를 생산한다.많은 해양 시데로포어들은 표면 활동적이며, 예를 들어 아쿠아셀린과 같은 분자 집단을 형성하는 경향이 있다.지방 아실 사슬의 존재는 높은 표면 활성과 미셀 [34]형성 능력을 가진 분자를 만든다.따라서, 분비될 때, 이러한 분자들은 표면과 서로 결합하고, 따라서 분비되는 유기체로부터 멀어지는 확산 속도를 늦추고 비교적 높은 국소 시데로포 농도를 유지한다.식물성 플랑크톤은 철분 요구량이 높지만 대부분(그리고 모든 것)은 시데로포어를 생성하지 않는다.그러나 식물성 플랑크톤은 막결합 환원효소의[35] 도움으로 철분을 시데로포어 복합체로부터 얻을 수 있으며, 확실히 철로부터 얻을 수 있다.II) 철(II) 시데로포어의 광화학 분해를 통해 생성된다.따라서 식물성 플랑크톤에 의해 흡수되는 철(아마도 모든 철)의 많은 부분이 세균성 시데로포어 [36]생산에 의존합니다.
식물 병원체
대부분의 식물 병원균은 침입한 유기체의 확산을 촉진하는 펙트 분해 효소를 방출함으로써 아포플라즘에 침입한다.박테리아는 기공을 통해 조직에 침입함으로써 식물을 감염시키는 경우가 많다.식물에 들어간 후 그들은 세포간 공간에서 퍼지고 번식한다.세균성 혈관 질환의 경우 목질을 통해 식물 내에서 감염이 확산된다.
일단 식물 안에 들어가면, 박테리아는 두 개의 주요 철분 운반 리간드인 니코티아나민과 [37]구연산염으로부터 철분을 청소할 수 있어야 한다.이를 위해 그들은 시데로포어를 생산하고, 따라서 장균성 엘위니아 국화는 크리소박틴과 아크로모박틴이라는 [38]두 개의 시데로포어를 생산합니다.크산토모나스 식물 병원체는 철분을 [39]청소하기 위해 크산토페린 시데로포어를 생성한다.
사람과 마찬가지로 식물도 주요 자작나무 꽃가루 알레르겐인 Bet v 1과 같이 숙주 방어에 관여하는 시데로포어 결합 단백질을 가지고 있는데, 이들은 보통 분비되고 리포칼린과 유사한 [36]구조를 가지고 있다.
동물 병원체
병원성 박테리아와 곰팡이는 동물 조직의 생존 수단을 발전시켰다.위장관(Escherichia, Shigella 및 Salmonella), 폐(Pseudomonas, Bordatella, Streptococcus 및 Corynebacterium), 피부(Staphyloccus), 요로(Escherichia 및 Pseudomonas)에 침입할 수 있습니다.이러한 박테리아는 상처(Vibrio와 Staphylocucus)를 굳히고 패혈증(Yersinia와 Bacillus)의 원인이 될 수 있습니다.마이코박테륨과 같은 몇몇 박테리아는 세포 내 장기간에 걸쳐 생존한다.(표 참조).세균과 진균의 지속적인 침입 위험 때문에, 동물들은 면역학적 전략, 보체 체계, 철-사이데로포어 결합 단백질의 생산 및 [40]철의 일반적인 "탈출"을 기반으로 많은 방어선을 발달시켰다.
| 감염유형 | 유기체 | 시데로포어 |
|---|---|---|
| 이질 | 시겔라 스펜서 | 에어로박틴 |
| 장내 감염 | 대장균 | 엔테로박틴 |
| 장티푸스 | 살모넬라균 발작 | 살모켈린 |
| 전염병 | 예르시니아 스펜서 | 예르시아박틴 |
| 콜레라 | Vibrio sp. | 비브리오박틴 |
| 폐감염 | Pseudomonas sp. | 피오버딘류 |
| 백일해 | Bordetella sp. | 알칼리긴 |
| 결핵 | 결핵균 | 마이코박틴류 |
| 피부 및 점막 감염 | 포도상구균성 포도상구균 | 포도상구균 A |
| 탄저균 | 무연균 | 페트로박틴 |
미생물의 침입에 대한 보호를 제공하는 대부분의 동물에는 두 가지 주요 철 결합 단백질 유형이 있습니다. 즉, 세포 외 보호는 트랜스페린 계열의 단백질에 의해 달성되고 세포 내 보호는 페리틴에 의해 달성됩니다.트랜스페린은 혈청 중 약 30μM에서 존재하며 철에 대한 친화력이 매우 높은 두 개의 철 결합 부위를 포함한다.정상 조건에서는 약 25~40%의 포화 상태이며, 이는 혈청에서 자유롭게 사용할 수 있는 철분이 즉시 소거되어 미생물의 성장을 방해한다는 것을 의미합니다.대부분의 시데로포어는 트랜스페린에서 철분을 제거할 수 없다.포유류는 또한 혈청 트랜스페린과 비슷하지만 [41]철분에 대한 친화력이 더 높은 락토페린을 생산한다.락토페린은 땀, 눈물 및 우유와 같은 분비액에 존재하여 세균 감염을 최소화합니다.
페리틴은 세포의 세포질에 존재하며 세포 내 철분 농도를 약 1μM으로 제한한다.페리틴은 트랜스페린보다 훨씬 큰 단백질이며 수천 개의 철 원자를 무독성 형태로 결합시킬 수 있습니다.시데로포어는 페리틴으로부터 철분을 직접 동원할 수 없다.
이들 2종류의 철결합단백질 외에 호르몬인 헥시딘은 흡수성 장세포, 철분저장 간세포 및 [42]대식세포로부터의 철분 방출을 제어하는 데 관여한다.감염은 염증을 유발하고 인터류킨-6(IL-6)의 방출로 이어지며 이는 헵시딘 발현을 자극한다.사람의 경우 IL-6가 생성되면 혈청 철분이 낮아져 침입한 병원균이 감염되기 어렵다.이러한 철분 고갈은 세포외 [40]및 세포내 위치 모두에서 세균의 성장을 제한하는 것으로 입증되었다.
"철 철수" 전술 외에도, 포유류는 철-사이데로포어 결합 단백질인 사이데로클린을 생산합니다.시데로클린(Siderochelin)은 배열은 다양하지만 여러 개의 인접한 β-스트랜드와 결합 부위를 형성하는 8가닥 역평행 β-배럴인 고도로 보존된 구조적 접힘을 나타낸다.시데로칼린(리포칼린 2)은 또한 소수성 포켓에 3개의 양전하 잔류물을 가지며, 이것들은 철(III)–엔터박틴에 [11]대한 높은 친화력 결합 부위를 형성한다.시데로칼린은 대장균에 대한 강력한 정균제이다.감염의 결과로 대식세포와 간세포에 의해 분비되며, 엔테로박틴은 세포외 공간에서 소거된다.
의료 응용 프로그램
시데로포어는 철과 알루미늄의 과부하 치료와 항생제의 개량된 [10][43][3]표적 치료를 위한 의학적 응용 분야를 가지고 있다.시데로포어의 역학적 경로를 이해하는 것은 시데로포어의 생합성을 차단하는 소분자 억제제를 설계할 수 있는 기회로 이어졌으며, 따라서 철분 [44][45]제한 환경에서 세균의 성장과 독성을 제한한다.
시데로포어는 철에 대한 친화력이 높기 때문에 인간의 철분 동원을 촉진하는 약물로 유용하다.잠재적으로 강력한 응용 프로그램 중 하나는 시데로포어와 항균제 사이의 결합체를 준비함으로써 시데로포어의 철분 수송 능력을 사용하여 약물을 세포로 운반하는 것이다.미생물은 특정 시데로포만을 인식하고 이용하기 때문에 이러한 결합체는 선택적 항균 [10][16]활성을 가질 것으로 예상된다.예를 들어 세팔로스포린 항생제 세피데로콜이 [46]있다.
미생물 철분수송(시데로포어) 매개 약물전달은 시데로포어를 철분전달제로서 인식함으로써 시데로포어가 부착된 약물과 동화되도록 한다.이러한 약물은 미생물에게 치명적이며 시데로포어 [10]결합체를 흡수할 때 미생물이 아포토시스화되도록 한다.시데로포어의 철결합 관능기를 항생제에 첨가함으로써 그 효력이 크게 향상되었다.이것은 박테리아의 시데로포어 매개 철분 흡수 시스템 때문이다.
농업 응용 프로그램
보리, 밀 등 농업적으로 중요한 종을 포함한 포과(풀)는 뿌리를 통해 주변 토양 뿌리권에 [18]식물성 포자를 방출함으로써 철분을 효율적으로 격리할 수 있다.뿌리권의 미생물에 의해 생성된 화합물 또한 철의 가용성과 흡수를 증가시킬 수 있다.귀리 같은 식물은 이 미생물 시데로포어를 통해 철분을 흡수할 수 있다.식물에서는 부생식근 콜로니제균에 의해 생합성된 하이드록사메이트형 시데로포어 페리크롬, 로도토룰산 및 페리오옥사민 B, 카테콜형 시데로포어, 아그로박틴 및 혼합 리간드 카테콜-히드록사메이트-히드록시산 시데로포어 생합성균을 사용할 수 있는 것으로 확인되었다.이러한 모든 화합물은 간단한 영양 요구 사항을 가진 근층 박테리아 균주에 의해 생성되며, 토양, 잎, 민물, 퇴적물, 그리고 [47]바닷물에서 자연에서 발견됩니다.
형광성 슈도모나드는 특정 토양에 매개되는 식물 병원균에 대한 생물학적 방제제로 알려져 왔다.그들은 자외선 아래에서 형광을 방출하고 시데로포어 역할을 하는 황록색 색소를 생산한다.그들은 병원균의 성장과 병원 [48]형성에 필요한 철분을 빼앗는다.
기타 금속 이온 킬레이트
시데로포어는 천연이든 합성이든 철 이온 이외의 금속 이온을 킬레이트할 수 있습니다.예를 들어 알루미늄,[2][21][47][49] 갈륨,[2][21][47][49] 크롬,[21][47] 구리,[21][47][49] 아연,[21][49] 납,[21] 망간,[21] 카드뮴,[21] 바나듐,[21] 지르코늄,[50] 인듐,[21][49] 플루토늄,[51] 베르켈륨, 캘리포니아,[52][51] 우라늄 등이 있습니다.
관련 프로세스
철분을 동화시키는 다른 방법은 표면 환원, pH의 저하, 헴의 이용 또는 단백질 복합 [2]금속의 추출이다.최근의 데이터는 시데로포어와 유사한 성질을 가진 철결 분자가 인산염 제한 성장 조건에서 해양 박테리아에 의해 생성되었음을 시사한다.자연에서 인산염은 다른 종류의 철광물에 결합하고, 따라서 박테리아가 [53]인산염에 접근하기 위해 시데로포어 같은 분자를 사용하여 그러한 복합체를 녹일 수 있다는 가설을 세웠다.
「 」를 참조해 주세요.
레퍼런스
- ^ Hossain MB, Eng-Wilmot DL, Loghry RA, an der Helm D (1980). "Circular Dichroism, Crystal Structure, and Absolute Configuration of the Siderophore Ferric N,N',N"-Triacetylfusarinine, FeC39H57N6O15". Journal of the American Chemical Society. 102 (18): 5766–5773. doi:10.1021/ja00538a012.
- ^ a b c d e f Neilands JB (November 1995). "Siderophores: structure and function of microbial iron transport compounds". The Journal of Biological Chemistry. 270 (45): 26723–6. doi:10.1074/jbc.270.45.26723. PMID 7592901.
- ^ a b c d e f g h i j Hider RC, Kong X (May 2010). "Chemistry and biology of siderophores". Natural Product Reports. 27 (5): 637–57. doi:10.1039/b906679a. PMID 20376388. S2CID 36973725.
- ^ a b Crosa JH, Mey AR, Payne SM, eds. (2004). Iron Transport in Bacteria. ASM Press. ISBN 978-1-55581-292-8.
- ^ Cornelis P, Andrews SC, eds. (2010). Iron Uptake and Homeostasis in Microorganisms. Caister Academic Press. ISBN 978-1-904455-65-3.
- ^ Johnstone TC, Nolan EM (April 2015). "Beyond iron: non-classical biological functions of bacterial siderophores". Dalton Transactions. 44 (14): 6320–39. doi:10.1039/C4DT03559C. PMC 4375017. PMID 25764171.
- ^ Kraemer SM (2005). "Iron oxide dissolution and solubility in the presence of siderophores" (PDF). Aquatic Sciences. 66: 3–18. doi:10.1007/s00027-003-0690-5. hdl:20.500.11850/51424. S2CID 41370228.
- ^ a b c d Miethke M, Marahiel MA (September 2007). "Siderophore-based iron acquisition and pathogen control". Microbiology and Molecular Biology Reviews. 71 (3): 413–51. doi:10.1128/MMBR.00012-07. PMC 2168645. PMID 17804665.
- ^ Challis GL (April 2005). "A widely distributed bacterial pathway for siderophore biosynthesis independent of nonribosomal peptide synthetases". ChemBioChem. 6 (4): 601–11. doi:10.1002/cbic.200400283. PMID 15719346. S2CID 30059412.
- ^ a b c d e Miller MJ, Malouin F (1993). "Microbial iron chelators as drug delivery agents: the rational design and synthesis of siderophore-drug conjugates". Accounts of Chemical Research. 26 (5): 241–249. doi:10.1021/ar00029a003.
- ^ a b c d Raymond KN, Dertz EA, Kim SS (April 2003). "Enterobactin: an archetype for microbial iron transport". Proceedings of the National Academy of Sciences of the United States of America. 100 (7): 3584–8. Bibcode:2003PNAS..100.3584R. doi:10.1073/pnas.0630018100. PMC 152965. PMID 12655062.
- ^ Abergel RJ, Wilson MK, Arceneaux JE, Hoette TM, Strong RK, Byers BR, Raymond KN (December 2006). "Anthrax pathogen evades the mammalian immune system through stealth siderophore production". Proceedings of the National Academy of Sciences of the United States of America. 103 (49): 18499–503. Bibcode:2006PNAS..10318499A. doi:10.1073/pnas.0607055103. PMC 1693691. PMID 17132740.
- ^ Cendrowski S, MacArthur W, Hanna P (January 2004). "Bacillus anthracis requires siderophore biosynthesis for growth in macrophages and mouse virulence" (PDF). Molecular Microbiology. 51 (2): 407–17. doi:10.1046/j.1365-2958.2003.03861.x. hdl:2027.42/72033. PMID 14756782. S2CID 20245136.
- ^ Zhou T, Ma Y, Kong X, Hider RC (June 2012). "Design of iron chelators with therapeutic application". Dalton Transactions. 41 (21): 6371–89. doi:10.1039/c2dt12159j. PMID 22391807.
- ^ Krewulak KD, Vogel HJ (September 2008). "Structural biology of bacterial iron uptake". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1778 (9): 1781–804. doi:10.1016/j.bbamem.2007.07.026. PMID 17916327.
- ^ a b c d Roosenberg JM, Lin YM, Lu Y, Miller MJ (February 2000). "Studies and syntheses of siderophores, microbial iron chelators, and analogs as potential drug delivery agents". Current Medicinal Chemistry. 7 (2): 159–97. doi:10.2174/0929867003375353. PMID 10637361.
- ^ Winkelmann G, Drechsel H (1999). "Chapter 5: Microbial Siderophores". Biotechnology (2nd ed.).
- ^ a b Kraemer SM, Crowley D, Kretzschmar R (2006). Siderophores in Plant Iron Acquisition: Geochemical Aspects. Advances in Agronomy. Vol. 91. pp. 1–46. doi:10.1016/S0065-2113(06)91001-3. ISBN 978-0-12-000809-4.
- ^ Kraemer SM, Butler A, Borer P, Cervini-Silva J (2005). "Siderophores and the dissolution of iron bearing minerals in marine systems". Reviews in Mineralogy and Geochemistry. 59 (1): 53–76. Bibcode:2005RvMG...59...53K. doi:10.2138/rmg.2005.59.4.
- ^ Huyer M, Page WJ (1988). "Zn2+ Increases Siderophore Production in Azotobacter vinelandii". Applied and Environmental Microbiology. 54 (11): 2625–2631. Bibcode:1988ApEnM..54.2625H. doi:10.1128/AEM.54.11.2625-2631.1988. PMC 204346. PMID 16347766.
- ^ a b c d e f g h i j k del Olmo A, Caramelo C, SanJose C (December 2003). "Fluorescent complex of pyoverdin with aluminum". Journal of Inorganic Biochemistry. 97 (4): 384–7. doi:10.1016/S0162-0134(03)00316-7. PMID 14568244.
- ^ Cobessi D, Meksem A, Brillet K (February 2010). "Structure of the heme/hemoglobin outer membrane receptor ShuA from Shigella dysenteriae: heme binding by an induced fit mechanism". Proteins. 78 (2): 286–94. doi:10.1002/prot.22539. PMID 19731368. S2CID 22986795.
- ^ Sugiura Y, Nomoto K (1984). "Phytosiderophores structures and properties of mugineic acids and their metal complexes". Structure and Bonding. 58: 107–135. doi:10.1007/BFb0111313. ISBN 978-3-540-13649-1.
- ^ Mori S, Sigel A, Sigel H, eds. (1998). Iron transport in graminaceous plants. Metal Ions in Biological Systems. pp. 216–238.
- ^ Walker EL, Connolly EL (October 2008). "Time to pump iron: iron-deficiency-signaling mechanisms of higher plants". Current Opinion in Plant Biology. 11 (5): 530–5. doi:10.1016/j.pbi.2008.06.013. PMID 18722804.
- ^ Buckling A, Harrison F, Vos M, Brockhurst MA, Gardner A, West SA, Griffin A (November 2007). "Siderophore-mediated cooperation and virulence in Pseudomonas aeruginosa". FEMS Microbiology Ecology. 62 (2): 135–41. doi:10.1111/j.1574-6941.2007.00388.x. PMID 17919300.
- ^ Harrison F, Browning LE, Vos M, Buckling A (July 2006). "Cooperation and virulence in acute Pseudomonas aeruginosa infections". BMC Biology. 4: 21. doi:10.1186/1741-7007-4-21. PMC 1526758. PMID 16827933.
- ^ Griffin AS, West SA, Buckling A (August 2004). "Cooperation and competition in pathogenic bacteria". Nature. 430 (7003): 1024–7. Bibcode:2004Natur.430.1024G. doi:10.1038/nature02744. hdl:1842/698. PMID 15329720. S2CID 4429250.
- ^ Winkelmann G (June 2007). "Ecology of siderophores with special reference to the fungi". Biometals. 20 (3–4): 379–92. doi:10.1007/s10534-006-9076-1. PMID 17235665. S2CID 25877869.
- ^ Winkelmann G, Crosa JH, Mey AR, Payne SM, eds. (2004). "28". Iron transport in Bacteria. ASM Press. pp. 437–450. ISBN 978-1-55581-292-8.
- ^ Rue EL, Bruland KW (1995). "Complexation of iron(III) by natural organic ligands in the Central North Pacific as determined by a new competitive ligand equilibration/adsorptive cathodic stripping voltammetric method". Mar. Chem. 50 (1–4): 117–138. doi:10.1016/0304-4203(95)00031-L.
- ^ Martin JH (1990). "Glacial-interglacial CO2 change: The Iron Hypothesis". Paleoceanography. 5 (1): 1–13. Bibcode:1990PalOc...5....1M. doi:10.1029/PA005i001p00001.
- ^ Butler A (August 2005). "Marine siderophores and microbial iron mobilization". Biometals. 18 (4): 369–74. doi:10.1007/s10534-005-3711-0. PMID 16158229. S2CID 1615365.
- ^ Xu G, Martinez JS, Groves JT, Butler A (November 2002). "Membrane affinity of the amphiphilic marinobactin siderophores". Journal of the American Chemical Society. 124 (45): 13408–15. doi:10.1021/ja026768w. PMID 12418892.
- ^ Hopkinson BM, Morel FM (August 2009). "The role of siderophores in iron acquisition by photosynthetic marine microorganisms". Biometals. 22 (4): 659–69. doi:10.1007/s10534-009-9235-2. PMID 19343508. S2CID 11008050.
- ^ a b Roth-Walter F, Gomez-Casado C, Pacios LF, Mothes-Luksch N, Roth GA, Singer J, et al. (June 2014). "Bet v 1 from birch pollen is a lipocalin-like protein acting as allergen only when devoid of iron by promoting Th2 lymphocytes". The Journal of Biological Chemistry. 289 (25): 17416–21. doi:10.1074/jbc.M114.567875. PMC 4067174. PMID 24798325.
- ^ Klair S, Bansal S, Briat JF, Khodr H, Shioiri T, Leigh RA, Hider RC (March 1999). "Nicotianamine chelates both FeIII and FeII. Implications for metal transport in plants". Plant Physiology. 119 (3): 1107–14. doi:10.1104/pp.119.3.1107. PMC 32093. PMID 10069850.
- ^ Expert D, Rauscher L, Franza T, Crosa JH, Mey AR, Payne SM, eds. (2004). "26". Iron transport in Bacteria. ASM Press. pp. 402–412. ISBN 978-1-55581-292-8.
- ^ Pandey SS, Patnana PK, Rai R, Chatterjee S (September 2017). "Xanthoferrin, the α-hydroxycarboxylate-type siderophore of Xanthomonas campestris pv. campestris, is required for optimum virulence and growth inside cabbage". Molecular Plant Pathology. 18 (7): 949–962. doi:10.1111/mpp.12451. PMC 6638303. PMID 27348422.
- ^ a b Weinberg ED (July 2009). "Iron availability and infection". Biochimica et Biophysica Acta (BBA) - General Subjects. 1790 (7): 600–5. doi:10.1016/j.bbagen.2008.07.002. PMID 18675317.
- ^ Crichton R, ed. (2001). Inorganic Biochemistry of Iron Metabolism. Wiley. ISBN 978-0-471-49223-8.
- ^ Rivera S, Liu L, Nemeth E, Gabayan V, Sorensen OE, Ganz T (February 2005). "Hepcidin excess induces the sequestration of iron and exacerbates tumor-associated anemia". Blood. 105 (4): 1797–802. doi:10.1182/blood-2004-08-3375. PMID 15479721.
- ^ Gumienna-Kontecka E, Carver PL (2019). "Chapter 7. Building a Trojan Horse: Siderophore-Drug Conjugates for the Treatment of Infectious Diseases". In Sigel A, Freisinger E, Sigel RK, Carver PL (eds.). Essential Metals in Medicine:Therapeutic Use and Toxicity of Metal Ions in the Clinic. Metal Ions in Life Sciences. Vol. 19. Berlin: de Gruyter GmbH. pp. 181–202. doi:10.1515/9783110527872-013. ISBN 978-3-11-052691-2. PMID 30855108.
- ^ Ferreras JA, Ryu JS, Di Lello F, Tan DS, Quadri LE (June 2005). "Small-molecule inhibition of siderophore biosynthesis in Mycobacterium tuberculosis and Yersinia pestis". Nature Chemical Biology. 1 (1): 29–32. doi:10.1038/nchembio706. PMID 16407990. S2CID 44826522.
- ^ Simpson DH, Scott P (2017). "Antimicrobial Metallodrugs". In Lo K (ed.). Inorganic and Organometallic Transition Metal Complexes with Biological Molecules and Living Cells. Elsevier. ISBN 9780128038871.
- ^ Ito A, Nishikawa T, Matsumoto S, et al. (December 2016). "Siderophore Cephalosporin Cefiderocol Utilizes Ferric Iron Transporter Systems for Antibacterial Activity against Pseudomonas aeruginosa". Antimicrobial Agents and Chemotherapy. 60 (12): 7396–7401. doi:10.1128/AAC.01405-16. PMC 5119021. PMID 27736756.
- ^ a b c d e Carrillo-Castañeda G, Juárez Muños J, Peralta-Videa JR, Gomez E, Tiemannb KJ, Duarte-Gardea M, Gardea-Torresdey JL (2002). "Alfalfa growth promotion by bacteria grown under iron limiting conditions". Advances in Environmental Research. 6 (3): 391–399. doi:10.1016/S1093-0191(02)00054-0.
- ^ Jagadeesh KS, Kulkarni JH, Krishnaraj PU (2001). "Evaluation of the role of fluorescent siderophore in the biological control of bacterial wilt in tomato using Tn5 mutants of fluorescent Pseudomonas sp". Current Science. 81: 882.
- ^ a b c d e Hider RC, Hall AD (1991). Clinically useful chelators of tripositive elements. Progress in Medicinal Chemistry. Vol. 28. pp. 41–173. doi:10.1016/s0079-6468(08)70363-1. ISBN 9780444812759. PMID 1843549.
- ^ Captain I, Deblonde GJ, Rupert PB, An DD, Illy MC, Rostan E, et al. (November 2016). "Engineered Recognition of Tetravalent Zirconium and Thorium by Chelator-Protein Systems: Toward Flexible Radiotherapy and Imaging Platforms". Inorganic Chemistry. 55 (22): 11930–11936. doi:10.1021/acs.inorgchem.6b02041. OSTI 1458481. PMID 27802058.
- ^ a b John SG, Ruggiero CE, Hersman LE, Tung CS, Neu MP (July 2001). "Siderophore mediated plutonium accumulation by Microbacterium flavescens (JG-9)". Environmental Science & Technology. 35 (14): 2942–8. Bibcode:2001EnST...35.2942J. doi:10.1021/es010590g. PMID 11478246.
- ^ Deblonde GJ, Sturzbecher-Hoehne M, Rupert PB, An DD, Illy MC, Ralston CY, et al. (September 2017). "Chelation and stabilization of berkelium in oxidation state +IV" (PDF). Nature Chemistry. 9 (9): 843–849. Bibcode:2017NatCh...9..843D. doi:10.1038/nchem.2759. OSTI 1436161. PMID 28837177.
- ^ Romano S, Bondarev V, Kölling M, Dittmar T, Schulz-Vogt HN (2017). "Pseudovibrio sp. FO-BEG1". Frontiers in Microbiology. 8 (364): 364. doi:10.3389/fmicb.2017.00364. PMC 5348524. PMID 28352252.
추가 정보
- Neilands JB (1952). "A Crystalline Organo-iron Pigment from a Rust Fungus (Ustilago sphaerogena)". J. Am. Chem. Soc. 74 (19): 4846–4847. doi:10.1021/ja01139a033.








