단구
Monocyte| 단구 | |
|---|---|
 | |
| 세부 사항 | |
| 시스템. | 면역 체계 |
| 식별자 | |
| 메쉬 | D009000 |
| TH | H2.00.04.1.02010 |
| FMA | 62864 |
| 미세해부술의 해부학적 용어 | |
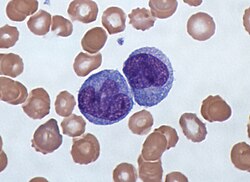
단구는 백혈구 또는 백혈구의 한 종류이다.그들은 혈액에서 가장 큰 유형의 백혈구이며 대식세포와 전통적인 수지상세포로 분화할 수 있다.척추동물의 일부로서 단구 또한 적응 면역 반응에 영향을 미치고 조직 복구 기능을 발휘한다.인간 혈액에는 표현형 수용체에 기초한 최소 3개의 아급 단구가 있다.
구조.
단구들은 외관상 아메보이드이며 비과립성 세포질을 [1]가지고 있다.따라서 이들은 때때로 아즈로필 과립 및/또는 액포를 나타낼 수 있지만 무과립구로 분류된다.직경이 15~22μm인 단구세포는 [2][3]말초혈액에서 가장 큰 세포형이다.단핵구는 단핵세포이며, 타원체 핵은 종종 소엽/침입되어 콩 모양 또는 신장 모양의 [4]외관을 일으킨다.단구들은 인체에 있는 모든 백혈구의 2%에서 10%를 차지한다.
발전
단구들은 조혈모세포와 [5]구별되는 2성세포인 단아세포라고 불리는 전구체로부터 골수에 의해 생산된다.단구들은 혈류에서 약 1일에서 3일 동안 순환한 후 전형적으로 대식세포와 수상세포로 분화되는 몸 전체의 조직으로 이동한다.
서브 모집단
인간에게는
흐름 세포측정법에 의한 단구 서브셋에 대한 최초의 명확한 설명은 CD16 양성 단구 집단이 기술된 1980년대 후반으로 거슬러 올라간다.[6][7]오늘날 인간의 [8]혈액에서 세 가지 유형의 단구들이 인식된다.
- 고전적인 단구들은 CD14 세포 표면 수용체(CD14− CD16 단구)의++ 높은 수준의 발현을 특징으로 한다.
- 비고전성 단구에서는 CD14의 낮은 수준 발현과 CD16 수용체(CD14CD16+++ 단구)[9]의 추가적인 공동 발현을 보인다.
- 중간 단구들은 높은 수준의 CD14와 낮은 수준의 CD16(CD14CD16+++ 단구)을 나타낸다.
사람의 경우 CD14 발현 수준을 사용하여 비고전적 단구 및 중간 단구를 구분할 수 있지만, slan (6-Sulfo LacNAc) 세포 표면 마커는 두 세포 [10][11]유형을 명확하게 분리하는 것으로 나타났다.
Ghattas 등은 "중간" 단구 집단은 회복 과정에 관여하는 표면 수용체(혈관 내피 성장 인자 수용체 1, 2, CXCR4, Tie-2 포함)의 비교적 높은 발현으로 인해 발달 단계와는 대조적으로 단구의 고유한 아집단이 될 가능성이 높다고 말한다.골수에서 [12]특히 "증명서" 서브셋이 풍부하다는 증거입니다.
마우스
생쥐에서 단구들은 두 개의 하위 집단으로 나눌 수 있다.인간 고전++ CD14− CD16 단구와 동등한 염증성 단구(CX3CR1low, CCR2pos, Ly6Chigh, PD-L1neg) 및 인간 비 고전 CD14에+ 해당하는 상주 단구(CX3CR1high, CCR2neg, Ly6Clow, PD-L1pos)상주하는 단구들은 내피벽을 따라 안정된 상태와 염증 조건에서 [13][14][15][16]순찰할 수 있는 능력을 가지고 있다.
기능.
단구들은 기계적으로 활성화된[17] 세포로 그들의 기능을 수행하기 위해 혈액에서 염증 부위로 이동한다.앞에서 설명한 바와 같이, 그들은 대식세포와 수상세포로 분화할 수 있지만, 다른 단구 아집단은 또한 그들 스스로 특정한 기능을 발휘할 수 있다.일반적으로, 단세포와 그 대식세포 및 수상세포 자손은 면역계에서 세 가지 주요 기능을 한다.식세포증, 항원 제시, 사이토카인 생성입니다.식세포증은 미생물과 입자를 흡수하고 그 후에 이 물질을 소화시키고 파괴하는 과정이다.단구들은 병원체를 덮는 항체나 보체와 같은 중간 단백질을 사용하여 식세포증을 수행할 수 있을 뿐만 아니라 병원체를 인식하는 패턴 인식 수용체를 통해 미생물에 직접 결합할 수 있다.단구 또한 항체 의존 세포 매개 세포 독성을 통해 감염된 숙주 세포를 죽일 수 있다.최근 이물질을 식세포화한 세포에 진공이 존재할 수 있다.
다른 이펙터 세포로의 분화
단구들은 조직으로 이동하고 상주 대식세포군을 보충할 수 있다.대식세포는 항균 및 식세포 활성도가 높아 조직을 이물질로부터 보호한다.그들은 크고 매끄러운 핵, 세포질의 넓은 영역, 그리고 이물질을 처리하기 위한 많은 내부 소포를 가진 세포들이다.단구로부터 유도할 수 있지만, 노른자낭과 태아의 [18]간에는 이미 많은 부분이 사후에 형성되어 있다.
체외에서 단구들은 사이토카인 과립구 대식세포 콜로니 자극인자(GM-CSF)와 인터류킨4를 [19]첨가함으로써 수지상 세포로 분화할 수 있다.그러나 이러한 단구유래 세포는 전사체 내에 단구의 특징을 유지하며, 본피드 [20]수지상세포가 아닌 단구와 함께 군집한다.
단구 서브 모집단의 특정 기능
단구들은 분화 능력 외에도 면역 반응을 직접적으로 조절할 수 있다.앞서 설명한 바와 같이 식세포증도 가능합니다.고전적인 하위 집단의 세포는 가장 효율적인 식세포이며 추가로 염증 자극 인자를 분비할 수 있다.중간 아군은 항원 제시와 T 림프구 [21]자극에 중요하다.간단히 말해서, 항원 제시란 식세포증 후 단구 내에 존재하는 미생물 조각이 MHC 분자로 통합되는 과정을 말한다.그런 다음 그것들은 단구(또는 대식세포 또는 수상세포)의 세포 표면으로 운반되고 항원으로 제시되어 T 림프구를 활성화하고, 그 항원에 대한 특정한 면역 반응을 일으킨다.비고전성 단구는 미생물 생성물에 의한 자극 후 종양괴사인자 및 인터류킨-12와 같은 소염성 사이토카인을 다량 생성한다.게다가, 단구 순찰을 하는 행동은 고전적 단구들과 비고전적 단구들에 대해 인간들에게 증명되어 왔는데,[22] 이것은 그들이 병원균을 검사하기 위해 내피를 따라 천천히 움직인다는 것을 의미합니다.상기 외에서는 활성화된 단구가 높은 수준의 PD-1을 발현하는 것으로 나타났으며, 이는 CD14CD16++− 단구에 비해 CD14CD16+++ 단구에서 PD-1의 높은 발현을 설명할 수 있다.그 배위자 PD-L1에 의해 단구 발현 PD-1을 유발함으로써 CD4 Th2 세포를 활성화하고 CD4 Th1 세포 [23]기능을 저해하는 IL-10 생성을 유도한다.다른 세포에 의해 생성된 많은 요소들은 단구들의 화학작용과 다른 기능들을 조절할 수 있다.이러한 인자는 특히 단구 화학요법 단백질-1(CCL2) 및 단구 화학요법 단백질-3(CCL7)과 같은 케모카인, 류코트리엔 B4와 같은 특정 아라키돈산 대사물 및 5-히드록시코사테트라산 및 옥시토에트라산 계열의 5-옥시코사테트라산 구성원을 포함한다.N-포르밀메티오닌류실페닐알라닌 및 기타 N-포르밀화 올리고펩타이드 수용체 [24]1을 활성화한다.다른 미생물 제품들은 단구들을 직접적으로 활성화 시킬 수 있고 이것은 소염과 약간의 지연과 함께 항염증 사이토카인의 생산으로 이어진다.단구에 의해 생성되는 대표적인 사이토카인은 TNF, IL-1, IL-12이다.
임상적 의의
단구수는 전체 혈액수의 일부이며, 전체 백혈구 중 단구의 백분율 또는 절대수로 표현된다.둘 다 유용할 수 있지만 이러한 세포는 단구 서브셋이 결정되었을 때만 유효한 진단 도구가 되었다.단구 세포는 COVID-19 [25]환자의 중증도와 질병 진행에 기여할 수 있다.
단구증
단구증이란 말초혈액에서 단구가 과잉된 상태를 말한다.다양한 질병 상태를 나타낼 수 있습니다.단구수를 증가시킬 수 있는 프로세스의 예는 다음과 같습니다.
- 만성 염증
- 당뇨병[26]
- 응력[27] 응답
- 쿠싱증후군(고신피질증)
- 면역 결핍증
- 육아종 질환
- 아테롬성[28] 동맥경화증
- 괴사
- 적혈구 재생
- 바이러스열
- 살코이도스
- 만성골수구성백혈병(CMML)
심각한 감염+++(패혈증)[29]에서 CD14CD16 단구 수치가 높습니다
아테롬성 동맥경화증 분야에서 CD14CD16+++ 중간 단구 다수는 위험에 [30][31]처한 모집단에서 심혈관 사건을 예측하는 것으로 나타났다.
CMML은 혈액의 지속 단구수가 1000/마이크로L 이상인 것이 특징이다.단구 서브셋의 분석은 고전적인 단구 우위와 CD14low CD16+ 단구 [32][33]부재를 보여주었다.비고전성 단구 부재는 질병 진단에 도움이 될 수 있으며, 지표로서 슬란을 사용하면 [34]특이성을 개선할 수 있다.
단핵구감소증
단구감소증은 단구결핍과 관련된 백혈구감소증의 한 형태이다.면역억제성 글루코코르티코이드 [35]치료 후 이들 세포의 수가 매우 적다.
또한 대식세포 콜로니 자극인자 수용체 [10]유전자의 돌연변이와 관련된 신경학적 질환인 스피로이드(HDLS)를 가진 유전성 확산성 백혈구증 환자에서 비클래식성 슬란+단구 수가 강하게 감소한다.
혈중 함량
「 」를 참조해 주세요.
레퍼런스
- ^ Nichols, Barbara A.; Bainton, Dorothy Ford; Farquhar, Marilyn G. (1 August 1971). "Differentiation of monocytes". Journal of Cell Biology. 50 (2): 498–515. doi:10.1083/jcb.50.2.498. PMC 2108281. PMID 4107019.
- ^ Palmer L, Briggs C, McFadden S 등명명법의 표준화와 말초혈구 형태학적 특징의 등급을 위한 ICSH 권고사항.Int J Lab Heamol. 2015;37(3):287-303.doi:10.1111/ijlh.1327
- ^ Steve, Paxton; Michelle, Peckham; Adele, Knibbs (28 April 2018). "The Leeds Histology Guide". leeds.ac.uk. Archived from the original on 11 October 2017. Retrieved 28 April 2018.
- ^ Zini, G. 광학 현미경으로 어려운 세포를 조사하는 방법.내과 J 연구실 헤마토르2021; 43: 346 ~353.https://doi.org/10.1111/ijlh.13437
- ^ Monga I, Kaur K, Dhanda S (March 2022). "Revisiting hematopoiesis: applications of the bulk and single-cell transcriptomics dissecting transcriptional heterogeneity in hematopoietic stem cells". Briefings in Functional Genomics. 21 (3): 159–176. doi:10.1093/bfgp/elac002. PMID 35265979.
- ^ Ziegler-Heitbrock, H W Loems; Passlick, Bernward; Flieger, Dimitri (December 1988). "The Monoclonal Antimonocyte Antibody My4 Stains B Lymphocytes and Two Distinct Monocyte Subsets in Human Peripheral Blood". Hybridoma. 7 (6): 521–527. doi:10.1089/hyb.1988.7.521. PMID 2466760.
- ^ Passlick, Bernward; Flieger, Dimitri; Ziegler-Heitbrock, H W Loems (November 1989). "Characterization of a human monocyte subpopulation coexpressing CD14 and CD16 antigens". Blood. 74 (7): 2527–2534. doi:10.1182/blood.V74.7.2527.2527. PMID 2478233.
- ^ Ziegler-Heitbrock, Loems; Ancuta, Petronela; Crowe, Suzanne; Dalod, Marc; Grau, Veronika; Hart, Derek N.; Leenen, Pieter J. M.; Liu, Yong-Jun; MacPherson, Gordon; Randolph, Gwendalyn J.; Scherberich, Juergen; Schmitz, Juergen; Shortman, Ken; Sozzani, Silvano; Strobl, Herbert; Zembala, Marek; Austyn, Jonathan M.; Lutz, Manfred B. (21 October 2010). "Nomenclature of monocytes and dendritic cells in blood". Blood. 116 (16): e74–e80. doi:10.1182/blood-2010-02-258558. hdl:11379/41075. PMID 20628149.
- ^ Ziegler-Heitbrock, Loems (March 2007). "The CD14+ CD16+ blood monocytes: their role in infection and inflammation". Journal of Leukocyte Biology. 81 (3): 584–592. doi:10.1189/jlb.0806510. PMID 17135573. S2CID 31534841.
- ^ a b Hofer, Thomas P.; Zawada, Adam M.; Frankenberger, Marion; Skokann, Kerstin; Satzl, Anna A.; Gesierich, Wolfgang; Schuberth, Madeleine; Levin, Johannes; Danek, Adrian; Rotter, Björn; Heine, Gunnar H.; Ziegler-Heitbrock, Loems (10 December 2015). "slan-defined subsets of CD16-positive monocytes: impact of granulomatous inflammation and M-CSF receptor mutation". Blood. 126 (24): 2601–2610. doi:10.1182/blood-2015-06-651331. PMID 26443621.
- ^ Hofer, Thomas P.; van de Loosdrecht, Arjan A.; Stahl-Hennig, Christiane; Cassatella, Marco A.; Ziegler-Heitbrock, Loems (13 September 2019). "6-Sulfo LacNAc (Slan) as a Marker for Non-classical Monocytes". Frontiers in Immunology. 10: 2052. doi:10.3389/fimmu.2019.02052. PMC 6753898. PMID 31572354.
- ^ Ghattas, Angie; Griffiths, Helen R.; Devitt, Andrew; Lip, Gregory Y.H.; Shantsila, Eduard (October 2013). "Monocytes in Coronary Artery Disease and Atherosclerosis". Journal of the American College of Cardiology. 62 (17): 1541–1551. doi:10.1016/j.jacc.2013.07.043. PMID 23973684.
- ^ Carlin, Leo M.; Stamatiades, Efstathios G.; Auffray, Cedric; Hanna, Richard N.; Glover, Leanne; Vizcay-Barrena, Gema; Hedrick, Catherine C.; Cook, H. Terence; Diebold, Sandra; Geissmann, Frederic (April 2013). "Nr4a1-Dependent Ly6Clow Monocytes Monitor Endothelial Cells and Orchestrate Their Disposal". Cell. 153 (2): 362–375. doi:10.1016/j.cell.2013.03.010. PMC 3898614. PMID 23582326.
- ^ Auffray, Cedric; Fogg, Darin; Garfa, Meriem; Elain, Gaelle; Join-Lambert, Olivier; Kayal, Samer; Sarnacki, Sabine; Cumano, Ana; Lauvau, Gregoire; Geissmann, Frederic (3 August 2007). "Monitoring of Blood Vessels and Tissues by a Population of Monocytes with Patrolling Behavior". Science. 317 (5838): 666–670. Bibcode:2007Sci...317..666A. doi:10.1126/science.1142883. PMID 17673663. S2CID 46067303.
- ^ Imhof, Beat A.; Jemelin, Stephane; Ballet, Romain; Vesin, Christian; Schapira, Marc; Karaca, Melis; Emre, Yalin (16 August 2016). "CCN1/CYR61-mediated meticulous patrolling by Ly6C low monocytes fuels vascular inflammation". Proceedings of the National Academy of Sciences. 113 (33): E4847–E4856. doi:10.1073/pnas.1607710113. PMC 4995973. PMID 27482114.
- ^ Bianchini, Mariaelvy; Duchêne, Johan; Santovito, Donato; Schloss, Maximilian J.; Evrard, Maximilien; Winkels, Holger; Aslani, Maria; Mohanta, Sarajo K.; Horckmans, Michael; Blanchet, Xavier; Lacy, Michael; von Hundelshausen, Philipp; Atzler, Dorothee; Habenicht, Andreas; Gerdes, Norbert; Pelisek, Jaroslav; Ng, Lai Guan; Steffens, Sabine; Weber, Christian; Megens, Remco T. A. (21 June 2019). "PD-L1 expression on nonclassical monocytes reveals their origin and immunoregulatory function". Science Immunology. 4 (36): eaar3054. doi:10.1126/sciimmunol.aar3054. PMID 31227596. S2CID 195259881.
- ^ Evers, Tom M.J.; Sheikhhassani, Vahid; Haks, Mariëlle C.; Storm, Cornelis; Ottenhoff, Tom H.M.; Mashaghi, Alireza (2022). "Single-cell analysis reveals chemokine-mediated differential regulation of monocyte mechanics". iScience. 25 (1): 103555. Bibcode:2022iSci...25j3555E. doi:10.1016/j.isci.2021.103555. PMC 8693412. PMID 34988399.
- ^ Murphy, K., Weaver, C. (2018년)그룬드 베그리프 데 임모놀로지.인: 제인웨이 임노졸로지.스프링거 슈펙트룸, 베를린, 하이델베르크https://doi.org/10.1007/978-3-662-56004-4_1
- ^ Sallusto, F; Cella, M; Danieli, C; Lanzavecchia, A (1 August 1995). "Dendritic cells use macropinocytosis and the mannose receptor to concentrate macromolecules in the major histocompatibility complex class II compartment: downregulation by cytokines and bacterial products". Journal of Experimental Medicine. 182 (2): 389–400. doi:10.1084/jem.182.2.389. PMC 2192110. PMID 7629501.
- ^ Robbins, Scott H; Walzer, Thierry; Dembélé, Doulaye; Thibault, Christelle; Defays, Axel; Bessou, Gilles; Xu, Huichun; Vivier, Eric; Sellars, MacLean; Pierre, Philippe; Sharp, Franck R; Chan, Susan; Kastner, Philippe; Dalod, Marc (2008). "Novel insights into the relationships between dendritic cell subsets in human and mouse revealed by genome-wide expression profiling". Genome Biology. 9 (1): R17. doi:10.1186/gb-2008-9-1-r17. PMC 2395256. PMID 18218067.
- ^ 왕, K.L. 등유전자 발현 프로파일링은 고전적, 중간적, 비고전적 인간 단구 서브셋의 정의적 특징을 드러낸다.혈액 118, e16-31, doi:10.1182/혈액-2010-12-326355 (2011)
- ^ Collison, Joanna L.; Carlin, Leo M.; Eichmann, Martin; Geissmann, Frederic; Peakman, Mark (1 August 2015). "Heterogeneity in the Locomotory Behavior of Human Monocyte Subsets over Human Vascular Endothelium In Vitro". The Journal of Immunology. 195 (3): 1162–1170. doi:10.4049/jimmunol.1401806. PMID 26085686.
- ^ Said, Elias A; Dupuy, Franck P; Trautmann, Lydie; Zhang, Yuwei; Shi, Yu; El-Far, Mohamed; Hill, Brenna J; Noto, Alessandra; Ancuta, Petronela; Peretz, Yoav; Fonseca, Simone G; Van Grevenynghe, Julien; Boulassel, Mohamed R; Bruneau, Julie; Shoukry, Naglaa H; Routy, Jean-Pierre; Douek, Daniel C; Haddad, Elias K; Sekaly, Rafick-Pierre (April 2010). "Programmed death-1–induced interleukin-10 production by monocytes impairs CD4+ T cell activation during HIV infection". Nature Medicine. 16 (4): 452–459. doi:10.1038/nm.2106. PMC 4229134. PMID 20208540.
- ^ Sozzani, S.; Zhou, D.; Locati, M.; Bernasconi, S.; Luini, W.; Mantovani, A.; O'Flaherty, J. T. (15 November 1996). "Stimulating properties of 5-oxo-eicosanoids for human monocytes: synergism with monocyte chemotactic protein-1 and -3". The Journal of Immunology. 157 (10): 4664–4671. PMID 8906847.
- ^ Gómez-Rial, Jose; Rivero-Calle, Irene; Salas, Antonio; Martinón-Torres, Federico (22 July 2020). "Role of Monocytes/Macrophages in Covid-19 Pathogenesis: Implications for Therapy". Infection and Drug Resistance. 13: 2485–2493. doi:10.2147/IDR.S258639. PMC 7383015. PMID 32801787.
- ^ Hoyer, FF; Zhang, X; Coppin, E; Vasamsetti, SB; Modugu, G; Schloss, MJ; Rohde, D; McAlpine, CS; Iwamoto, Y; Libby, P; Naxerova, K; Swirski, F; Dutta, P; Nahrendorf, P (April 2020). "Bone Marrow Endothelial Cells Regulate Myelopoiesis in Diabetes". Circulation. 142 (3): 244–258. doi:10.1161/CIRCULATIONAHA.120.046038. PMC 7375017. PMID 32316750.
- ^ Heidt, Timo; Sager, Hendrik B; Courties, Gabriel; Dutta, Partha; Iwamoto, Yoshiko; Zaltsman, Alex; von zur Muhlen, Constantin; Bode, Christoph; Fricchione, Gregory L; Denninger, John; Lin, Charles P; Vinegoni, Claudio; Libby, Peter; Swirski, Filip K; Weissleder, Ralph; Nahrendorf, Matthias (July 2014). "Chronic variable stress activates hematopoietic stem cells". Nature Medicine. 20 (7): 754–758. doi:10.1038/nm.3589. PMC 4087061. PMID 24952646.
- ^ Swirski, Filip K.; Libby, Peter; Aikawa, Elena; Alcaide, Pilar; Luscinskas, F. William; Weissleder, Ralph; Pittet, Mikael J. (2 January 2007). "Ly-6Chi monocytes dominate hypercholesterolemia-associated monocytosis and give rise to macrophages in atheromata". Journal of Clinical Investigation. 117 (1): 195–205. doi:10.1172/JCI29950. PMC 1716211. PMID 17200719.
- ^ Fingerle, G; Pforte, A; Passlick, B; Blumenstein, M; Strobel, M; Ziegler- Heitbrock, Hw (15 November 1993). "The novel subset of CD14+/CD16+ blood monocytes is expanded in sepsis patients". Blood. 82 (10): 3170–3176. doi:10.1182/blood.v82.10.3170.3170. PMID 7693040.
- ^ Heine, G.H.; Ulrich, C.; Seibert, E.; Seiler, S.; Marell, J.; Reichart, B.; Krause, M.; Schlitt, A.; Köhler, H.; Girndt, M. (March 2008). "CD14++CD16+ monocytes but not total monocyte numbers predict cardiovascular events in dialysis patients". Kidney International. 73 (5): 622–629. doi:10.1038/sj.ki.5002744. PMID 18160960.
- ^ Rogacev, Kyrill S.; Cremers, Bodo; Zawada, Adam M.; Seiler, Sarah; Binder, Nadine; Ege, Philipp; Große-Dunker, Gunnar; Heisel, Isabel; Hornof, Florian; Jeken, Jana; Rebling, Niko M.; Ulrich, Christof; Scheller, Bruno; Böhm, Michael; Fliser, Danilo; Heine, Gunnar H. (October 2012). "CD14++CD16+ Monocytes Independently Predict Cardiovascular Events". Journal of the American College of Cardiology. 60 (16): 1512–1520. doi:10.1016/j.jacc.2012.07.019. PMID 22999728.
- ^ Vuckovic, S.; Fearnley, D. B.; Gunningham, S.; Spearing, R. L.; Patton, W. N.; Hart, D. N. J. (June 1999). "Dendritic cells in chronic myelomonocytic leukaemia: Dendritic Cells in CMML". British Journal of Haematology. 105 (4): 974–985. doi:10.1046/j.1365-2141.1999.01431.x. PMID 10554809. S2CID 22571555.
- ^ Selimoglu-Buet, Dorothée; Wagner-Ballon, Orianne; Saada, Véronique; Bardet, Valérie; Itzykson, Raphaël; Bencheikh, Laura; Morabito, Margot; Met, Elisabeth; Debord, Camille; Benayoun, Emmanuel; Nloga, Anne-Marie; Fenaux, Pierre; Braun, Thorsten; Willekens, Christophe; Quesnel, Bruno; Adès, Lionel; Fontenay, Michaela; Rameau, Philippe; Droin, Nathalie; Koscielny, Serge; Solary, Eric (4 June 2015). "Characteristic repartition of monocyte subsets as a diagnostic signature of chronic myelomonocytic leukemia". Blood. 125 (23): 3618–3626. doi:10.1182/blood-2015-01-620781. PMC 4497970. PMID 25852055.
- ^ Tarfi, Sihem; Badaoui, Bouchra; Freynet, Nicolas; Morabito, Margot; Lafosse, Jeffie; Toma, Andréa; Etienne, Gabriel; Micol, Jean-Baptiste; Sloma, Ivan; Fenaux, Pierre; Solary, Eric; Selimoglu-Buet, Dorothée; Wagner-Ballon, Orianne (April 2020). "Disappearance of slan-positive non-classical monocytes for diagnosis of chronic myelomonocytic leukemia with an associated inflammatory state". Haematologica. 105 (4): e147–e152. doi:10.3324/haematol.2019.219782. PMID 31413091. S2CID 199663779.
- ^ Fingerle-Rowson, G; Angstwurm, M; Andreesen, R; Ziegler-Heitbrock, HW (June 1998). "Selective depletion of CD14 + CD16 + monocytes by glucocorticoid therapy: Depletion of CD14+ CD16+ monocytes by glucocorticoids". Clinical & Experimental Immunology. 112 (3): 501–506. doi:10.1046/j.1365-2249.1998.00617.x. PMC 1904988. PMID 9649222.
외부 링크
- 조직 이미지: 01702ooa – 보스턴 대학교 조직학 학습 시스템
- 인간 단구: 교수님.지글러-하이트브록 박사
- 체액의 순환






