금속 본딩
Metallic bonding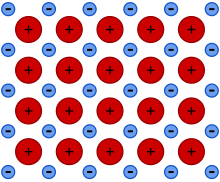
| 반지름의 종류 |
|---|
금속 결합은 전도 전자(탈국재 전자의 전자 구름 형태)와 양전하를 띤 금속 이온 사이의 정전적 유인력에서 발생하는 화학 결합의 한 종류입니다.양전하를 띤 이온( 양이온) 구조 사이에서 자유 전자가 공유되는 것으로 설명할 수 있습니다.금속 결합은 강도, 연성, 열 및 전기 저항률, 전도율, 불투명도 및 [1][2][3][4]광택과 같은 금속의 많은 물리적 특성을 설명합니다.
금속 결합은 순수한 물질로서도 금속이 보일 수 있는 유일한 화학적 결합 유형은 아닙니다.예를 들어, 원소 갈륨은 액체 및 고체 상태의 공유 결합 원자의 쌍으로 구성됩니다. 이 쌍들은 금속 결합을 통해 결정 구조를 형성합니다.금속-금속 공유 결합의 또 다른 예는 수은 이온(Hg2+
2)이다.
역사
화학이 과학으로 발전함에 따라, 금속이 원소의 주기율표의 대부분을 형성하고 있다는 것이 분명해졌고, 산과 반응하여 형성될 수 있는 소금의 기술에 큰 진전이 있었다.전기화학이 등장하면서 금속은 일반적으로 양전하를 띤 이온으로 용액에 들어가는 것이 분명해졌고, 금속의 산화 반응은 전기화학 계열에서 잘 이해되었다.금속의 그림이 음전자의 바다에 의해 결합되는 양이온으로 나타났다.
양자역학의 출현과 함께, 이 그림은 자유 전자 모델과 그것의 더 확장된, 거의 자유 전자 모델의 형태로 더 공식적인 해석이 주어졌습니다.두 모델 모두 전자는 본질적으로 등방성이며, 운동량 벡터 k의 방향이 아닌 크기의 제곱에 의존한다는 점에서 고체의 구조를 통과하는 기체로 보입니다.따라서 3차원 k-공간에서 가장 높게 채워진 수준(Fermi 표면)의 점 집합은 구가 되어야 한다.거의 프리 모델에서는 상자 모양의 브릴루인 존이 (이온) 구조에서 경험하는 주기적 전위에 의해 k 공간에 추가되어 등방성이 약간 깨진다.
X선 회절과 열분석의 등장으로 금속과 그 합금을 포함한 결정성 고체의 구조를 연구할 수 있게 되었고, 위상도가 개발되었다.이러한 모든 진보에도 불구하고, 금속간 화합물과 합금의 본질은 대부분 미스터리로 남아 있었고 그들의 연구는 종종 단지 경험적인 것이었다.화학자들은 일반적으로 달튼의 여러 비율의 법칙을 따르지 않는 것으로 보이는 어떤 것도 피하려고 했다; 그리고 그 문제는 다른 과학, 즉 야금학의 영역으로 여겨졌다.
이 분야 연구자들, 특히 흄-로테리는 왜 특정 조성을 가진 금속간 합금이 형성되고 다른 합금은 형성되지 않는지를 설명하기 위해 거의 자유에 가까운 전자 모델을 적극적으로 채택했다.처음에 Hume-Rothery의 시도는 꽤 성공적이었다.그의 아이디어는 일련의 브릴루인 상자 안에 있는 구형 페르미 풍선을 부풀리기 위해 전자를 추가하고 특정 상자가 언제 가득 찰지 결정하는 것이었다.이것은 나중에 관찰된 꽤 많은 합금 성분을 예측했다.사이클로트론 공명을 이용할 수 있게 되고 풍선의 모양을 결정할 수 있게 되자, 풍선이 구형이라는 가정은 아마도 세슘의 경우를 제외하고는 성립되지 않는 것으로 밝혀졌다.이 연구 결과는 모형이 정확한 예측 시리즈를 제공하면서도 잘못된 예측을 할 수 있는 방법에 대한 예시로 많은 결론을 줄였습니다.
거의 자유에 가까운 전자 대란은 이온이 자유 전자의 바다에 있다고 가정한 어떤 모델도 수정이 필요하다는 것을 연구자들에게 보여주었다.그래서 분자 궤도나 밀도 함수 이론에 기초한 밴드 구조 계산과 같은 많은 양자 역학 모델이 개발되었습니다.이러한 모델에서, 하나는 전자를 공유하는 중성 원자의 원자 궤도에서 이탈하거나 (밀도 함수 이론의 경우) 총 전자 밀도에서 이탈합니다.그럼에도 불구하고, 자유 전자 그림은 여전히 교육계에서 지배적인 그림으로 남아 있다.
전자 밴드 구조 모델은 금속 연구뿐만 아니라 반도체 연구에서도 주요 초점이 되었다.전자 상태와 함께 진동 상태도 띠를 형성하는 것으로 나타났습니다.Rudolf Peierls는 금속 원자의 1차원 열(예를 들어 수소)의 경우 그러한 사슬을 개별 분자로 분해하는 불안정성이 발생해야 한다는 것을 보여주었다.이에 따라 일반적인 질문에 대한 관심이 높아졌습니다. 즉, 언제 집단 금속 접합이 안정되고 언제 보다 국소적인 접합 형태가 그 자리를 차지하게 됩니까?많은 연구가 금속 원자의 군집화에 대한 연구에 투입되었다.
밴드 구조 모델의 개념이 금속 결합을 설명하는 데 있어 강력한 것으로 증명된 만큼, 다체 문제의 1전자 근사치로 남는 단점이 있습니다.즉, 각 전자의 에너지 상태는 다른 모든 전자가 단순히 균질한 배경을 형성하는 것처럼 기술된다.Mott와 Hubbard와 같은 연구자들은 이것이 아마도 강하게 비국재화된 s-전자와 p-전자에 적합하다는 것을 깨달았다. 그러나 d-전자의 경우, 그리고 f-전자의 경우, 광범위한 대역으로 이어지는 비국재화보다 전자(및 원자 변위)와의 상호작용이 더 강해질 수 있다.따라서, 국소적으로 짝을 이루지 않은 전자에서 금속 결합에 관여하는 떠돌이 전자로의 전환은 더욱 이해할 수 있게 되었다.
금속 접합의 특성
두 현상의 조합은 금속 결합을 일으킵니다: 전자의 비국재화와 비국재화된 [clarification needed]전자보다 훨씬 더 많은 수의 비국재화된 에너지 상태의 가용성입니다.후자는 전자 결핍이라고 불릴 수 있다.
2D로
그래핀은 2차원 금속 결합의 한 예이다.그것의 금속 결합은 벤젠, 나프탈렌, 안트라센, 오발렌 등의 방향족 결합과 유사합니다.
3D로
금속 클러스터에서의 금속 방향족도 비국재화의 또 다른 예로, 이번에는 종종 3차원 배열로 나타납니다.금속은 탈국소화 원리를 극단적으로 받아들이고, 금속의 결정은 모든 전도 전자가 3차원 모두에서 탈국소화된 단일 분자를 나타낸다고 말할 수 있다.즉, 금속 내부에서는 일반적으로 분자를 구별할 수 없기 때문에 금속 결합은 분자 내 또는 분자 간 결합이 아닙니다.'Non molecular'가 더 나은 용어일 것이다.금속 결합은 대부분 무극성이며, 합금에서도 결합 상호작용에 참여하는 원자의 전기음성 사이에 거의 차이가 없기 때문입니다(순수 원소 금속에서는 전혀 차이가 없습니다).따라서 금속 결합은 극도로 비국재화된 공유 결합 형태입니다.어떤 의미에서 금속 결합은 전혀 새로운 유형의 결합이 아닙니다.이는 결정성 고체, 액체 또는 유리 등 응축 물질 덩어리에 존재하는 결합만을 설명합니다.반면 금속 증기는 종종 원자(Hg)이거나 Na와 같은2 분자를 포함하며, 보다 전통적인 공유 결합에 의해 결합된다.이것이 단일 '금속 결합'[clarification needed]을 말하는 것이 옳지 않은 이유이다.
s-전자와 p-전자에 대해 지역화 해제가 가장 두드러진다.세슘의 탈국소화는 너무 강해서 전자는 사실상 세슘 원자로부터 해방되어 금속의 표면에만 의해 구속된 가스를 형성합니다.따라서 세슘의 경우 음전하 전자 가스에 의해 Cs 이온이 함께 유지되는 그림은+ [a]정확하지 않다.다른 원소의 경우 전자가 덜 자유롭습니다. 전자는 여전히 금속 원자의 전위를 경험하고 있으며, 때로는 매우 강합니다.그것들은 벤젠의 탄소 원자와 같이 원자가 중립으로 보이는 더 복잡한 양자역학 처리(예: 엄격한 결합)를 필요로 합니다.d-, 특히 f-전자의 경우, 비국재화는 전혀 강하지 않으며, 이는 왜 이러한 전자가 스핀을 유지하는 쌍이 없는 전자로 계속 작동할 수 있는지 설명하며, 이러한 금속에 흥미로운 자기 특성을 더한다.
전자 결핍 및 이동성
금속 원자는 주기나 에너지 수준에 비해 원자가 껍데기에 전자가 거의 없다.그것들은 전자에 결함이 있는 요소들이고 공동 공유는 그것을 바꾸지 않습니다.공유 전자보다 사용 가능한 에너지 상태가 훨씬 더 많이 남아 있습니다.따라서 전도성에 대한 두 가지 요건, 즉 강력한 비국재화와 부분적으로 채워진 에너지 대역이 모두 충족됩니다.따라서 이러한 전자는 하나의 에너지 상태에서 약간 다른 에너지 상태로 쉽게 변할 수 있습니다.따라서, 그것들은 비국소화 되어 구조를 관통하는 전자의 바다를 형성할 뿐만 아니라, 외부 전기장이 가해지면 구조를 통해 이동할 수 있고, 전기 전도성으로 이어진다.자기장이 없으면 모든 방향으로 균등하게 움직이는 전자가 있습니다.이러한 필드 내에서 일부 전자는 다른 파동 벡터를 채택하여 상태를 약간 조정합니다.그 결과, 한 방향으로의 이동이 다른 방향으로의 이동보다 많아지고 순전류가 발생합니다.
전자가 자유롭게 이동할 수 있기 때문에 금속 원자, 즉 층이 서로 미끄러져 지나갈 수 있습니다.국소적으로 변형 후 결합을 쉽게 끊고 새 결합으로 교체할 수 있다.이 과정은 일반적인 금속 결합에 큰 영향을 미치지 않으며, 이로 인해 금속의 특징적인 가단성과 연성이 발생합니다.이것은 특히 순수한 요소에 해당됩니다.용해된 불순물이 있는 경우, 통상적으로 형성되기 쉬운 난이도가 차단되어 재료가 경화될 수 있다.예를 들어 금은 순수한 형태(24캐럿)가 매우 부드러워서 보석류에서 합금이 선호된다.
금속은 또한 일반적으로 열의 전도체이지만 전도 전자는 이 현상에 부분적으로만 기여합니다.파동으로 고체 속을 이동하는 포논으로 알려진 원자의 집합적(즉, 비국소화) 진동이 더 큰 원인입니다.
그러나 다이아몬드처럼 열을 잘 전도하는 물질은 전도체가 아니다.이것은 다이아몬드에 비국재화가 없는 결과가 아니라 단순히 탄소가 전자 결핍이 아니라는 것이다.
전자 결핍은 금속과 기존의 공유 결합을 구별하는 데 중요합니다.따라서 위의 표현은 다음과 같이 수정해야 합니다. 금속 결합은 전자[b] 결핍 공유 결합의 극도로 비국재화된 공용 형태입니다.
금속 반지름
금속 반경은 금속 구조에서 인접한 두 금속 이온 사이의 거리의 1/2로 정의됩니다.이 반경은 원자의 특성, 환경, 특히 배위수(CN)에 따라 달라집니다.CN은 온도와 가해지는 압력에 따라 달라집니다.
원자의 크기에서 주기적인 추세를 비교할 때, 종종 원자 반경을 원자가 12좌표일 경우 가질 수 있는 값으로 변환하는 소위 골드슈미트 보정을 적용하는 것이 바람직하다.금속 반경은 가장 높은 좌표 숫자에 대해 가장 크기 때문에 밀도가 낮은 좌표의 보정은 x를 곱하는 것을 포함한다. 여기서 0 < x < 1. 구체적으로 CN = 4, x = 0.88, CN = 6의 경우 x = 0.96, CN = 8, x = 0.97이다.이 보정은 [6]위에서 인용한 수치를 얻은 Victor Goldschmidt의 이름을 딴 것이다.
반지름은 일반적인 주기적 경향을 따른다. 즉, 유효 핵 전하의 증가로 인해 기간에 걸쳐 감소하지만, 원자 전자의 수가 증가해도 상쇄되지 않는다. 그러나 반지름은 주 양자 수의 증가로 인해 그룹을 감소시킨다.4d와 5d 요소 사이에 란타니드 수축이 관찰된다. 즉, 잘 보호되지 않는 f 궤도의 존재로 인해 그룹 아래로 반지름이 거의 증가하지 않는다.
유대의 강도
이 섹션은 어떠한 출처도 인용하지 않습니다.(2014년 9월 (이 및 ) |
금속에 있는 원자들은 그들 사이에 강한 유인력을 가지고 있다.그것을 극복하기 위해서는 많은 에너지가 필요하다.따라서 금속은 텅스텐(5828K)이 매우 높을 정도로 끓는점이 높은 경우가 많습니다.주목할 만한 예외는 아연기 원소인 Zn, Cd 및 Hg입니다.그들의 전자 구성은 헬륨과 같은 고귀한 기체 구성과 비슷한 ...ns로2 끝나는데, 주기율표를 내려갈 때, 빈 np 궤도에 대한 에너지 차이가 점점 더 커지기 때문입니다.따라서 이러한 금속은 비교적 휘발성이 높기 때문에 초고진공 시스템에서는 사용하지 않습니다.
그렇지 않으면 갈륨과 같은 용해된 금속에서도 금속 결합이 매우 강해질 수 있습니다.갈륨은 상온 바로 위의 열로 녹지만 끓는점은 구리와 멀지 않다.녹은 갈륨은 강한 금속 결합 덕분에 매우 비휘발성 액체입니다.
액체 상태의 금속이 강하게 결합하는 것은 금속 결합의 에너지가 결합의 방향에 크게 의존하지 않는다는 것을 보여줍니다. 이러한 결합 방향성의 결여는 전자 비국재화의 직접적인 결과이며 공유 결합의 방향성 결합과는 대조적으로 가장 잘 이해됩니다.따라서 금속 결합의 에너지는 대부분 내장 [7]원자 모델에서 볼 수 있듯이 금속 원자를 둘러싸고 있는 전자 수의 함수입니다.그 결과 일반적으로 금속은 FCC, BCC, HCP와 같이 비교적 단순하고 밀착된 결정 구조를 가정하게 됩니다.
충분한 냉각 속도와 적절한 합금 조성으로 인해 비정질 구조를 가진 유리에서도 금속 접합이 발생할 수 있습니다.
많은 생화학은 금속 이온과 생체 분자의 약한 상호작용에 의해 매개된다.이러한 상호작용과 그와 관련된 구조 변화는 이중 편파 간섭계를 사용하여 측정되었다.
용해도 및 화합물 형성
금속과 함께 반응을 일으키지 않는 한 물이나 유기 용제에 녹지 않는다.전형적으로 이것은 금속 원자의 떠돌이 전자를 빼앗아 금속 결합을 파괴하는 산화 반응입니다.그러나 금속은 종종 결합의 금속 특성을 유지하면서 서로 쉽게 용해됩니다.예를 들어, 금은 실온에서도 수은에 쉽게 녹는다.고형금속에서도 용해성이 클 수 있다.두 금속의 구조가 같으면 은과 금의 합금인 일렉트로넘의 경우처럼 완전한 고체 용해성이 있을 수 있다.그러나 때로는 두 개의 금속이 두 개의 부모 중 하나와 다른 구조의 합금을 형성합니다.이런 물질들을 금속 화합물이라고 부를 수 있다.그러나 금속 결합을 가진 재료는 일반적으로 분자가 아니기 때문에 돌턴의 적분 비율 법칙은 유효하지 않으며, 종종 화학비율 범위가 달성될 수 있습니다.이러한 경우에는 '순수 물질'이나 '용질'과 같은 개념을 버리고 대신 단계를 말하는 것이 좋습니다.이러한 단계의 연구는 두 분야가 상당히 겹치지만 전통적으로 화학보다는 야금학의 영역이었다.
현지화 및 클러스터링: 본딩에서 본딩으로
복합 화합물의 금속 결합이 모든 구성 요소를 동등하게 포함하는 것은 아닙니다.전혀 관여하지 않는 요소를 하나 이상 가질 수 있습니다.섬이나 큰 바위 주변의 강처럼 그들 주위를 흐르는 전도 전자를 상상할 수 있다.예를 들어 XPS(X-ray photoelectron spectrocopy) 스펙트럼의 코어 레벨을 보면 어떤 원소가 관여하는지 관찰할 수 있다.요소가 분할되면 해당 피크는 기울어지는 경향이 있습니다.
예를 들어, 금속간 물질은 분자를 연상시키는 금속 클러스터를 나타내며, 이러한 화합물은 야금이라기보다는 화학의 주제입니다.클러스터의 형성은 전자 결핍 결합을 보다 국소적인 성질의 결합으로 '응축'(국소화)하는 방법으로 볼 수 있다.수소는 이러한 형태의 응축의 극단적인 예이다.고압에서는 그것은 금속이다.목성의 핵은 중력에 의해 유도되는 금속 결합과 고압의 조합에 의해 함께 유지된다고 말할 수 있다.그러나 낮은 압력에서는 결합이 완전히 정규 공유 결합으로 국소화된다.위치 파악이 너무 완벽하여 (더 친숙한) H2 가스가 생성됩니다.붕소와 같은 원소에 대해서도 같은 주장이 성립합니다.탄소에 비해 전자 부족하지만 금속을 형성하지는 않습니다.대신, 그것은 20면체12 B 클러스터가 지배하는 많은 복잡한 구조를 가지고 있다.전하 밀도파는 이와 관련된 현상입니다.
이러한 현상은 원자가 서로 방향 또는 멀어지는 것을 수반하므로, 그것들은 물질의 전자와 진동 상태(즉, 포논) 사이의 결합으로 해석될 수 있다.이러한 전자와 폰의 상호작용이 다른 경우, 낮은 온도에서 초전도라는 매우 다른 결과를 초래할 것으로 생각됩니다.국소결합에 전자쌍을 형성함으로써 전하담체의 이동성을 차단하는 것이 아니라 이동성에 대한 저항을 더 이상 경험하지 않는 쿠퍼쌍이 형성된다.
광학적 특성
이동 전하 운반체의 존재는 금속의 광학적 특성에 지대한 영향을 미치며, 이는 보다 전통적인 공유 결합에 관여하는 개별 전자의 상태를 고려하는 것이 아니라 전자를 집합적으로 고려하는 것으로만 이해할 수 있다.
빛은 전기장과 자기장의 조합으로 구성됩니다.일반적으로 전기장은 금속 결합에 관여하는 전자로부터 탄성 반응을 자극할 수 있습니다.그 결과 광자는 금속에 매우 멀리 침투할 수 없고 일반적으로 반사되지만 일부는 흡수될 수도 있습니다.이것은 가시 스펙트럼의 모든 광자에 동일하게 유지되며, 이것이 금속이 종종 은백색 또는 회색을 띠며 금속 광택의 특징적인 반사이다.반사와 흡수 사이의 균형에 따라 금속이 얼마나 하얗고 얼마나 회색인지 결정되지만 표면 오염은 광택을 가릴 수 있습니다.전도성이 높은 금속인 은은 가장 하얀 금속 중 하나이다.
눈에 띄는 예외는 불그스름한 구리와 노란 금이다.금속 전자가 쉽게 반응할 수 있는 빛의 주파수에 상한선이 있기 때문입니다. 즉, 플라즈몬 주파수입니다.플라즈몬 주파수에서 자유전자가스의 주파수 의존 유전체 함수는 음(반사)에서 양(투과)으로 변화하고 고주파 광자는 표면에서 반사되지 않으며 금속색에 기여하지 않는다.인듐 주석 산화물(ITO)과 같은 일부 물질은 금속 전도체(실제로 퇴화 반도체)로, 이 임계값이 [8]적외선에 있기 때문에 가시적으로는 투명하지만 적외선의 반사체는 양호합니다.
은의 경우 제한 주파수는 먼 자외선이지만 구리와 금의 경우 가시광선에 더 가깝습니다.이것이 이 두 금속의 색깔을 설명해준다.금속의 표면에서는 표면 플라스몬으로 알려진 공명 효과가 발생할 수 있습니다.그것들은 전도 전자의 집합적인 진동입니다. 마치 전자 해양의 파문처럼요.그러나 광자가 충분한 에너지를 가지고 있다고 해도, 그들은 보통 파문을 일으키기에 충분한 운동량을 가지고 있지 않다.따라서, 플라스몬은 벌크 메탈에서 흥분하기 어렵습니다.이것이 금과 구리가 약간 색이 있긴 하지만 광택이 나는 금속처럼 보이는 이유입니다.그러나 콜로이드 금의 경우 금속 결합이 아주 작은 금속 입자에 국한되어 있어 플라스몬의 진동파가 '도주'하는 것을 방지합니다.따라서 운동량 선택 규칙이 깨지고 플라즈몬 공명은 녹색에서 극단적으로 강한 흡수를 유발하여 보라색-빨간색을 발생시킵니다.이러한 색상은 염료 등에서 볼 수 있는 일반적인 흡수보다 훨씬 강렬하며, 개별 전자와 그 에너지 상태를 포함한다.
「 」를 참조해 주세요.
- 요소의 원자 반지름(데이터 페이지)
- 고체에서의 결합 – 결합의 분류
- 금속 방향성 – 금속으로 확장된 방향성 개념
메모들
레퍼런스
- ^ 메탈릭 본딩chemguide.co.uk
- ^ 금속 구조물.chemguide.co.uk
- ^ 화학 결합chemguide.co.uk
- ^ "물리학 133 강의 노트" Spring, 2004. 마리온 캠퍼스physics.ohio-state.edu
- ^ Okumura, K. & Templeton, I. M. (1965). "The Fermi Surface of Caesium". Proceedings of the Royal Society of London A. 287 (1408): 89–104. Bibcode:1965RSPSA.287...89O. doi:10.1098/rspa.1965.0170. JSTOR 2415064. S2CID 123127614.
- ^ Shriver and Atkins' Inorganic Chemistry. Oxford University Press. 2010. pp. 74–. ISBN 978-0-19-923617-6.
- ^ Daw, Murray S.; Foiles, Stephen M.; Baskes, Michael I. (1993). "The embedded-atom method: a review of theory and applications". Materials Science Reports (Submitted manuscript). 9 (7–8): 251–310. doi:10.1016/0920-2307(93)90001-U.
- ^ Brewer, Scott H.; Franzen, Stefan (2002). "Indium Tin Oxide Plasma Frequency Dependence on Sheet Resistance and Surface Adlayers Determined by Reflectance FTIR Spectroscopy". The Journal of Physical Chemistry B. 106 (50): 12986–12992. doi:10.1021/jp026600x.





