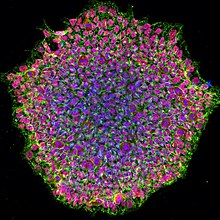
유도만능줄기세포
Induced pluripotent stem cell유도 만능 줄기세포는 체세포에서 직접 생성될 수 있는 만능 줄기세포의 한 종류이다.iPSC 기술은 2006년 일본 교토에 있는 야마나카 신야 연구소가 개발한 것으로, 야마나카 인자로 알려진 4개의 특정 유전자(Myc, Octor3/4, Sox2, Klf4)를 도입하면 체세포를 만능 줄기세포로 [1]바꿀 수 있다는 것을 보여주었다.그는 "성숙한 세포가 [2]만능이 되도록 재프로그래밍될 수 있다는 발견"으로 존 거든 경과 함께 2012년 노벨상을 받았다.
만능줄기세포는 재생의학 [3]분야에서 유망하다.그것들은 무한히 번식할 수 있을 뿐만 아니라 신체의 모든 다른 세포 유형(뉴런, 심장, 췌장, 그리고 간 세포)을 일으킬 수 있기 때문에, 그것들은 손상이나 질병으로 잃어버린 세포들을 대체하는데 사용될 수 있는 단일 원천을 나타냅니다.
만능줄기세포의 가장 잘 알려진 유형은 배아줄기세포이다.그러나 배아줄기세포의 생성은 착상 전 단계 배아의 파괴(또는 적어도 조작)[4]를 수반하기 때문에, 배아줄기세포의 사용을 둘러싼 많은 논란이 있었다.이제 체세포핵이식(SCNT)을 사용하여 환자 일치 배아줄기세포주를 도출할 수 있다.
iPSC는 성인 조직으로부터 직접 유도될 수 있기 때문에 배아의 필요성을 우회할 뿐만 아니라 환자 일치 방식으로 만들어질 수 있는데, 이것은 각 개인이 그들만의 만능 줄기세포주를 가질 수 있다는 것을 의미한다.이 무한한 자가 세포 공급은 면역 거부 반응의 위험 없이 이식을 일으키는데 사용될 수 있다.iPSC 기술은 아직 치료적 이식이 안전하다고 간주되는 단계까지는 발전하지 않았지만, iPPSC는 개인화된 약물 발견 노력과 환자 고유의 [5]질병 기초를 이해하는 데 쉽게 사용되고 있다.
야마나카 사장은 아이팟 등의 [6][7][8][9][dubious ]인기에 따라 iPSC에 소문자를 i로 붙였다.
그의 노벨 세미나에서 야마나카는 iPSC의 [10]발견의 중요한 전조로서 근육 계통에 세포 운명을 재프로그래밍하는 MyoD의 역할에 대한 해롤드 와인트로브의 초기 중요한 연구를 인용했다.
생산.
iPSC는 일반적으로 특정 다능성 관련 유전자 세트 또는 "재프로그래밍 인자"의 산물을 주어진 세포 유형에 도입함으로써 도출된다.원래 재프로그래밍 계수 세트(Yamanaka 계수라고도 함)는 전사 계수 Oct4(Pou5f1), Sox2, Klf4 및 cMyc입니다.이 조합은 iPSC를 생산하는 데 있어 가장 전통적인 방법이지만, 각각의 인자는 관련된 전사 인자, miRNA, 작은 분자, 또는 심지어 혈통 특정인과 같은 [11]관련이 없는 유전자에 의해 기능적으로 대체될 수 있다.
iPSC 도출은 일반적으로 느리고 비효율적인 프로세스로 마우스 세포의 경우 1-2주, 인간 세포의 경우 3-4주가 소요되며 효율은 약 0.01-0.1%이다.그러나 효율성과 iPSC를 획득하는 데 걸리는 시간을 개선하는 데 상당한 진전이 있었다.재프로그래밍 인자의 도입으로, 세포는 만능줄기세포와 유사한 군집을 형성하기 시작하는데, 이것은 형태학, 성장하기 위해 선택된 조건 또는 표면표지 또는 리포터 유전자의 발현을 통해 분리될 수 있다.
제1세대(마우스)
유도만능줄기세포는 2006년 [1]일본 교토대 야마나카 신야 교수팀에 의해 처음 생성됐다.그들은 배아줄기세포(ESC) 기능에 중요한 유전자가 성체 세포에서 배아 상태를 유도할 수 있을 것이라는 가설을 세웠다.그들은 이전에 ESC에서 중요한 것으로 확인된 24개의 유전자를 선택했고, 이 유전자를 쥐의 섬유아세포에 전달하기 위해 레트로바이러스를 사용했다.섬유아세포는 ESC 특이 유전자 Fbx15를 재활성화하는 어떤 세포도 항생제 선택을 사용하여 분리할 수 있도록 설계되었다.
24가지 요인이 모두 전달되자, Fbx15 리포터를 재활성화하고 무기한 전파할 수 있는 ESC 유사 집락이 나타났다.재프로그래밍에 필요한 유전자를 식별하기 위해, 연구원들은 24개의 인자를 한번에 하나씩 제거했다.이 과정에서 Fbx15의 재활성화를 위해 선택되는 ESC 유사 콜로니를 생성하는데 필요한 4가지 요소인 Oct4, Sox2, cMyc 및 Klf4를 식별하였다.
제2세대(마우스)
2007년 6월, 야마나카, 하버드/캘리포니아 대학, 로스앤젤레스, MIT의 공동 연구 그룹 등 3개의 별도 연구 그룹이 재프로그래밍 접근방식을 대폭 개선한 연구를 발표하여 ESC와 구별할 수 없는 iPSC가 탄생했다.1세대 iPSC와 달리, 이러한 2세대 iPSC는 생존 가능한 키메라 마우스를 생산하고 마우스 생식선에 기여하여 만능 줄기세포의 '골드 스탠더드'를 달성했다.
이러한 2세대 iPSC는 동일한 네 가지 전사 인자(Oct4, Sox2, cMyc, Klf4)의 레트로바이러스 매개 발현에 의해 마우스 섬유아세포에서 파생되었다.하지만, 만능 세포를 선택하기 위해 Fbx15를 사용하는 대신에, 연구원들은 ESC에서 기능적으로 중요한 유전자인 나노그를 사용했다.이 다른 전략을 사용하여 연구원들은 ESC와 [12][13][14][15]기능적으로 동일한 iPSC를 만들었다.
인간유도만능줄기세포
인간 섬유아세포 생성
2007년 11월 두 개의 독립적인 연구 그룹에 의해 iPSC에 대한 인간 세포의 재프로그래밍이 보고되었다.최초의 iPSC 방법을 개척한 일본 교토 대학의 야마나카 신야 교수와 인간 배아 줄기세포를 최초로 개발한 위스콘신 매디슨 대학의 제임스 톰슨 교수.마우스 재프로그래밍에 사용된 것과 동일한 원리로 야마나카 연구팀은 레트로바이러스 시스템을 [16]사용하여 인간의 섬유아세포를 Oct4, Sox2, Klf4, cMyc의 4개 중추 유전자를 가진 iPSC로 변환하는 데 성공했고, Thomson과 동료들은 Oct4, Sox2, Nanogiv, 및 Liniv28을 사용하여 다른 요인 세트를 사용했습니다.
추가 셀 유형에서 생성
iPSC를 생성하기 위해 섬유아세포를 얻는 것은 피부 생검을 수반하며, 보다 쉽게 접근할 [18][19]수 있는 세포 유형을 식별하기 위한 노력이 있었다.2008년, iPSC는 단일 털 [20][21]뽑기에서 얻을 수 있는 인간 각질세포에서 파생되었다.2010년에는 말초혈구로부터 [22][23]iPSC가 유도되었고,[24] 2012년에는 소변의 신장상피세포로부터 iPSC가 만들어졌다.
시작 세포 유형에 대한 다른 고려 사항으로는 돌연변이 부하(예를 들어, 피부 세포는 UV [18][19]노출로 인해 더 많은 돌연변이를 가질 수 있음), 시작 [18]세포 수를 확장하는 데 걸리는 시간 및 주어진 세포 [25]유형으로 분화할 수 있는 능력이 있습니다.
iPSC 생성에 사용되는 유전자
[필요한 건]
유도 만능 세포의 생성은 유도에 사용되는 전사 인자에 의해 결정적으로 좌우된다.
Oct-3/4 및 Sox 유전자 패밀리의 특정 제품(Sox1, Sox2, Sox3, 및 Sox15)은 유도를 불가능하게 만드는 유도 프로세스에 관여하는 중요한 전사 조절제로 확인되었습니다.그러나 유도 효율을 높이기 위해 Klf 패밀리(Klf1, Klf2, Klf4, Klf5)의 특정 멤버, Myc 패밀리(c-myc, L-myc 및 N-myc), Nanog 및 LIN28을 포함한 추가 유전자가 확인되었다.
- Oct-3/4(Pou5f1) Oct-3/4은 옥타머('Oct') 전사인자의 1패밀리로 다능성을 유지하는 데 중요한 역할을 합니다.10-3/4+ 세포에 10-3/4가 없는 것은, 배반체, 배아줄기세포 등, 자발적인 영양아세포 분화로 이어지며, 10-3/4의 존재는 배아줄기세포의 다능성과 분화 가능성을 낳는다.Oct-3/4의 가까운 친척인 Oct1과 Oct6을 포함한 Oct 패밀리의 다양한 다른 유전자들은 유도를 유도하지 못하며, 따라서 Oct-3/4의 유도 과정에 대한 배타성을 보여준다.그러나 Hans Schöler가 이끄는 팀은 재프로그래밍 중 10월 4일 과발현이 iPSC의 품질을 악화시키는 후생유전학적 변화를 일으킨다는 것을 보여주었다.OSKM(Oct4, Sox2, Klf4, c-Myc)과 비교하여, 새로운 SKM(Sox2, Klf4, c-Myc)의 재프로그래밍은 테트라플라이드 보완 [26][27]배아를 통해 all-iPSC 마우스를 생성하는 능력에 따라 결정되는 배아 줄기세포와 동등한 발달 잠재력을 가진 iPSC를 생성한다.
- Sox 패밀리:Sox 계열의 전사 인자는 다능성 및 만능성 줄기세포에서만 발현되는 10월 3/4과 대조적으로 다능성 및 만능성 줄기세포와 관련이 있지만 10월 3/4과 유사한 다능성을 유지하는 것과 관련이 있다.Sox2는 야마나카 외 연구진, 재니쉬 외 연구진 및 톰슨 외 연구진에 의해 유도에 사용된 초기 유전자였지만, Sox 패밀리의 다른 전사 인자는 유도 과정에서도 작용하는 것으로 밝혀졌다.Sox1은 Sox2와 같은 효율로 iPS 셀을 생성하며 Sox3, Sox15 및 Sox18도 효율이 떨어지지만 iPS 셀을 생성합니다.
- Klf 패밀리: Klf 계열의 전사 인자의 Klf4는 야마나카 등에 의해 최초 확인되었고 재니쉬 등에 의해 확인되었다.마우스 iPS 세포 생성 인자로서 야마나카 등에 의해 인간 iPS 세포 생성 인자로 실증되었다.그러나 톰슨 외 연구진은 Klf4가 인간 iPS 세포 생성에 불필요하며 사실상 인간 iPS 세포 생성에 실패했다고 보고했다.Klf2와 Klf4는 iPS 세포를 생성할 수 있는 인자로 확인되었으며, 관련 유전자 Klf1과 Klf5도 효율이 떨어졌지만 생성했다.
- 마이크 패밀리:Myc 계열의 전사 인자는 암에 관여하는 원생 원생 원생 원생 원생 원생 원생원인이다.야마나카 외와 재니쉬 외는 c-myc가 마우스 iPS 세포 생성에 관여하는 인자이며 야마나카 외는 인간 iPS 세포 생성에 관여하는 인자임을 입증했다.단, 톰슨 등, 야마나카 등.iPS 세포 유도에 myc 유전자 패밀리를 사용하는 것은 임상 치료법으로서 iPS 세포의 우발성에 문제를 일으킨다. c-myc 유도 iPS 세포를 이식받은 생쥐의 25%가 치명적인 기형종을 일으키기 때문이다.N-myc와 L-myc는 유사한 효율로 c-myc 대신 유도하는 것으로 확인되었습니다.
- 나노그: 배아줄기세포에서, 나노그는 10월 3/4일 그리고 Sox2와 함께 다능성을 촉진하는데 필요합니다.따라서 야마나카 등이 톰슨 등에도 불구하고 나노그가 유도에 불필요하다고 보고했을 때 놀라웠다.는 나노그를 인자의 하나로 하여 iPS 세포를 생성할 수 있다고 보고했습니다.
- LIN28: LIN28은 분화 및 증식과 관련된 배아줄기세포와 배아암세포에서 발현되는 mRNA 결합단백질이다[28].Thomson 등은 LIN28이 OCT4, SOX2, 및 NAOG와 [17]조합하여 iPSC 생성의 요인임을 입증했습니다.
- Glis1: Glis1은 Oct-3/4, Sox2 및 Klf4와 함께 사용할 수 있는 전사인자입니다.C-myc [29]대신 사용하면 많은 장점이 있습니다.
세포를 다능성으로 재프로그래밍할 때의 과제
비록 그 방법 야마나카와 다른 사람들에 의해 개척된 이후 세포 세포 iPS에 리 프로그램 할 수 있다는 것을 보여 준다, 여전히 도전 이 기술과 관련되어 있습니다.
- 낮은 효율성:일반적으로iPS 세포로 변환하는 것이 믿을 수 없을 정도로 낮았다.예를 들어, 속도를 체세포 야마나카의 원래 쥐 연구에서iPS 세포에 진입 0.01–0.1%프로그래밍을 다시 해 줬다.[1]그 낮은 효율율 정확한 타이밍, 균형 그리고 재프로그래밍 유전자의 표현의 절대적인 수준의 필요성을 반영할 수 있다.그것은 또한 원래 체세포 인구 또는 장기적인 문화에 희귀한 및/또는 후생 유전적 변화에 대한 필요성을 제시할 수 있다.하지만, 최근 한 경로 효율적인 이것은 뉴클레오솜 지프니와 아세틸 이탈(NuRD)단지의 downregulation를 요구했다 다시 프로그래밍하는 것으로 밝혀졌다.Mbd3, NuRD의 소단위의 Overexpression iPSCs의 유도를 금하고 있다.Mbd3의 소모는 반면에, 동기화된 결정론적 iPS세포를 다시 프로그래밍(7일 이내에 쥐와 인간 세포 근처에 100%효율)가 된다는 것을 재프로그래밍 efficiency,[30]을 향상시킨다.[31일]
- Genomic 삽입:전사한 요인 중에 유전자 통합 돌연변이들이 표적 세포의 게놈에 삽입하는 위험성 때문에 전사 인자 접근법의 유용성을 제한한다.[32]유전자 삽입을 피하기 위해 일반적인 전략 입력을 위한 다른 벡터를 이용하는 것이었다.플라스미드는, adenoviruses, 트랜스포슨 벡터. 그러나 종종 낮은 처리량의 절충에 도달하게 탐구되어 왔다.[33][34][35]
- Tumorigenicity:사용된 방법에, 성인 세포 iPSCs를 얻기 위해 리프 로그램을 따라 인간에 그들의 사용을 제한할 수 있을 정도 위험을 가할 수 있다.만약 바이러스 genomically는 세포를 변경하는데 사용된다 예를 들어, oncogenes의 표현(발암 유전자)잠재적으로 야기되어 질것이다.2008년 2월 과학자들, 그에 따라iPS 세포 인간의 질환의 잠재력 사용을 증가시키는 것은 전분화능의 유도 후 oncogenes을 제거할 수 있는 기술인의 발견했다고 발표했다.[36]또 다른 연구에서, 야마나카는 그 종양 유전자 c-Myc 없이 iPSCs을 만들 수 있다고 보고했다.그 과정은 더 오래 걸리고 효율적이지 않았지만, 그 결과로 생긴 키메라에는 [37]암이 발병하지 않았다.암의 핵심 조절제인 종양 억제제 p53의 비활성화 또는 결실은 재프로그래밍 [38]효율을 크게 증가시킨다.따라서 재프로그래밍 효율성과 종양 생성 사이에 트레이드오프가 있는 것 같습니다.
- 불완전한 재프로그래밍: 재프로그래밍도 완전성의 문제에 직면해 있습니다.게놈 전체의 후생유전자 코드를 표적 세포 타입의 후생유전자 코드로 다시 포맷해야 세포를 완전히 재프로그래밍할 수 있기 때문에 이것은 특히 어렵다.그러나 세 개의 별도 그룹이 사배엽 배반포에 주입될 수 있는 마우스 배아섬유아세포(MEF) 유래 iPS 세포를 발견할 수 있었고 완전히 iPS 세포에서 파생된 생쥐의 생환으로 이어졌고, 따라서 배아줄기세포(ESC)와 다지능에 [39]대한 IPS의 등가성에 대한 논쟁은 종결되었다.
오른쪽 표는 2006년 야마나카 외 연구진의 혁신 이후 첫 5년간 iPS 세포 개발에 사용한 주요 전략과 기술을 정리한 것이다.유사한 색상의 행은 재프로그래밍에 유사한 전략을 사용한 연구를 나타냅니다.
대체 어프로치
화학 약품을 사용한 전사 인자 모방
(1)과 (2)의 문제를 피하기 위한 주요 전략 중 하나는 전사 인자의 효과를 모방할 수 있는 작은 분자를 사용하는 것이었다.이러한 화합물은 게놈을 효과적으로 겨냥하지 않거나 다른 이유로 재프로그래밍에 실패한 재프로그래밍 인자를 보상할 수 있습니다. 따라서 재프로그래밍 효율성이 높아집니다.그들은 또한 어떤 경우에 종양 발생의 원인이 되는 게놈 통합의 문제를 회피한다.이러한 전략을 이용한 주요 연구는 2008년에 실시되었다.멜튼 등은 히스톤탈아세틸라아제(HDAC) 억제제 발프로산의 영향을 연구했다.그들은 이것이 (기존의 야마나카의 전사 인자 [40]방법과 비교하여) 재프로그래밍 효율을 100배 향상시켰다는 것을 발견했다.연구자들은 이 화합물이 보통 전사인자 c-Myc에 의해 일어나는 신호를 모방하고 있다고 제안했다.Sox2의 효과를 모방하기 위해 유사한 유형의 보상 메커니즘이 제안되었다.2008년, 딩 등.는 재프로그래밍 [41]효율을 높이기 위해 혈장막의 칼슘 채널 활성화와 함께 BIX-01294와 함께 히스톤메틸전달효소(HMT) 억제를 사용했다.베이징 대학의 덩 외 연구진은 2013년 7월 유전자 변형 없이 유도 다능성 줄기세포를 만들 수 있다고 보고했다.그들은 DZNep을 포함한 7개의 소분자 화합물의 혼합물을 사용하여 쥐의 체세포를 줄기세포로 유도했는데, 이 세포는 0.2%로 표준 iPSC 생산 기술을 사용하는 것과 비슷한 효율로 CiPS 세포라고 불렀다.CiPS 세포는 생쥐 배아 발달에 도입되었고 모든 주요 세포 유형에 기여하는 것으로 밝혀졌으며, 그 다능성을 [42][43]증명했다.
딩 등은 약물 유사 화학 물질의 사용을 통한 전사 인자 재프로그래밍의 대안을 입증했다.섬유아세포가 줄기세포와 같은 상태로 밀려나는 MET(Mesenchymal-상피 전이) 과정을 연구함으로써, Ding의 그룹은 고전적인 100배 접기 방법으로 ALK5 억제제 SB431412와 MEK 억제제 PD0325901의 두 가지 화학물질을 확인했다.티아조비빈은 세포 생존 경로에 관여하는 것으로 알려진 세 번째 화합물을 첨가함으로써 효율을 200배 더 높인다.이 세 가지 화합물의 조합을 사용함으로써 인간 섬유아세포의 재프로그래밍 과정이 4주에서 2주로 [44][45]감소하였다.
2009년 4월, 성체 세포의 유전자 변화 없이 iPS 세포의 생성이 가능하다는 것이 입증되었다. 폴리 아르기닌 앵커를 통해 세포로 전달된 특정 단백질로 세포를 반복적으로 처리하면 다능성을 [46]유도하기에 충분했다.이러한 iPSCs의 약자는 piPSCs(단백질 유도 만능 줄기세포)이다.
대체 벡터
종양 발생과 낮은 처리량과 같은 문제를 피하기 위한 또 다른 핵심 전략은 대체 형태의 벡터: 아데노바이러스, 플라스미드, 그리고 나체 DNA 및/또는 단백질 화합물을 사용하는 것입니다.
2008년에는 Hochedlinger 등필요한 네 가지 전사인자를 쥐의 피부와 간세포의 DNA로 전달하기 위해 아데노바이러스를 사용했고, 결과적으로 ESC와 동일한 세포를 만들었다.아데노바이러스는 표적 숙주에 자신의 유전자를 전혀 통합하지 않고 삽입형 돌연변이 [41]유발 가능성을 피하기 때문에 바이러스나 레트로바이러스 같은 다른 벡터들과는 다르다.2009년, Freed 등은 iPS [47]세포에 대한 인간 섬유아세포의 성공적인 재프로그래밍을 입증했다.아데노바이러스를 사용하는 것의 또 다른 장점은 효과적인 재프로그래밍이 이루어지기 위해 짧은 시간 동안만 제시하면 된다는 것이다.
또, 2008년에는 야마나카등이 [33]플라스미드를 사용해 필요한 4개의 유전자를 이식할 수 있는 것을 발견했다.야마나카 그룹은 재프로그래밍 인자를 운반하는 두 개의 플라스미드 구조를 사용하여 마우스 세포를 트랜스펙션에 의해 성공적으로 재프로그래밍했다. 첫 번째 플라스미드는 c-Myc를 표현했고 두 번째 플라스미드는 다른 세 가지 인자(10월 4, Klf4, Sox2)를 표현했다.플라스미드 방법은 바이러스를 피하지만 재프로그래밍을 위해 암을 촉진하는 유전자를 필요로 한다.이러한 방법의 또 다른 주요 문제는 레트로바이러스 방법에 비해 효율성이 훨씬 떨어지는 경향이 있다는 것이다.또한 트랜스감염 플라스미드는 숙주 게놈에 통합되어 있는 것으로 나타나므로 여전히 삽입성 돌연변이 유발의 위험을 내포하고 있다.비레트로바이러스 접근법이 그렇게 낮은 효율 수준을 보여왔기 때문에, 연구자들은 피기백 트랜스포존 시스템으로 알려진 기술을 효과적으로 구조하려고 시도했다.여러 연구에서 이 시스템이 숙주 세포 게놈에 발자국 돌연변이를 남기지 않고 주요 재프로그래밍 인자를 효과적으로 전달할 수 있다는 것이 입증되었습니다.PiggyBac Transposon System은 외인성 유전자의 재절제를 수반하여 삽입형 돌연변이 [citation needed]유발의 문제를 없앤다.
자극 유발 다능성 세포 획득
2014년 1월, 특정 유형의 스트레스(박테리아 독소, 5.7의 낮은 pH 또는 물리적 압착)에 의해 세포가 생성될 수 있다는 두 개의 논문이 발표되었고, 그 결과 생성된 세포를 자극 유발된 다능성 [48]획득을 위해 STAP 세포라고 불렀다.
2014년 3월, 다른 연구소가 놀라운 연구 결과를 복제하는 데 어려움을 겪었기 때문에, 공동 저자 중 한 명이 기사를 [49]철회할 것을 요구했습니다.2014년 6월 4일 주저자인 오보카타는 2014년 [51]4월 1일 RIKEN의 조사에서 결론난 '연구 부정행위'가 드러난 후 두 논문을 철회하기로 합의했다.
RNA 분자
마이크로 RNA는 메신저 RNA의 상보적 배열에 결합하고 유전자의 발현을 차단하는 짧은 RNA 분자이다.iPS 세포의 마이크로RNA 발현 변화를 측정하여 분화 [52]가능성을 예측할 수 있다.iPS의 가능성을 높이기 위해서도 마이크로RNA를 추가할 수 있습니다.몇 가지 메커니즘이 [52]제안되었다.( 같은 miR-291, miR-294과 miR-295)하류 c-Myc.[53]microRNAs의 행동으로 유도 전분화능의 효율성을 증진시키는 줄기cell-specific microRNA 분자들도, 그리고 추가적인 메커니즘 추가된 외생 tr가 없는 상태에서도 리프 로그램을 유도할 수 있야마나카의 4전사한 요인 중에 repressors의 표현 차단할 수 있다.굴러다녔다.cription factors.[52]
신원
유도만능줄기세포는 특정 줄기세포 유전자와 단백질의 발현, 염색질 메틸화 패턴, 배속시간, 배아체 형성, 기형종 형성, 생존성 키메라 형성, 효력과 분화성 등 많은 면에서 배아줄기세포와 유사하다.자연만능줄기세포와의 관계 전체는 여전히 [1]평가되고 있다.
유전자 발현과 게놈 전체의 H3K4me3, H3K27me3는 배아줄기세포와 [54][citation needed]iPS세포 사이에서 매우 유사한 것으로 밝혀졌다.생성된 iPSC는 다음과 같은 점에서 자연적으로 분리된 만능 줄기세포(마우스 및 인간 배아 줄기세포, mESC 및 hESC 등)와 현저하게 유사했으며, 따라서 자연적으로 분리된 만능 줄기세포에 대한 iPSC의 동일성, 진정성 및 다능성을 확인했다.
- 세포 생물학적 특성
- 형태학: iPSC는 형태학적으로 ESC와 유사했다.각각의 세포는 둥근 모양, 큰 핵과 적은 세포질을 가지고 있었다.iPSC의 군집도 ESC의 군집과 유사했다.인간의 iPSC는 hESC와 유사하게 끝이 뾰족하고 평평하며 촘촘히 채워진 집락을 형성했으며 마우스 iPSC는 mESC와 유사하게 집적 집락을 형성했다.
- 성장 속성:줄기세포가 정의의 일부로서 자가 재생해야 하기 때문에 시간 및 유사분열 활동의 배가 ESC의 주춧돌이다.iPSC는 유사분열, 자기 재생, 증식 및 ESC와 동일한 속도로 활성화되었다.
- 줄기세포 마커: iPSC는 ESC에 발현되는 세포 표면 항원 마커를 발현한다.인간 iPSC는 SSEA-3, SSEA-4, TRA-1-60, TRA-1-81, TRA-2-49/6E 및 Nanog를 포함하여 hESC에 고유한 마커를 표현했다.마우스 iPSC는 MSC와 마찬가지로 SSEA-1을 나타냈지만 SSEA-3도 SSEA-4도 나타내지 않았다.
- 줄기세포 유전자: iPSC는 10월 3/4일, Sox2, Nanog, GDF3, REX1, FGF4, ESG1, DPA2, DPA4, HTERT를 포함한 미분화 ESC에서 발현되는 유전자를 발현시켰다.
- 텔로머라아제 활동:Telomerase는 Hayflick 한계인 약 50개의 세포분열을 제한 없이 유지하기 위해 필요하며, hESC는 자기재생과 증식을 지속하기 위해 높은 Telomerase 활성을 나타내며, iPSC는 또한 Telomerase protei에 필요한 성분인 Htert(인간 Telomerase reverse transcriptase)를 나타낸다.n 콤플렉스
- 다능성: iPSC는 ESC와 유사한 방식으로 완전히 분화된 조직으로 분화할 수 있었다.
- 신경분화 : iPSC는 βII-tubulin, 티로신 하이드록실화효소, AADC, DAT, ChAT, LMX1B, MAP2를 발현하는 뉴런으로 분화하였다.카테콜아민 관련 효소의 존재는 iPSC가 hESC와 마찬가지로 도파민 작동성 뉴런으로 분화할 수 있음을 나타낼 수 있다.줄기세포 관련 유전자는 분화 후 하향 조절됐다.
- 심장 분화: iPSC는 자발적으로 뛰기 시작하는 심근세포로 분화되었다.심근세포는 TnTc, MEF2C, MYL2A, MYHCβ, NKX2.5를 발현하였다.줄기세포 관련 유전자는 분화 후 하향 조절됐다.
- 기형종 형성: 면역 결핍 생쥐에게 주입된 iPSCs는 9주 후에 자연적으로 기형종을 형성했다.기형종은 내배엽, 중배엽, 외배엽의 세 가지 배아층에서 파생된 조직을 포함하는 여러 계통의 종양이다. 이것은 전형적으로 하나의 세포 유형인 다른 종양과 다르다.테라토마 형성은 다능성의 획기적인 검사이다.
- 배아체: 배양 중의 hESC는 자연적으로 "배아체"라고 불리는 공 모양의 배아 구조를 형성한다.이들은 유사분화 HESC의 핵심과 3개의 모든 배아층으로부터의 완전 분화 세포의 주변으로 구성된다.iPSC는 또한 배아체를 형성하고 말초 분화 세포를 가진다.
- 키메라 마우스: hESC는 배반포의 내부 세포질량(배아아세포) 내에 자연적으로 존재하며, 배아세포에서는 배반포의 껍질(배아세포)이 태아외 조직으로 분화한다.중공영양모세포는 살아있는 배아를 형성할 수 없기 때문에 배아모세포 내의 배아줄기세포가 분화 및 배아를 형성할 필요가 있으며, iPSCs는 마이크로피펫에 의해 영양모세포에 주입되고 배반포는 이식된 암컷에게 전달되었다.키메라 살아있는 쥐 새끼를 만들었다. iPSC 유도체를 가진 쥐는 10-90% 키메라증과 함께 몸 전체에 통합되었다.
- 사배체 보완: 사배체 배반포에 주입된 생쥐 태아 섬유아세포의 iPS 세포는 비록 낮은 [39][55][56]성공률이지만, 온전한, 비기모성, 가임성 생쥐를 형성할 수 있습니다.
- 후생유전 재프로그래밍
- 프로모터 탈메틸화:메틸화(methylation)는 메틸기가 DNA 베이스로 전달되는 것으로, 일반적으로 CpG 부위에서 메틸기가 시토신 분자로 전달된다(인접 시토신/구아닌 배열).유전자의 광범위한 메틸화는 발현 단백질의 활성을 방해하거나 발현을 방해하는 효소를 모집함으로써 발현을 방해한다.따라서 유전자의 메틸화는 전사를 방지함으로써 유전자를 효과적으로 침묵시킨다.Oct-3/4, Rex1, Nanog를 포함한 다능성 관련 유전자의 프로모터는 iPSC에서 탈메틸화되었으며, 이는 프로모터 활성과 iPSC에서의 다능성 관련 유전자의 적극적인 촉진 및 발현을 입증하였다.
- DNA 메틸화:인간의 iPS 세포는 세포들이 메틸화되어 있는 패턴에서 배아줄기세포와 매우 유사하며, 다른 세포들보다 더 유사하다.단, 약 1,000개의 사이트에서 몇 가지 iPS 셀 회선의 차이를 볼 수 있습니다.이들 중 절반은 iPS 세포가 유래한 체세포군과 유사하며, 나머지는 iPSC 특이적이다.또한 iPS 셀이 ES [57]셀 상태로 재프로그래밍되지 않은 수십 개의 메가베이스 영역도 발견되었습니다.
- 히스톤 탈메틸화:히스톤은 구조적으로 DNA 배열에 국재화된 단백질을 압축하는 것으로 다양한 염색질 관련 변형을 통해 그들의 활동에 영향을 미칠 수 있다.Oct-3/4, Sox2 및 Nanog와 관련된 H3 히스톤이 탈메틸화되어 Oct-3/4, Sox2 및 Nanog의 발현을 나타낸다.
안전.
- iPSC의 잠재적 임상 적용에 대한 주요 관심사는 [58]종양 형성 성향이다.ESC와 마찬가지로, iPSC는 면역 결핍 생쥐에게 주입될 때 쉽게 기형종을 형성한다.테라토마 형성은 FDA에 의해 줄기세포 기반 재생 의학의 주요 장애물로 여겨진다.
- 쥐의 척수 손상 후 운동 기능 회복에 대한 보다 최근의 연구는 인간에 의해 유도된 만능 줄기세포가 쥐에게 이식된 후, 그 세포들은 척수에서 세 개의 신경 계통으로 분화되었다는 것을 보여주었다.그 세포들은 손상된 척수의 재생을 자극하고, 골수화를 유지하며, 시냅스를 형성했다.이러한 양성 결과는 척수 손상 후 112일 이상 동안 종양 [59]형성 없이 관찰되었습니다.그럼에도 불구하고, 같은 그룹의 후속 연구는 인간에 의해 유도된 만능 줄기세포의 뚜렷한 클론이 결국 [60]종양을 형성했다는 것을 보여주었다.
- iPSC는 현재 수정을 통해서만 높은 효율로 생산될 수 있기 때문에 일반적으로 hESC에 비해 안전성이 떨어지고 종양 유발성이 더 높을 것으로 예측된다.iPSC 형성을 촉진하는 것으로 밝혀진 모든 유전자들은 어떤 식으로든 암과 연관되어 있다.마이크족을 포함한 일부 유전자는 종양유전자로 알려져 있다.Myc를 생략해도 IPSC 형성은 가능하지만 효율은 최대 100배까지 감소합니다.
- iPSC를 생산하는 비유전자적 방법은 재조합 단백질을 사용하여 입증되었지만, 그 효율은 상당히 [46]낮았다.단, 이 방법론을 개량하여 효율을 높이면 보다 안전한iPSC를 생산할 수 있습니다.아데노바이러스나 플라스미드를 사용하는 것과 같은 다른 접근법은 일반적으로 레트로바이러스 방법보다 안전하다고 생각됩니다.
- iPSC 분야에서 향후 연구를 위한 중요한 영역은 재생 의학 치료에 사용되는 접근방식을 모방하는 방법을 사용하여 iPSC 종양 발생성을 직접 테스트하는 것이다.이러한 연구는 iPSC가 기형종을 형성할 뿐만 아니라 iPSC에서 파생된 생쥐도 악성 [61]암으로 인한 사망률이 높기 때문에 중요하다.iPS세포가 ESC보다 종양유전성이 훨씬 뛰어나다는 것을 보여주는 2010년 논문은 줄기세포 저널에 발표되었으며, 이는 iPS세포의 안전성이 심각한 [62]우려 사항이라는 개념을 뒷받침한다.
- IPS 세포의 면역원성에 대한 우려는 2011년 Zhou 등이 기형종 형성 분석을 포함한 연구를 수행하고 IPS 세포가 거부반응을 일으킬 만큼 강한 면역반응을 보인다는 것을 증명했을 때 제기되었다.그러나 유전적으로 동등한 배아줄기세포에 대해 유사한 시술이 수행되었을 때, Zhou 등은 그 세포가 면역체계에 [63]의해 내성이 있다는 것을 나타내는 기형종을 발견했다.2013년 아라키 등은 저우 등이 도출한 결론을 재현하려고 시도했다.다른 절차를 사용하여.그들은 IPSC 클론에서 자란 키메라 세포와 쥐 배아에서 세포를 추출하여 이 조직을 신생쥐에게 이식했습니다.그들은 IPSC 클론 대신 ES 세포를 사용하여 유사한 시험을 실시하여 결과를 비교하였다.조사 결과 IPS 세포와 ES 세포에 의해 생성된 면역원성 반응에는 큰 차이가 없었다.또한 아라키 외 연구진은 두 [64]세포주에 대해 면역원성 반응이 거의 또는 전혀 없다고 보고했다.따라서 아라키 등은 저우 등과 같은 결론을 내릴 수 없었다.
안전한 iPSC 기반 세포 치료를 위한 최근의 성과와 향후 과제는 Okano [65]등의 검토에서 수집된다.
의학 연구
iPS 셀을 생산하는 작업은 위에서 언급한 6가지 문제로 인해 여전히 어려운 작업입니다.극복해야 할 중요한 단점은 효율성과 게놈 통합입니다.트랜스유전자의 통합에 의존하지 않는 대부분의 방법은 비효율적이지만, 트랜스유전자의 통합에 의존하는 방법은 수많은 기술과 방법이 시도되었지만 불완전한 재프로그래밍과 종양 발생의 문제에 직면합니다.또 다른 큰 전략 세트는 iPS [56]세포의 단백질학적 특성을 수행하는 것입니다.추가 연구와 새로운 전략은 5가지 주요 과제에 대한 최적의 해결책을 도출해야 한다.하나의 접근방식은 이러한 전략의 긍정적인 속성을 iPS 세포로 재프로그래밍하기 위한 궁극적인 효과적인 기술로 결합하려고 시도할 수 있다.
또 다른 접근법은 표현형을 구할 수 있는 치료약을 식별하기 위해 환자로부터 파생된 iPS 세포를 사용하는 것이다.예를 들어 p63 유전자가 변이된 외배엽이형성증후군(EEC)에 감염된 환자로부터 유도된 iPS 세포주는 소량 [66]화합물에 의해 부분적으로 구제될 수 있는 비정상적인 상피공약을 나타낸다.
질병 모델링 및 약물 개발
인간 iPS 세포의 매력적인 특징은 인간 질병의 세포 기반을 연구하기 위해 성인 환자로부터 그것들을 유도할 수 있는 능력이다.iPS 세포는 자가 재생이 가능하고 만능이기 때문에 이론적으로 환자 유래 세포의 무한한 원천을 나타내며, 이는 신체에서 어떤 종류의 세포로도 변할 수 있다.이것은 특히 중요하다. 왜냐하면 환자로부터 파생된 많은 다른 종류의 인간 세포들이 실험실 배양에서 몇 번의 과정을 거친 후에 성장을 멈추는 경향이 있기 때문이다. iPS 세포는 다운 증후군이나 다낭포성 신장 [67][68]질환과 같은 흔한 질병을 포함한 다양한 인간 유전 질환에 대해 생성되어 왔다.많은 경우, 환자 유래의 iPS 세포는 건강한 환자의 iPS 세포에서 관찰되지 않는 세포 결함을 나타내 질병의 [69]병태생리학에 대한 통찰력을 제공한다.국제협력 프로젝트 StemBANCC는 다양한 질병에 대한 약물 선별을 위한 iPS 세포주 컬렉션을 구축하기 위해 2012년에 결성되었다.옥스퍼드 대학에서 관리한 이 노력은 10개의 제약회사와 23개의 대학으로부터 자금과 자원을 모았다.목표는 모의 인간 질병 [70]환경을 제공함으로써 초기 약물 테스트에 사용될 1,500개의 iPS 세포주 라이브러리를 생성하는 것이다.또한, hiPSC 기술과 유전적으로 인코딩된 전압 및 칼슘 지표를 결합하여 심혈관 약물 안전성 검사를 [71][72]위한 대규모 및 높은 처리량 플랫폼을 제공했다.
장기합성
이식용 인간 장기를 생성하기 위해 유도 만능 줄기세포(iPSC)를 사용하는 개념의 증명은 일본의 연구자들에 의해 보고되었다.인간의 '간 싹' (iPSC-LBs)은 세 가지 다른 종류의 줄기세포의 혼합물로부터 자라났다: iPSC로부터 유도된 간세포 (간 기능용), 탯줄혈액으로부터 내피 줄기세포 (혈관 내막을 형성하기 위한) 그리고 간엽 줄기세포 (결합 조직을 형성하기 위한)이 새로운 접근법은 다른 종류의 세포들이 태아 발달 과정을 모방하면서 복잡한 기관으로 자기 조직화되도록 한다.며칠 동안 체외에서 자란 후, 간봉오리는 '간'이 숙주 혈관과 빠르게 연결되어 계속 자라나는 생쥐에게 이식되었다.가장 중요한 것은, 그것은 약물 대사 및 간 특이적 단백질 생성을 포함한 규칙적인 간 기능을 수행했다.추가 연구는 숙주 내에서 이식된 장기의 수명(통합 또는 거부반응을 피할 수 있는 능력)과 종양이 [73][74]될 것인지 여부를 감시할 것이다.이 방법을 사용하면, 한 생쥐의 세포는 간 질환을 치료하기 위한 1,000가지의 약물 화합물을 테스트하는데 사용될 수 있고, 동물의 사용을 최대 5만 [75]마리까지 줄일 수 있다.
장기 재생
2021년에는 종양 형성이 없는 손상된 심장의 재생을 위한 전환 가능한 야마나카 인자 재프로그래밍 기반 접근방식이 생쥐를 대상으로 시연되었으며 심장마비 [76]직전 또는 직후에 개입을 수행한 경우 성공적이었다.
조직 복구
배아 제대혈구는 플라스미드 DNA를 사용하여 만능줄기세포로 유도되었다.세포 표면 내피/주변성 마커 CD31과 CD146을 사용하여 연구원들은 고품질의 다기능 혈관 줄기세포인 '혈관 전구체'를 확인했다.iPS 세포를 생쥐의 손상된 망막의 유리액에 직접 주입한 후, 줄기세포는 망막에 이식되어 혈관을 [77][78]성장시키고 고쳤다.
뇌 병변이 있는 실험실 동물에게 주입된 라벨 부착 iPSC 유래 NSC는 병변으로 이동하는 것으로 나타났으며 운동 기능 개선이 [79]관찰되었다.
심근 세포
iPSC에서 파생된 심근세포인 심장근세포를 박동시키는 것은 화학적으로 정의된 분화 [80]프로토콜을 사용하여 대량 생산할 수 있다.이 프로토콜들은 전형적으로 심장 [81]발달에 필요한 동일한 발달 신호 경로를 조절합니다.이러한 iPSC-심근세포는 유전적 부정맥과 심장약 반응을 반복할 수 있는데, 이는 그것들이 [82][83]유래된 환자와 동일한 유전적 배경을 보이기 때문이다.
2014년 6월, 타카라 바이오는 아시아 지역에서 iPS 세포를 심근세포로 분화하는 기술이나 특허를 독점적으로 사용할 수 있도록, 교토 대학 iPS 세포 연구소의 벤처 기업 iHeart Japan으로부터 기술이전을 받았다.그 회사는 심장병 [84]신약을 개발하는 것을 돕기 위해 심근세포를 제약회사와 대학에 판매한다는 아이디어를 발표했다.
2018년 3월 9일, 오사카 대학 특정 재생의학 위원회는, iPS 세포로 만든 「근막 시트」를 중증 심부전 환자의 심장에 이식하는 임상 연구 계획을 세계 최초로 승인했습니다.오사카 대학은 같은 날 후생노동성에 신청서를 제출했다고 발표했다.
2018년 5월 16일 [85][86]후생노동성 전문가그룹으로부터 조건부로 임상연구계획이 승인되었다.
2019년 10월, 오카야마 대학 연구진은 iPS [87]세포와 분화된 심근 세포를 이용한 허혈성 심장병 모델을 개발했다.
적혈구
비록 1파인트의 기증된 혈액이 약 2조 개의 적혈구를 포함하고 있고 세계적으로 1억 7백만 개 이상의 헌혈이 수집되고 있지만, 여전히 수혈을 위한 혈액이 절대적으로 필요하다.2014년 스코틀랜드 국립수혈원에서 iPSC의 O형 적혈구가 합성되었다.그 세포들은 중배엽이 되도록 유도되었고, 그 다음에는 혈구, 그 다음에는 적혈구가 되었다.마지막 단계는 그들이 핵을 배출하고 적절하게 성숙하도록 만드는 것이었다.O형은 모든 환자에게 수혈할 수 있다.인간 임상시험은 2016년 [88]이전에 시작될 것으로 예상되지 않았다.
임상 시험
자가iPSC를 이용한 최초의 인간 임상시험은 일본 보건성의 승인을 받아 2014년 고베의 리켄 개발 생물학 센터에서 실시될 예정이었다.그러나 2015년 [89]11월 일본의 새로운 재생의료법이 시행되면서 재판이 중단됐다.구체적으로는, 기존의 가이드 라인이 법률의 효력을 가지도록 강화되었다(이전에는 단순한 [90]권고 사항).습식 노화 관련 황반변성 환자 6명의 피부 세포에서 파생된 iPSC는 망막 색소 상피(RPE) 세포로 분화되도록 재프로그래밍되었다.세포 시트는 퇴화된 RPE 조직이 절제된 영향을 받은 망막에 이식될 것이다.안전 및 시력 회복 모니터링은 1년에서 3년 [91][92]정도 지속될 예정이었다.
2017년 3월 다카하시 마사요(高橋正o)가 이끄는 팀은 기증자의 iPS유래 망막세포를 [93]황반변성이 진행된 사람의 눈에 최초로 이식하는 데 성공했다.그러나 현재 [94]합병증이 있는 것으로 알려졌다.자가 iPSC를 사용하는 것의 장점은 이론적으로 거부반응의 위험이 없고 배아줄기세포를 사용할 필요가 없다는 것이다.단, 이러한 iPSC는 다른 [92]사람에게서 파생되었습니다.
IPSC와 관련된 새로운 임상시험은 현재 일본뿐만 아니라 미국과 유럽에서도 [95]진행 중이다.2021년 시용 등록부 Clinicaltrials.gov에 대한 조사에서는 IPSC를 언급하는 129개의 시용 목록이 확인되었지만 대부분은 [96]비시용이었다.
범용iPSC를 입수하는 전략
iPSC 기반 재생 의학 기술을 더 많은 환자에게 제공하기 위해서는 HLA의 하플로타입과는 독립적으로 이식할 수 있는 범용 iPSC를 만들어야 한다.현재의 범용iPSC 작성 전략에는 HLA 발현 삭제와 HLA 삭제에 의한 NK 셀 공격을 방지하는 두 가지 주요 목표가 있습니다.CRISPR/Cas9 시스템을 이용한 B2M 및 CITA 유전자의 결실은 각각 HLA 클래스 I 및 클래스 II의 발현을 억제하는 것으로 보고되었다.NK 세포 공격을 피하기 위해 HLA-E 및 CD47과 같은 NK 세포를 억제하는 리간드의 전달이 사용되었습니다.[97]HLA-C는 12개의 일반적인 HLA-C 대립 유전자가 세계 [97]인구의 95%를 차지하기에 충분하기 때문에 변경되지 않은 채로 남아 있습니다.
안티에이징 속성
다기능 간엽 줄기세포는 다능성으로 유도될 때 노화 표현형을 늦추거나 역전시킬 가능성이 크다.이러한 노화방지 특성은 2017년 [98]초기 임상시험에서 입증되었다.2020년 스탠포드 대학 연구진은 고령의 쥐를 연구한 후 야마나카 인자에 의해 늙은 인간 세포가 회춘해 [99]젊은 세포와 거의 구별할 수 없게 될 수 있다고 결론지었다.
「 」를 참조해 주세요.
- 유도줄기세포
- 줄기세포 치료법
- 자극 유발 다능성 세포의 획득, 산에 세포를 담그고 만능 줄기세포 생성에 대한 현재 신뢰받지 못하는 주장
- SCNT를 통해 얻은 유도 다능성 줄기세포 대 배아줄기세포주(논의 비교
- 탈분화
- 지향적 차별화
- 다능성
레퍼런스
- ^ a b c d Takahashi K, Yamanaka S (August 2006). "Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors". Cell. 126 (4): 663–76. doi:10.1016/j.cell.2006.07.024. PMID 16904174.

- ^ "The Nobel Prize in Physiology or Medicine – 2012 Press Release". Nobel Media AB. 8 October 2012.
- ^ Mahla RS (2016). "Stem Cells Applications in Regenerative Medicine and Disease Therapeutics". International Journal of Cell Biology. 2016: 6940283. doi:10.1155/2016/6940283. PMC 4969512. PMID 27516776.
- ^ Klimanskaya I, Chung Y, Becker S, Lu SJ, Lanza R (November 2006). "Human embryonic stem cell lines derived from single blastomeres". Nature. 444 (7118): 481–5. Bibcode:2006Natur.444..481K. doi:10.1038/nature05142. PMID 16929302. S2CID 84792371.
- ^ Hockemeyer D, Jaenisch R (May 2016). "Induced Pluripotent Stem Cells Meet Genome Editing". Cell Stem Cell. 18 (5): 573–86. doi:10.1016/j.stem.2016.04.013. PMC 4871596. PMID 27152442.
- ^ 2010, 페이지 . : 없음: CITEREF(도움말)
- ^ "「i」PSなぜ小文字? 山中さんってどんな人?". 朝日新聞. 8 October 2012. Retrieved 27 April 2013.
- ^ "万能なiPS細胞「iPodのように普及してほしい」". スポーツニッポン. 9 October 2012. Retrieved 14 October 2012.
- ^ "山中教授の「iPS細胞」ってiPod のパクリ!?流行らせたいと頭小文字". J-CASTニュース. 9 October 2012. Retrieved 28 April 2013.
- ^ Yamanaka S (December 2013). "The winding road to pluripotency (Nobel Lecture)". Angewandte Chemie. 52 (52): 13900–9. doi:10.1002/anie.201306721. PMID 24255017.
- ^ Guo XL, Chen JS (2015). "Research on induced pluripotent stem cells and the application in ocular tissues". International Journal of Ophthalmology. 8 (4): 818–25. doi:10.3980/j.issn.2222-3959.2015.04.31. PMC 4539634. PMID 26309885.
- ^ Okita K, Ichisaka T, Yamanaka S (July 2007). "Generation of germline-competent induced pluripotent stem cells". Nature. 448 (7151): 313–7. Bibcode:2007Natur.448..313O. doi:10.1038/nature05934. PMID 17554338. S2CID 459050.
- ^ Wernig M, Meissner A, Foreman R, Brambrink T, Ku M, Hochedlinger K, et al. (July 2007). "In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state". Nature. 448 (7151): 318–24. Bibcode:2007Natur.448..318W. doi:10.1038/nature05944. PMID 17554336. S2CID 4377572.
- ^ Maherali N, Sridharan R, Xie W, Utikal J, Eminli S, Arnold K, et al. (June 2007). "Directly reprogrammed fibroblasts show global epigenetic remodeling and widespread tissue contribution". Cell Stem Cell. 1 (1): 55–70. doi:10.1016/j.stem.2007.05.014. PMID 18371336.
- ^ "Generations of iPSCs and related references".
- ^ Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanaka S (November 2007). "Induction of pluripotent stem cells from adult human fibroblasts by defined factors". Cell. 131 (5): 861–72. doi:10.1016/j.cell.2007.11.019. PMID 18035408.
- ^ a b Yu J, Vodyanik MA, Smuga-Otto K, Antosiewicz-Bourget J, Frane JL, Tian S, et al. (December 2007). "Induced pluripotent stem cell lines derived from human somatic cells". Science. 318 (5858): 1917–20. Bibcode:2007Sci...318.1917Y. doi:10.1126/science.1151526. PMID 18029452. S2CID 86129154.
- ^ a b c Yamanaka S (July 2010). "Patient-specific pluripotent stem cells become even more accessible". Cell Stem Cell. 7 (1): 1–2. doi:10.1016/j.stem.2010.06.009. PMID 20621038.
- ^ a b Maherali N, Hochedlinger K (December 2008). "Guidelines and techniques for the generation of induced pluripotent stem cells". Cell Stem Cell. 3 (6): 595–605. doi:10.1016/j.stem.2008.11.008. PMID 19041776.
- ^ Maherali N, Ahfeldt T, Rigamonti A, Utikal J, Cowan C, Hochedlinger K (September 2008). "A high-efficiency system for the generation and study of human induced pluripotent stem cells". Cell Stem Cell. 3 (3): 340–5. doi:10.1016/j.stem.2008.08.003. PMC 3987901. PMID 18786420.
- ^ Aasen T, Raya A, Barrero MJ, Garreta E, Consiglio A, Gonzalez F, et al. (November 2008). "Efficient and rapid generation of induced pluripotent stem cells from human keratinocytes". Nature Biotechnology. 26 (11): 1276–84. doi:10.1038/nbt.1503. PMID 18931654. S2CID 205274019.
- ^ Staerk J, Dawlaty MM, Gao Q, Maetzel D, Hanna J, Sommer CA, et al. (July 2010). "Reprogramming of human peripheral blood cells to induced pluripotent stem cells". Cell Stem Cell. 7 (1): 20–4. doi:10.1016/j.stem.2010.06.002. PMC 2917234. PMID 20621045.
- ^ Loh YH, Hartung O, Li H, Guo C, Sahalie JM, Manos PD, et al. (July 2010). "Reprogramming of T cells from human peripheral blood". Cell Stem Cell. 7 (1): 15–9. doi:10.1016/j.stem.2010.06.004. PMC 2913590. PMID 20621044.
- ^ Zhou T, Benda C, Dunzinger S, Huang Y, Ho JC, Yang J, et al. (December 2012). "Generation of human induced pluripotent stem cells from urine samples". Nature Protocols. 7 (12): 2080–9. doi:10.1038/nprot.2012.115. PMID 23138349. S2CID 205465442.
- ^ Polo JM, Liu S, Figueroa ME, Kulalert W, Eminli S, Tan KY, et al. (August 2010). "Cell type of origin influences the molecular and functional properties of mouse induced pluripotent stem cells". Nature Biotechnology. 28 (8): 848–55. doi:10.1038/nbt.1667. PMC 3148605. PMID 20644536.
- ^ Velychko S, Adachi K, Kim KP, Hou Y, MacCarthy CM, Wu G, Schöler HR (December 2019). "Excluding Oct4 from Yamanaka Cocktail Unleashes the Developmental Potential of iPSCs". Cell Stem Cell. 25 (6): 737–753.e4. doi:10.1016/j.stem.2019.10.002. PMC 6900749. PMID 31708402.
- ^ 유도만능줄기세포의 품질은 가장 중요한 재프로그래밍 인자로 생각되는 것을 생략함으로써 극적으로 향상된다. Oct4는 불필요할 뿐만 아니라 마우스 유도만능줄기세포(iPSC) 생성 중에 손상된다.
- ^ Ali PS, Ghoshdastider U, Hoffmann J, Brutschy B, Filipek S (November 2012). "Recognition of the let-7g miRNA precursor by human Lin28B". FEBS Letters. 586 (22): 3986–90. doi:10.1016/j.febslet.2012.09.034. PMID 23063642. S2CID 28899778.
- ^ Maekawa M, Yamaguchi K, Nakamura T, Shibukawa R, Kodanaka I, Ichisaka T, et al. (June 2011). "Direct reprogramming of somatic cells is promoted by maternal transcription factor Glis1". Nature. 474 (7350): 225–9. doi:10.1038/nature10106. hdl:2433/141930. PMID 21654807. S2CID 4428172.
- ^ Luo M, Ling T, Xie W, Sun H, Zhou Y, Zhu Q, et al. (July 2013). "NuRD blocks reprogramming of mouse somatic cells into pluripotent stem cells". Stem Cells. 31 (7): 1278–86. doi:10.1002/stem.1374. hdl:10397/18487. PMID 23533168. S2CID 206512562.
- ^ Rais Y, Zviran A, Geula S, Gafni O, Chomsky E, Viukov S, et al. (October 2013). "Deterministic direct reprogramming of somatic cells to pluripotency". Nature. 502 (7469): 65–70. Bibcode:2013Natur.502...65R. doi:10.1038/nature12587. PMID 24048479. S2CID 4386833.
- ^ Selvaraj V, Plane JM, Williams AJ, Deng W (April 2010). "Switching cell fate: the remarkable rise of induced pluripotent stem cells and lineage reprogramming technologies". Trends in Biotechnology. 28 (4): 214–23. doi:10.1016/j.tibtech.2010.01.002. PMC 2843790. PMID 20149468.
- ^ a b Okita K, Nakagawa M, Hyenjong H, Ichisaka T, Yamanaka S (November 2008). "Generation of mouse induced pluripotent stem cells without viral vectors". Science. 322 (5903): 949–53. Bibcode:2008Sci...322..949O. doi:10.1126/science.1164270. PMID 18845712. S2CID 23735743.
- ^ Stadtfeld M, Nagaya M, Utikal J, Weir G, Hochedlinger K (November 2008). "Induced pluripotent stem cells generated without viral integration". Science. 322 (5903): 945–9. Bibcode:2008Sci...322..945S. doi:10.1126/science.1162494. PMC 3987909. PMID 18818365.
- ^ Woltjen K, Michael IP, Mohseni P, Desai R, Mileikovsky M, Hämäläinen R, et al. (April 2009). "piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells". Nature. 458 (7239): 766–70. Bibcode:2009Natur.458..766W. doi:10.1038/nature07863. PMC 3758996. PMID 19252478.
- ^ Kaplan K (6 March 2009). "Cancer threat removed from stem cells, scientists say". Los Angeles Times.
- ^ Swaminathan N (30 November 2007). "Stem Cells – This Time Without the Cancer". Scientific American News. Retrieved 11 December 2007.
- ^ Marión RM, Strati K, Li H, Murga M, Blanco R, Ortega S, et al. (August 2009). "A p53-mediated DNA damage response limits reprogramming to ensure iPS cell genomic integrity". Nature. 460 (7259): 1149–53. Bibcode:2009Natur.460.1149M. doi:10.1038/nature08287. PMC 3624089. PMID 19668189.
- ^ a b Zhao XY, Li W, Lv Z, Liu L, Tong M, Hai T, et al. (September 2009). "iPS cells produce viable mice through tetraploid complementation". Nature. 461 (7260): 86–90. Bibcode:2009Natur.461...86Z. doi:10.1038/nature08267. PMID 19672241. S2CID 205217762.
- ^ Huangfu D, Maehr R, Guo W, Eijkelenboom A, Snitow M, Chen AE, Melton DA (July 2008). "Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds". Nature Biotechnology. 26 (7): 795–7. doi:10.1038/nbt1418. PMC 6334647. PMID 18568017.
- ^ a b Shi Y, Desponts C, Do JT, Hahm HS, Schöler HR, Ding S (November 2008). "Induction of pluripotent stem cells from mouse embryonic fibroblasts by Oct4 and Klf4 with small-molecule compounds". Cell Stem Cell. 3 (5): 568–74. doi:10.1016/j.stem.2008.10.004. PMID 18983970.
- ^ Cyranoski D (18 July 2013). "Stem cells reprogrammed using chemicals alone". Nature News. doi:10.1038/nature.2013.13416. S2CID 88247014. Retrieved 22 July 2013.
- ^ Hou P, Li Y, Zhang X, Liu C, Guan J, Li H, et al. (August 2013). "Pluripotent stem cells induced from mouse somatic cells by small-molecule compounds". Science. 341 (6146): 651–4. Bibcode:2013Sci...341..651H. doi:10.1126/science.1239278. PMID 23868920. S2CID 45685692.
- ^ "Major Step In Making Better Stem Cells From Adult Tissue". Science Daily. 19 October 2009. Retrieved 30 September 2013.
- ^ Lin T, Ambasudhan R, Yuan X, Li W, Hilcove S, Abujarour R, et al. (November 2009). "A chemical platform for improved induction of human iPSCs". Nature Methods. 6 (11): 805–8. doi:10.1038/nmeth.1393. PMC 3724527. PMID 19838168.
- ^ a b Zhou H, Wu S, Joo JY, Zhu S, Han DW, Lin T, et al. (May 2009). "Generation of induced pluripotent stem cells using recombinant proteins". Cell Stem Cell. 4 (5): 381–4. doi:10.1016/j.stem.2009.04.005. PMID 19398399.
- ^ Zhou W, Freed CR (November 2009). "Adenoviral gene delivery can reprogram human fibroblasts to induced pluripotent stem cells". Stem Cells. 27 (11): 2667–74. doi:10.1002/stem.201. PMID 19697349. S2CID 41418742.
- ^ 네이처 뉴스의 데이비드 시라노스키입니다.2014년 1월 29일 산욕은 줄기세포로 가는 쉬운 길을 제공한다.
- ^ 과학자의 트레이시 밴스입니다2014년 3월 11일 STAP 철회 요청
- ^ Lies E (4 June 2014). "Japan researcher agrees to withdraw disputed stem cell paper". Reuters. Retrieved 4 June 2014.
- ^ Press Release (1 April 2014). "Report on STAP Cell Research Paper Investigation". RIKEN. Retrieved 2 June 2014.
- ^ a b c Bao X, Zhu X, Liao B, Benda C, Zhuang Q, Pei D, et al. (April 2013). "MicroRNAs in somatic cell reprogramming". Current Opinion in Cell Biology. 25 (2): 208–14. doi:10.1016/j.ceb.2012.12.004. PMID 23332905.
- ^ Judson RL, Babiarz JE, Venere M, Blelloch R (May 2009). "Embryonic stem cell-specific microRNAs promote induced pluripotency". Nature Biotechnology. 27 (5): 459–61. doi:10.1038/nbt.1535. PMC 2743930. PMID 19363475.
- ^ Guenther MG, Frampton GM, Soldner F, Hockemeyer D, Mitalipova M, Jaenisch R, Young RA (August 2010). "Chromatin structure and gene expression programs of human embryonic and induced pluripotent stem cells". Cell Stem Cell. 7 (2): 249–57. doi:10.1016/j.stem.2010.06.015. PMC 3010384. PMID 20682450.
- ^ Kang L, Wang J, Zhang Y, Kou Z, Gao S (August 2009). "iPS cells can support full-term development of tetraploid blastocyst-complemented embryos". Cell Stem Cell. 5 (2): 135–8. doi:10.1016/j.stem.2009.07.001. PMID 19631602.
- ^ a b Boland MJ, Hazen JL, Nazor KL, Rodriguez AR, Gifford W, Martin G, et al. (September 2009). "Adult mice generated from induced pluripotent stem cells". Nature. 461 (7260): 91–4. Bibcode:2009Natur.461...91B. doi:10.1038/nature08310. PMID 19672243. S2CID 4423755.
- ^ Lister R, Pelizzola M, Kida YS, Hawkins RD, Nery JR, Hon G, et al. (March 2011). "Hotspots of aberrant epigenomic reprogramming in human induced pluripotent stem cells". Nature. 471 (7336): 68–73. Bibcode:2011Natur.471...68L. doi:10.1038/nature09798. PMC 3100360. PMID 21289626.
- ^ Knoepfler PS (May 2009). "Deconstructing stem cell tumorigenicity: a roadmap to safe regenerative medicine". Stem Cells. 27 (5): 1050–6. doi:10.1002/stem.37. PMC 2733374. PMID 19415771.
- ^ Nori S, Okada Y, Yasuda A, Tsuji O, Takahashi Y, Kobayashi Y, et al. (October 2011). "Grafted human-induced pluripotent stem-cell-derived neurospheres promote motor functional recovery after spinal cord injury in mice". Proceedings of the National Academy of Sciences of the United States of America. 108 (40): 16825–30. Bibcode:2011PNAS..10816825N. doi:10.1073/pnas.1108077108. PMC 3189018. PMID 21949375.
- ^ Nori S, Okada Y, Nishimura S, Sasaki T, Itakura G, Kobayashi Y, et al. (March 2015). "Long-term safety issues of iPSC-based cell therapy in a spinal cord injury model: oncogenic transformation with epithelial-mesenchymal transition". Stem Cell Reports. 4 (3): 360–73. doi:10.1016/j.stemcr.2015.01.006. PMC 4375796. PMID 25684226.
- ^ Aoi T, Yae K, Nakagawa M, Ichisaka T, Okita K, Takahashi K, et al. (August 2008). "Generation of pluripotent stem cells from adult mouse liver and stomach cells". Science. 321 (5889): 699–702. Bibcode:2008Sci...321..699A. doi:10.1126/science.1154884. hdl:2433/124215. PMID 18276851. S2CID 52869734.
- ^ Gutierrez-Aranda I, Ramos-Mejia V, Bueno C, Munoz-Lopez M, Real PJ, Mácia A, et al. (September 2010). "Human induced pluripotent stem cells develop teratoma more efficiently and faster than human embryonic stem cells regardless the site of injection". Stem Cells. 28 (9): 1568–70. doi:10.1002/stem.471. PMC 2996086. PMID 20641038.
- ^ Zhao T, Zhang ZN, Rong Z, Xu Y (May 2011). "Immunogenicity of induced pluripotent stem cells". Nature. 474 (7350): 212–5. CiteSeerX 10.1.1.864.8029. doi:10.1038/nature10135. PMID 21572395. S2CID 4416964.
- ^ Araki R, Uda M, Hoki Y, Sunayama M, Nakamura M, Ando S, et al. (February 2013). "Negligible immunogenicity of terminally differentiated cells derived from induced pluripotent or embryonic stem cells". Nature. 494 (7435): 100–4. Bibcode:2013Natur.494..100A. doi:10.1038/nature11807. PMID 23302801. S2CID 205232231.
- ^ Okano H, Nakamura M, Yoshida K, Okada Y, Tsuji O, Nori S, et al. (February 2013). "Steps toward safe cell therapy using induced pluripotent stem cells". Circulation Research. 112 (3): 523–33. doi:10.1161/CIRCRESAHA.111.256149. PMID 23371901.
- ^ Shalom-Feuerstein R, Serror L, Aberdam E, Müller FJ, van Bokhoven H, Wiman KG, et al. (February 2013). "Impaired epithelial differentiation of induced pluripotent stem cells from ectodermal dysplasia-related patients is rescued by the small compound APR-246/PRIMA-1MET". Proceedings of the National Academy of Sciences of the United States of America. 110 (6): 2152–6. Bibcode:2013PNAS..110.2152S. doi:10.1073/pnas.1201753109. PMC 3568301. PMID 23355677.
- ^ Park IH, Arora N, Huo H, Maherali N, Ahfeldt T, Shimamura A, et al. (September 2008). "Disease-specific induced pluripotent stem cells". Cell. 134 (5): 877–86. doi:10.1016/j.cell.2008.07.041. PMC 2633781. PMID 18691744.
- ^ Freedman BS, Lam AQ, Sundsbak JL, Iatrino R, Su X, Koon SJ, et al. (October 2013). "Reduced ciliary polycystin-2 in induced pluripotent stem cells from polycystic kidney disease patients with PKD1 mutations". Journal of the American Society of Nephrology. 24 (10): 1571–86. doi:10.1681/ASN.2012111089. PMC 3785271. PMID 24009235.
- ^ Grskovic M, Javaherian A, Strulovici B, Daley GQ (November 2011). "Induced pluripotent stem cells--opportunities for disease modeling and drug discovery". Nature Reviews. Drug Discovery. 10 (12): 915–29. doi:10.1038/nrd3577. PMID 22076509. S2CID 7945956.
- ^ Gerlin A (5 December 2012). "Roche, Pfizer, Sanofi Plan $72.7 Million Stem-Cell Bank". Bloomberg.com. Retrieved 23 December 2012.
- ^ Shinnawi R, Huber I, Maizels L, Shaheen N, Gepstein A, Arbel G, et al. (October 2015). "Monitoring Human-Induced Pluripotent Stem Cell-Derived Cardiomyocytes with Genetically Encoded Calcium and Voltage Fluorescent Reporters". Stem Cell Reports. 5 (4): 582–96. doi:10.1016/j.stemcr.2015.08.009. PMC 4624957. PMID 26372632.
- ^ Shaheen N, Shiti A, Huber I, Shinnawi R, Arbel G, Gepstein A, et al. (June 2018). "Human Induced Pluripotent Stem Cell-Derived Cardiac Cell Sheets Expressing Genetically Encoded Voltage Indicator for Pharmacological and Arrhythmia Studies". Stem Cell Reports. 10 (6): 1879–1894. doi:10.1016/j.stemcr.2018.04.006. PMC 5989818. PMID 29754959.
- ^ Baker M (3 July 2013). "Miniature human liver grown in mice". Nature. doi:10.1038/nature.2013.13324. S2CID 87064973. Retrieved 19 July 2013.
- ^ Takebe T, Sekine K, Enomura M, Koike H, Kimura M, Ogaeri T, et al. (July 2013). "Vascularized and functional human liver from an iPSC-derived organ bud transplant". Nature. 499 (7459): 481–4. Bibcode:2013Natur.499..481T. doi:10.1038/nature12271. PMID 23823721. S2CID 4423004.
- ^ "Mini-Livers May Reduce Animal Testing". Laboratory Equipment.com. 27 February 2014.
- ^ Chen Y, Lüttmann FF, Schoger E, Schöler HR, Zelarayán LC, Kim KP, et al. (September 2021). "Reversible reprogramming of cardiomyocytes to a fetal state drives heart regeneration in mice". Science. 373 (6562): 1537–1540. doi:10.1126/science.abg5159. PMID 34554778.
- ^ Mullin E (28 January 2014). "Researchers repair retinas in mice with virus-free stem cells". fiercebiotech.com. Retrieved 17 February 2014.
- ^ Park TS, Bhutto I, Zimmerlin L, Huo JS, Nagaria P, Miller D, et al. (January 2014). "Vascular progenitors from cord blood-derived induced pluripotent stem cells possess augmented capacity for regenerating ischemic retinal vasculature". Circulation. 129 (3): 359–72. doi:10.1161/CIRCULATIONAHA.113.003000. PMC 4090244. PMID 24163065.
- ^ Tang H, Sha H, Sun H, Wu X, Xie L, Wang P, et al. (October 2013). "Tracking induced pluripotent stem cells-derived neural stem cells in the central nervous system of rats and monkeys". Cellular Reprogramming. 15 (5): 435–42. doi:10.1089/cell.2012.0081. PMC 3787483. PMID 24020696.
- ^ Burridge PW, Matsa E, Shukla P, Lin ZC, Churko JM, Ebert AD, et al. (August 2014). "Chemically defined generation of human cardiomyocytes". Nature Methods. 11 (8): 855–60. doi:10.1038/nmeth.2999. PMC 4169698. PMID 24930130.
- ^ Willems E, Spiering S, Davidovics H, Lanier M, Xia Z, Dawson M, et al. (August 2011). "Small-molecule inhibitors of the Wnt pathway potently promote cardiomyocytes from human embryonic stem cell-derived mesoderm". Circulation Research. 109 (4): 360–4. doi:10.1161/CIRCRESAHA.111.249540. PMC 3327303. PMID 21737789.
- ^ Itzhaki I, Maizels L, Huber I, Zwi-Dantsis L, Caspi O, Winterstern A, et al. (March 2011). "Modelling the long QT syndrome with induced pluripotent stem cells". Nature. 471 (7337): 225–9. Bibcode:2011Natur.471..225I. doi:10.1038/nature09747. PMID 21240260. S2CID 4384573.
- ^ Sharma A, Burridge PW, McKeithan WL, Serrano R, Shukla P, Sayed N, et al. (February 2017). "High-throughput screening of tyrosine kinase inhibitor cardiotoxicity with human induced pluripotent stem cells". Science Translational Medicine. 9 (377): eaaf2584. doi:10.1126/scitranslmed.aaf2584. PMC 5409837. PMID 28202772.
- ^ "iPSから心筋細胞製造 タカラバイオとベンチャー". 日本経済新聞 電子版 (in Japanese). 24 June 2014. Retrieved 8 November 2019.
- ^ "iPSで心臓治療了承 高難度の再生医療へ一歩". 日本経済新聞 電子版 (in Japanese). 16 May 2018. Retrieved 8 November 2019.
- ^ "iPS細胞の心筋シート移植、臨床研究を国が大筋了承:朝日新聞デジタル". 朝日新聞デジタル (in Japanese). Retrieved 8 November 2019.
- ^ Wei H, Wang C, Guo R, Takahashi K, Naruse K (December 2019). "Development of a model of ischemic heart disease using cardiomyocytes differentiated from human induced pluripotent stem cells". Biochemical and Biophysical Research Communications. 520 (3): 600–605. doi:10.1016/j.bbrc.2019.09.119. PMID 31623826.
- ^ "First transfusions of "manufactured" blood planned for 2016". Gizmag.com. 23 April 2014. Retrieved 23 April 2014.
- ^ Garber K (September 2015). "RIKEN suspends first clinical trial involving induced pluripotent stem cells". Nature Biotechnology. 33 (9): 890–1. doi:10.1038/nbt0915-890. PMID 26348942. S2CID 205271169.
- ^ Tobita M, Konomi K, Torashima Y, Kimura K, Taoka M, Kaminota M (June 2016). "Japan's challenges of translational regenerative medicine: Act on the safety of regenerative medicine". Regenerative Therapy. 4: 78–81. doi:10.1016/j.reth.2016.04.001. PMC 6581824. PMID 31245489.
- ^ Riken Center for Developmental Biology. "Information on p=roposed pilot study of the safety and feasibility of transplantation of autologous hiPSC-derived retinal pigment epithelium (RPE) cell sheets in patients with neovascular age-related macular degeneration". Research. Archived from the original on 26 June 2013. Retrieved 23 July 2013.
- ^ a b Gallagher J (19 July 2013). "Pioneering adult stem cell trial approved by Japan". BBC News. Retrieved 23 July 2013.
- ^ "First donor iPSC-derived RPE cell transplantation in AMD patient". RIKEN Center for Developmental Biology. 4 April 2017. Retrieved 6 September 2017.
- ^ "First serious adverse reaction to iPS-derived retinal cell transplant reported". The Japan Times Online. 17 January 2018.
- ^ Deinsberger J, Reisinger D, Weber B (11 September 2020). "Global trends in clinical trials involving pluripotent stem cells: a systematic multi-database analysis". NPJ Regenerative Medicine. 5 (1): 15. doi:10.1038/s41536-020-00100-4. PMC 7486930. PMID 32983575.
- ^ Knoepfler P (25 January 2021). "What are induced pluripotent stem cells or IPS cells & clinical prospects?". The Niche. Retrieved 7 February 2021.
- ^ a b Koga K, Wang B, Kaneko S (2020). "Current status and future perspectives of HLA-edited induced pluripotent stem cells". Inflammation and Regeneration. 40: 23. doi:10.1186/s41232-020-00132-9. PMC 7528263. PMID 33014207.
- ^ Haridy R (23 October 2017). "Anti-Aging Stem Cell Treatment Proves Successful in Early Human Trials". New Atlas.
- ^ Sarkar TJ, Quarta M, Mukherjee S, Colville A, Paine P, Doan L, et al. (March 2020). "Transient non-integrative expression of nuclear reprogramming factors promotes multifaceted amelioration of aging in human cells". Nature Communications. 11 (1): 1545. Bibcode:2020NatCo..11.1545S. doi:10.1038/s41467-020-15174-3. PMC 7093390. PMID 32210226.
외부 링크
- 교토 대학 iPS 세포 연구 응용 센터
- 몇 가지 요인과 함께 성체 세포는 배아줄기세포의 특성을 띤다.
- Sox-2, Oct-4, c-Myc 및 Klf4의 강제 표현을 통한 MEFS로부터의 iPS 셀 생성
- 유도 다능성 줄기세포에 관한 BSCRF의 2분 비디오
- 야마나카 박사의 20분 비디오 / 유도 만능 줄기세포의 발견과 미래 2008년 1월 8일
- 재프로그래밍에 관한 팩트 시트
- 옥스퍼드 대학 만능 줄기세포 기술 실무 워크숍
- Allen Cell Explorer - 멀티 퍼텐트 상태에서 살아있는 hiPSC를 사실적으로 3D 시각화합니다.
- CamBioScience iPSC 코스