GMP 합성효소
GMP synthase| GMP합성효소(글루타민 가수분해) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 GMP 합성효소, 사람 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 6.3.5.2 | ||||||||
| CAS 번호 | 37318-71-1 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| 진 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
| GMP합성효소C말단 도메인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
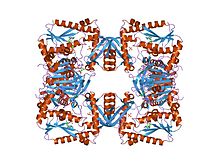 암페어 및 피로인산과 복합된 대장균 gmp 합성효소.[1] | |||||||||
| 식별자 | |||||||||
| 기호. | GMP_synt_C | ||||||||
| 팜 | PF00958 | ||||||||
| 인터프로 | IPR001674 | ||||||||
| 프로 사이트 | PDOC00405 | ||||||||
| SCOP2 | 1gpm/SCOPe/SUPFAM | ||||||||
| |||||||||
| GMPS | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||
| 에일리어스 | GMPS, GMP합성효소, 구아닌1인산합성효소, GATD7, GMP합성효소 | ||||||||||||||||||||||||
| 외부 ID | OMIM: 600358 MGI: 2448526 HomoloGene: 68367 GenCard: GMPS | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 맞춤법 | |||||||||||||||||||||||||
| 종. | 인간 | 마우스 | |||||||||||||||||||||||
| 엔트레즈 | |||||||||||||||||||||||||
| 앙상블 | |||||||||||||||||||||||||
| 유니프로트 | |||||||||||||||||||||||||
| RefSeq(mRNA) | |||||||||||||||||||||||||
| RefSeq(단백질) | |||||||||||||||||||||||||
| 장소(UCSC) | Chr 3: 155.87 ~155.94 Mb | Chr 3: 63.88 ~63.93 Mb | |||||||||||||||||||||||
| PubMed 검색 | [4] | [5] | |||||||||||||||||||||||
| 위키데이터 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
구아노신 일인산 합성효소(EC 6.3.5.2)는 GMPS로도 알려져 있으며 크산토신 일인산을 [6]구아노신 일인산염으로 변환하는 효소이다.
퓨린뉴클레오티드의 탈노보 합성에서 IMP는 경로가 구아닌 또는 아데닌뉴클레오티드의 합성으로 분기하는 분기점 대사물이다.구아닌뉴클레오티드경로는 IMP에서 GMP로의 변환에 관여하는 2개의 효소, 즉 IMP에서 XMP로의 산화를 촉매하는 IMP탈수소효소(IMPD1)와 XMP에서 [6]GMP로의 아미노화를 촉매하는 GMP합성효소이다.
효소학
효소학에서 GMP 합성효소(글루타민 가수분해효소)(EC 6.3.5.2)는 화학 반응을 촉매하는 효소이다.
- ATP + 크산토신 5'-인산 + L-글루타민 + HO2 { \ AMP + 2인산 + GMP + L-글루탐산
이 효소의 4가지 기질은 ATP, 크산토신 5'-인산, L-글루타민, HO이며2, 4가지 생성물은 AMP, 2인산, GMP, L-글루탐산이다.
이 효소는 결합효소군에 속하며, 특히 아미노-N-공여체로서 글루타민과 탄소-질소 결합을 형성하는 결합효소이다.이 효소 클래스의 계통명은 크산토신-5'-인산이다.L-글루타민아미도리가아제(AMP형성)이 효소는 푸린 대사와 글루탐산 대사에 관여합니다.적어도 하나의 화합물인 Psicofuranin은 이 효소를 저해하는 것으로 알려져 있다.
구조 연구
2007년 말 현재 이 등급의 효소에 대해 5가지 구조가 해결되었으며 PDB 가입 코드는 1GPM, 1WL8, 2A9V, 2D7J 및 2DPL이다.
신진대사의 역할
푸린 대사
GMP 합성효소는 IMP로부터의 GMP 생성의 두 번째 단계이며, 첫 번째 단계는 IMP 탈수소효소가 XMP를 생성하고, 그 후 GMP 합성효소가 글루타민 및 ATP와 반응하여 GMP를 생성할 수 있으며, IMP는 아데닐로숙신효소에 [7]의해 AMP로 생성될 수도 있다.
아미노산 대사
GMP 합성효소는 또한 L-글루타민으로부터 [7]L-글루탐산을 생성하기 때문에 아미노산 대사에 관여한다.
유기적 관여
이 효소는 널리 분포되어 있으며 대장균, 파이로코커스 호리코시이, 열가소성 아스마 산성호르몬, 호모 사피엔스, 테르무스 서모필루스, 마이코박테륨 결핵을 포함한 많은 결정 구조가 해결되었습니다.가장 [8]광범위한 구조 연구는 대장균에서 이루어졌다.
구조 및 기능
GMP 합성효소는 열린 상자 모양으로 이합체의 이합체인 4량체를 형성한다.R 인터페이스는 소수성 코어 및 베타 시트와 함께 유지되며, P 이합체 인터페이스는 소수성 코어가 없으며 R [8]인터페이스보다 더 가변적입니다.이 효소는 또한 인산염, 피로인산염, AMP, 구연산염 및 [9]마그네슘을 포함한 여러 리간드를 결합합니다.
클래스 I 아미도전달효소 도메인
아미드전달효소 도메인은 글루타민 기질에서 아미드 질소를 제거하는 역할을 한다.클래스 I 아미도전달효소 도메인은 효소의 N 말단 206 잔류물로 구성되며, 12개의 베타 가닥과 5개의 알파 나선으로 구성되어 있으며, 이 도메인의 핵심은 개방된 7가닥 혼합 베타 시트이다.촉매 삼합체에는 Cys86, His181 및 Glu183이 포함됩니다.His181은 염기이고 Glu183은 히스티딘 이미다졸 고리의 수소 결합 수용체이다.Cys86은 촉매 잔류물이며 보존됩니다.이것은 친핵성 엘보우(nucleophile elvo)로 떨어져 베타 가닥의 끝과 알파 나선의 시작 부분에 있으며 phi 및 psi 각도의 유연성이 거의 없습니다. 따라서 Gly84 및 Gly88은 보존되어 촉매 [8]잔류물을 둘러싼 아미노산의 밀착을 가능하게 합니다.
합성효소 도메인: ATP 피로포스파타아제 도메인
합성효소 도메인은 추상화된 질소를 수용체 기질에 추가하는 역할을 합니다.ATP 파이로포스파타아제 도메인은 각 면에 여러 개의 알파 나선형 가닥이 있는 5개의 평행 가닥을 포함하는 베타 시트로 구성됩니다.P 루프는 뉴클레오티드 결합 모티브이며 잔류물 235-241은 피로인산에 [8]특이적으로 결합하는 P 루프를 구성합니다.
이 도메인의 구조는 ATP에 대한 이 효소의 특이성을 만드는 것이다.결합 포켓은 아데닌 고리와 소수성 상호작용을 형성하고 Val260의 골격은 C2 푸린 고리의 치환기를 제외한 AMP 고리의 여러 니트로겐과 H 결합을 형성합니다.이것은 아데닌과 ATP [8]결합에 대한 극단적인 특이성을 만들어낸다.
레퍼런스
- ^ Tesmer JJ, Klem TJ, Deras ML, Davisson VJ, Smith JL (January 1996). "The crystal structure of GMP synthetase reveals a novel catalytic triad and is a structural paradigm for two enzyme families". Nature Structural Biology. 3 (1): 74–86. doi:10.1038/nsb0196-74. PMID 8548458. S2CID 30864133.
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG00000163655: 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000027823 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b "Entrez Gene: GMPS guanine monphosphate synthetase".
- ^ a b Garrett RH (1998). Biochemistry. [Place of publication not identified]: Harcourt College. ISBN 0-03-044857-3. OCLC 947935503.
- ^ a b c d e Tesmer JJ, Klem TJ, Deras ML, Davisson VJ, Smith JL (January 1996). "The crystal structure of GMP synthetase reveals a novel catalytic triad and is a structural paradigm for two enzyme families". Nature Structural Biology. 3 (1): 74–86. doi:10.1038/nsb0196-74. PMID 8548458.
- ^ "Ligand/metal interactions: 1gpm". www.ebi.ac.uk. Retrieved 2021-10-21.
추가 정보
- Page T, Bakay B, Nyhan WL (1984). "Human GMP synthetase". The International Journal of Biochemistry. 16 (1): 117–20. doi:10.1016/0020-711X(84)90061-2. PMID 6698284.
- Nakamura J, Straub K, Wu J, Lou L (October 1995). "The glutamine hydrolysis function of human GMP synthetase. Identification of an essential active site cysteine". The Journal of Biological Chemistry. 270 (40): 23450–5. doi:10.1074/jbc.270.40.23450. PMID 7559506.
- Nakamura J, Lou L (March 1995). "Biochemical characterization of human GMP synthetase". The Journal of Biological Chemistry. 270 (13): 7347–53. doi:10.1074/jbc.270.13.7347. PMID 7706277.
- Hirst M, Haliday E, Nakamura J, Lou L (September 1994). "Human GMP synthetase. Protein purification, cloning, and functional expression of cDNA". The Journal of Biological Chemistry. 269 (38): 23830–7. PMID 8089153.
- Maruyama K, Sugano S (January 1994). "Oligo-capping: a simple method to replace the cap structure of eukaryotic mRNAs with oligoribonucleotides". Gene. 138 (1–2): 171–4. doi:10.1016/0378-1119(94)90802-8. PMID 8125298.
- Fedorova L, Kost-Alimova M, Gizatullin RZ, Alimov A, Zabarovska VI, Szeles A, et al. (1997). "Assignment and ordering of twenty-three unique NotI-linking clones containing expressed genes including the guanosine 5'-monophosphate synthetase gene to human chromosome 3". European Journal of Human Genetics. 5 (2): 110–6. doi:10.1159/000484744. PMID 9195163.
- Suzuki Y, Yoshitomo-Nakagawa K, Maruyama K, Suyama A, Sugano S (October 1997). "Construction and characterization of a full length-enriched and a 5'-end-enriched cDNA library". Gene. 200 (1–2): 149–56. doi:10.1016/S0378-1119(97)00411-3. PMID 9373149.
- Pegram LD, Megonigal MD, Lange BJ, Nowell PC, Rowley JD, Rappaport EF, Felix CA (December 2000). "t(3;11) translocation in treatment-related acute myeloid leukemia fuses MLL with the GMPS (GUANOSINE 5' MONOPHOSPHATE SYNTHETASE) gene". Blood. 96 (13): 4360–2. doi:10.1182/blood.V96.13.4360. PMID 11110714.
- Guo D, Han J, Adam BL, Colburn NH, Wang MH, Dong Z, et al. (December 2005). "Proteomic analysis of SUMO4 substrates in HEK293 cells under serum starvation-induced stress". Biochemical and Biophysical Research Communications. 337 (4): 1308–18. doi:10.1016/j.bbrc.2005.09.191. PMID 16236267.
- Abrams R, Bentley M (1959). "Biosynthesis of nucleic acid purines. III. Guanosine 5'-phosphate formation from xanthosine 5'-phosphate and L-glutamine". Arch. Biochem. Biophys. 79: 91–110. doi:10.1016/0003-9861(59)90383-2.
- Lagerkvist U (July 1958). "Biosynthesis of guanosine 5'-phosphate. II. Amination of xanthosine 5'-phosphate by purified enzyme from pigeon liver". The Journal of Biological Chemistry. 233 (1): 143–9. PMID 13563458.








