소포체
Endoplasmic reticulum| 세포생물학 | |
|---|---|
| 동물 세포도 | |
 |

소포체(Endoplasmic reticulum, ER)는 진핵 세포의 수송 시스템의 일부이며, 단백질 접힘과 같은 다른 많은 중요한 기능을 가지고 있습니다. 그것은 거친 소포체(RER)와 부드러운 소포체(SER)의 두 소단위로 구성된 소기관의 한 종류입니다. 소포체는 대부분의 진핵 세포에서 발견되며 시스터네(RER)로 알려진 평평한 막으로 둘러싸인 주머니와 SER의 세뇨관 구조의 상호 연결된 네트워크를 형성합니다. ER의 막은 외부 핵막과 연속적입니다. 소포체는 적혈구나 정자에서 발견되지 않습니다.
두 종류의 ER은 많은 동일한 단백질을 공유하고 특정 지질과 콜레스테롤의 합성과 같은 특정한 공통적인 활동에 참여합니다. 다른 종류의 세포는 세포의 활동에 따라 두 종류의 ER의 비율이 다릅니다. RER은 주로 세포의 핵 쪽으로, SER은 세포의 세포막 또는 원형질막 쪽으로 발견됩니다.
RER의 외부(세포질) 면에는 단백질 합성 부위인 리보솜이 박혀 있습니다. RER은 간세포와 같은 세포에서 특히 두드러집니다. SER은 리보솜이 부족하고 지질 합성에는 기능하지만 대사, 스테로이드 호르몬 생성 및 해독에는 기능하지 않습니다.[1] SER은 특히 포유류의 간 및 생식선 세포에 풍부합니다.
ER은 1897년 Garnier에 의해 광학 현미경으로 관찰되었습니다. Garnier는 에르고플라스마라는 용어를 만들었습니다.[2][3] 소포체의 레이시 막은 1945년 키스 포터(Keith R. Porter), 알버트 클로드(Albert Claude), 어니스트 F(Ernest F.)에 의해 전자현미경으로 처음 관찰되었습니다. 풀람.[4] 후에, "네트워크"를 의미하는 레티큘럼이라는 단어는 1953년 포터에 의해 이 막의 구조를 설명하기 위해 적용되었습니다.[5]
구조.
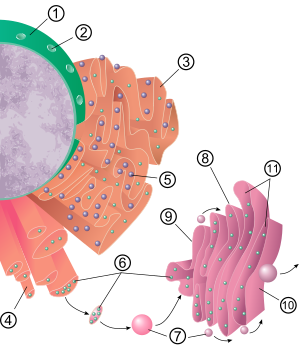

소포체의 일반적인 구조는 시스터네라고 불리는 막의 네트워크입니다. 이 주머니 같은 구조는 세포골격에 의해 함께 고정됩니다. 인지질 막은 시스널 공간(또는 내강)을 둘러싸고 있으며, 이 공간은 핵주위 공간과 연속적이지만 세포질과는 분리되어 있습니다. 소포체의 기능은 단백질과 막 지질의 합성과 수출로 요약될 수 있지만 ER과 세포 유형 및 세포 기능에 따라 다릅니다. 세포 내 거칠고 매끄러운 소포체의 양은 세포의 대사 활동 변화에 따라 한 종류에서 다른 종류로 천천히 바뀔 수 있습니다. 변환에는 구조적 변화뿐만 아니라 막에 새로운 단백질을 내장하는 것이 포함될 수 있습니다. 단백질 함량의 변화는 눈에 띄는 구조 변화 없이 일어날 수 있습니다.[6][7]
거친 소포체

거친 소포체(흔히 RER 또는 거친 ER로 약칭됨)의 표면에는 단백질을 제조하는 리보솜이 박혀 있어 "거친" 모습을 보여줍니다(따라서 그 이름).[8] 거친 소포체에 있는 리보솜의 결합 부위는 트랜스콘입니다.[9] 하지만 리보솜은 막에서 끊임없이 결합되고 방출되기 때문에 이 소기관의 구조에서 안정적인 부분이 아닙니다. 리보솜은 세포질에서 특정 단백질-핵산 복합체가 형성된 후에만 RER에 결합합니다. 이 특별한 복합체는 유리 리보솜이 분비 경로로 향하는 단백질의 mRNA를 번역하기 시작할 때 형성됩니다.[10] 중합된 최초의 5-30개 아미노산은 신호 인식 입자(SRP)에 의해 인식되고 결합되는 분자 메시지인 신호 펩티드를 암호화합니다. 번역이 일시 중지되고 리보솜 복합체가 RER 트랜스포콘에 결합하여 초기(새로운) 단백질이 RER 내강 및/또는 막으로 형성되면서 번역이 계속됩니다. 단백질은 신호 펩타이드를 제거하는 효소(신호 펩티다아제)에 의해 ER 내강에서 처리됩니다. 이 시점에서 리보솜은 다시 세포질로 방출될 수 있지만, 번역되지 않는 리보솜은 트랜스로콘과 연관되어 있는 것으로도 알려져 있습니다.[11]
거친 소포체의 막은 핵 외피의 외부 층 근처에 위치하고 연속적으로 있는 큰 이중 막 시트의 형태입니다.[12] 이중 멤브레인 시트는 여러 개의 오른손 또는 왼손 나선형 경사로인 "테라사키 경사로"를 통해 적층 및 연결되어 주차장과 유사한 구조를 만듭니다.[13][14] 소포체와 골지 장치 사이에는 연속적인 막이 없지만 막 결합 수송 소포체는 이 두 구획 사이에 단백질을 셔틀합니다.[15] 소포는 COPI와 COPII라고 불리는 코팅 단백질로 둘러싸여 있습니다. COPI는 소포를 골지 장치로 겨냥하고 COPI는 소포를 거친 소포체로 가져오도록 표시합니다. 거친 소포체는 골지 복합체와 협력하여 새로운 단백질을 적절한 목적지로 표적화합니다. 소포체 밖으로 운반하는 두 번째 방법은 막 접촉 부위라고 불리는 영역을 포함하는데, 여기서 소포체와 다른 소기관의 막은 서로 가깝게 유지되어 지질과 다른 작은 분자의 전달을 가능하게 합니다.[16][17]
거친 소포체는 다양한 기능에서 핵심입니다.[citation needed]
- 시스-골기 네트워크에 만노스-6-인산 마커를 추가한 리소좀 효소의 제조.[citation needed]
- 태그 없이 구성적으로 분비되거나 신호 펩티드에서 클라트린과 쌍을 이루는 염기성 아미노산을 포함하는 조절 방식으로 분비되는 분비 단백질의 제조.
- 소포가 빠져나가면서 막에 박혀 있는 통합 막 단백질이 새로운 막에 결합합니다. 랍 단백질은 막을 표적으로 삼는 데 핵심이고, SNAP과 SNARE 단백질은 융합 이벤트의 핵심입니다.
- 조립이 계속됨에 따라 초기 글리코실화. 이것은 N-linked(골지에서 O-linking이 발생함)입니다.
매끄러운 소포체

대부분의 세포에서 매끄러운 소포체(smooth endoplasmic reticulum, 약칭 SER)는 부족합니다. 대신 ER이 부분적으로 매끄럽고 부분적으로 거친 영역이 있으며, 이 영역을 천이 ER이라고 합니다. 전환형 ER은 ER 종료 사이트를 포함하기 때문에 이름을 가져옵니다. ER에서 만들어진 지질과 단백질을 포함하는 수송 소포가 ER에서 분리되어 골지 장치로 이동하기 시작하는 영역입니다. 특수화된 세포는 매끄러운 소포체를 많이 가질 수 있으며, 이 세포에서 매끄러운 ER은 많은 기능을 가지고 있습니다.[6] 지질, 인지질,[18][19][20] 스테로이드를 합성합니다. 고환, 난소 및 피지선과 같은 이러한 제품을 분비하는 세포에는 부드러운 소포체가 풍부합니다.[21] 또한 탄수화물의 대사, 천연 대사 산물 및 알코올 및 약물의 해독, 세포막 단백질에 대한 수용체 부착, 스테로이드 대사를 수행합니다.[22] 근육세포에서는 칼슘 이온 농도를 조절합니다. 매끄러운 소포체는 다양한 세포 유형(동물과 식물 모두)에서 발견되며, 각각 다른 기능을 수행합니다. 매끄러운 소포체에는 포도당-6-인산을 포도당신생합성의 한 단계인 포도당으로 전환시키는 효소 포도당-6-인산분해효소도 포함되어 있습니다. 핵 외피와 연결되어 있으며 세포 주변부 근처에 위치한 세뇨관으로 구성되어 있습니다. 이 튜브들은 때때로 모양이 망상적인 네트워크를 형성하는 분기점을 형성합니다.[12] 일부 세포에는 거친 소포체의 주머니와 같은 확장된 영역이 있습니다. 매끄러운 소포체 네트워크는 증가된 표면적이 주요 효소와 이러한 효소의 생성물의 작용 또는 저장에 전념할 수 있도록 합니다.[citation needed]
근막망막

그리스 σάρξ 사르스(sarx)에서 유래한 육질 망상체(SR)는 근육 세포에서 발견되는 매끄러운 ER입니다. 이 소기관과 매끄러운 소포체 사이의 유일한 구조적 차이는 그들이 가지고 있는 단백질의 구성으로 막에 결합되어 내강의 경계 내에서 표류한다는 것입니다. 이러한 근본적인 차이는 다음과 같은 기능을 나타냅니다. 소포체는 분자를 합성하고, 소포체는 칼슘 이온을 저장하고 근육 섬유가 자극되면 그것을 소포체 안으로 밀어냅니다.[23][24] 칼슘 이온은 근막 망상체에서 방출된 후 ATP를 사용하는 수축성 단백질과 상호 작용하여 근육 섬유를 단축시킵니다. 근막 망상체는 여기-수축 결합에 중요한 역할을 합니다.[25]
기능들
소포체는 시스터네라고 불리는 주머니에서 단백질 분자를 접고 소포에서 합성된 단백질을 골지 장치로 운반하는 것을 포함하여 많은 일반적인 기능을 합니다. 거친 소포체도 단백질 합성에 관여합니다. 새로 만들어진 단백질의 올바른 접힘은 단백질 이황화 이성질화효소(PDI), ERP29, Hsp70 계열 구성원 BiP/Grp78, 칼넥신, 칼레티쿨린 및 펩티딜프로릴 이성질화효소 계열을 포함한 여러 소포체 샤페론 단백질에 의해 가능합니다. 적절하게 접힌 단백질만 거친 ER에서 골지 장치로 운반됩니다. 펼쳐진 단백질은 ER에서 스트레스 반응으로 펼쳐진 단백질 반응을 일으킵니다. 산화환원 조절, 칼슘 조절, 포도당 결핍, 바이러스 감염의[26] 장애 또는 단백질의[27] 과발현은 단백질의 접힘이 느려져 펼쳐진 단백질의 증가로 이어지는 상태인 소포체 스트레스 반응(ER stress)을 초래할 수 있습니다. 이러한 스트레스는 저산소/허혈, 인슐린 저항성 및 기타 장애의 잠재적인 손상 원인으로 떠오르고 있습니다.[28]
단백질 수송
분비 단백질, 대부분 당단백질은 소포체 막을 가로질러 이동합니다. 세포 전체에 걸쳐 소포체에 의해 운반되는 단백질에는 신호 시퀀스라는 주소 태그가 표시됩니다. 폴리펩티드 사슬(즉, 단백질)의 N-말단은 주소 태그(address tag) 역할을 하는 몇 개의 아미노산을 포함하고 있으며, 이 아미노산은 폴리펩티드가 목적지에 도달하면 제거됩니다. 초기 펩티드는 막으로 내장된 다단백 복합체인 트랜스로콘을 통해 ER에 도달합니다. 소포체 밖의 장소로 가는 단백질은 수송 소포에 포장되어 세포골격을 따라 목적지를 향해 이동합니다. 인간 섬유아세포에서 ER은 항상 미세소관과 공동 분포되어 있으며 후자의 해중합은 ER과도 관련이 있는 미토콘드리아와의 공동 응집을 유발합니다.[29]
소포체는 또한 단백질 분류 경로의 일부입니다. 그것은 본질적으로 진핵 세포의 수송 시스템입니다. 대부분의 상주 단백질은 유지 모티프를 통해 그 안에 유지됩니다. 이 모티브는 단백질 서열의 끝에 있는 4개의 아미노산으로 구성되어 있습니다. 가장 일반적인 보유 서열은 내강에 위치한 단백질의 경우 KDEL이고 막횡단 단백질의 경우 KKXX입니다.[30] 그러나 KDEL 및 KKXX의 변이가 발생하며 다른 서열도 소포체 보유를 유발할 수 있습니다. 이러한 변동이 서브 ER 국소화로 이어질 수 있는지 여부는 알려져 있지 않습니다. 포유류 세포에는 3개의 KDEL(1, 2, 3) 수용체가 있는데, 이들은 서열 동일성이 매우 높습니다. 이 수용체들 사이의 기능적 차이는 아직 밝혀지지 않았습니다.[31]
CaATiER 메커니즘에 의한 ERATP 공급의 생체 에너지 조절

소포체에는 ATP 재생 기계가 없기 때문에 미토콘드리아에서 ATP를 가져와야 합니다. 수입된 ATP는 ER이 단백질 접힘 및 밀매와 같은 하우스키핑 세포 기능을 수행하는 데 필수적입니다.[32]
ER ATP 수송체인 SLC35B1/AXER는 최근에 복제되고 특성화되었으며,[33] 미토콘드리아는 Ca-antagonized2+ transport를 통해 ER(CaATiER) 메커니즘으로 ATP를 공급합니다.[34] CaATiER 메커니즘은 높은 nM 범위에서 낮은 μM 범위에 이르는 세포질 Ca에2+ 대한 민감도를 나타내며 Ca 감지2+ 요소는 아직 식별 및 검증되지 않았습니다.[citation needed]
임상적 의의
췌장 β 세포의 증가 및 상생리학적 ER 스트레스는 정상적인 인슐린 분비를 방해하여 고인슐린혈증을[35] 유발하고 결과적으로 인간의 비만과 관련된 말초 인슐린 저항성을 유발합니다.[36] 인간 임상시험에서도 비만으로 인한 인슐린 분비 증가와 말초 인슐린 저항성 사이의 인과관계가 제시되었습니다.[37]
XBP1의 이상은 소포체 스트레스 반응을 증가시키고 그 결과 알츠하이머병에 기여할 수 있는 염증 과정에 대한 더 높은 민감도를 유발합니다.[38] 대장에서 XBP1 이상은 크론병을 포함한 염증성 장질환과 연관이 있습니다.[39]
펼쳐진 단백질 반응(UPR)은 소포체와 관련된 세포 스트레스 반응입니다.[40] UPR은 소포체 내강에 펼쳐지거나 잘못 접힌 단백질이 축적되면 반응하여 활성화됩니다. UPR은 단백질 번역을 중단하고 잘못 접힌 단백질을 분해하며 단백질 접힘에 관여하는 분자 샤페론의 생성을 증가시키는 신호 전달 경로를 활성화함으로써 세포의 정상적인 기능을 회복시키는 기능을 합니다. UPR의 지속적인 과활성화는 프리온 질환뿐만 아니라 여러 신경퇴행성 질환과 관련이 있으며 UPR의 억제는 이러한 질환에 대한 치료법이 될 수 있습니다.[41]
참고문헌
- ^ "Endoplasmic Reticulum (Rough and Smooth)". British Society of Cell Biology. Archived from the original on 24 November 2015. Retrieved 21 November 2015.
- ^ Garnier, C. (1897). "Les filaments basaux des cellules glandulaires. Note préliminaire". Bibliographie Anatomique. 5: 278–289. OCLC 493441682.
- ^ Buvat, R. (1963). "Electron Microscopy of Plant Protoplasm". International Review of Cytology Volume 14. Vol. 14. pp. 41–155. doi:10.1016/S0074-7696(08)60021-2. ISBN 978-0-12-364314-8. PMID 14283576.
- ^ Porter KR, Claude A, Fullam EF (March 1945). "A study of tissue culture cells by electron microscopy: methods and preliminary observations". The Journal of Experimental Medicine. 81 (3): 233–46. doi:10.1084/jem.81.3.233. PMC 2135493. PMID 19871454.
- ^ PORTER KR (May 1953). "Observations on a submicroscopic basophilic component of cytoplasm". The Journal of Experimental Medicine. 97 (5): 727–50. doi:10.1084/jem.97.5.727. PMC 2136295. PMID 13052830.
- ^ a b Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). Molecular biology of the cell (4th ed.). New York: Garland Science. ISBN 978-0-8153-3218-3. Archived from the original on 2017-10-03.
- ^ Cooper GM (2000). The cell: a molecular approach (2nd ed.). Washington (DC): ASM Press. ISBN 978-0-87893-106-4.
- ^ "reticulum". The Free Dictionary.
- ^ Görlich D, Prehn S, Hartmann E, Kalies KU, Rapoport TA (October 1992). "A mammalian homolog of SEC61p and SECYp is associated with ribosomes and nascent polypeptides during translocation". Cell. 71 (3): 489–503. doi:10.1016/0092-8674(92)90517-G. PMID 1423609. S2CID 19078317.
- ^ Lodish H, et al. (2003). Molecular Cell Biology (5th ed.). W. H. Freeman. pp. 659–666. ISBN 978-0-7167-4366-8.
- ^ Seiser RM, Nicchitta CV (October 2000). "The fate of membrane-bound ribosomes following the termination of protein synthesis". The Journal of Biological Chemistry. 275 (43): 33820–7. doi:10.1074/jbc.M004462200. PMID 10931837.
- ^ a b Shibata Y, Voeltz GK, Rapoport TA (August 2006). "Rough sheets and smooth tubules". Cell. 126 (3): 435–9. doi:10.1016/j.cell.2006.07.019. PMID 16901774. S2CID 16107069.
- ^ Terasaki M, Shemesh T, Kasthuri N, Klemm RW, Schalek R, Hayworth KJ, Hand AR, Yankova M, Huber G, Lichtman JW, Rapoport TA, Kozlov MM (July 2013). "Stacked endoplasmic reticulum sheets are connected by helicoidal membrane motifs". Cell. 154 (2): 285–96. doi:10.1016/j.cell.2013.06.031. PMC 3767119. PMID 23870120.
- ^ Guven J, Huber G, Valencia DM (October 2014). "Terasaki spiral ramps in the rough endoplasmic reticulum". Physical Review Letters. 113 (18): 188101. Bibcode:2014PhRvL.113r8101G. doi:10.1103/PhysRevLett.113.188101. PMID 25396396.
- ^ 소포체. (n.d.). 맥그로힐 과학기술 백과사전. 2006년 9월 13일 Answers.com 웹사이트에서 검색:
- ^ Levine T (September 2004). "Short-range intracellular trafficking of small molecules across endoplasmic reticulum junctions". Trends in Cell Biology. 14 (9): 483–90. doi:10.1016/j.tcb.2004.07.017. PMID 15350976.
- ^ Levine T, Loewen C (August 2006). "Inter-organelle membrane contact sites: through a glass, darkly". Current Opinion in Cell Biology. 18 (4): 371–8. doi:10.1016/j.ceb.2006.06.011. PMID 16806880.
- ^ Kannan, Muthukumar; Lahiri, Sujoy; Liu, Li-Ka; Choudhary, Vineet; Prinz, William A. (March 2017). "Phosphatidylserine synthesis at membrane contact sites promotes its transport out of the ER". Journal of Lipid Research. 58 (3): 553–562. doi:10.1194/jlr.M072959. PMC 5335585. PMID 28119445.
- ^ Kannan, Muthukumar; Riekhof, Wayne R.; Voelker, Dennis R. (February 2015). "Transport of Phosphatidylserine from the Endoplasmic Reticulum to the Site of Phosphatidylserine Decarboxylase2 in Yeast: Phosphatidylserine Transport to the Locus of Psd2p". Traffic. 16 (2): 123–134. doi:10.1111/tra.12236. PMID 25355612. S2CID 34302.
- ^ Friedman, Jonathan R.; Kannan, Muthukumar; Toulmay, Alexandre; Jan, Calvin H.; Weissman, Jonathan S.; Prinz, William A.; Nunnari, Jodi (January 2018). "Lipid Homeostasis Is Maintained by Dual Targeting of the Mitochondrial PE Biosynthesis Enzyme to the ER". Developmental Cell. 44 (2): 261–270.e6. doi:10.1016/j.devcel.2017.11.023. PMC 5975648. PMID 29290583.
- ^ "Functions of Smooth ER". University of Minnesota Duluth.
- ^ Maxfield FR, Wüstner D (October 2002). "Intracellular cholesterol transport". The Journal of Clinical Investigation. 110 (7): 891–8. doi:10.1172/JCI16500. PMC 151159. PMID 12370264.
- ^ Toyoshima C, Nakasako M, Nomura H, Ogawa H (June 2000). "Crystal structure of the calcium pump of sarcoplasmic reticulum at 2.6 A resolution". Nature. 405 (6787): 647–55. Bibcode:2000Natur.405..647T. doi:10.1038/35015017. PMID 10864315. S2CID 4316039.
- ^ Goodman SR (2007-11-26). Medical Cell Biology (3rd ed.). Academic Press. p. 69. ISBN 9780080919317.
- ^ Martini F, Nath J, Bartholomew E (2014). Fundamentals of Anatomy and Physiology (10th ed.). ISBN 978-0321909077.
- ^ Xu C, Bailly-Maitre B, Reed JC (October 2005). "Endoplasmic reticulum stress: cell life and death decisions". The Journal of Clinical Investigation. 115 (10): 2656–64. doi:10.1172/JCI26373. PMC 1236697. PMID 16200199.
- ^ Kober L, Zehe C, Bode J (October 2012). "Development of a novel ER stress based selection system for the isolation of highly productive clones". Biotechnology and Bioengineering. 109 (10): 2599–611. doi:10.1002/bit.24527. PMID 22510960. S2CID 25858120.
- ^ Ozcan U, Cao Q, Yilmaz E, Lee AH, Iwakoshi NN, Ozdelen E, Tuncman G, Görgün C, Glimcher LH, Hotamisligil GS (October 2004). "Endoplasmic reticulum stress links obesity, insulin action, and type 2 diabetes". Science. 306 (5695): 457–61. Bibcode:2004Sci...306..457O. doi:10.1126/science.1103160. PMID 15486293. S2CID 22517395.
- ^ Soltys BJ, Gupta RS (1992). "Interrelationships of endoplasmic reticulum, mitochondria, intermediate filaments, and microtubules--a quadruple fluorescence labeling study". Biochemistry and Cell Biology. 70 (10–11): 1174–86. doi:10.1139/o92-163. PMID 1363623.
- ^ Stornaiuolo M, Lotti LV, Borgese N, Torrisi MR, Mottola G, Martire G, Bonatti S (March 2003). "KDEL and KKXX retrieval signals appended to the same reporter protein determine different trafficking between endoplasmic reticulum, intermediate compartment, and Golgi complex". Molecular Biology of the Cell. 14 (3): 889–902. doi:10.1091/mbc.E02-08-0468. PMC 151567. PMID 12631711.
- ^ Raykhel I, Alanen H, Salo K, Jurvansuu J, Nguyen VD, Latva-Ranta M, Ruddock L (December 2007). "A molecular specificity code for the three mammalian KDEL receptors". The Journal of Cell Biology. 179 (6): 1193–204. doi:10.1083/jcb.200705180. PMC 2140024. PMID 18086916.
- ^ Clairmont, CA; De Maio, A; Hirschberg, CB (25 February 1992). "Translocation of ATP into the lumen of rough endoplasmic reticulum-derived vesicles and its binding to luminal proteins including BiP (GRP 78) and GRP 94". The Journal of Biological Chemistry. 267 (6): 3983–90. doi:10.1016/S0021-9258(19)50622-6. PMID 1740446.
- ^ Klein, Marie-Christine; Zimmermann, Katharina; Schorr, Stefan; Landini, Martina; Klemens, Patrick A. W.; Altensell, Jacqueline; Jung, Martin; Krause, Elmar; Nguyen, Duy; Helms, Volkhard; Rettig, Jens; Fecher-Trost, Claudia; Cavalié, Adolfo; Hoth, Markus; Bogeski, Ivan; Neuhaus, H. Ekkehard; Zimmermann, Richard; Lang, Sven; Haferkamp, Ilka (28 August 2018). "AXER is an ATP/ADP exchanger in the membrane of the endoplasmic reticulum". Nature Communications. 9 (1): 3489. Bibcode:2018NatCo...9.3489K. doi:10.1038/s41467-018-06003-9. PMC 6113206. PMID 30154480.
- ^ Yong, Jing; Bischof, Helmut; Burgstaller, Sandra; Siirin, Marina; Murphy, Anne; Malli, Roland; Kaufman, Randal J (9 September 2019). "Mitochondria supply ATP to the ER through a mechanism antagonized by cytosolic Ca2+". eLife. 8. doi:10.7554/eLife.49682. PMC 6763289. PMID 31498082.
- ^ Yong, Jing; Johnson, James D.; Arvan, Peter; Han, Jaeseok; Kaufman, Randal J. (August 2021). "Therapeutic opportunities for pancreatic β-cell ER stress in diabetes mellitus". Nature Reviews Endocrinology. 17 (8): 455–467. doi:10.1038/s41574-021-00510-4. PMC 8765009. PMID 34163039.
- ^ van Vliet, Stephan; Koh, Han-Chow E.; Patterson, Bruce W.; Yoshino, Mihoko; LaForest, Richard; Gropler, Robert J.; Klein, Samuel; Mittendorfer, Bettina (1 October 2020). "Obesity Is Associated With Increased Basal and Postprandial β-Cell Insulin Secretion Even in the Absence of Insulin Resistance". Diabetes. 69 (10): 2112–2119. doi:10.2337/db20-0377. PMC 7506835. PMID 32651241.
- ^ Mittendorfer, Bettina; Patterson, Bruce W.; Smith, Gordon I.; Yoshino, Mihoko; Klein, Samuel (1 February 2022). "β Cell function and plasma insulin clearance in people with obesity and different glycemic status". Journal of Clinical Investigation. 132 (3): e154068. doi:10.1172/JCI154068. PMC 8803344. PMID 34905513.
- ^ Casas-Tinto S, Zhang Y, Sanchez-Garcia J, Gomez-Velazquez M, Rincon-Limas DE, Fernandez-Funez P (June 2011). "The ER stress factor XBP1s prevents amyloid-beta neurotoxicity". Human Molecular Genetics. 20 (11): 2144–60. doi:10.1093/hmg/ddr100. PMC 3090193. PMID 21389082.
- ^ Kaser A, Lee AH, Franke A, Glickman JN, Zeissig S, Tilg H, Nieuwenhuis EE, Higgins DE, Schreiber S, Glimcher LH, Blumberg RS (September 2008). "XBP1 links ER stress to intestinal inflammation and confers genetic risk for human inflammatory bowel disease". Cell. 134 (5): 743–56. doi:10.1016/j.cell.2008.07.021. PMC 2586148. PMID 18775308.
- ^ Walter, Peter. "Peter Walter's Short Talk: Unfolding the UPR". iBiology.
- ^ Moreno JA, Halliday M, Molloy C, Radford H, Verity N, Axten JM, Ortori CA, Willis AE, Fischer PM, Barrett DA, Mallucci GR (October 2013). "Oral treatment targeting the unfolded protein response prevents neurodegeneration and clinical disease in prion-infected mice". Science Translational Medicine. 5 (206): 206ra138. doi:10.1126/scitranslmed.3006767. PMID 24107777. S2CID 25570626.
외부 링크
- OPM 데이터베이스 내 소포체의 지질 및 단백질 조성
- 여기 참조된 다양한 셀 기능의 애니메이션 Wayback Machine에서 Archive 2008-04-22


