DCMU
DCMU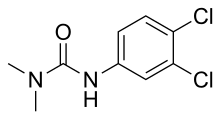 | |
 | |
| 이름 | |
|---|---|
| 우선 IUPAC 이름 N--(3,4-디클로로페닐)-N, N-디메틸우레아 | |
| 기타 이름 3-(3,4-디클로로페닐)-1,1-디메틸우레아, 카르멕스, 디우론, 디렉스 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 첸블 | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.005.778 |
| EC 번호 |
|
| 케그 | |
PubChem CID | |
| RTECS 번호 |
|
| 유니 | |
| UN 번호 | 3077, 2767 |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| C9H10클론2N2O | |
| 몰 질량 | 233.09 g/120−1 |
| 외모 | 백색 결정성[1] 고체 |
| 밀도 | 1.48g/cm3 |
| 녹는점 | 158 °C (316 °F, 431 K) |
| 비등점 | 180 °C (356 °F, 453 K) |
| 42 mg/L | |
| 증기압 | 0.0000002mmHg(20°[1]C) |
| 위험 요소 | |
| GHS 라벨링: | |
   | |
| 경고 | |
| H302, H351, H373, H410 | |
| P201, , , , , , , , , , , | |
| 플래시 포인트 | 불연성의[1] |
| NIOSH(미국 건강 노출 제한): | |
PEL(허용) | 없음[1] |
REL(권장) | TWA 10 mg/m3[1] |
IDLH(즉시 위험) | N.D.[1] |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
DCMU(3-(3,4-디클로로페닐)-1,1-디메틸루레아)는 광합성을 저해하는 아릴루레아 등급의 살충제 및 제초제이다.1954년 바이엘이 Diuron이라는 상표명으로 도입했다.
역사
1952년 E. I. du Pont de Nemours and Company의 화학자들은 일련의 아릴 요소 유도체를 제초제로 특허 취득했습니다.이 특허에 포함된 여러 화합물은 제초제로 상용화되었습니다. 모노론(4-클로로페닐), 클로르톨루론(3-클로로페닐), DCMU(3,4-디클로로페닐)[2][3]입니다.그 후 동일한 작용 메커니즘을 가진 30개 이상의 관련 요소 아날로그가 [4]전 세계에 출시되었습니다.
합성
duPont 특허에 기재되어 있는 바와 같이, 원료는 치환 아릴아민, 아닐린이며, 이를 포스겐으로 처리하여 이소시아네이트 유도체를 형성한다.이어서 디메틸아민과 반응하여 최종 생성물을 [2]얻는다.
- 아릴-NH2 + COCl2 → 아릴-NCO
- 아릴-NCO + NH(CH3)2 → 아릴-NHCON(CH3)2
작용 메커니즘
DCMU는 광합성의 매우 특이하고 민감한 억제제이다.그것은 광계 II의B Q플라스토키논 결합 부위를 차단하여 광계 II에서 [5]플라스토키논으로의 전자 흐름을 허용하지 않습니다.이것은 광합성의 광합성 전자 전달 사슬을 방해하고, 따라서 빛 에너지를 화학 에너지로 바꾸는 식물의 능력을 감소시킨다.
DCMU는 광계 II로부터의 전자 흐름을 차단할 뿐이며, 광합성에서의 광흡수 또는 캘빈 [citation needed]사이클에서의 탄소 고정과 같은 광계 I 또는 다른 반응에 영향을 미치지 않습니다.
그러나 PSII에서 물 산화로 생성된 전자가 플라스토키논 풀로 들어가는 것을 차단하기 때문에 NADP를+ NADPH로 환원하기 위해 광합성 전자 흐름 사이클을 빠져나갈 수 있는 사용 가능한 전자가 없기 때문에 "선형" 광합성은 효과적으로 차단된다.실제로 DCMU는 순환 광합성 경로를 억제할 뿐만 아니라 특정 상황에서 실제로 [6][7]DCMU를 자극하는 것으로 밝혀졌다.
이러한 효과들 때문에, DCMU는 종종 광합성의 에너지 흐름을 연구하는데 사용된다.
독성
DCMU(Diuron)는 동물실험을 [8][9]통해 알려진/인류 발암물질로 특징지어졌습니다.
레퍼런스
- ^ a b c d e f NIOSH Pocket Guide to Chemical Hazards. "#0247". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b 미국 특허 2655445, Todd C.W., "3-(할로페닐)-1-메틸-1-(메틸 또는 에틸) 소변 및 제초 조성물 및 이를 사용하는 방법"은 E. I. du Pont de Nemours & Co.에 할당되었다.
- ^ Liu, Jing (2010). "Phenylurea Herbicides". Hayes' Handbook of Pesticide Toxicology. pp. 1725–1731. doi:10.1016/B978-0-12-374367-1.00080-X. ISBN 9780123743671.
- ^ "Urea herbicides". alanwood.net. Retrieved 2021-03-26.
- ^ Metz, J; Pakrasi, H; Seibert, M; Arntzer, C (1986). "Evidence for a dual function of the herbicide-binding D1 protein in photosystem II". FEBS Letters. 205 (2): 269. doi:10.1016/0014-5793(86)80911-5. S2CID 84205263.
- ^ HUBER, S.C. EDOWS, G.E.(1976), C4 공장의 중엽 엽록체 순환 전자 흐름 경로에 관한 연구, 바이오키미카 et 바이오피시카 액타(BBA) - 바이오 에너지학, 제449권, 제3호, 1976년 12월 643쪽
- ^ Hosler, J. P.; Yocum, C. F. (April 1987). "Regulation of Cyclic Photophosphorylation during Ferredoxin-Mediated Electron Transport : Effect of DCMU and the NADPH/NADP Ratio". Plant Physiol. 83 (4): 965–9. doi:10.1104/pp.83.4.965. PMC 1056483. PMID 16665372.
- ^ "Diuron". National Center for Biotechnology Information. United States National Library of Medicine. Retrieved 9 November 2021.
- ^ Linda, Taylor; Esther, Rinde (1997-05-08). Carcinogenicity Peer Review of Diuron (PDF) (Memorandum). Washington, D.C.: United States Environmental Protection Agency. 20460.


