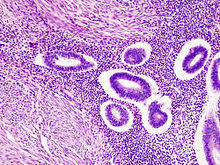
자궁선근증
Adenomyosis| 자궁선근증 | |
|---|---|
 | |
| 복강경 검사 중에 보이는 자궁선근증: 부드럽고 커진 자궁; 파란 반점은 하위 자궁내막증을 나타낸다. | |
| 전문 | 산부인과 |
| 빈도 | 20에서 35%.[1] |
자궁선근증은 자궁벽(묘내막)을 올린 세포 내에 비정상으로 위치한 자궁(내막) 내부를 형성하는 세포가 성장하면서 자궁이 두꺼워지는 것을 특징으로 하는 질환이다.[2] 이 질환이 있는 환자에게 잘못 배치된 것뿐만 아니라 자궁내막 조직은 완벽하게 기능한다. 월경 주기마다 조직이 두꺼워지고, 헐거워지고, 피가 난다.[2]
자궁내막증과 함께 자궁내막증도 함께 발견될 수 있지만 자궁내막증 환자들은 자궁 바깥 전체에 비정상적으로 위치한 자궁내막 조직을 가지고 있다. 이 두 조건은 많은 경우에서 함께 발견되지만 따로 발생하는 경우가 많다.[3][4] 뚜렷한 질환으로 인식되기 전에는 자궁내막증 내막증이라고 불렸다. 덜 흔하게 쓰이는 용어인 자궁선근막염은 자궁의 관여를 명시하면서 그 질환에 대한 보다 구체적인 명칭이다.[5][6]
이 질환은 일반적으로 35세에서 50세 사이의 여성에게서 발견되지만, 젊은 여성들에게도 영향을 미친다.[7] 자궁선근증 환자들은 종종 고통스러운 병, 많은 병, 또는 둘 다로 나타난다. 다른 가능한 증상으로는 성교 중 통증, 만성 골반 통증, 요변 방광의 자극 등이 있다.[citation needed]
자궁선근증에서 기저내막은 과플라스틱 근막 섬유로 침투한다. 따라서 기능층과는 달리 기저층은 생리주기와 함께 전형적인 순환변화를 겪지 않는다.[4][8]
자궁근종은 자궁을 중심으로 관여하여 자궁근종을 일으킬 수 있다. 확산 관여로 자궁은 부피가 커지고 무거워진다.[9]
징후 및 증상
자궁선근증은 그것이 일으키는 증상의 종류와 심각도에 따라 크게 다를 수 있는데, 이는 전적으로 무증상 33%에서 어떤 경우에는 심각하고 쇠약해지는 상태에 이르기까지 다양하다. 자궁선근증이 있는 여성은 일반적으로 40~50세 사이에 증상을 먼저 보고하지만 젊은 여성에게서 증상이 나타날 수 있다.[7][9]
증상 및 영향을 받는 추정 백분율에는 다음이 포함될 수 있다.[9]
- 만성 골반 통증(77%)
- 중월경 출혈(40~60%)은 자궁선근증이 더 심한 여성에게 더 흔하다. 출혈은 피로, 현기증, 기분전환을 동반하는 증상과 함께 빈혈의 원인이 될 수 있을 정도로 유의할 수 있다.
- 비정상 자궁 출혈
- 고통스러운 경련 월경(15~30%)
- 고통스러운 질성교(7%)
- '내리는' 다운 느낌
- 방광 압력
- 허벅지와 다리 아래로 감촉을 끌어 당긴다.
자궁선근증의 임상적 징후는 다음을 포함할 수 있다.
- 자궁 확대(30%)는 골반 충만 증상으로 이어질 수 있다.
- 연성 자궁
- 불임 또는 난임(11-12%) - 또한 자궁선근증은 임신 전 노동의 발생률 증가 및 세포막의 조기 파열과 관련이 있다.[10][11]
자궁선근증이 있는 여성은 다음과 같은 다른 자궁 질환을 가질 가능성이 더 높다.
원인들
제왕절개, 수술적 임신종료, 임신중절 등 접합부로 알려진 자궁내막과 자궁내막 사이의 장벽을 무너뜨릴 수 있는 어떤 종류의 자궁외상과도 관련이 있지만, 자궁선근증의 원인은 알려져 있지 않다. 그것은 자궁내막증과 연관될 [12]수 있지만, 이 두 조건들 사이의 유사점과 차이점을 조사하는 연구는 상반된 결과를 가지고 있다.[13]
자궁선근증의 병원체는 여전히 불명확한 상태지만, 접합부(JZ)라고도 불리는 내측근막의 기능이 자궁선근증의 발달에 큰 역할을 하는 것으로 생각된다. 생식장애와 주요 산부인과 질환의 연관성도 여기에 있는지 여부도 논의 대상이다.[14] 패리티, 나이, 이전의 자궁 마모는 자궁선근증의 위험을 증가시킨다. 국소적 과프로레스트로겐증, s프로락틴의 상승과 같은 호르몬 인자와 자가면역인자 또한 가능한 위험 인자로 확인되었다.[15][16][17] 자궁에 영향을 받은 자궁근종에서 근막과 스트로마 모두 영향을 받지 않은 자궁과 상당한 차이를 보이므로 유전적, 생화학적 수준 모두에서 다방면의 변화를 포함하는 복합적 기원이 있을 가능성이 높다.[18][19]
조직 손상 및 수리(TIAR) 이론은 현재 널리 받아들여지고 있으며, 생식 초기 기간 동안 자궁 내막-요강 인터페이스(EMI) 부위에서 미세 부상이 유발될 것이라는 것을 시사한다.[20] 그것은 다시 손상을 치료하기 위해 지역 에스트로겐의 상승으로 이어진다. 동시에 에스트로겐 치료는 자궁경막증을 다시 증가시켜, 선근증의 발달을 위해 필수적인 악순환과 연쇄적인 생물학적 변형으로 이어질 것이다. 접합부의 이아트로겐성 부상이나 태반 삽입에 의한 생리학적 손상은 동일한 병리학적 폭포를 야기할 가능성이 높다.[21] 이것은 또한 자궁내막증이 임신과 출산 후에 더 심해지는 반면 자궁내막증은 개선될 것이라는 것을 설명한다.[citation needed]
메커니즘
병리학
잘못 배치된 자궁내막조직 증식은 다른 메커니즘을 통해 증상을 일으킨다.[9]
자궁 월경수축은 정상 자궁내막조직에서 생성되는 프로스타글란딘에 의해 발생한다.[9] 난독증은 프로스타글란딘 수치가 높은 이 질병의 주요 특징이다. 자궁내막 증식은 또한 에스트로겐에 의해 주도된다; 어떤 치료들은 증상을 줄이기 위해 그것의 수준을 낮추려고 노력한다.[9] 자궁내막조직의 증가, 혈관화 정도 증가, 비정형 자궁수축 및 프로스타글란딘, 에스트로겐, 아이코사노이드의 증가 등으로 인해 중월경 출혈이 있는 자궁선근증 환자.[22]
조직병리학
자궁선근증의 진단은 병리학자를 통해 자궁의 작은 조직 샘플을 현미경으로 검사한다.[4] 이 조직 샘플은 자궁 조직검사에서 나올 수도 있고 자궁 절제술에서 바로 나올 수도 있다. 자궁 생체검사는 복부를 통한 복강경 수술이나 질과 자궁경부를 통한 히스테리 진단으로 얻을 수 있다.[9]
이 진단은 병리학자가 자궁내막조직의 침입을 발견했을 때 확립된다. 몇 가지 진단 기준을 사용할 수 있지만, 일반적으로 자궁내막 조직이 근막의 2% 이상을 침범하거나 2.5~8mm 사이의 최소 침습 깊이를 필요로 한다.[9]
총 결과:
- 확대 자궁
- 삼베식 외관으로 두터워진 자궁벽
- 벽[23] 전체에 걸쳐 출혈성 핀포인트 또는 낭포성 공간
현미경 소견:
- 자궁내막샘과 스트로마 하바즈리히 분포하는 자궁내막샘
- 자궁근종 포커스를 중심으로 동심원근 과대증상이 자주 발생함
- 변형: 글랜드-불량, 스트로마-불량, 혈관내[23]
차등 진단:
- 자궁선근종
- 근침습성 자궁내막내막내막암(stroma-불량 자궁선근증 vs.)
- 저급 자궁내막 스트롬팔육종 (vs. gland-불량 및 혈관내선근증)[23]
진단
이미징
자궁선근증은 자궁 내 침공의 범위와 위치에 따라 매우 다양할 수 있다. 그 결과 비침습적 영상을 통한 자궁선근증의 확정적 진단을 할 수 있는 확립된 병리학적 특징이 없다. 그럼에도 불구하고 경막초음파검사(TVUS)와 자기공명영상(MRI)과 같은 비침습적 영상기법을 모두 사용하여 자궁선근증 진단, 치료 선택안내, 치료에 대한 모니터 반응 등을 강력하게 제안할 수 있다.[9] 실제로 TVUS와 MRI는 수술 전 진단을 확립하기 위해 이용할 수 있는 유일한 두 가지 실질적인 수단이다.[24]
초음파 검사
트랜스바질 초음파 검사는 저렴하고 쉽게 구할 수 있는 영상검사로서 일반적으로 부인과 증상 평가 시 초기에 사용된다.[24] 초음파 영상촬영은 MRI와 마찬가지로 방사선을 사용하지 않으며 골반과 여성 생식기관 검사에 안전하다.[25] 전체적으로 대뇌초음파검사에서 자궁선근증 검출에 대한 민감도는 79%, 특이도는 85%로 추정된다.[11]
자궁선근증이 있는 환자에서 흔히 발견되는 경막 초음파 검사 결과는 다음과 같다.[9][26][27]
- 구상 자궁, 확대 자궁 및 비대칭 자궁
- 비정상적으로 밀도가 높거나 특히 근막내 밀도가 변화함
- 근막 낭종 - 자궁의 매끄러운 근육 내의 유체 주머니
- 자궁섬유종이 없는 선형 음향 그림자
- Echogenic 선형 선조립 - 밝은 선 또는 줄무늬
- 전/전벽의 비대칭
- 자궁 내 작은 혈관의 확산
덜 일반적인 결과:
- 등고선 이상 없음
- 질량효과 부재
- 정상과 비정상적인 근막 사이에 잘못 정의된 여백
파워도플러나 도플러초음파검사 기능은 전신초음파검사 시 자궁근종과 자궁섬유종을 구별하는데 도움을 준다.[24][28][29] 자궁 섬유종은 전형적으로 섬유종의 캡슐을 돌고 있는 혈관을 가지고 있기 때문이다. 이와는 대조적으로 자궁근종은 병변 내에 혈관이 널리 분포되어 있는 것이 특징이다.[24] 도플러초음파검사는 또한 근막내 정액과 혈관내 흐르는 혈액을 구분하는 역할을 한다.[24]
자궁내막과 자궁내막 인터페이스의 연결 구역(JZ) 또는 작은 별개의 호르몬 의존 영역은 3차원 대상 초음파(3D TVUS)와 MRI로 평가할 수 있다. 자궁선근증의 특징은 교란, 두꺼워짐, 확대 또는 접합부의 침공이다.[21]
자기공명영상
자기공명영상(MRI)은 MRI가 다양한 연조직의 유형을 객관적으로 구분할 수 있는 MRI의 능력이 높아져 TVUS에 비해 진단 능력이 다소 우수하다.[24] 이는 MRI의 높은 공간 및 대비 분해능으로 가능하다. 전체적으로 MRI의 민감도는 74%, 특이도는 91%로 추정되고 있다.[11] MRI를 통한 진단은 주로 접합 영역을 조사하는 데 초점을 맞춘다. 자궁은 T1과 T2 가중치 순서에 어두운/소거 신호가 있는 두껍게 접합부를 가질 것이다.[24]
연결 구역의 세 가지 객관적인 측정 방법을 사용하여 선근증을 진단할 수 있다.[24]
- 접합부의 두께가 8-12mm보다 크다. 8mm 미만은 정상이다.
- 접합 구역 폭은 근방 폭의 40%를 초과한다.
- 접합부 폭의 변동성은 5mm 이상이다.
접합부의 두꺼워지고 어두운 신호 내에 있는 사람들은 종종 작은 낭포성 분비선이나 더 급성 미세 출혈 부위를 나타내는 T2 가중치 스캔에서 초강도(밝은 점)의 초점을 보게 될 것이다.[24]
MRI는 다른 요인에 의해 제한되지만 석회화된 자궁 섬유종(초음파처럼)에 의해 제한되지는 않는다. 특히 MRI는 자궁선근증을 여러 개의 작은 자궁섬유종과 더 잘 구별할 수 있다.
치료
자궁선근증은 자궁을 수술로 제거해야만 확실하게 치료할 수 있다. 자궁선근증은 생식 호르몬에 반응하기 때문에 이러한 호르몬이 감소하면 갱년기 이후에 합리적으로 감소한다. 생식기에 있는 여성의 경우, 자궁선근증은 일반적으로 통증 완화를 제공하고, 과정의 진행을 제한하며, 상당한 월경 출혈을 줄이기 위한 목적으로 관리될 수 있다.
약물
- NSAIDs: 이부프로펜과 나프록센과 같은 비살균성 항염증제는 일반적으로 통증 완화를 위한 다른 치료법과 함께 사용된다. NSAIDs는 효소 cyclooxygenase의 활성을 감소시킴으로써 프로스타글란딘의 생산을 억제한다. 프로스타글랜딘은 주로 난임이나 멘스와 관련된 경련성 골반 통증에 책임이 있는 것으로 밝혀졌다.
호르몬 및 호르몬 조절기
- 미레나와 같은 자궁내 장치나 호르몬 IUD는 자궁선근증에 효과적인 치료법이다.[30] 자궁내막의 해독을 일으켜 월경 흐름을 줄이거나 제거함으로써 증상을 감소시킨다.[9] 게다가, 에스트로겐 수용체들을 하향 조절하는 것을 도와줌으로써 호르몬 IUDs는 근막내 자궁내막 조직의 군집을 축소시킨다. 이는 생리혈류 감소로 이어지고 자궁의 수축에 도움을 주며 생리통 감소에도 도움이 된다. 자궁선근증 환자에게 호르몬 IUD를 사용하면 월경 출혈이 줄고 빈혈과 철분 수치가 개선되며 통증을 줄일 수 있으며 심지어 의료 영상상에 자궁이 작아 자궁선근증이 개선된다는 사실이 입증됐다.[9][30] 적어도 단기적으로는 자궁선근증 치료를 위해 호르몬 IUD를 견딜 수 있는 환자들은 자궁절제술을 받는 여성들에 비해 증상의 동등한 향상과 삶의 질과 사회복지가 향상되는 결과를 낳는다.[9] 호르몬 IUD는 미래의 출산 잠재력을 유지하면서 자궁선근증의 효과적인 치료가 필요한 개인에게 특히 적합하다. 호르몬 IUD의 가장 흔한 부작용은 불규칙한 월경 출혈이나 얼룩이다.[9]
- 경구 피임약은 자궁선근증과 관련된 생리통 및 출혈을 감소시킨다. 이것은 생리 흐름을 줄이거나 없애기 위해 지속적인 호르몬 치료를 받아야 할 수도 있다. 경구 피임약은 심지어 자궁선근증의 단기 퇴행으로 이어질 수도 있다.
- 프로게스테론 또는 프로게스틴: 프로게스테론은 에스트로겐에 대항하여 자궁내막 조직의 성장을 억제한다. 그러한 치료는 조절되고 되돌릴 수 있는 방식으로 월경을 감소시키거나 제거할 수 있다. 프로게스틴은 천연 프로게스테론의 화학적 변형이다.
- 고나도트로핀 방출 호르몬(GnRH) 작용제 및 다나졸은 자궁선근증 관련 증상을 완화하고 어느 정도 효과를 발휘하기 위해 실험해 왔으나 주로 소급 연구 설계로 연구가 적고 표본 크기가 작다.[31] GnRH-아날로그의 장시간 사용은 종종 심각한 부작용, 골밀도 손실 및 심혈관 질환 위험 증가와 관련이 있으며, 따라서 젊은 여성에게는 실현 가능하지 않다. 게다가, 현재의 모든 치료 선택사항은 임신을 시도하려는 여성들에게 관계없는 선택사항이다. 외생성 인공 치료는 효과가 없는 것으로 밝혀졌다.[18] 체외수정 설정에서 체외수정 이전에 장기간 하향조정이 임신율에 긍정적인 영향을 미칠 수 있다.[32]
수술
대체로 자궁선근증의 외과적 관리는 자궁경련과 비 자궁경련 절차의 두 가지 범주로 나뉜다. 자궁경부절개술은 자궁의 외과적 제거술은 포함하지 않는 외과수술이다. 일부 자궁경부 시술은 생식력을 향상시키거나 임신을 만기까지 지속시킬 수 있는 이점이 있다. 이와는 대조적으로 일부 자궁경련 시술은 다산을 악화시키거나 심지어 완전 불임까지 초래한다. 각 시술이 여성의 출산율에 미치는 영향은 특히 우려되며 전형적으로 선택을 이끈다. 비 자궁경부 절차는 정의에 따라 자궁의 외과적 제거를 포함하며 결과적으로 모두 완전 불임으로 이어질 것이다.[9]
자궁경련시술
- 자궁동맥색전(UAE): 이 최소침습적 시술에서 의사들은 자궁동맥이라고 불리는 자궁을 공급하는 두 개의 큰 동맥들을 의도적으로 차단한다. 자궁으로의 혈액 공급을 획기적으로 줄이기 위해 시행되는 것이다. 그렇게 함으로써 혈액과 산소가 부족하여 자궁선근증이 발달하고 확산될 수 있으며, 일반적으로 UAE에서 자궁선근증으로 고생하는 여성의 57~75%가 생리통 및 출혈이 장기간 호전되었다고 보고한다. 그러나 아랍에미리트(UAE)에 이어 여성의 35%가 재발하고 있다. 또한, UAE는 수술을 받는 여성의 5%에게 심각한 합병증을 일으킬 위험이 있다. 주요 합병증으로는 감염, 중대한 출혈, 추가 수술 필요 등이 있다. 아랍에미리트(UAE)에서도 난소 기능을 줄이는 사례가 나왔다. 마지막으로 UAE를 거치는 여성의 26%는 결국 자궁 절제술을 받아야 한다.[9]
- 자궁내막 또는 자궁선근종 절제술: 이 절차에서 외과의사들은 자궁선근종이라고 알려진 자궁선근증의 초점 결합을 제거한다. 이 절차가 성공하려면 자궁선근증이 상대적으로 집중적으로 격리되고 최소 확산이 있어야 한다. 불행히도 자궁선근증은 일반적으로 확산되며 수술은 50%만 성공한다. 그 절차는 복강경이나 히스테리경 중 하나로 행해진다. 게다가 확산성 선모증이 신체적으로 근계를 약화시키고 수술 봉합이 최소한의 힘으로 근육을 찢을 수 있어 수술이 어려울 수 있다. 성공하면 생리통과 출혈이 현저하게 개선된다. 또한, 수술 후 임신을 시도하려는 여성의 임신율이 78%에 달하며, 임신 중 69%가 성공적인 분만을 통해 출산율이 개선될 수 있다. 반면 유산율 증가(임신의 39%)는 일반 인구보다 높은 것으로 나타났다. 이는 수술로 인한 자궁 흉터 조직 형성이 증가했기 때문으로 보인다.[9]
- 근막 전기 응고[9]
- 근막감소[9]
- MRI 유도 초점 초음파 수술[9]
자궁내막절제술 및 절제술
- 자궁내막절제술은 출산을 마친 여성만을 위한 것이다. 이 기법은 히스테리를 통한 자궁내막 절제술과 자궁내막 제거술을 포함하거나 자궁내막층을 즉시 제거하지 않고 절제하거나 죽이는 데 초점을 맞춘다. 자궁내막절제술과 절제술은 얕은 자궁선근증에 가장 적합하다. 자궁선근증이 너무 광범위하거나 심하면 시술 효과가 떨어진다. 게다가, 깊은 자궁선근증은 흉터가 있는 부위 뒤에 갇혀서 더 많은 출혈과 고통을 초래할 수 있다. 자궁내막절제술도 자궁내 깊이가 5mm인 큰 동맥의 손상으로 상당한 출혈이 발생할 수 있기 때문에 비교적 얕은 자궁선근증으로 제한된다.[9]
- 비위생적 절차: 이러한 기법은 히스테리가 필요 없고, 비교적 빠르며, 많은 기법들이 외래환자 치료로 행해질 수 있다.
- 고에너지 무선 주파수 절제: 자궁 내에 놓인 작은 확장형 망사를 사용하여, 제공자들은 자궁 내막을 수축시키기 위해 고에너지 전파를 사용한다.
- 열기구: 자궁 안에 놓인 얇게 팽창하는 풍선을 이용하여, 제공자들은 가열된 액체를 도입하고 자궁내막을 수축시킬 수 있다. 이 시술은 환자의 23%에서 12개월 동안 무월경이나 월경 출혈의 완전 중단을 초래하는 것으로 나타났다. 환자의 16%는 추가 치료나 자궁 절제술이 필요한 통증이나 출혈로 결국 치료 실패를 경험한다. 45세 이상의 여성들과 가벼운 자궁선근증을 가진 사람들은 그 시술에 따라 성공적인 자궁근종을 경험할 가능성이 더 높았다. 이와는 대조적으로, 45세 미만의 여성들, 다발성 출산, 이전 관통사, 그리고/또는 생리통 이력이 있는 여성들은 치료 실패를 경험할 가능성이 더 높았다.[9]
- 극저온절제술(CEA): 작은 탐침을 이용하여 제공자가 자궁 내 영하의 온도를 자궁내부에 직접 적용하여 자궁내막을 얼리고 축출할 수 있는 극저온 요법의 일종이다.
- 순환온수 : 자궁에 직접 유입되는 가열수는 자궁내막을 열적으로 수축시키는 데 쓰인다.
- 마이크로파 절제: 자궁에 도입된 작은 탐침을 이용하여, 제공자는 자궁 내막을 수축시키기 위해 마이크로파 에너지를 사용한다.
- 히스테리 진단 절차: 이 기술들은 모두 히스테리를 사용하여 수행해야 한다.
- 와이어 루프 절제: 히스테리경을 통한 직접 시각화 하에서, 전류를 충전한 와이어 루프 기구는 공급자가 자궁내막을 스트립으로 조심스럽게 제거할 수 있도록 한다.
- 레이저 절제: 히스테리를 통한 직접적인 시각화 하에서는 레이저를 사용하여 자궁내막을 증발시키고 수축시킨다.
- 롤러볼 절제: 히스테리를 통한 직접 시각화에서는 프로브 끝에 있는 금속 공이 전기로 충전되어 자궁내막 표면을 가로질러 굴러간다. 이것은 2-3 mm 깊이의 근막내 심층까지 응고 효과가 있는 것으로 나타났다. 이것은 자궁내막과 기능장애가 있는 부드러운 근육의 근접한 성장을 파괴한다. 더 깊은 자궁선근증은 이 응고 효과를 면한다.[9]
- 비위생적 절차: 이러한 기법은 히스테리가 필요 없고, 비교적 빠르며, 많은 기법들이 외래환자 치료로 행해질 수 있다.
비 자궁적 공간 확보 절차
자궁 절제술, 즉 자궁의 외과적 제거술은 역사적으로 선근증을 진단하고 치료하는 일차적인 방법이었다.[9] 특히 출산을 마친 여성이나 출산을 원하지 않는 경우에서 인기가 높았다. 오늘날, 더 많은 의학 및 외과적 개입이 가능하다. 호르몬 치료와 자궁내막 절제술과 같은 이러한 치료법은 자궁 절제술을 필요로 하는 여성의 수를 현저히 감소시켰다. 말하자면, 자궁적정증은 다른 치료가 실패한 여성들에게 최종 치료 선택사항으로 남아있다.[33] 일반적으로 자궁선근증과 관련된 출혈과 골반 통증에 대한 결정적인 치료법으로 간주되는 자궁절제술은 항상 불임과 월경 출혈의 중단을 초래할 것이다. 반면에 골반 통증은 여성의 22%가 자궁 절제술을 받은 후에도 지속될 수 있다.[9]
자궁 절제술에는 여러 가지 종류가 있는데, 나팔관, 난소, 자궁경부를 제거하는 옵션이 다양하다. 또한, 다양한 종류의 자궁 절제술은 많은 다른 수술 기법에 의해 수행될 수 있다.
자궁 절제술은 다음과 같이 수행할 수 있다.
- 복부의 작은 구멍을 통해 복강경 수술로
- 복강경 수술과 비슷한 방식으로 로봇적으로
- 복부 절개술도 없이 전적으로 음부를 경유하여.
- 더 큰 복부 절개를 통해
이러한 여러 기술을 결합한 변형도 존재하며, 수술은 예상치 못한 장애물이나 개별 해부학적 고려사항에 대응하여 한 기법에서 다른 기법으로 변경될 수 있다. 예를 들어 자궁선근증은 자궁의 크기를 증가시켜 자궁을 먼저 더 작은 조각으로 자르지 않고는 물리적으로 질로 제거할 수 없을 정도로 증가시킬 수 있다.
역학
최근의 자료에 의하면 20-35%[1]의 유병률을 보이고 있다.
예후
자궁선근증은 종종 진행형 질환이다. 자궁선근증이 암 발병의 위험성을 증가시키지 않는다고 주장한다. 그러나 두 실체가 공존할 수 있고, 자궁내막 조직에는 자궁내막선상피종(endometrioid adenocarcinoma)이 있을 수 있으며, 잠재적으로 깊은 자궁내막 침투를 일으킬 수 있다.[34] 에스트로겐 의존적인 상태인 만큼 폐경기는 자연적인 치료법을 제시한다. 폐경 후에도 자궁선근증의 초음파 특징이 나타날 것이다. 자궁선근증이 있는 사람도 자궁섬유종이나 자궁내막증이 있을 가능성이 높다.[citation needed]
다산성
자궁선근증 자체는 불임 문제를 일으킬 수 있지만 레보노게스트렐 요법과 같은 호르몬 요법에 따라 자궁선근증이 해결되면 생식력을 향상시킬 수 있다.[citation needed] 약물치료 중단이나 IUD 제거는 불임치료와 조정되도록 타이밍을 맞출 수 있다.[citation needed] 또한 자궁선근증의 고주파 초음파 절제술에 따른 성공적인 임신과 건강한 출산에 대한 보고가 한 건 있었다.[citation needed]
자궁선근증이 있는 여성에게서 임신 전 노동과 조기 막 파열 모두 더 자주 발생한다.[10][11]
체외수정(IVF)을 받은 난임 여성의 경우 자궁선근증이 있는 여성은 임신 가능성이 낮아져 결과적으로 유산을 경험할 가능성이 높았다.[35] 이에 따라 여성들에게 TVUS나 MRI로 자궁선근증을 검사한 뒤 보조복제치료(ART)를 시작하는 것이 좋다.[35]
어원
자궁근증이라는 용어는 그리스어 용어로 아데노-(샘을 의미함), myo-(근육을 의미함), -osis(조건)에서 유래되었다.[citation needed]
참고 항목
참조
- ^ a b Gunther, Rutger; Walker, Christopher Walker (2020). "Adenomyosis". Statpearls. PMID 30969690.
- ^ a b R, Gunther; C, Walker (2020). "Adenomyosis". PMID 30969690. Cite 저널은 필요로 한다.
journal=(도움말) - ^ Lazzeri L, Di Giovanni A, Exacoustos C, Tosti C, Pinzauti S, Malzoni M, Petraglia F, Zupi E (August 2014). "Preoperative and Postoperative Clinical and Transvaginal Ultrasound Findings of Adenomyosis in Patients With Deep Infiltrating Endometriosis". Reprod Sci. 21 (8): 1027–1033. doi:10.1177/1933719114522520. PMID 24532217. S2CID 24041889.
- ^ a b c Katz VL (2007). Comprehensive gynecology (5th ed.). Philadelphia PA: Mosby Elsevier.
- ^ 도랜드 의학 사전의 "아데노메트염"
- ^ Matalliotakis, I.; Kourtis, A.; Panidis, D. (2003). "Adenomyosis". Obstetrics and Gynecology Clinics of North America. 30 (1): 63–82, viii. doi:10.1016/S0889-8545(02)00053-0. PMID 12699258.
- ^ a b Brosens I, Gordts S, Habiba M, Benagiano G (December 2015). "Uterine Cystic Adenomyosis: A Disease of Younger Women". J Pediatr Adolesc Gynecol. 28 (6): 420–6. doi:10.1016/j.jpag.2014.05.008. PMID 26049940.
- ^ Leyendecker, G.; Herbertz, M.; Kunz, G.; Mall, G. (2002). "Endometriosis results from the dislocation of basal endometrium". Hum. Reprod. 17 (10): 2725–2736. doi:10.1093/humrep/17.10.2725. PMID 12351554.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y Struble, Jennifer; Reid, Shannon; Bedaiwy, Mohamed A. (2016). "Adenomyosis: A Clinical Review of a Challenging Gynecologic Condition". Journal of Minimally Invasive Gynecology. 23 (2): 164–185. doi:10.1016/j.jmig.2015.09.018. PMID 26427702.
- ^ a b Juang, C-M; Chou, P; Yen, M-S; Twu, N-F; Horng, H-C; Hsu, W-L (2007-02-01). "Adenomyosis and risk of preterm delivery". BJOG: An International Journal of Obstetrics & Gynaecology. 114 (2): 165–169. doi:10.1111/j.1471-0528.2006.01186.x. ISSN 1471-0528. PMID 17169011. S2CID 37765088.
- ^ a b c d Maheshwari, A.; Gurunath, S.; Fatima, F.; Bhattacharya, S. (2012). "Adenomyosis and subfertility: A systematic review of prevalence, diagnosis, treatment and fertility outcomes". Human Reproduction Update. 18 (4): 374–392. doi:10.1093/humupd/dms006. PMID 22442261.
- ^ Leyendecker G, Kunz G, Kissler S, Wildt L (August 2006). "Adenomyosis and reproduction". Best Pract Res Clin Obstet Gynaecol. 20 (4): 523–46. doi:10.1016/j.bpobgyn.2006.01.008. PMID 16520094.
- ^ Benagiano, G.; Brosens, I.; Habiba, M. (2013). "Structural and molecular features of the endomyometrium in endometriosis and adenomyosis". Human Reproduction Update. 20 (3): 386–402. doi:10.1093/humupd/dmt052. ISSN 1355-4786. PMID 24140719.
- ^ Brosens I, Derwig I, Brosens J, Fusi L, Benagiano G, Pijnenborg R (March 2010). "The enigmatic uterine junctional zone: the missing link between reproductive disorders and major obstetrical disorders?". Hum. Reprod. 25 (3): 569–74. doi:10.1093/humrep/dep474. PMID 20085913.
- ^ Kitawaki J (August 2006). "Adenomyosis: the pathophysiology of an oestrogen-dependent disease". Best Pract Res Clin Obstet Gynaecol. 20 (4): 493–502. doi:10.1016/j.bpobgyn.2006.01.010. PMID 16564227.
- ^ Kitawaki J, Obayashi H, Ishihara H, Koshiba H, Kusuki I, Kado N, Tsukamoto K, Hasegawa G, Nakamura N, Honjo H (January 2001). "Oestrogen receptor-alpha gene polymorphism is associated with endometriosis, adenomyosis and leiomyomata". Hum. Reprod. 16 (1): 51–55. doi:10.1093/humrep/16.1.51. PMID 11139535.
- ^ Ota H, Igarashi S, Hatazawa J, Tanaka T (1998). "Is adenomyosis an immune disease?". Hum. Reprod. Update. 4 (4): 360–7. doi:10.1093/humupd/4.4.360. PMID 9825851.
- ^ a b Bergeron C, Amant F, Ferenczy A (August 2006). "Pathology and physiopathology of adenomyosis". Best Pract Res Clin Obstet Gynaecol. 20 (4): 511–21. doi:10.1016/j.bpobgyn.2006.01.016. PMID 16563870.
- ^ Nepomnyashchikh LM, Lushnikova EL, Molodykh OP, Pichigina AK (August 2013). "Immunocytochemical analysis of proliferative activity of endometrial and myometrial cell populations in focal and stromal adenomyosis". Bull. Exp. Biol. Med. 155 (4): 512–7. doi:10.1007/s10517-013-2190-5. PMID 24143380. S2CID 478916.
- ^ Leyendecker G, Wildt L, Mall G (October 2009). "The pathophysiology of endometriosis and adenomyosis: tissue injury and repair". Arch. Gynecol. Obstet. 280 (4): 529–38. doi:10.1007/s00404-009-1191-0. PMC 2730449. PMID 19644696.
- ^ a b Leyendecker G, Bilgicyildirim A, Inacker M, Stalf T, Huppert P, Mall G, Böttcher B, Wildt L (April 2015). "Adenomyosis and endometriosis. Re-visiting their association and further insights into the mechanisms of auto-traumatisation. An MRI study". Arch. Gynecol. Obstet. 291 (4): 917–32. doi:10.1007/s00404-014-3437-8. PMC 4355446. PMID 25241270.
- ^ Koike, H.; Egawa, H.; Ohtsuka, T.; Yamaguchi, M.; Ikenoue, T.; Mori, N. (June 1992). "Correlation between dysmenorrheic severity and prostaglandin production in women with endometriosis". Prostaglandins, Leukotrienes and Essential Fatty Acids. 46 (2): 133–137. doi:10.1016/0952-3278(92)90219-9. ISSN 0952-3278. PMID 1502250.
- ^ a b c Nucci, Marisa R. (3 February 2020). Gynecologic pathology : a volume in the series Foundations in diagnostic pathology (Second ed.). p. 489. ISBN 978-0-323-35909-2.
- ^ a b c d e f g h i Exacoustos, Caterina; Manganaro, Lucia; Zupi, Errico (2014). "Imaging for the evaluation of endometriosis and adenomyosis" (PDF). Best Practice & Research Clinical Obstetrics & Gynaecology. 28 (5): 655–681. doi:10.1016/j.bpobgyn.2014.04.010. hdl:2108/137400. PMID 24861247.
- ^ Torloni, M. R.; Vedmedovska, N.; Merialdi, M.; Betrán, A. P.; Allen, T.; González, R.; Platt, L. D. (2009-05-01). "Safety of ultrasonography in pregnancy: WHO systematic review of the literature and meta-analysis". Ultrasound in Obstetrics and Gynecology. 33 (5): 599–608. doi:10.1002/uog.6328. ISSN 1469-0705. PMID 19291813. S2CID 9986561.
- ^ Kepkep K, Tuncay YA, Göynümer G, Tutal E (2007). "Transvaginal sonography in the diagnosis of adenomyosis: which findings are most accurate?". Ultrasound Obstet Gynecol. 30 (3): 341–5. doi:10.1002/uog.3985. PMID 17659649. S2CID 26333703.
- ^ Sakhel K, Abuhamad A (May 2012). "Sonography of adenomyosis". J Ultrasound Med. 31 (5): 805–8. doi:10.7863/jum.2012.31.5.805. PMID 22535729. S2CID 37627898.
- ^ Dartmouth, Katherine (2014-08-01). "A systematic review with meta-analysis: the common sonographic characteristics of adenomyosis". Ultrasound. 22 (3): 148–157. doi:10.1177/1742271X14528837. ISSN 1742-271X. PMC 4760530. PMID 27433212.
- ^ Sharma, Kaveri (2015). "Role of 3D Ultrasound and Doppler in Differentiating Clinically Suspected Cases of Leiomyoma and Adenomyosis of Uterus". Journal of Clinical and Diagnostic Research. 9 (4): QC08–12. doi:10.7860/jcdr/2015/12240.5846. PMC 4437118. PMID 26023602.
- ^ a b Bragheto A.M.; et al. (2007). "Effectiveness of the levonorgestrel-releasing intrauterine system in the treatment of adenomyosis diagnosed and monitored by magnetic resonance imaging". Contraception. 76 (3): 195–9. doi:10.1016/j.contraception.2007.05.091. PMID 17707716.
- ^ Maheshwari A, Gurunath S, Fatima F, Bhattacharya S (July 2012). "Adenomyosis and subfertility: a systematic review of prevalence, diagnosis, treatment and fertility outcomes". Hum. Reprod. Update. 18 (4): 374–92. doi:10.1093/humupd/dms006. PMID 22442261.
- ^ Niu Z, Chen Q, Sun Y, Feng Y (December 2013). "Long-term pituitary downregulation before frozen embryo transfer could improve pregnancy outcomes in women with adenomyosis". Gynecol. Endocrinol. 29 (12): 1026–30. doi:10.3109/09513590.2013.824960. PMID 24006906. S2CID 39831081.
- ^ [1], Levgur, M. (2007). "Therapeutic options for adenomyosis: a review". Archives of Gynecology and Obstetrics. 276 (1): 1–15. doi:10.1007/S00404-006-0299-8. PMID 17186255. S2CID 228334.
- ^ Ismiil N, Rasty G, Ghorab Z, et al. (August 2007). "Adenomyosis involved by endometrial adenocarcinoma is a significant risk factor for deep myometrial invasion". Ann Diagn Pathol. 11 (4): 252–7. doi:10.1016/j.anndiagpath.2006.08.011. PMID 17630108.
- ^ a b Vercellini, Paolo; Consonni, Dario; Dridi, Dhouha; Bracco, Benedetta; Frattaruolo, Maria Pina; Somigliana, Edgardo (2014-05-01). "Uterine adenomyosis and in vitro fertilization outcome: a systematic review and meta-analysis". Human Reproduction. 29 (5): 964–977. doi:10.1093/humrep/deu041. ISSN 0268-1161. PMID 24622619.