아나파제 추진 단지
Anaphase-promoting complex아나파제 촉진 복합체(Cyclosome 또는 APC/C라고도 함)는 26S 프로테아솜에 의해 분해될 대상 세포주기 단백질을 표시하는 E3 유비퀴틴 리가제다.APC/C는 SCF와 매우 유사한 Cullin (Apc2)과 RING (Apc11) 하위 단위를 포함한 11–13 하위 단위의 큰 복합체다.APC/C의 다른 부분들은 알려지지 않은 기능을 가지고 있지만 보존성이 높다.[1]
세포 생물학에서 유비퀴틴 매개 단백질 분해의 중요성을 확립한 것은 APC/C(및 SCF)의 발견과 진핵 세포 주기 규제의 핵심 역할이었다.한때 손상된 단백질을 세포에서 제거하는 데만 관여하는 시스템으로 인식되었던 프로테아솜에 의한 편재화와 그에 따른 단백질 분해는 이제 단백질 인산화 중요성에 접근하는 신호 전달을 위한 보편적인 규제 메커니즘으로 인식되고 있다.
2014년에는 나노미터 이하의 해상도로 APC/C를 3D로 지도화했는데, 이 역시 2차 구조를 밝혀냈다.이 발견은 암에 대한 이해를 향상시키고 미래의 암 약물에 대한 새로운 결합 장소를 밝혀낼 수 있다.[2][3]
함수
APC/C의 주요 기능은 특정 단백질을 분해에 태그하여 은유효소에서 아나파아제로의 전환을 촉발하는 것이다.APC/C에 의한 3대 열화 대상은 증권, S, M 사이클린이다.Securin은 분해될 때 프로테아제인 분리효소를 방출한다.분리효소는 그 후 자매 크로마티드를 결합하는 단백질 복합체인 응집체의 갈라짐을 유발한다.은유효소 동안, 자매 크로마티드는 온전한 응집 복합체에 의해 연결된다.증권화가 APC/C에 의해 편재되어 응집력을 저하시키는 분리효소를 방출할 때, 자매 크로마티드는 아나파제를 위해 반대 극지방으로 자유롭게 이동하게 된다.또한 APC/C는 미토틱 사이클린을 대상으로 하여, M-CDK(미토틱 사이클린 의존성 키나제) 복합체가 비활성화되어 유사분열과 사이토키네시스[1] 퇴출을 촉진한다.
SCF와 달리, 활성제는 APC/C를 제어한다.Cdc20과 Cdh1은 셀 주기에 특히 중요한 두 가지 활성제다.이 단백질들은 세포 주기의 서로 다른 시간에 특정 기질들의 집합으로 APC/C를 겨냥하고, 따라서 그것을 앞으로 몰고 간다.또한 APC/C는 특히 G1과 G0에서 염색질 대사 유지에 필수적인 역할을 하며, 오로라 A 키나제 파괴를 통한 H3의 인산화에도 핵심적인 역할을 한다.[4]
APC/C의 임계 기판은 증권가와 B형 사이클린으로 나타난다.이것은 포유류와 효모 사이에 보존되어 있다.실제로 효모는 이 두 기판을 대상으로 하는 요건이 제거되면 APC/C가 없을 때 생존할 수 있다.[5]
수부닛
대부분 어댑터 역할을 하는 APC/C 서브유닛에 대한 광범위한 조사는 많지 않다.APC 하위유닛에 대한 연구는 주로 효모에서 수행되며, 효모 APC 하위유닛의 대다수가 척추동물에서도 존재한다는 연구결과가 나와 이는 진핵생물 전반에 걸친 보존을 시사한다.척추동물에서는 11개의 핵심 APC 하위유닛이 발견되었고 효모에서는 13개가 발견되었다.[1]활성화 서브유닛은 셀 주기의 다양한 단계에서 유비쿼터스 활동을 제어하기 위해 APC에 바인딩되며, 종종 APC가 유비쿼터스화를 위해 예정된 기판을 목표로 하도록 지시한다.APC 리가스의 특수성은 기질 인산화 대신 리가세 복합체에 특수성 인자를 통합하여 제어하도록 제안한다. 즉,:소단위인 CDC20은 APC가 아나파제 억제제(Pdsp1)와 같은 기질을 아나파제 시작 시 저하시키는 반면, CDC20이 특수성 인자 Hct1로 대체될 때 APC는 다른 기질 집합, 특히 늦은 아나파제의 유사성 사이클린을 분해한다.액티베이터 CDC20과 Cdh1은 특히 중요하며 APC/C 서브유닛에 대해 가장 널리 연구되고 친숙하다.
APC/C의 촉매 코어는 Cullin 하위 장치 Apc2와 RING H2 도메인 하위 장치 Apc11로 구성된다.이 두 서브유닛은 Apc2의 C-단자 영역이 Apc11과 긴밀하게 콤플렉스를 형성할 때 기판의 편재화를 촉진한다.RING/APC11은 E2의 활성 사이트로 유비퀴틴의 전달을 촉진하는 E2-유비퀴틴 결합체에 결합한다.[1]촉매 기능 외에도 APC의 다른 핵심 단백질은 분자 비계 지지대를 제공하는 주된 목적을 가진 다중 반복 모티브로 구성된다.여기에는 아미노산 서열 35–40의 11 탠덤 반복을 포함하는 가장 큰 서브 유닛인 Apc1과 총 130개의 아미노산 서열 중 3개의 컬린 반복을 포함하는 Apc2가 포함된다.[6]비록 정확한 메커니즘을 통해 APCactiv을 증가시키 APC서브 유닛의 주요 모티브tetratricopeptide(TPR)문양과 WD40 CDC20과 Cdh1의 1.[1]C-termini 지역, 따라서 AsynchronousProcedureCall능력 면을 겨냥하기에 기여하는 APC는 기질을 이렇게 바인딩 플랫폼을 형성하는 것이 좋다는 WD40 도메인 반복할 뿐이다 포함한다.그것y는 알 수 없음.[7]또한 이러한 WD40 영역의 변동은 기질특성을 변화시킬 것을 제안하며, 이는 최근 결과에 의해 서로 다른 APC 기판이 직접적이고 구체적으로 Cdc20과 Cdh1/Hct1에 결합할 수 있음을 시사한다. 궁극적으로, 특정성 차이는 여러 APC 대상의 파괴 시기에 책임이 있다.s 체세포 분열 중은유에서 몇 개의 주요 기판을 대상으로 하는 CDC20과 늦은 유사분열과 G1을 향한 더 광범위한 기판을 목표로 하는 Cdh1과 함께.[8]
가장 주목할 만한 것은 효모 APC/C의 4개 서브유닛은 34개의 아미노산 사트라토펩타이드 잔여물(TPR) 모티브의 거의 모든 반복실험으로 구성된다.이러한 TPR 서브유닛, Cdc16,[9] Cdc27,[10] Cdc23, Apc5는 주로 다른 단백질-단백질 상호작용을 중재하기 위한 비계와 지원을 제공한다.Cdc27과 Cdc23은 이러한 서브유닛의 주요 잔류물에서 돌연변이가 활성제의 분리를 증가시키면서 Cdc20과 Cdh1의 결합을 지원하는 것으로 나타났다.Apc10/Doc1은 Cdh1 및 Cdc20과의 상호작용을 매개하여 기질 결합을 촉진하는 것으로 나타났다.[11]
특히 CDC20(p55CDC, Fizzy 또는 Slp1)은 B형 사이클린의 편재화를 통해 CDK1을 비활성화한다.이로 인해 Cdh1(a.k.a)이 활성화된다.후기 유사시 및 G1/G0 동안 APC와 상호작용하는 피지 관련, Hct1, Ste9 또는 Srw1).Cdh1은 S, G2 및 초기 M 단계 중에 인산화를 통해 비활성화된다.주기의 이 지점들 중에는 조립할 수 없다.[12]
증거는 APC3와 APC7이 아나파제 추진단지에 Cdh1을 모집하는 역할을 한다는 것을 보여준다.[13]이것은 또한 Cdh1이 G1 동안 APC 활동을 유지하는 책임을 지고 있다는 것을 뒷받침한다.사실 Cdh1은 Cdk에 의한 Cdh1의 인산화 때문에 APC가 S상에서 M상까지 APC에 결합되지 않도록 하기 위해 APC를 인산화할 필요가 없다.M-Cdk가 파괴되면서 APC에서 CDC20이 출시되고 Cdh1이 바인딩될 수 있게 되어 G1 진입 중에도 APC 활동이 계속될 수 있게 되었다.[1]Cdh1은 M과 S 사이클린을 인식하여 전체 셀이 새로운 사이클로 진행하기로 약속할 때까지 그 파괴를 허용하는 반면, G1/S 사이클린을 인식하지 못하며, G1/S 페이즈 동안 사이클린 활동은 숨김이 없고 인산화되어 Cdh1과 APC가 활성화되지 않을 수 있다.
apc15 하위유닛은 은유체 판을 가로지르는 자매 크로마티드의 양방향화에 따른 APC/CCdc20 활성화에 중요한 역할을 한다.키네토코어가 스핀들에 부착되지 않은 경우, 유사 체크포인트 콤플렉스(MCC)와 APC를 억제한다.Apc15가 없는 경우, MCCs와 Cdc20은 스핀들 체크포인트 요건이 충족되면 APC/C의 활동을 방해하는 잠금 상태를 유지한다.apc15는 Cdc20과 MCC의 이전을 매개하여 키네토코어의 부착 상태에 관한 정보를 제공한다.[14]
CDC27/APC3
TPR 모티브를 보여주는 하위 유니트 중 하나인 CDC27은 Mad2, p55CDC, BUBR1과 같은 유사 체크포인트 단백질과 상호작용하는 것으로 확인되어 M 페이즈 타이밍에 관여할 수 있음을 시사했다.[15]증거는 CDC27이 SMAD2/3과 Cdh1이 있는 3차 복합체에 관여하고 있으며, TGFβ 신호 전달에 대응하여 생성된다.특히 Cdh1과의 상호작용 때문에 APC와 그 활동가 Cdc20과 Cdh1 사이의 친화력을 결정하는 잠재적인 역할을 가지고 있다.연구에 따르면 TGF-β 유도 Cdc27 인산화 작용이 APC 활성화에 직접 관여하는 Cdc27과 Cdh1 사이의 상호작용을 강화한다고 한다.[16]CDC27은 TGFβ 신호 전달이 APC를 활성화할 수 있는 차량 역할을 할 수 있다.TGFβ에 의한 유도 CDC27 초인산화는 APC 활성도 증가를 보였다.
CDC23, CDC16, CDC27
또 다른 TPR 서브 유닛인 CDC23은 CLB2의 D-박스에 결합하여 SWM1과 상호작용한다.생체내 및 시험관내 공동면역복귀와 하이브리드 검사에 기초하여 Cdc16p, Cdc23p, Cdc27p(Sacchyromyces cerevisiae의 아날로그)가 상호작용하여 고분자 복합체를 형성하는 것이 제안된다.TPR의 공통 주제는 이러한 상호작용을 중재하기 위해 제안된다.[17]드로소필라의 Cdc27과 Cdc16에 대해서는 RNA 간섭(RNAi)을 통해 그 기능을 시험해 보았다.[18]결과는 그들이 서로 다른 현장의 다른 메커니즘을 통해 전체 단지의 활동을 중재할 수 있음을 시사한다.추가 드로필라 연구에서, Cdk16과 Cdk23은 폴로 유사 키나제 1 (Plk1)에 의한 인산화를 통해 활성화되는 것으로 보이며, 그 핵분열 효모 상대는 특히 Cdc23에 결합하는 것으로 보인다.[19]
이 단지는 유사시 활성제 CDC20과 Cdh1에 의해 규제되는 것으로 이해된다.사이클린 B의 분해에서 그들의 역할은 CDC16과 CDC23 유전자에서 돌연변이가 발견된 사이클린 B 분해에 결함이 있는 사카로마이오스 세레비시아 돌연변이의 스크린에 의해 증명된다.CDC27, CDC23, CDC27의 돌연변이는 모두 은유법에서 세포주기 구속을 초래했다.[20]
기질인식
APC/C 기질에는 APC/C가 기질을 식별할 수 있는 인식 아미노산 시퀀스가 있다.가장 흔한 수열은 파괴 상자나 D-box로 알려져 있다. APC/C는 중간 공밸런스 운반체라기 보다는 E2 ubiquitin-conjugging 효소와 D-box를 조합한다.[21]D-box에는 다음과 같은 아미노산 시퀀스의 버전이 있어야 한다: R은 아르기닌, X는 모든 아미노산, L은 루신, N은 아스파라긴이다.켄박스는 또 다른 중요한 모티브다.그것의 순서는 K는 리신이고 E는 글루탐산염인 KENXXN과 닮아야 한다.켄 박스의 마지막 아미노산 위치는 매우 가변적이다.염기서열에서 돌연변이가 " 생체내" 단백질의 파괴를 억제한다는 것이 밝혀졌지만, 단백질이 APC/C의 표적이 되는 방법에 대해서는 아직 배울 것이 많다.[1]
일단 APC/C에 바인딩되면, Cdc20과 Cdh1은 다양한 APC 기질에 대한 D와 KEN 박스 수용체 역할을 한다.크래프트 외기판의 D 박스가 APC 활성제의 WD40 반복 프로펠러 영역에 직접 바인딩된다는 것을 보여주었다.Cdh1 프로펠러의 보존 면적이 Cdc20보다 훨씬 넓어 APC/CCdh1 또한 기판을 포함한 KEN 박스의 APC 매개 파괴를 활성화한다는 사실과 일치하여 Cdh1이 보다 넓은 기질 특수성을 가질 수 있다는 점에 유의해야 한다.D 박스는 단백질 분해 능력을 더욱 강화하는데, D 박스에 근접한 리신 잔류물이 유비쿼터스화의 표적으로 작용하기 때문이다.Lys 잔여물은 D 박스에 즉시 C-단자 형태로 전달될 수 있는 것으로 밝혀졌다.[22]
많은 APC 기판은 D 박스와 KEN 박스를 모두 포함하며, 두 시퀀스에 따라 APC/CCdc20 또는 APC/C에Cdh1 의한 유비쿼터스화를 포함하지만, 일부 기판은 D 박스나 KEN 박스만 하나 또는 여러 개의 복사본에 포함한다.두 개의 뚜렷한 분해 시퀀스를 갖는 것은 APC/C에 높은 수준의 기질 특수성을 생성하며, APC/C는Cdc20 D 박스에, APC/C는Cdh1 KEN 박스에 더 의존한다.예를 들어 APC/C는Cdh1 Tome-1과 Sororrin과 같은 KEN 박스 전용 기판을 편재할 수 있다.[6]
Cdc20과 Cdh1은 D와 KEN 박스 수용체 역할을 할 수 있지만, 이러한 공동활성-하향 상호작용의 친화력이 낮다는 것은 공동활성자만으로는 APC/C와Cdc20 APC/C에Cdh1 고선호도 기질 결합을 부여하기에 충분할 가능성이 낮다는 것을 시사한다.[6]결과적으로, Apc10과 같은 핵심 APC/C 하위 단위는 기질 연관성에 기여한다.Apc10/Doc1 서브유닛이 부족한 APC/C 구조에서 Clb2와 같은 기판은Δdoc1 APC-Cdh1 구조와 연결할 수 없는 반면, APC-Cdh1Δdoc1 구조물에 정제 Doc1을 추가하면 기판 결합 능력이 복원된다.[11]
아나파제 전환에 대한 은유효소
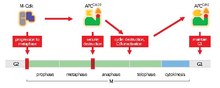
은유효소가 시작되면, 스핀들 체크포인트는 모든 자매-키네토코르들이 염색체 생체변화로 알려진 과정인 유사체 스핀들의 반대 극에 부착될 때까지 APC/C를 억제한다.모든 키네토코어가 제대로 부착되면 스핀들 체크포인트가 침묵되고 APC/C가 활성화될 수 있다.APC/C에 있는 M-Cdks 인산염 서브유닛은 Cdc20에 대한 바인딩을 촉진한다.그런 다음 Securin과 M 사이클린(사이클린 A와 사이클린 B)은 APC/C의Cdc20 성능저하를 목표로 한다.분해되면 분리가 분비되고 응집력이 저하되며 자매 크로마티드가 각각의 극지방으로 이동하여 아나파제를 투여할 준비를 한다.[1]
동물 세포에서는 적어도 APC/C의Cdc20 활성화의 일부가 기판의 분해 시기에 근거한 세포 주기(프로상 또는 프로메타파아제) 초기에 발생할 가능성이 있다.사이클린 A는 체세포 분열 초기에 분해되어 이론을 뒷받침하지만 사이클린 B와 증권가는 은유효소까지 분해되지 않는다.지연의 분자적 근거는 알 수 없지만, 아나파제 시작의 정확한 타이밍에 대한 열쇠가 포함된 것으로 생각된다.동물 세포에서 스핀들 체크포인트 시스템은 염색체의 양방향성을 교정할 필요가 있을 경우 지연에 기여한다.스핀들 체크포인트 시스템이 사이클린 B와 증권 파괴를 억제하면서 사이클린 A의 성능 저하를 어떻게 허용하는지 알 수 없다.또한 지연은 규제 기관과의 알려지지 않은 상호작용, 국산화 및 인산화 변화에 의해 설명될 수 있다.[1]
이렇게 하면 음의 피드백 루프가 시작된다.APC/C를Cdc20 활성화하려면 M-Cdk가 필요하지만, 이 단지는 M-CdK를 비활성화하기 위해 사이클린을 파손하는 역할도 담당한다.이는 APC/C가Cdc20 자체 불능화를 조장한다는 것을 의미한다.이 부정적인 피드백은 M과 S 사이클린 농도 진동에 의해 제어되는 Cdk 활동의 중추일 가능성이 있다.[1]
M1 to G 전환
유사분열을 완료한 후, 다음 세포 주기에 필요한 요소들을 성장시키고 생산하기 위해서는 (배아 세포는 제외) G상이라고1 알려진 성장기를 거치는 것이 중요하다.Cdk 활동을 억제함으로써 또 다른 한 차례의 유사분열로 들어가는 것을 막는다.다른 프로세스가 이러한 억제에 책임이 있지만, 중요한 것은 Cdh1에 의한 APC/C의 활성화다.이러한 지속적인 활성화는 또 다른 유사분열을 유발할 수 있는 사이클린의 축적을 방지하고 대신 유사분열에서 빠져나오게 한다.[1]
세포주기의 초기에는 Cdh1이 M-Cdk에 의해 인산염화되어 APC/C에 부착되는 것을 막는다. 그러면 APC/C는 Cdc20에 자유롭게 부착되고 은유효소에서 아나파제로의 전환을 안내한다.M-Cdk는 나중에 유사분열로 분해됨에 따라 Cdc20이 해제되고 Cdh1이 APC/C에 바인딩되어 M/G1 전환을 통해 활성화될 수 있다.주목해야 할 중요한 차이점은 Cdc20과 APC/C의 결합은 유사 Cdk에 의한 APC/C의 인산화 여부에 의존하지만 Cdh1의 결합은 그렇지 않다는 것이다.따라서 비활동적인 유사분열성 Cdks로 인한 탈인산화로 인해 은유 중에 APC가Cdc20 비활성화됨에 따라 Cdh1은 즉시 APC/C에 바인딩하여 Cdc20을 대신할 수 있게 된다.Cdc20도 APC/C의Cdh1 타겟으로, APC/C가Cdc20 종료되도록 한다.그런 다음 APC/C는Cdh1 파괴를1 위해 S와 M 사이클린에 태그를 붙이기 위해 G에서 작업을 계속한다.그러나 G1/S 사이클린은 APC/C의Cdh1 기판이 아니므로 이 단계 전체에 걸쳐 축적되고 인산화 Cdh1이 된다.G1 후반에 이르러, 충분히1 많은 G/S 사이클린이 축적되고 인산화 Cdh1이 다음 은유까지 APC/C를 비활성화할 수 있게 되었다.[1]
일단 G에1 들어가면, APC는Cdh1 적절한 세포 주기 진행을 촉진하는 다양한 단백질의 분해에 책임이 있다.제미닌은 원산지 인식 콤플렉스(ORC)와의 결합을 막는 Cdt1에 결합하는 단백질이다.APC는Cdh1 G 전체에1 걸쳐 보편화를 위한 보미닌을 목표로 하며, 수준을 낮게 유지한다.이를 통해 Cdt1은 사전 RC 조립 시 그 기능을 수행할 수 있다.G1/S 사이클린에 의한 Cdh1의 인산화 작용으로 APC가Cdh1 비활성화되면 제미니 활성도가 다시 증가한다.또한 Dbf4는 Cell division cycle 7 관련 단백질 kinase(Cdc7) 활동을 자극하여 복제기원의 활성화를 촉진한다.APCCdh1은 dbf4의 파괴를 목표로 하는 것으로 생각된다.이것은 Cdc7이 새로운 셀 사이클의 시작에 어떻게 활성화되는지에 대한 해답을 제공할 수 있다.그것의 활동은 G/S 사이클린에 의한 APC/CCdh1 불활성화에 해당할 가능성이 있다.[1]
부가규정
세포 주기의 초기 단계에서 APC/CCdc20 비활성화는 부분적으로 Emi1 단백질에 의해 달성된다.초기 실험에서는 Xenopus 사이클링 추출물에 Emi1을 추가하면 내생성 사이클린 A, 사이클린 B, 미토틱 출구 파괴를 막을 수 있다는 것이 밝혀져 Emi1이 APC의 활동을 상쇄할 수 있음을 시사했다.나아가 체세포에서 에미1이 고갈되면 사이클린 B가 축적되지 않게 된다.Emi1이 부족하면 APC의 억제 부족으로 인해 사이클린 B가 축적되지 않을 가능성이 있다.[23]
이러한 초기 관측을 통해, G2와 초기 유사분열에서 Emi1은 APC 기판과의 연관성을 방지함으로써 Cdc20을 결합·억제하는 것으로 확인되었다.Cdc20은 여전히 인산화되어 APC/C에 바인딩될 수 있지만, 바인딩된 Emi1은 APC 대상과의 Cdc20의 상호작용을 차단한다.[1]Emi1은 Cdc20과의 연관성을 통해 S, G2 단계 전반에 걸쳐 다양한 사이클린의 안정화가 가능하지만, 유사화를 통한 진행을 위해서는 Emi1의 제거가 필수적이다.따라서 후기 프로 페이즈에서 에미1은 폴로 유사키나제인 Plk에 의해 인산염화된다.Plk는 Cdk1 활동에 의한 초기 유사분열 시 활성화되며, Emi1의 BTRC(gene) βTrCP 결합 사이트의 인산화 작용으로 SCF의 표적이 되어 프로메타파아제에서의 후속 파괴로 이어진다.[24]Emi1의 파괴는 APC/CCdc20 활성화를 주도하여 초기 유사분열 시 사이클린 A의 파괴를 가능하게 한다.Emi1 레벨은 G에서 다시 상승하기 시작하며, 이는 APC/C를Cdh1 억제하는 데 도움이 된다.[1]
증권 및 사이클린 B와 같은 은유효소 기질에 대한 APC/CCdc20 활성의 규제는 세포 내 국산화 결과일 수 있다.APC/C를Cdc20 억제하는 스핀들 체크포인트 단백질은 유사 스핀들 근처에 국부화된 Cdc20 모집단의 일부와만 연관된다는 가설이 있다.이런 방식으로, 사이클린 A는 분해될 수 있고 사이클린 B와 증권가는 자매 크로마티드가 바이 오리엔테이션을 달성해야만 분해될 수 있다.[1]
참고 항목
참조
- ^ a b c d e f g h i j k l m n o p Morgan DO (2007). "Chapter 3-10: The Anaphase Promoting Complex". The Cell Cycle: Principles of Control. London: New Science Press. pp. 48–49. ISBN 978-0-9539181-2-6.
- ^ "Scientists map one of most important proteins in life – and cancer". The Institute of Cancer Research. 20 July 2014. Retrieved 22 July 2014.
- ^ Chang LF, Zhang Z, Yang J, McLaughlin SH, Barford D (September 2014). "Molecular architecture and mechanism of the anaphase-promoting complex". Nature. 513 (7518): 388–393. Bibcode:2014Natur.513..388C. doi:10.1038/nature13543. PMC 4456660. PMID 25043029.
- ^ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P, eds. (2002). "Chapter 17. The Cell Cycle and Programmed Cell Death". Molecular Biology of the Cell (4th ed.). Garland Science. ISBN 0-8153-3218-1.
- ^ Thornton BR, Toczyski DP (December 2003). "Securin and B-cyclin/CDK are the only essential targets of the APC". Nature Cell Biology. 5 (12): 1090–4. doi:10.1038/ncb1066. PMID 14634663. S2CID 30582585.
- ^ a b c Barford D (December 2011). "Structural insights into anaphase-promoting complex function and mechanism". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 366 (1584): 3605–24. doi:10.1098/rstb.2011.0069. PMC 3203452. PMID 22084387.
- ^ Castro A, Bernis C, Vigneron S, Labbé JC, Lorca T (January 2005). "The anaphase-promoting complex: a key factor in the regulation of cell cycle". Oncogene. 24 (3): 314–25. doi:10.1038/sj.onc.1207973. PMID 15678131.
- ^ Schwab M, Neutzner M, Möcker D, Seufert W (September 2001). "Yeast Hct1 recognizes the mitotic cyclin Clb2 and other substrates of the ubiquitin ligase APC". The EMBO Journal. 20 (18): 5165–75. doi:10.1093/emboj/20.18.5165. PMC 125620. PMID 11566880.
- ^ Wang J, Dye BT, Rajashankar KR, Kurinov I, Schulman BA (September 2009). "Insights into anaphase promoting complex TPR subdomain assembly from a CDC26-APC6 structure". Nature Structural & Molecular Biology. 16 (9): 987–9. doi:10.1038/nsmb.1645. PMC 2759704. PMID 19668213.
- ^ Yamaguchi M, Yu S, Qiao R, Weissmann F, Miller DJ, VanderLinden R, et al. (April 2015). "Structure of an APC3-APC16 complex: insights into assembly of the anaphase-promoting complex/cyclosome". Journal of Molecular Biology. 427 (8): 1748–64. doi:10.1016/j.jmb.2014.11.020. PMC 4444369. PMID 25490258.
- ^ a b Passmore LA, McCormack EA, Au SW, Paul A, Willison KR, Harper JW, Barford D (February 2003). "Doc1 mediates the activity of the anaphase-promoting complex by contributing to substrate recognition". The EMBO Journal. 22 (4): 786–96. doi:10.1093/emboj/cdg084. PMC 145444. PMID 12574115.
- ^ Kramer ER, Scheuringer N, Podtelejnikov AV, Mann M, Peters JM (May 2000). "Mitotic regulation of the APC activator proteins CDC20 and CDH1". Molecular Biology of the Cell. 11 (5): 1555–69. doi:10.1091/mbc.11.5.1555. PMC 14867. PMID 10793135.
- ^ Vodermaier HC, Gieffers C, Maurer-Stroh S, Eisenhaber F, Peters JM (September 2003). "TPR subunits of the anaphase-promoting complex mediate binding to the activator protein CDH1". Current Biology. 13 (17): 1459–68. doi:10.1016/s0960-9822(03)00581-5. PMID 12956947. S2CID 5942532.
- ^ Mansfeld J, Collin P, Collins MO, Choudhary JS, Pines J (September 2011). "APC15 drives the turnover of MCC-CDC20 to make the spindle assembly checkpoint responsive to kinetochore attachment". Nature Cell Biology. 13 (10): 1234–43. doi:10.1038/ncb2347. PMC 3188299. PMID 21926987.
- ^ "엔트레스 진: CDC27 세포분할 주기 27 homologic (S. serebisiae)"
- ^ Zhang L, Fujita T, Wu G, Xiao X, Wan Y (March 2011). "Phosphorylation of the anaphase-promoting complex/Cdc27 is involved in TGF-beta signaling". The Journal of Biological Chemistry. 286 (12): 10041–50. doi:10.1074/jbc.M110.205518. PMC 3060455. PMID 21209074.
- ^ Lamb JR, Michaud WA, Sikorski RS, Hieter PA (September 1994). "Cdc16p, Cdc23p and Cdc27p form a complex essential for mitosis". The EMBO Journal. 13 (18): 4321–8. doi:10.1002/j.1460-2075.1994.tb06752.x. PMC 395359. PMID 7925276.
- ^ Huang JY, Raff JW (July 2002). "The dynamic localisation of the Drosophila APC/C: evidence for the existence of multiple complexes that perform distinct functions and are differentially localised". Journal of Cell Science. 115 (Pt 14): 2847–56. PMID 12082146.
- ^ Deak P, Donaldson M, Glover DM (October 2003). "Mutations in mákos, a Drosophila gene encoding the Cdc27 subunit of the anaphase promoting complex, enhance centrosomal defects in polo and are suppressed by mutations in twins/aar, which encodes a regulatory subunit of PP2A". Journal of Cell Science. 116 (Pt 20): 4147–58. doi:10.1242/jcs.00722. PMID 12953067.
- ^ Hartwell LH, Smith D (July 1985). "Altered fidelity of mitotic chromosome transmission in cell cycle mutants of S. cerevisiae". Genetics. 110 (3): 381–95. PMC 1202570. PMID 3894160.
- ^ King RW, Deshaies RJ, Peters JM, Kirschner MW (December 1996). "How proteolysis drives the cell cycle". Science. 274 (5293): 1652–9. Bibcode:1996Sci...274.1652K. doi:10.1126/science.274.5293.1652. PMID 8939846. S2CID 25369228.
- ^ Kraft C, Vodermaier HC, Maurer-Stroh S, Eisenhaber F, Peters JM (May 2005). "The WD40 propeller domain of Cdh1 functions as a destruction box receptor for APC/C substrates". Molecular Cell. 18 (5): 543–53. doi:10.1016/j.molcel.2005.04.023. PMID 15916961.
- ^ Reimann JD, Freed E, Hsu JY, Kramer ER, Peters JM, Jackson PK (June 2001). "Emi1 is a mitotic regulator that interacts with Cdc20 and inhibits the anaphase promoting complex". Cell. 105 (5): 645–55. doi:10.1016/s0092-8674(01)00361-0. PMID 11389834. S2CID 16366514.
- ^ Hansen DV, Loktev AV, Ban KH, Jackson PK (December 2004). "Plk1 regulates activation of the anaphase promoting complex by phosphorylating and triggering SCFbetaTrCP-dependent destruction of the APC Inhibitor Emi1". Molecular Biology of the Cell. 15 (12): 5623–34. doi:10.1091/mbc.e04-07-0598. PMC 532041. PMID 15469984.
추가 읽기
- Visintin R, Prinz S, Amon A (October 1997). "CDC20 and CDH1: a family of substrate-specific activators of APC-dependent proteolysis". Science. 278 (5337): 460–3. Bibcode:1997Sci...278..460V. doi:10.1126/science.278.5337.460. PMID 9334304.
- Hsu JY, Reimann JD, Sørensen CS, Lukas J, Jackson PK (May 2002). "E2F-dependent accumulation of hEmi1 regulates S phase entry by inhibiting APC(Cdh1)". Nature Cell Biology. 4 (5): 358–66. doi:10.1038/ncb785. PMID 11988738. S2CID 25403043.
- Zachariae W, Nasmyth K (August 1999). "Whose end is destruction: cell division and the anaphase-promoting complex". review. Genes & Development. 13 (16): 2039–58. doi:10.1101/gad.13.16.2039. PMID 10465783.
- Harper JW, Burton JL, Solomon MJ (September 2002). "The anaphase-promoting complex: it's not just for mitosis any more". review. Genes & Development. 16 (17): 2179–206. doi:10.1101/gad.1013102. PMID 12208841.
- Lima M, Eloy NB, Pegoraro C, Sagit R, Rojas C, Bretz T, et al. (November 2010). "Genomic evolution and complexity of the Anaphase-promoting Complex (APC) in land plants". BMC Plant Biology. 10: 254. doi:10.1186/1471-2229-10-254. PMC 3095333. PMID 21087491.
외부 링크
- 미국 국립 의학 도서관의 아나파제 홍보+복합체(MesH)
- 전자파 데이터 뱅크(EMDB)의 아나파제 촉진 복합체의 3D 전자 현미경 구조