Strychanine 총합성
Strychnine total synthesis화학에서의 Strychnine 총합성은 복잡한 생체 분자 Strychinine의 총합성을 설명한다.1954년 로버트 번즈 우드워드 그룹이 처음으로 보고한 방법은 이 연구 분야에서 고전적인 것으로 여겨진다.[2][3][4][5]
당시 그것은 1818년 피에르 조셉 펠레티에와 조셉 비에나이메 카벤투에 의해 Strychnos Ignatii의 콩에서 Strychnine이 분리되면서 시작된 정교한 분자 구조 용해 과정으로 자연적인 결론을 형성했다.[6]그 노력의 주요 공헌자는 250개 이상의 출판물을 가진 로버트 로빈슨 경과 40년이라는 기간 동안 125개의 논문을 쓴 헤르만 레우치였다.로빈슨은 알칼로이드에 대한 연구로 1947년 노벨 화학상을 받았다.
화학적 식별의 과정은 1946년 로빈슨에 의해 출판물로 완성되었고 이후 1947년 우드워드에 의해 확인되었다.[10] 절대 구성을 확립하는 X선 구조물은 요하네스 마틴 비주보와[11][12] J. H. 로버트슨의[13] 출판물로 1947년과 1951년 사이에 이용 가능하게 되었다.[14]
우드워드는 1954년(단 3페이지), 1963년 장편(42페이지)의 스트라이크닌 합성에 관한 아주 간략한 설명을 발표했다.[16]
마그누스,[17] 오버만,[18] 쿠엔,[19][20] 라왈,[21] 보쉬,[22][23] 볼하르트,[24][25] 모리,[26][27] 시바사키,[28] 리,[29] 후쿠야마 반데르왈, 맥밀란의 연구 그룹에 의해 더 많은 방법이 존재하고 보고되고 있다.[32]합성(+-strychanine)도 알려져 있다.[33][34]레이스믹 신디사이즈는 파드와가 2007년과 2010년 안드레이드와 레이시그가 출간했다.[37]그의 1963년 출판물에서 우드워드는 분자 크기 때문에 그것은 알려진 것 중 가장 복잡한 물질이라고 로버트 로빈슨 경의 말을 인용했다.
분자
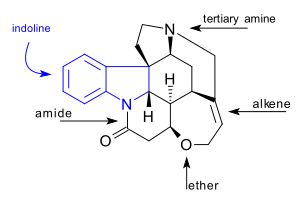
CHNO212222 Strychanine 분자는 인돌린 시스템을 포함한 7개의 고리를 포함하고 있다.3차 아민군, 아미드군, 알켄군, 에테르군 등이 있다.자연적으로 발생하는 화합물은 또한 1 쿼터리를 포함한 6개의 비대칭 탄소 원자를 가진 치랄이다.
목관합성
링 II, V 합성
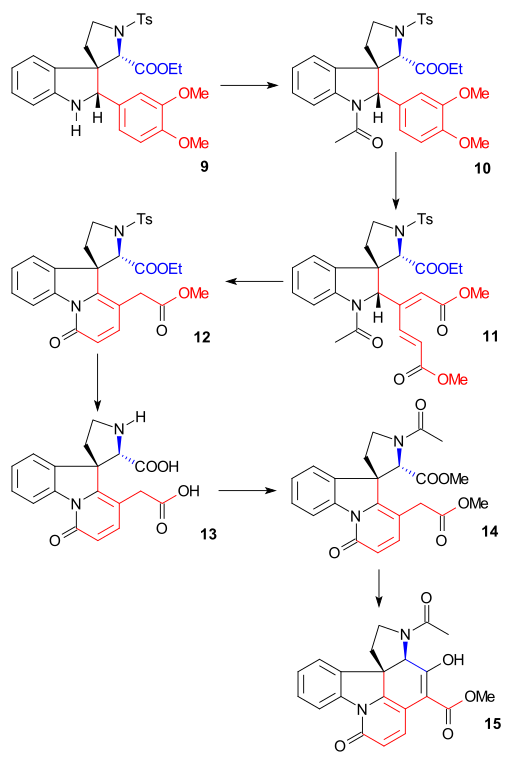
링 II의 합성은 페닐하이드라진 1과 아세토페논 파생상품 아세토바트론 2(촉매 폴리인산)를 사용하여 2-베라트리린돌레 3을 투여하는 피셔 인도레 합성을 통해 이루어졌다.베라트릴 그룹은 추가적인 전기적 치환을 위해 2개의 위치를 차단할 뿐만 아니라 스트라이크닌 골격의 일부가 될 것이다.포름알데히드와 디메틸아민)과의 만니치 반응으로 그램닌 4가 생성되었다.요오드메탄과의 알킬화는 중급 쿼터리 암모늄 소금을 니트리올 5로 핵소화성 치환한 다음 트립타민 6으로 리튬 알루미늄 하이드라이드를 줄였다.에틸글리옥실산염과 아민-카르보닐 응결은 이미네에게 7을 준다.이 이미인과 피리딘의 TsCl in pyridine에 대한 반응은 Woodward에 의해 결합된 핵종양성 에나민 공격과 공식적으로 Pictet-Spengler 반응으로 설명되었다.이 화합물은 이질성 쌍으로 형성되어야 하지만 조사되지 않은 화합물은 하나만 발견되었다.마지막으로 새로 형성된 이중 결합은 C8 수소 원자가 가장 방해받지 않는 쪽에서 접근하는 인돌린 9로 보로하이드화나트륨에 의해 감소되었다(이 양성자는 나중에 시퀀스에서 제거되며 중요하지 않다).
링 III, IV 합성
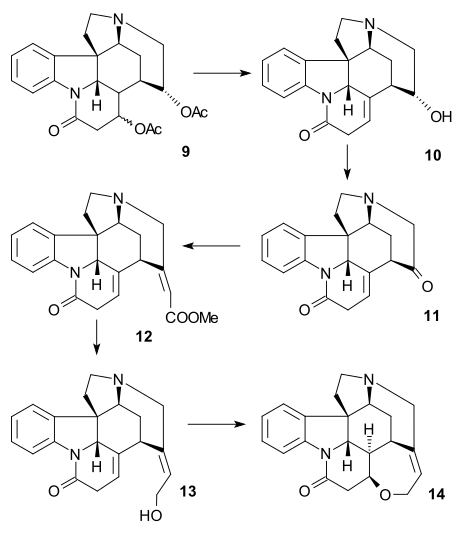
인돌린 9는 N-아세틸 화합물 10(아세트산 무수화물, 피리딘)에 아세틸화되었고, 그 후 베라트리엘 그룹은 아쿠아 아세트산에 있는 오존과 함께 링을 열어 뮤코닉 에스테르 11(두 전자 기부 메톡시드 그룹에 의해 가능)로 만들었다.이것은 우드워드가 1948년에 이미 제안한 생체영향 합성 사례다.[39]아세틸 그룹의 갈라짐과 메탄올에 HCl이 있는 에스테르 가수분해로 인해 피리돈 에스테르 12가 형성되었고, 내복성 이중 결합에 대한 엑소사이클릭 이중 결합의 추가적인 이성질화(하나의 비대칭 중심 파괴)가 이루어졌다.이후 요오드화수소와 적인(붉은 인)을 이용한 치료는 토실군을 제거하고 남은 두 에스테르군을 모두 가수 분해하여 디아시드 13을 형성했다.아세틸화 및 에스테르화(diazomethane)는 아세틸화합물 14를 생성했으며, 그 다음 메탄올에 메톡시드나트륨이 함유된 다이크만 응결로 15를 생성했다.
링 VII 합성
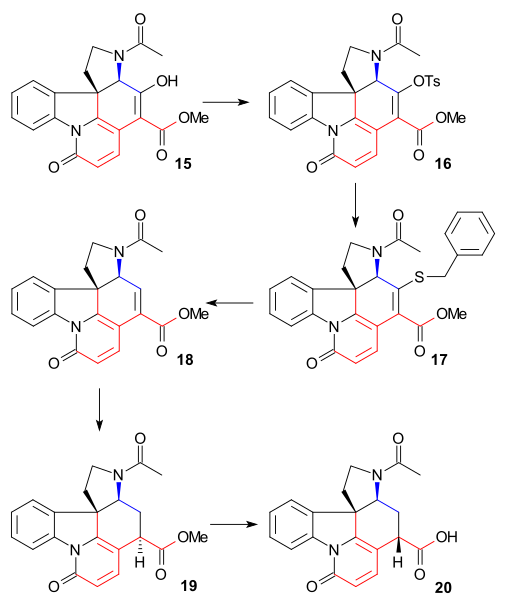
C15 알코올 그룹을 제거하기 위해 에놀 15를 16(TsCl, 피리딘)으로 변환한 다음 17(소듐 벤질머캡틴드)로 변환하여 래니 니켈과 수소에 의해 불포화 에스테르 18으로 환원하였다.탄소 위에 수소/팔라듐을 더 감소시켜 포화 에스테르 19를 제공했다.알칼리성 에스테르 가수분해와 카르복실산 20은 C14에서 경과를 동반했다.
이 특별한 화합물은 이미 Strychanine 열화 연구로부터 알려져 있다.지금까지는 모든 매개체가 인종적이었지만 이 특정 단계에서 키니딘을 이용한 치랄 분해능을 통해 치랄성이 도입되었다.
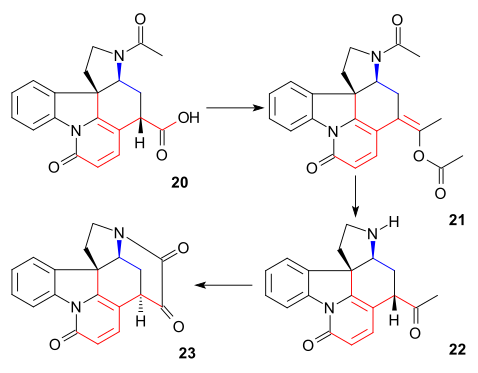
그 후 C20 탄소 원자는 아세트산 무수화물 에놀 아세테이트 21을 형성하기 위해 도입되었고, 아미노케톤 22는 염산으로 가수분해하여 얻었다.중간 23의 링 VII는 C14에서 다시 경시화를 동반한 과정인 셀레늄 이산화 탄화에 의해 폐쇄되었다.
21의 형성은 아킬화, 디프로토닝, 이산화탄소 손실로 인한 재배열, 그리고 다시 아킬화의 순서로 상상할 수 있다.
링 VI 합성
디케톤 23에 아세틸라이드 나트륨(탄소 원자 22와 23을 가져옴)을 첨가하여 알카인 24를 주었다.이 화합물은 린들러 촉매와 리튬 알루미늄 하이드라이드를 사용하여 아군 알코올 25로 감소되었으며, 26년에 나머지 케톤 그룹을 제거하였다.아군 재배열은 아세트산 브롬화수소 다음으로 아황산을 이용한 가수 분해에 의해 발생되었다.마지막 단계(----strychanine 28 처리)에서 에탄올 칼륨 수산화물로 27을 처리한 경우 히드록실 음이온에 의한 결합에서 C12-13 이중 결합 및 링 폐쇄가 재배열되었다.
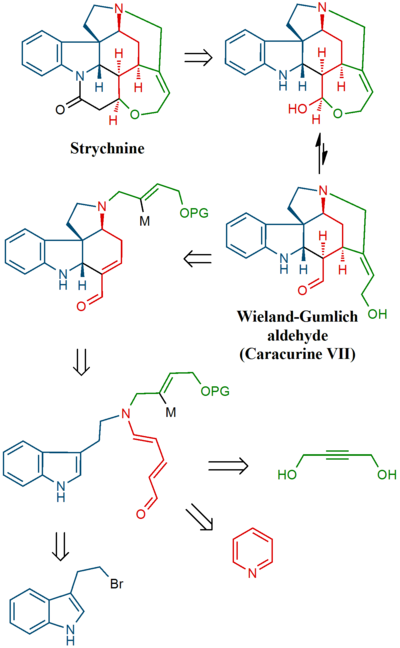
마그너스 합성
이 노력의 일환으로 Strychinine의 많은 분해물 중 하나가 먼저 합성되었다(계전기 화합물). 또한 Wieland-Gumlich 알데히드라고 불리는 또 다른 분해물로부터 몇 단계로 사용할 수 있는 화합물이 있다.마지막 다리에서는 계전기 화합물에서 Strychinine 자체가 합성되었다.
오버맨 합성
오버맨 합성(1993)은 시스-1,4-다이아세톡시사이클로펜트-2-ene의 효소 가수분해를 통해 얻은 시작 물질로 키랄 시클로펜텐테네 화합물을 취하였다.이 출발 물질은 몇 단계로 나누어 트릴킬스탄네 2로 변환되었으며, 그 후 일산화탄소(트리스(디벤질리데네아세톤) 디팔라듐(0), 트리페닐라르신)이 있는 스틸 반응에서 아릴화 1과 결합되었다.3의 내부 더블은 테르트-부틸 수산화수소를 사용하여 에폭시드로 변환되었고, 그 후 카르보닐 그룹은 PhP3=CH를2 이용한 위티그 반응에서 알켄으로 변환되었으며, TBAS 그룹은 가수 분해(TBAF)되었고, 4년에는 트라이플루오로아세타미드 그룹(NHCOCF23, NaH)으로 대체되었다.다음으로 사이클화(NaH)가 진행되어 에폭시드 링을 열었고, 아자비시클룩탄 5를 제공하는 KOH를 이용하여 트리플루오로아세틸 그룹을 제거하였다.
핵심 단계는 아민-카르보닐 응결에 의해 시작된 아자-코프-마니히 반응으로 포름알데히드를 사용하고 양적 수율에서 6을 형성했다.
마지막 순서에서 Strychnine은 Wieland-Gumlich 알데히드(10):
중간 6은 메틸 시아노포메이트를 사용하여 아세틸화되었고 7년에는 HCl / MeOH를 사용하여 두 개의 보호 그룹(테르트부틸 및 )을 제거했다.C8C13 이중 결합은 아연(MeOH/H+)을 포화 에스테르 8(혼합물)로 환원하였다.MeOH에서 메톡사이드 나트륨을 사용한 C13에서 에피머라이징은 9번 베타 에세르를 생성했는데, 이 베타 에세르 9는 디이소부틸릴루미늄 하이드라이드와 함께 비엘란트-검리히알데히드 10으로 축소되었다.말론산을 사용한 이 화합물의 (---strychanine 11)로의 변환은 이미 절차로 알려져 있었다.
쿠엔 합성
1993년 Keuhne 합성은 인종적 스트리치닌에 관한 것이다.시작 화합물 트립타민 1과 4,4-디메톡시 아크로레인 2는 아민-카르보닐 응결/시그미티방성 재배열 순서에서 단일 이산화질소로서 아세트 3에 붕소 3플루오라이드와 함께 반응했다.
알데히드 4를 공급한 과염소산 가수분해.존슨-코리-체이콥스키 반응(트리메틸설포늄 요오드화염/n-부틸리튬)은 알데히드를 에폭시드로 변환했고, 이 알데히드는 3차 아민과 함께 상황에 따라 반응하여 암모늄 소금 5(기타 사이클화 제품과 함께 오염됨)로 변환했다.감량(탄소/수소계 팔라듐)은 벤질 그룹을 알코올 6, 더 많이 제거했으며(시아노보로 무수화물), 아틸화(아세트산 무수화물/피리딘)는 에피머(C17) 혼합물로 7을 생성했다.그 후 링 III에서 8까지의 링 클로징은 리튬 비스(트리메틸릴)아미드(정확한 구성의 에피머만 사용)를 이용한 알돌 반응으로 이루어졌다.훨씬 더 많은 감량(소듐 붕수화물)과 아틸화(acylation)는 후두산성 di-acetate 9를 초래했다.
DDU 매개 제거 반응은 올레핀 알코올 10을 형성하고 후속 스월 산화에는 불안정한 아미노 케톤 11이 있다.In the final steps a Horner–Wadsworth–Emmons reaction (methyl 2-(diethy1phosphono)acetate) give acrylate ester 12 as a mixture of cis and trans isomers which could be coached into the right (trans) direction by application of light in a photochemical rearrangement, the ester group was reduced (DIBAL / boron trifluoride) to isostrychnine 13 and racEmic Strychanine 14는 Woodward 합성에 있는 것처럼 베이스로 만들어진 링 클로저에 의해 형성되었다.
1998년 치랄(---strychanine)의 Keuhne 합성에서 출발 물질은 치랄 트립토판으로부터 파생되었다.
원시합성
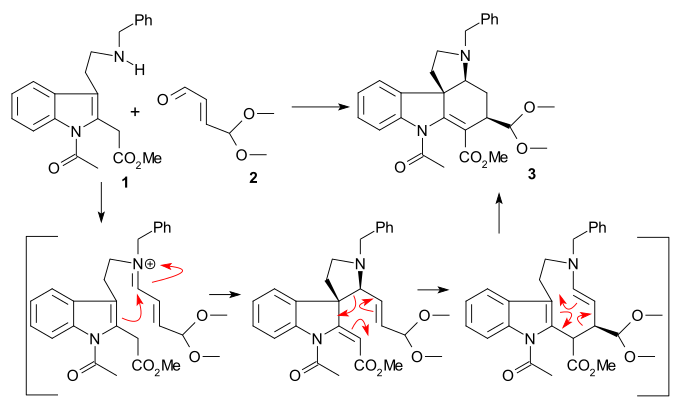
Rawal 합성(1994, 인종적)에서 아민 아민 1과 에논 2는 아민-카르보닐 응축으로 결합되었고, 그 후 트리엔 3에 메틸 클로로포름산염의 침출물이 이어졌으며, 이후 디엘-알데르 반응(벤젠 185 °C)에서 헥센 4에 반응했다.3개의 에스테르 그룹은 7개의 반응 단계(그 중 하나는 다이크만 응결)의 조합으로 메탄올이 응결된 후 5번 펜타시클릭 락탐을 형성하는 요오드토트리메틸실린을 사용하여 가수 분해되었다.C4 세그먼트 6은 TBS 제거 후 7 형성 이소스트리치닌 8의 아민 알킬화와 헥 반응에 추가되었다.
전체 수익률(10%)은 지금까지 발표된 방법 중 가장 큰 것이다.
보쉬 합성
(1999, chiral)의 보쉬 합성에서는 (1999, chiral) 1의 올레핀 그룹이 오조놀리시스(ozonolyisis)에 의해 알데히드로 변환되었고 (S)-1-페네틸아민과의 이중 환원 아미네 2가 형성되었다.페닐 대체물은 ClCOCHCLCH를23 사용하여 제거되었으며, 에논 그룹은 TMSI, HMDS, PhSCl을 사용한 그리코 제거에서, 그 다음 오존과 카바메이트를 형성하는 디이소프로필아민 3을 도입하였다.아미노 그룹은 메탄올에서 역류하여 부패한 후 (Z)-BrCHICH2=CHOTBDMS를2 사용하여 3차 아민 4에 알킬화되었다.다음으로 환원 헥 반응이 일어났고, 이어서 메톡시카르보닐화(LiHMDS, NCOMe2)가 세발자전거 5로 이어졌다.10% 황산에서 아연 분진과의 반응은 TBDMS 보호 그룹을 제거하고 니트로 그룹을 줄였으며 4번 반복 6(Epimeric 혼합물)로 한 번에 환원되는 아미노 카르보닐 사이클화를 가져왔다.MeOH에서 NaH와 함께 Wieland-Gumlich 알데히드 7 반응의 마지막 단계에서는 정확한 에피머가 제공되었고 이어서 Meoh에서 메틸에스테르를 DIBAH 감소시켰다.
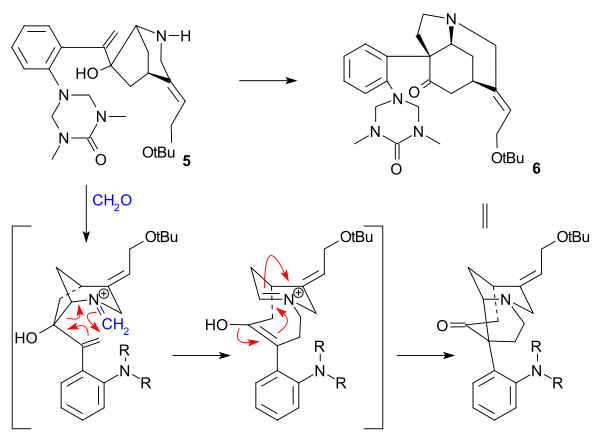
볼하르트 합성
볼하르트 합성(2000, 레이스미틱)의 핵심 반응은 아민군(KOH, MeOH/HO2 환류)을 분해한 후 세발자전거 2에 아세틸렌과 유기농코발트 화합물 CpCo(CH24,2 0 °C)를 사용한 트립타민 유도체 1을 알킨 트리머라이제이션이었다.Subsequent reaction with iron nitrate brought about a [1,8]-conjugate addition to tetracycle 3, amine alkylation with (Z)-1-bromo-4-[(tert-butyldimethylsilyl)oxy]-2-iodobut-2-ene (see Rawal synthesis) and lithium carbonate, and isomerization of the diene system (NaOiPr, iPrOH) formed enone 4. A Heck reaction as in the Rawal synthesis (palladium ac에타이트/트리페닐인산염)과 함께 피리돈 5를 형성한 아로마화 및 리튬 알루미늄 하이드라이드 감소를 동반하고 TBS 그룹 제제가 이소스트리치닌 6을 형성한다.
모리합성
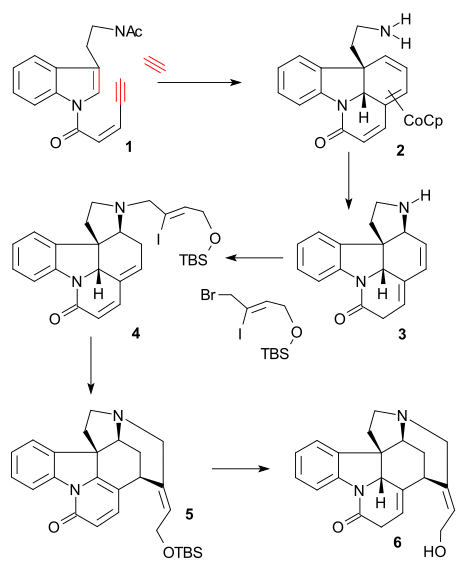
모리 합성 (-) 치랄, 2003)은 비대칭 반응 단계를 포함하는 최초의 합성이었다.Pd 촉매 반응도 대거 특징이다.그2 안에서 N-to-syl amine 1은 Pd(dba)3를 이용한 아군 비대칭 대체에서 아군 탄산염 2와 반응했고, 비대칭 리간드(S-BINAPO)는 치랄 2차 아민 3에 반응했다.다음으로 TBDMS 그룹의 탈일화는 HCl에 의해 수산화물까지, 그리고 브로마이드(PBR3)를 통해 NaCN(Natrile 4 (NaCN)Heck reaction (Pd(OAc)2 / Me2PPh) and debromination (Ag2CO3) afforded tricycle 5. LiALH4 Nitrile reduction to the amine and its Boc2O protection to boc amine 6 was then followed by a second allylic oxidation (Pd(OAc)2 / AcOH / benzoquinone / MnO2) to tetracycle 7.하이드로보레이션(9-BBN/HO22)은 알코올 8과 그에 따른 스웨른 산화 케톤 9를 투여했다.LDA / PhNTF와의2 반응은 에놀 3불산염 10을 내렸고, 알켄 11에서는 Pd(OAc)2와 PPh와의3 반응으로 3불산염을 제거했다.
11(나트륨 naphthalenide)과 아미드화의 산 염화물 3-bromoacryloyl 염화와 Detosylation 아미드와 다른 선곡표 반응 pentacycle 13을 주었다. 12(Rawal 보)화합물 14(하나 Voll와 동일해 주었다(Z)-BrCH2CICH=CH2OTBDMS과 이중 결합 이성질화(나트륨/iPrOH), 보크 그룹 deprotection(triflic 산성)과 아민 알킬 레이션을 주었다.하rdt 중간자).최종 헥 반응(15)과 TBDMS 감소가 형성됨(---isostrychanine 16).
시바사키합성
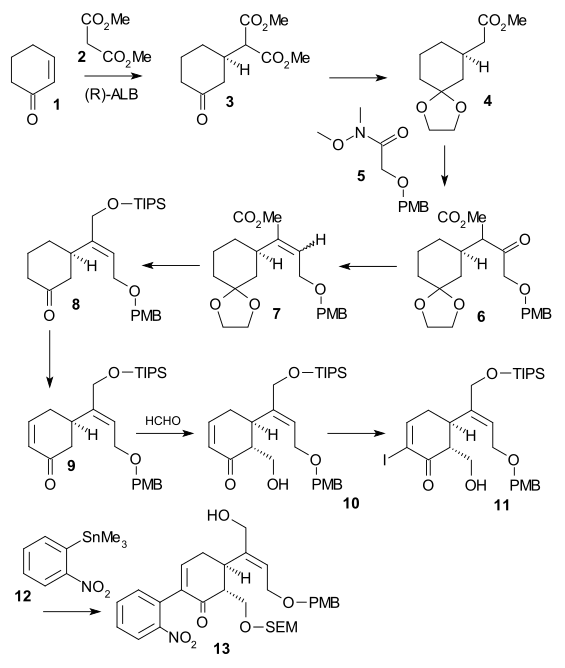
시바사키 합성(-) 치랄, 2002년)은 비대칭 반응 단계를 이용한 스트라이치닌 총합성에서 두 번째로 발표된 방법이었다.사이클로헥세논 1은 알리비스(비나프타산화물)를 이용한 비대칭 마이클 반응에서 디메틸 말론산염 2로 반응해 3을 형성했다.케톤 그룹은 아세트(2-에틸-2-메틸-1,3-디옥솔레인, TsOH)로 보호되었고 카복실 그룹은 모노에스터 4에서 제거되었다(LiCl, DMSO 140 °C).Weinreb amide 5로 C2 파편이 추가되어 LDA를 이용하여 PMB ether 6을 형성하였다.그 후 케톤을 알코올(NaBHCN3, TiCl4)로 감소시킨 후 물을 제거(DCC, CuCl)하여 알켄을 형성하였다. 알코올에 대한 에스테르 감소(DIBAL)와 그 TIPS 보호(TipsOtf, triethylamine) 후, 아세트 그룹은 케톤에서 제거(촉성 CSA)되었다.이어 에노네 9는 새구사 산화에 의해 형성되었다.알코올 10으로의 전환은 포름알데히드, 요오드화 11(다이오드, DMAP)을 이용한 무카이야마 알돌 첨가를 통해 이루어졌으며, 니트로벤젠 12단위를 통합한 스틸 커플링(Pddba23, PhAs3, CuI)이 그 뒤를 이었다.알코올 13은 SEM 보호(SEMCl,i-Pr2NET)와 TIPS 제거(HF) 후 형성되었다.
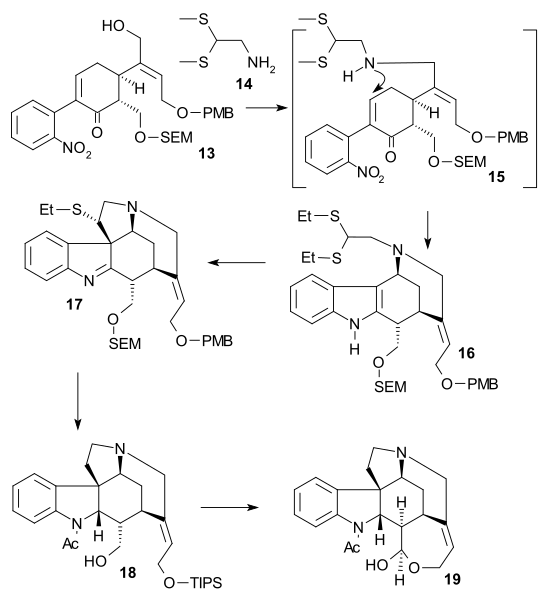
In the second part of the sequence alcohol 13 was converted to a triflate (triflic anhydride, N,N-diisopropylethylamine), then 2,2-bis(ethylthio)ethylamine 14 was added immediately followed by zinc powder, setting of a tandem reaction with nitro group reduction to the amine, 1,4-addition of the thio-amine group and amine-keto condensation to indole16. DMTSF와의 반응은 17을 형성하는 C7에서 티오늄 공격을 가했고, 그 후 이미네 그룹은 축소되었다(NaBHCN3, TiCl4), 새로운 아미노 그룹 아세틸화(아세트산 무수화물, 피리딘), 두 알콜 보호 그룹 모두 제거되었다(NaOMe / meOH), 그리고 다시 보호되었다(TIPS).이로써 에틸티오 그룹(NiCl2, NaBH4, EtOH/MeOH)을 18로 제거할 수 있었다.알콜은 패리크-도어링 산화를 이용해 알데히드로 산화됐고 TIPS 그룹 제거로 아큐레이트 비엘랑-검리히 알데히드인 (+-diaboline) 19라는 헤미아세트(+-diaboline)를 투여했다.
리합성
보드웰/리(Racesic, 2002년)가 보고한 합성은 라왈(Rawal 합성 제5호)이 이미 준비한 화합물을 생산했기 때문에 형식 합성이었다.핵심 단계는 사이클로판 1의 역전자 수요 디엘-알데르 반응으로 N,N-디에틸라닐린(식염은 유화)을 가열한 후 보로하이드나트륨/시팔산에 의한 2-3의 이중 결합 감소와 카바메이트 보호군(PDC/셀라이트)을 4로 제거하는 것이었다.
이 방법은 레이시그에 의해 논란이 된다(레이시그 합성 참조).
후쿠야마 합성
후쿠야마 합성(치랄(-), 2004)은 순환 아민 1에서 시작되었다.Chirality는 어느 시점에 전구체 중 하나의 효소 분해능에 의해 이 시작 물질에 도입되었다.Acyloin 2는 루보톰 산화 및 가수 분해에 의해 형성되었다.아세트산 납 형성 알데히드 3, 노실 그룹(티오페놀/세슘 탄산염)의 제거는 이미늄 이온 4와 함께 아민-카르보닐 응결을 유발했고, 알려진 화학 물질에 의해 비엘란-검리히 알데히드로 변환될 수 있는 경동 사이클화에서 계속 반응했다.
레이시그 합성
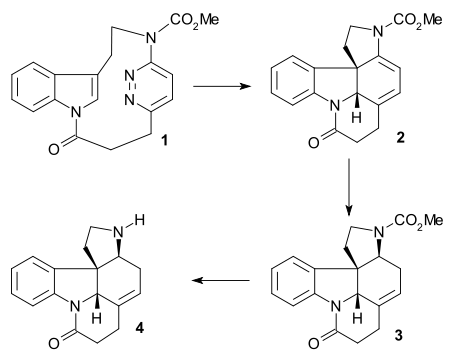
Beemelmanns & Reisig(레이시컬, 2010)가 보고한 방법은 Rawal 펜타시클(Rawal pentacycle)으로 이어지는 또 다른 공식 합성법이다(Rawal 방법의 amine 5 참조).이 방법에서는 indole 1tetracycle 2(함께 부산물로)에 단일 캐스케이드 반응 사마륨 diiodide과 HMPA.[41]레이니 nickel/ H2감소 아민 3 주었곤 원 포트 반응 클로르 의산 메틸, 디지털 지도와 테트라 에틸 암모늄 다음 MsCl, 디지털 지도와 테트라 에틸 암모늄을 사용한 다음 DBU Rawal 원하는 데 핵심적인 수소 원자를 가지고 전조 4을 주었다 바뀌었다.개미.I configuration.
중단된 경로에서 중간 2는 먼저 이미네 5로 감소되었다가 카바메이트 6으로 변환되었다가 디엔 7(Burgess 시약)으로 탈수되었고 마지막으로 8(시아노보로 무수화물)로 감소되었다.8의 수소 원자는 원치 않는 시스 관계에 있으며, 이는 같은 반응에 대해 2002년 보드웰/리가 얻은 결과와 상반된다.
반데르왈 합성
2011년 반데르왈 그룹은 6단계의 간결하고 긴 선형 시퀀스, 즉 스트라이치닌의 총합성을 보고했다.[42]아연케 반응에 이어 음이온 자전거화 반응과 탠덤 브룩 재배열/결합 추가가 특징이다.
외부 링크
참조
- ^ X-ray; Messerschmidt, M.; Scheins, S.; Luger, P. (2005). "Charge density of (−)-strychnine from 100 to 15 K, a comparison of four data sets". Acta Crystallogr B. 61 (1): 115–121. doi:10.1107/S0108768104032781. PMID 15659864.
- ^ 니콜라우, K. C.; 소렌센, E. J. (1996)전체 합성의 고전:대상, 전략, 방법.와일리, ISBN 978-3-527-29231-8
- ^ K. C. 니콜라우, 디오니시오스 부루루미스, 니콜라스 윈싱어, 필 S. Baran The Art and Science of Total Composition of the Total Composition of the Twitter Chemie International Edition 2000; 제39권 제1호, 페이지: 44-122
- ^ Bonjoch, Josep; Sole, Daniel (2000). "Synthesis of Strychnine". Chem. Rev. 100 (9): 3455–3482. doi:10.1021/cr9902547. PMID 11777429.
- ^ Proudfoot, John R. (2013). "Reaction Schemes Visualized in Network Form: The Syntheses of Strychnine as an Example". Journal of Chemical Information and Modeling. 53 (5): 1035–1042. doi:10.1021/ci300556b. PMID 23597302.
- ^ 펠러 티어, Caventou(1818년)."주surnouvel alkalai(주에 새로운 등)".Annales 드 Chimie 에 드 Physique.8:323–324.참고 항목:펠러 티어, Caventou(1819년)."Mémoire 제공하는 불행nouvelalcali vegetal((스트리 크닌)trouvé dans 라 feve 드 Saint-Ignace, 라 noix vomique, etc.(회고록은 새로운 채소 등에 스트리 크닌)성에서 발견되이그나티우스 콩, 마전자 등)"라고.Annales 드 Chimie 에 드 Physique.10:142–176.
- ^ Robinson, R. (1946). "The constitution of strychnine". Experientia. 2 (1): 1946. doi:10.1007/BF02154708. PMID 21012825.
- ^ Briggs, L. H.; Openshaw, H. T.; Robinson, Robert (1946). "Strychnine and brucine. Part XLII. Constitution of the neo-series of bases and their oxidation products". J. Chem. Soc. 1946: 903. doi:10.1039/JR9460000903.
- ^ Openshaw, H. T.; Robinson, R. (1946). "Constitution of Strychnine and the Biogenetic Relationship of Strychnine and Quinine". Nature. 157 (3988): 438. Bibcode:1946Natur.157..438O. doi:10.1038/157438a0. PMID 21024272.
- ^ Woodward, R. B.; Brehm, Warren J.; Nelson, A. L. (1947). "The Structure of Strychnine". J. Am. Chem. Soc. 69 (9): 2250. doi:10.1021/ja01201a526. PMID 20262753.
- ^ Bijvoet, Schoone and Bokhoven, Kon. Ned.Akad. Wet, 50, No 8, 51, No. 8, 52, No. 2 (1947–49)
- ^ Bokhoven, C.; Schoone, J. C.; Bijvoet, J. M. (1951). "The Fourier synthesis of the crystal structure of strychnine sulphate pentahydrate" (PDF). Acta Crystallogr. 4 (3): 275–280. doi:10.1107/S0365110X51000891.
- ^ Robertson, J. H.; Beevers, C. A. (1950). "Crystal Structure of Strychnine Hydrobromide". Nature. 165 (4200): 690–691. Bibcode:1950Natur.165..690R. doi:10.1038/165690a0. PMID 15416785.
- ^ Robertson, J. H.; Beevers, C. A. (1951). "The crystal structure of strychnine hydrogen bromide". Acta Crystallogr. 4 (3): 270–275. doi:10.1107/S0365110X5100088X.
- ^ Woodward, R. B.; Cava, Michael P.; Ollis, W. D.; Hunger, A.; Daeniker, H. U.; Schenker, K. (1954). "The Total Synthesis of Strychnine". J. Am. Chem. Soc. 76 (18): 4749–4751. doi:10.1021/ja01647a088.
- ^ Woodward, R. B.; Cava, M. P.; Ollis, W. D.; Hunger, A.; Daeniker, H. U.; Schenker, K. (1963). "The total synthesis of strychnine". Tetrahedron. 19 (2): 247–288. doi:10.1016/s0040-4020(01)98529-1.
- ^ Magnus, Philip; Giles, Melvyn; Bonnert, Roger; Kim, Chung S.; McQuire, Leslie; Merritt, Andrew; Vicker, Nigel (1992). "Synthesis of strychnine via the Wieland-Gumlich aldehyde". J. Am. Chem. Soc. 114 (11): 4403–4405. doi:10.1021/ja00037a058.
- ^ Knight, Steven D.; Overman, Larry E.; Pairaudeau, Garry (1993). "Synthesis applications of cationic aza-Cope rearrangements. 26. Enantioselective total synthesis of (−)-strychnine". J. Am. Chem. Soc. 115 (20): 9293–9294. doi:10.1021/ja00073a057.
- ^ Kuehne, Martin E.; Xu, Feng (1993). "Total synthesis of strychnan and aspidospermatan alkaloids. 3. The total synthesis of (+-)-strychnine". J. Org. Chem. 58 (26): 7490–7497. doi:10.1021/jo00078a030.
- ^ Kuehne, Martin E.; Xu, Feng (1998). "Syntheses of Strychnan- and Aspidospermatan-Type Alkaloids. 10. An Enantioselective Synthesis of (−)-Strychnine through the Wieland−Gumlich Aldehyde". J. Org. Chem. 63 (25): 9427–9433. doi:10.1021/jo9813989.
- ^ Rawal, Viresh H.; Iwasa, Seiji (1994). "A Short, Stereocontrolled Synthesis of Strychnine". J. Org. Chem. 59 (10): 2685–2686. doi:10.1021/jo00089a008.
- ^ (-)-위엘란드-구믈리히 알데히드 안젤랑트 케미 국제판 38권, 1999년호, 페이지: 395-397 다니엘 솔레, 요제프 본조흐, 실비나 가르시아 루비오, 엠마 페이드루, 조안 보쉬를 통한 슈트리치닌의 총합성
- ^ Solé, Daniel; Bonjoch, Josep; García-Rubio, Silvina; Peidró, Emma; Bosch, Joan (2000). "Enantioselective Total Synthesis of Wieland-Gumlich Aldehyde and (−)-Strychnine". Chemistry: A European Journal. 6 (4): 655–665. doi:10.1002/(SICI)1521-3765(20000218)6:4<655::AID-CHEM655>3.0.CO;2-6.
- ^ Eichberg, Michael J.; Dorta, Rosa L.; Lamottke, Kai; Vollhardt, K. Peter C. (2000). "The Formal Total Synthesis of (±)-Strychnine via a Cobalt-Mediated [2 + 2 + 2]Cycloaddition". Org. Lett. 2 (16): 2479–2481. doi:10.1021/ol006131m. PMID 10956526.
- ^ Eichberg, Michael J.; Dorta, Rosa L.; Grotjahn, Douglas B.; Lamottke, Kai; Schmidt, Martin; Vollhardt, K. Peter C. (2001). "Approaches to the Synthesis of (±)-Strychnine via the Cobalt-Mediated [2 + 2 + 2] Cycloaddition: Rapid Assembly of a Classic Framework". J. Am. Chem. Soc. 123 (38): 9324–9337. doi:10.1021/ja016333t. PMID 11562215.
- ^ Nakanishi, Masato; Mori, Miwako (2002). "Total Synthesis of (−)-Strychnine". Angewandte Chemie International Edition. 41 (11): 1934–1936. doi:10.1002/1521-3773(20020603)41:11<1934::AID-ANIE1934>3.0.CO;2-F. PMID 19750638.
- ^ Mori, Miwako; Nakanishi, Masato; Kajishima, Daisuke; Sato, Yoshihiro (2003). "A Novel and General Synthetic Pathway to Strychnos Indole Alkaloids: Total Syntheses of (−)-Tubifoline, (−)-Dehydrotubifoline, and (−)-Strychnine Using Palladium-Catalyzed Asymmetric Allylic Substitution". J. Am. Chem. Soc. 125 (32): 9801–9807. doi:10.1021/ja029382u. PMID 12904045.
- ^ Ohshima, Takashi; Xu, Youjun; Takita, Ryo; Shimizu, Satoshi; Zhong, Dafang; Shibasaki, Masakatsu (2002). "Enantioselective Total Synthesis of (−)-Strychnine Using the Catalytic Asymmetric Michael Reaction and Tandem Cyclization". J. Am. Chem. Soc. 124 (49): 14546–14547. doi:10.1021/ja028457r. PMID 12465959.
- ^ Bodwell, Graham J.; Li, Jiang (2002). "A Concise Formal Total Synthesis of (±)-Strychnine by Using a Transannular Inverse-Electron-Demand Diels–Alder Reaction of a [3](1,3)Indolo[3](3,6)pyridazinophane". Angewandte Chemie International Edition. 41 (17): 3261–3262. doi:10.1002/1521-3773(20020902)41:17<3261::AID-ANIE3261>3.0.CO;2-K.
- ^ Kaburagi, Y; Tokuyama, H; Fukuyama, T (2004). "Total synthesis of (−)-strychnine". J. Am. Chem. Soc. 126 (33): 10246–10247. doi:10.1021/ja046407b. PMID 15315428.
- ^ Martin, David B. C.; Vanderwal, Christopher D. (2011). "A synthesis of strychnine by a longest linear sequence of six steps". Chemical Science. 2 (4): 649. doi:10.1039/C1SC00009H.
- ^ Jones, Spencer B.; Simmons, Bryon; Mastracchio, Anthony; MacMillan, David W. C. (2011). "Collective synthesis of natural products by means of organocascade catalysis". Nature. 475 (7355): 183–188. doi:10.1038/nature10232. PMC 3439143. PMID 21753848.
- ^ Knight, Steven D.; Overman, Larry E.; Pairaudeau, Garry (1995). "Asymmetric Total Syntheses of (−)- and (+)-Strychnine and the Wieland-Gumlich Aldehyde". J. Am. Chem. Soc. 117 (21): 5776–5788. doi:10.1021/ja00126a017.
- ^ 계산되지 않음:길버트 황새의 미발표 방법, 이탈리아 이스치아 포브 이스키아 유기화학학교 강의, 1992년 9월.
- ^ Zhang, Hongjun; Boonsombat, Jutatip; Padwa, Albert (2007). "Total Synthesis of (±)-Strychnine via a [4 + 2]-Cycloaddition/Rearrangement Cascade". Org. Lett. 9 (2): 279–282. doi:10.1021/ol062728b. PMC 2587098. PMID 17217284.
- ^ Sirasani, Gopal; Paul, Tapas; William Dougherty, Jr.; Kassel, Scott; Andrade, Rodrigo B. (2010). "Concise Total Syntheses of (±)-Strychnine and (±)-Akuammicine". The Journal of Organic Chemistry. 75 (10): 3529–3532. doi:10.1021/jo100516g. PMID 20408591.
- ^ Beemelmanns, C.; Reissig, H.-U. (2010). "A Short Formal Total Synthesis of Strychnine with a Samarium Diiodide Induced Cascade Reaction as the Key Step". Angewandte Chemie International Edition. 49 (43): 8021–8025. doi:10.1002/anie.201003320. PMID 20848626.
- ^ R. 로빈슨 "스트라이크닌, 브루신, 토머스 프로그의 분자 구조. 조직. 화학, 1952; 1,2
- ^ Woodward, R. B. (1948). "Biogenesis of the Strychnos Alkaloids". Nature. 162 (4108): 155–156. Bibcode:1948Natur.162..155W. doi:10.1038/162155a0. PMID 18871488.
- ^ Cannon, J. S.; Overman, L. E. (2012). "Is There No End to the Total Syntheses of Strychnine? Lessons Learned in Strategy and Tactics in Total Synthesis". Angew. Chem. Int. Ed. 51 (18): 4288–4311. doi:10.1002/anie.201107385. PMC 3804246. PMID 22431197.
- ^ Szostak, M.; Procter, D. J. (2011). "Concise Syntheses of Strychnine and Englerin A: the Power of Reductive Cyclizations Triggered by Samarium Iodide". Angewandte Chemie International Edition. 50 (34): 7737–7739. doi:10.1002/anie.201103128. PMID 21780264.
- ^ Martin, David B. C.; Vanderwal, Christopher D. (2011). "A synthesis of strychnine by a longest linear sequence of six steps". Chemical Science. 2 (4): 649. doi:10.1039/C1SC00009H.