무카이야마알돌 덧셈
Mukaiyama aldol addition| 유혹의 손길 |
|---|
 알데히드(R1 = 알킬, 아릴) 또는 공식화(R1 = OR) |
 실릴 에톨 에테르(R1 = 알킬, 아릴, H; R2 = 알킬, 아릴, H, OR, SR) |
무카이야마 알돌 첨가물은 실릴 에놀 에테르와 알데히드 또는 포메이트 사이의 유기반응과 일종의 알돌 반응이다.[1] 이 반응은 1973년 무카이야마 데루아키(1927~2018년)에 의해 발견되었다.[2] 그의 반응제 선택은 알데히드와 케톤 사이의 교차 알돌 반응이나 알데히드의 자가 응축 없이 다른 알데히드를 허용한다. 이러한 이유로 그 반응은 유기적 합성에 광범위하게 사용된다.
일반 반응 방식
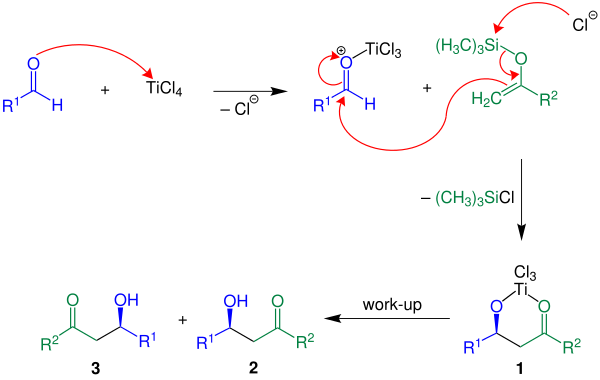
무카이야마 알돌 첨가제는 카보닐 화합물에 에놀 사일렌을 첨가한 루이스산 매개 첨가물이다. 이 반응에는 다양한 유기 그룹이 있는 화합물을 사용할 수 있다(고정 참조).[3] 치랄 촉매가 없는 기본 버전(R2 = H)은 아래와 같다.
에나토머의 인종적 혼합물이 만들어진다. 만약 Z- 또는 E-enol 사일런스를 이 반응에 사용할 경우, 네 가지 제품이 혼합되어 두 명의 레이싱 메이트가 생성된다.
항-이질-이질-이질-이질-이질-이질-이질-이질-이질-이질-이질-이질-이질-이질-이질-이질-이질-이질-이질-이질
전형적인 반응은 시클로헥사논의 실릴 에톨 에테르와 벤츠알데히드의 반응이다. 상온에서 그것은 세레오(63%)와 에리스로(19%) β-히드록시케톤과 엑소사이클릭 에논 응축제의 6%를 이질화합물로 만든다. 원래 범위에서는 루이스산(티타늄 테트라클로라이드)이 스토오치오메트리얼 양에 사용되었지만, 진정한 촉매 시스템도 존재한다. 그 반응은 비대칭 합성에도 최적화되어 있다.
메커니즘
아래에는 반응 메커니즘이 R2 = H:와 함께 표시된다.
인용된 예에서 루이스 산 TiCl을4 사용한다. 먼저 루이스산은 알데히드 성분을 활성화한 뒤 에놀 실레인과 활성알데히드 사이에 탄소-탄소 결합 형성이 일어난다. 클로로실레인이 손실되면 화합물 1이 만들어진다. 2와 3의 경주 동료인 원하는 제품은 수성 작업으로 얻는다.[3]
범위
두 케톤과 관련된 대표적인 반응은 에놀과 아세톤으로서의 아세토페논 사이에서 다음과 같다.[4]
이런 유형의 케톤 반응은 더 높은 반응 온도를 필요로 한다. 이 작품을 위해 무카이야마는 1966년 게오르크 위틱이 석판화 이미인과 교차한 알돌 반응에 대해 행한 초기 작품에서 영감을 받았다.[5][6] 리튬 에놀레이트 알돌반응과의 경쟁작품은 1973년 허버트 오에 의해서도 출판되었다. 집이다.[7]
무카이야마는 택솔 총합성(1999)에 케틴 실릴 아세탈과 과잉 마그네슘 브롬화 두 가지를 첨가하여 고용했다.[8][9]
비대칭 촉매 공정에서 치랄 루이스산 단지와 루이스 기지의 활용은 무카이야마 알돌반응의 사용량이 가장 빠르게 증가하고 있는 분야다.[3]
참조
- ^ Mukaiyama, T.; Kobayashi, S. (1994). "Tin(II) Enolates in the Aldol, Michael, and Related Reactions". Org. React. 46: 1. doi:10.1002/0471264180.or046.01. ISBN 0471264180.
- ^ 새로운 알돌형 반응 무카이야마 테루아키, 나라사카 고이치, 반노 화학 편지 제2권(1973), 도이 9번 페이지 1011–1014, 도이:10.1246/cl.1973.1011).
- ^ a b c Kürti, László; Czakó, Barbara (2005). Strategic applications of named reactions in organic synthesis : background and detailed mechanisms. Elsevier Academic Press. pp. 298–299. ISBN 978-0-12-429785-2.
- ^ 유기합성체, 콜. 제8권, 페이지 323호(1993); 제65권, 페이지 6(1987). http://www.orgsynth.org/orgsyn/pdfs/CV8P0323.pdf
- ^ Wittig, G.; Suchanek, P. (January 1966). "Über gezielte aldokondensationen—II". Tetrahedron. 22: 347–358. doi:10.1016/S0040-4020(01)82193-1.
- ^ 방향 알돌 응축: β-페닐신나말데히드 유기 합성물, 콜론 제6권, 제901권(1988); 제50권, 제66권(1970). G. 위티그 A 헤세, 알란 Y. 테라니시와 허버트 O. 하우스 http://www.orgsynth.org/orgsyn/prep.asp?prep=cv6p0901
- ^ House, Herbert O.; Crumrine, David S.; Teranishi, Allan Y.; Olmstead, Hugh D. (May 1973). "Chemistry of carbanions. XXIII. Use of metal complexes to control the aldol condensation". Journal of the American Chemical Society. 95 (10): 3310–3324. doi:10.1021/ja00791a039.
- ^ Mukaiyama, Teruaki; Shiina, Isamu; Iwadare, Hayato; Saitoh, Masahiro; Nishimura, Toshihiro; Ohkawa, Naoto; Sakoh, Hiroki; Nishimura, Koji; Tani, Yu-ichirou; Hasegawa, Masatoshi; Yamada, Koji; Saitoh, Katsuyuki (4 January 1999). "Asymmetric Total Synthesis of Taxol\R". Chemistry - A European Journal. 5 (1): 121–161. doi:10.1002/(SICI)1521-3765(19990104)5:1<121::AID-CHEM121>3.0.CO;2-O.
- ^ TBS = t-butyldimethyl, Bn = benzyl, PMB = p-methoxybenzyl 에테르