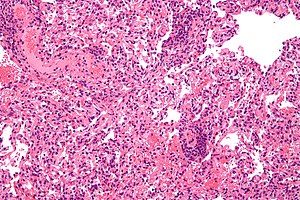
이식 거부
Transplant rejection| 이식 거부 | |
|---|---|
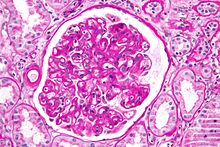
 | |
| 폐 이식 거부반응을 보여주는 현미경 사진이야폐 조직 검사.H&E 염색. | |
| 전문 | 면역학 |
| 치료 | 면역억제제 |
이식 거부반응은 이식된 조직이 수용자의 면역체계에 의해 거부반응을 일으켜 이식된 조직을 파괴할 때 발생한다.이식거부반응은 기증자와 수용자 간의 분자유사성을 [1]결정하고 이식 후 면역억제제를 사용함으로써 감소시킬 수 있다.
이식 거부 유형
이식 거부반응은 과급성, 급성, [2]만성의 세 가지 유형으로 나눌 수 있다.이러한 유형은 수용자의 면역체계가 얼마나 빨리 활성화되는지와 [3]관련된 면역의 특정 측면 또는 측면에 따라 구별됩니다.
초급성 거부
초급성 거부반응은 이식 [4]후 몇 분에서 몇 시간 안에 나타나는 거부반응의 한 형태이다.그것은 기증자의 [5]장기에 있는 항원을 인식하는 수용체에 이미 존재하는 항체의 존재에 의해 야기된다.이들 항원은 이식된 장기 내 혈관의 내피 라이닝에 위치하며 항체가 결합하면 보체계가 [6]빠르게 활성화된다.혈전증 및 후속 이식편 괴사를 통한 돌이킬 수 없는 손상이 예상된다.[7]이식된 조직은 작동하지 않고 면역체계가 외부 [8]조직에 작용하기 때문에 고열과 불안을 초래할 수 있다.
과급성 거부반응에 2차적인 이식편 부전은 [4]공여조직에 대한 항체에 대한 이식 전 스크리닝을 개선한 결과 발생률이 유의하게 감소하였다.이 항체들은 이전 이식, 이전 수혈 또는 임신에서 항체를 형성할 수 있지만, 초급성 거부반응은 ABO 혈액형 [6]항원에 대한 항체에서 가장 흔하게 발생한다.따라서, ABO 혈액형이 다른 개인들 간의 이식은 일반적으로 매우 어린 아이들(일반적으로 12개월 미만, 그러나 종종 완전히 발달된 면역 [10]체계를 가지고 있지 않은 24개월[9])에서 추구될 수 있지만, 일반적으로 피한다.장기 부족과 장기 이식 대기자 명단에 올라 있는 것과 관련된 질병과 사망률 또한 노년기와 [11]성인의 ABO 호환 이식에 대한 관심을 증가시켰다.
급성 거부반응
급성 거부반응은 몇 주에서 몇 달 사이에 발생하는 거부반응의 범주이며,[6][8] 대부분의 증상은 이식 후 처음 3개월에서 1년 사이에 발생한다.초급성 거부반응과는 달리, 백혈구의 서브셋인 림프구가 이식된 장기/[12]이식물의 항원을 인식하기 시작하면서 급성 거부반응은 두 개의 뚜렷한 면역학적 메커니즘에서 발생하는 것으로 생각된다.이러한 인식은 T세포에서 [13]발견되는 T세포 수용체에 제시되는 세포 표면의 단백질인 주요 조직적합성 복합체(MHC) 때문에 일어난다.인간에게서, 이것은 인간 백혈구 항원(HLA[13]) 체계로 알려져 있고 17,000개 이상의 HLA 대립 유전자 또는 유전적 변이가 설명되어 두 사람이 동일한 대립 유전자를 [14]갖는 것은 매우 드문 일이다.작은 조직적합성 항원으로 알려진 다른 비 HLA 단백질은 존재하지만 다수의 비 HLA 단백질이 [15]일치하지 않는 한 일반적으로 급성 거부반응을 일으킬 수 없다.따라서 (ABO 그룹 매칭과 더불어) HLA 매칭은 급성 [16]거부반응을 방지하는 데 매우 중요합니다.
T세포에 의한 이러한 인식 과정은 직간접적으로 일어날 수 있으며 각각 [6]급성 세포와 급성 체액 거부반응을 초래할 수 있다.직접 알로레인지란 신체의 항원 제시 세포(APC)인 수지상 세포가 기증자 조직에서 림프 조직(림프상 난포 및 림프절)으로 이동하여 MHC 펩타이드를 수용자 [17]림프구에 제시하는 이식 면역학 내 현상이다.이에 비해 간접적 알로레인지(Alorecognition)는 외래 [18]항원이 면역체계에 의해 어떻게 인식되는지와 더 유사하다.수용자의 수상세포는 순환 중이든 림프조직이든 기증자 조직 [18]자체든 간에 기증자 조직으로부터 펩타이드와 마주친다.직접적인 항원 제시의 결과는 아니기 때문에, 이것들은 반드시 온전한 MHC 분자는 아닐 수 있지만, 대신 수용체와 충분히 다른 것으로 간주되는 다른 단백질은 [18]반응을 일으킬 수 있다.이 과정은 2차적으로 진행되는 [2]펩타이드에 반응하기 위한 T세포의 프라이밍으로 이어진다.수용자 APC가 완전히 온전한 기증자 [17]MHC를 나타내는 세 번째 반직접 경로가 설명되었지만 급성 거부반응에 대한 상대적 기여는 잘 [15]알려져 있지 않다.
급성 세포 거부반응은 세포독성 T세포가 세포자멸 또는 세포사멸을 직접적으로 [4][6]야기할 뿐만 아니라 더 많은 림프구를 모집하기 위해 사이토카인을 분비하기 시작하는 세포독성 T세포에 의해 MHC가 일치하지 않는 것을 직접적으로 인지한 후에 발생한다.기증자와 수용자 간의 MHC 차이가 클수록 이식편을 [6]손상시키기 위해 세포독성 T세포가 모집되며, 이는 고형 장기 이식 시 생체검사를 통해 나타날 수 있으며, 림프구 침윤이 증가하여 급성 [15]세포 거부반응이 더욱 심각함을 나타낸다.급성 체액 거부반응은 보통 수용체 도우미 [6]T세포에서 발생하는 간접적인 알로케이션에 의해 시작되는 과정이다.이러한 도우미 T 세포는 기증자 특이 항체를 [4]만들 수 있는 B 세포의 발달에 중요한 역할을 한다.항체는 기증자 이식편 안에 퇴적되어 림프구로부터 분리된 백혈구의 일종인 호중구와 함께 항체 매개 세포독성과 함께 [6]보체 캐스케이드의 활성화를 이끈다.
유전적으로 일란성 쌍둥이를 제외하고, 급성 거부반응은 어느 [16]정도 예상될 것이다.면역억제요법의 발달로 이식을 위태롭게 할 수 있는 임상적으로 유의한 급성 거부반응의 비율이 현저하게 감소하였다.신장 이식을 예로 들면, 급성 거부반응률은 1970년대 50% 이상에서 10-20%[19]로 감소했습니다.급성 거부반응의 단발성 발작들은, 즉시 치료될 때, 이식을 위태롭게 해서는 안 된다. 하지만, 반복되는 발작들은 만성 [16]거부반응으로 이어질 수 있다.
만성 거부
만성 거부반응은 수개월에 걸쳐 이식편 파괴로 이어지는 음흉한 거부반응의 한 형태이지만, 대부분 조직 이식 [12]후 몇 년이 지난 후이다.만성 거부반응의 메커니즘은 아직 완전히 이해되지 않았지만, 이전의 급성 거부반응이 만성 [6]거부반응의 발달에 대한 주요 임상예측인 것으로 알려져 있다.특히, 발병률은 심각하거나 지속적인 급성 거부반응에 따라 증가하는 반면, 다시 기선으로 기능하는 급성 거부반응은 이식편 [20][21]생존에 큰 영향을 미치지 않는다.만성 거부반응은 일반적으로 혈관 손상 또는 후속 섬유화를 [22]수반하는 실질 손상과 관련이 있는 것으로 생각됩니다.이러한 과정에서 면역체계의 정확한 기여는 알려지지 않았지만, 알로레인지의 간접 경로와 관련 항체 형성이 특히 [6]관여하는 것으로 보인다.
만성 거부반응을 검사할 때, 그것은 다른 장기에 광범위하게 다양한 영향을 미친다는 것을 주목하는 것이 중요하다.이식 후 5년이면 폐 이식의 80%, 심장 이식의 60%, 신장 이식의 50%가 영향을 받습니다. 반면 간 이식은 [20]10%만 영향을 받습니다.따라서, 만성 거부반응은 대부분의 폐 이식 [23][24]환자들에게서 장기 이식을 설명하는데, 이는 다른 주요 장기 [25]이식에 비해 절반 정도인 약 4.7년의 중간 생존 기간이다.다른 원인에 기인하지 않는 기류 장애는 기관지염 폐색 증후군(BOS)으로 분류되며, 강제 호기량(FEV)이1 [26]최소 20% 이상 지속적으로 감소하는 것으로 확인된다.먼저 알려진 것은 림프구에 의한 침윤, 상피세포 손상, 염증성 병변 및 흉터 [27]조직을 형성하는 단백질을 증식 및 분비하는 섬유아세포와 근섬유아세포의 모집이다.간 이식에서도 비슷한 현상을 볼 수 있는데, 섬유화는 간 내 담관 파괴에 이차적인 황달로 이어지며, 소실 담관 [28]증후군이라고도 알려져 있다.
비접착성으로 인한 거부
이식 거부반응의 한 가지 주된 이유는 규정된 면역억제제 요법에 대한 비접착성이다.이것은 특히 청소년 [29]수급자의 경우로,[29] 비점착률이 50%에 육박하는 경우도 있습니다.
플로리다 주립 대학의 마이클 O. 킬리언 박사와 플로리다 대학의 디판카 굽타 박사가 2022년 4월 소아 이식에 발표한 파일럿 연구는 청소년 심장 이식 환자들 사이에서 비동기 직접 관찰 치료 모바일 건강 애플리케이션의 수용 가능성과 타당성을 연구했다.연구 대상 환자들은 진료팀과 주고받은 비동기 비디오 메시지와 채팅 메시지를 포함하는 이모차 헬스(emocha Health)의 디지털 약물 고수 프로그램을 이용했다.연구를 완료한 환자는 90.1%의 접착률을 달성했습니다.연구진은 최초 발견을 확인하기 위해서는 추가적인 무작위 실험이 필요하다고 지적했다.그러나 소아환자들의 약물 복용을 지원할 수 있는 선택지가 거의 없다는 점을 고려하면 결과는 매우 유망했다.
거부 검출
급성 거부반응 진단은 임상 데이터(환자 증상과 증상)에 의존하지만 혈액이나 조직 생검과 같은 실험실 데이터도 필요합니다.실험실 병리학자는 일반적으로 세 가지 주요 조직학적 징후를 찾는다. (1) 침투 호산구, 혈장 세포 및 호중구, 특히 텔테일러블 비율로 동반되는 침투 T 세포, (2) 이식된 조직 유형에 따라 변화하는 조직 해부학의 구조적 손상, (3) 혈관에 대한 손상이다.그러나 조직 생검의 제한과 침습적 시술의 [31][32][33]위험/복잡성으로 인해 조직 생검이 제한됩니다.생체 내 방사선 라벨이 부착된 면역 세포의 세포 자기공명영상(MRI)은 유전자 발현 프로파일링(GEP)과 유사하게 비침습적 [34][35]검사를 제공할 수 있다.
거부 처리
이 섹션은 확인을 위해 추가 인용문이 필요합니다.2020년 6월 (이를 에 대해 설명합니다) |
초급성 거부반응은 심각하고 몇 분 안에 나타나기 때문에 즉각적인 치료: 조직을 제거하는 것이다.급성 거부반응은 하나 또는 몇 가지 전략으로 치료된다.치료에도 불구하고 거부반응은 여전히 [36]이식 실패의 주요 원인이다.흡입된 시클로스포린은 폐 이식의 만성 거부반응을 지연 또는 방지하기 위해 조사되고 있지만 만성 거부반응은 일반적으로 돌이킬 수 없고 치료에 잘 적응하지 못하는 것으로 간주된다.
면역 억제 요법
단시간 고용량 코르티코스테로이드를 도포하고 반복할 수 있다.삼중 요법은 칼시뉴린 억제제와 항증식제를 첨가한다.칼시뉴린 억제제 또는 스테로이드제가 금지된 경우에는 mTOR 억제제를 사용한다.
면역억제제:
항체 기반 치료법
면역억제요법에 선택된 면역성분에 특이적인 항체를 첨가할 수 있다.한때 거부반응을 막기 위해 사용됐지만 여전히 심각한 급성 거부반응을 치료하기 위해 종종 사용되는 모노클로널 항체 OKT3는 일반적으로 심각한 사이토카인 방출 증후군과 이식 후 림프 증식 장애를 일으키기 때문에 인기가 떨어졌다. (OKT3는 명명된 환자만 사용할 수 있다.)
항체제:
- 모노클로널항IL-2Rα수용체항체
- 모노클로널항IL-6R수용체항체
- 폴리클론항T세포항체
- 모노클로널항CD20항체
혈액이식
면역억제 또는 항체치료에 내성이 있는 경우는 이식된 조직에 특이적인 항체분자를 제거하기 위해 광페레시스 또는 체외광면역치료(ECP)로 처리되는 경우가 있다.
골수 이식
골수이식은 이식 대상자의 면역체계를 기증자의 면역체계로 대체할 수 있고, 이식자는 거부반응 없이 새로운 장기를 받아들인다.골수의 조혈모세포(면역계를 형성하는 백혈구를 포함한 고갈된 혈액세포를 보충하는 줄기세포의 저장고)는 장기를 기증한 개인 또는 일란성 쌍둥이 또는 복제 세포여야 한다.그러나 골수와 함께 들어온 성숙한 림프구가 새로운 숙주 조직을 이물질로 인식하고 파괴하는 이식편 대 숙주 질환(GVHD)의 위험이 있다.
유전자 치료
유전자 치료는 사용될 수 있는 또 다른 방법이다.이 방법에서는, 신체가 이식을 거부하게 하는 유전자가 비활성화 될 것이다.연구는 여전히 진행 중이며,[37][38][39][40] 현재까지 환자를 치료하기 위해 유전자 치료법이 사용되고 있지 않다.현재의 연구는 CD4와 CD8 T [41]세포를 통해 동종이식 거부반응을 중재하는 Th1과 Th17에 초점을 맞추는 경향이[citation needed] 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ Frohn C, Fricke L, Puchta JC, Kirchner H (February 2001). "The effect of HLA-C matching on acute renal transplant rejection". Nephrology, Dialysis, Transplantation. 16 (2): 355–360. doi:10.1093/ndt/16.2.355. PMID 11158412.
- ^ a b Moreau A, Varey E, Anegon I, Cuturi MC (November 2013). "Effector mechanisms of rejection". Cold Spring Harbor Perspectives in Medicine. 3 (11): a015461. doi:10.1101/cshperspect.a015461. PMC 3808773. PMID 24186491.
- ^ Moreau A, Varey E, Anegon I, Cuturi MC (November 2013). "Effector mechanisms of rejection". Cold Spring Harbor Perspectives in Medicine. 3 (11): a015461. doi:10.1101/cshperspect.a015461. PMC 3808773. PMID 24186491.
- ^ a b c d Chang YC (2021-01-01). "The surgical and immunosuppressive basis for infections in the pediatric solid organ transplant recipient". In Steinbach WJ, Green MD, Michaels MG, Danziger-Isakov LA (eds.). Pediatric Transplant and Oncology Infectious Diseases. Philadelphia: Elsevier. pp. 1–9.e3. doi:10.1016/B978-0-323-64198-2.00010-5. ISBN 978-0-323-64198-2. S2CID 228907807.
- ^ Harmon WE (2010-01-01). "Chapter 41 - Pediatric Renal Transplantation". In Himmelfarb J, Sayegh MH (eds.). Chronic Kidney Disease, Dialysis, and Transplantation (Third ed.). Philadelphia: W.B. Saunders. pp. 591–608. doi:10.1016/B978-1-4377-0987-2.00041-8. ISBN 978-1-4377-0987-2.
- ^ a b c d e f g h i j Mak TW, Saunders ME, Jett BD, eds. (2014-01-01). "Chapter 17 - Transplantation". Primer to the Immune Response (Second ed.). Boston: Academic Cell. pp. 457–486. doi:10.1016/B978-0-12-385245-8.00017-0. ISBN 978-0-12-385245-8.
- ^ Dharnidharka VR (2019-01-01). "43 - Pediatric Renal Transplantation". In Himmelfarb J, Ikizler TA (eds.). Chronic Kidney Disease, Dialysis, and Transplantation (Fourth ed.). Philadelphia: Elsevier. pp. 661–675.e7. doi:10.1016/B978-0-323-52978-5.00043-4. ISBN 978-0-323-52978-5. S2CID 81475473.
- ^ a b Vitak K (2014-01-01). "Chapter 14 - Organ Transplantation". In Paz JC, West MP (eds.). Acute Care Handbook for Physical Therapists (Fourth ed.). St. Louis: W.B. Saunders. pp. 335–356. doi:10.1016/B978-1-4557-2896-1.00014-7. ISBN 978-1-4557-2896-1.
- ^ West LJ, Pollock-Barziv SM, Dipchand AI, Lee KJ, Cardella CJ, Benson LN, Rebeyka IM, Coles JG (March 2001). "ABO-incompatible heart transplantation in infants". The New England Journal of Medicine. 344 (11): 793–800. doi:10.1056/NEJM200103153441102. PMID 11248154.
- ^ West LJ (October 2011). "ABO-incompatible hearts for infant transplantation". Current Opinion in Organ Transplantation. 16 (5): 548–554. doi:10.1097/MOT.0b013e32834a97a5. PMID 21836514. S2CID 26070409.
- ^ Subramanian V, Ramachandran S, Klein C, Wellen JR, Shenoy S, Chapman WC, Mohanakumar T (August 2012). "ABO-incompatible organ transplantation". International Journal of Immunogenetics. 39 (4): 282–290. doi:10.1111/j.1744-313x.2012.01101.x. PMID 22339811. S2CID 41947505.
- ^ a b Justiz Vaillant AA, Mohseni M (2022). "Chronic Transplantation Rejection". StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 30571056. Retrieved 2022-03-16.
- ^ a b Delves PJ. "Human Leukocyte Antigen (HLA) System - Immunology; Allergic Disorders". Merck Manuals Professional Edition. Merck & Co. Retrieved 30 September 2020.
- ^ Frenet EM, Scaradavou A (2019-01-01). "Chapter 32 - Human Leukocyte Antigens". In Shaz BH, Hillyer CD, Gil MR (eds.). Transfusion Medicine and Hemostasis (Third ed.). Elsevier. pp. 191–197. doi:10.1016/B978-0-12-813726-0.00032-5. ISBN 978-0-12-813726-0. S2CID 91582896.
- ^ a b c Menon MC, Cravedi P, El Salem F (2017-01-01). "Chapter 32 - Acute Cellular Rejection". In Orlando G, Remuzzi G, Williams DF (eds.). Kidney Transplantation, Bioengineering and Regeneration. Academic Press. pp. 461–474. doi:10.1016/B978-0-12-801734-0.00032-1. ISBN 978-0-12-801734-0.
- ^ a b c Justiz Vaillant AA, Misra S, Fitzgerald BM (2022). "Acute Transplantation Rejection". StatPearls. Treasure Island (FL): StatPearls Publishing. PMID 30571031. Retrieved 2022-03-16.
- ^ a b Boardman DA, Jacob J, Smyth LA, Lombardi G, Lechler RI (2016). "What Is Direct Allorecognition?". Current Transplantation Reports. 3 (4): 275–283. doi:10.1007/s40472-016-0115-8. PMC 5107184. PMID 27909647.
- ^ a b c Ingulli E (January 2010). "Mechanism of cellular rejection in transplantation". Pediatric Nephrology. 25 (1): 61–74. doi:10.1007/s00467-008-1020-x. PMC 2778785. PMID 21476231.
- ^ Clayton PA, McDonald SP, Russ GR, Chadban SJ (September 2019). "Long-Term Outcomes after Acute Rejection in Kidney Transplant Recipients: An ANZDATA Analysis". Journal of the American Society of Nephrology. 30 (9): 1697–1707. doi:10.1681/ASN.2018111101. PMC 6727270. PMID 31308074.
- ^ a b Gautreaux MD (2017-01-01). "Chapter 17 - Histocompatibility Testing in the Transplant Setting". In Orlando G, Remuzzi G, Williams DF (eds.). Kidney Transplantation, Bioengineering and Regeneration. Academic Press. pp. 223–234. doi:10.1016/b978-0-12-801734-0.00017-5. ISBN 978-0-12-801734-0.
- ^ Srinivas TR, Schold JD, Meier-Kriesche HU (2010-01-01). "Chapter 105 - Outcomes of Renal Transplantation". In Floege J, Johnson RJ, Feehally J (eds.). Comprehensive Clinical Nephrology (Fourth ed.). Philadelphia: Mosby. pp. 1222–1231. doi:10.1016/b978-0-323-05876-6.00105-2. ISBN 978-0-323-05876-6.
- ^ Dharnidharka VR (2019-01-01). "Chapter 43 - Pediatric Renal Transplantation". In Himmelfarb J, Ikizler TA (eds.). Chronic Kidney Disease, Dialysis, and Transplantation (Fourth ed.). Philadelphia: Elsevier. pp. 661–675.e7. doi:10.1016/B978-0-323-52978-5.00043-4. ISBN 978-0-323-52978-5. S2CID 81475473.
- ^ Jaramillo A, Fernández FG, Kuo EY, Trulock EP, Patterson GA, Mohanakumar T (February 2005). "Immune mechanisms in the pathogenesis of bronchiolitis obliterans syndrome after lung transplantation". Pediatric Transplantation. 9 (1): 84–93. doi:10.1111/j.1399-3046.2004.00270.x. PMID 15667618. S2CID 25841425.
- ^ Lau CL, Patterson GA (November 2003). "Current status of lung transplantation". The European Respiratory Journal. Supplement. 47: 57s–64s. doi:10.1183/09031936.03.00022103. PMID 14621118.
- ^ "Organ Procurement and Transplantation Network". U.S. Department of Health & Human Services.
- ^ Lama VN, Murray S, Lonigro RJ, Toews GB, Chang A, Lau C, et al. (June 2007). "Course of FEV(1) after onset of bronchiolitis obliterans syndrome in lung transplant recipients". American Journal of Respiratory and Critical Care Medicine. 175 (11): 1192–1198. doi:10.1164/rccm.200609-1344OC. PMC 1899272. PMID 17347496.
- ^ Nicod LP (July 2006). "Mechanisms of airway obliteration after lung transplantation". Proceedings of the American Thoracic Society. 3 (5): 444–449. doi:10.1513/pats.200601-007AW. PMID 16799090.
- ^ Hübscher SG, Clouston AD (January 2012). "Chapter 15 - Transplantation pathology". In Burt AD, Portmann BC, Ferrell LD (eds.). MacSween's Pathology of the Liver (Sixth ed.). Edinburgh: Churchill Livingstone. pp. 853–933. doi:10.1016/B978-0-7020-3398-8.00015-5. ISBN 978-0-7020-3398-8.
- ^ a b Dobbels F, Hames A, Aujoulat I, Heaton N, Samyn M (February 2012). "Should we retransplant a patient who is non-adherent? A literature review and critical reflection". Pediatric Transplantation. 16 (1): 4–11. doi:10.1111/j.1399-3046.2011.01633.x. PMID 22248250. S2CID 1895827.
- ^ Killian, Michael O.; Clifford, Stephanie; Lustria, Mia Liza A.; Skivington, Gage L.; Gupta, Dipankar (2022-04-18). "Directly observed therapy to promote medication adherence in adolescent heart transplant recipients". Pediatric Transplantation: e14288. doi:10.1111/petr.14288. ISSN 1397-3142. PMID 35436376. S2CID 248242427.
- ^ "Kidney biopsy:risks". Johns Hopkins Medicine. The Johns Hopkins University.
- ^ 임상시험번호 NCT00351559 - "IMAGE: 심장이식 거부반응을 위한 AlloMap 분자시험과 기존 생체검사 기반 감시 비교" (ClinicalTrials.gov )
- ^ "Lung biopsy:risks". Johns Hopkins Medicine. The Johns Hopkins University. 8 August 2021.
- ^ Hitchens TK, Ye Q, Eytan DF, Janjic JM, Ahrens ET, Ho C (April 2011). "19F MRI detection of acute allograft rejection with in vivo perfluorocarbon labeling of immune cells". Magnetic Resonance in Medicine. 65 (4): 1144–1153. doi:10.1002/mrm.22702. PMC 3135171. PMID 21305593.
- ^ Gheith OA (2011). "Gene expression profiling in organ transplantation". International Journal of Nephrology. 2011: 180201. doi:10.4061/2011/180201. PMC 3154482. PMID 21845224.
- ^ Naesens M, Kuypers DR, De Vusser K, Evenepoel P, Claes K, Bammens B, et al. (August 2014). "The histology of kidney transplant failure: a long-term follow-up study". Transplantation. 98 (4): 427–435. doi:10.1097/TP.0000000000000183. PMID 25243513. S2CID 20703626.
- ^ "The Genetic Basis Of Transplant Rejection". Medicine Encyclopedia.
- ^ Yang JY, Sarwal MM (May 2017). "Transplant genetics and genomics". Nature Reviews. Genetics. 18 (5): 309–326. doi:10.1038/nrg.2017.12. PMID 28286337. S2CID 2222755.
- ^ Bagley J, Iacomini J (April 2003). "Gene therapy progress and prospects: gene therapy in organ transplantation". Gene Therapy. 10 (8): 605–611. doi:10.1038/sj.gt.3302020. PMID 12692588.
- ^ Giannoukakis N, Thomson A, Robbins P (September 1999). "Gene therapy in transplantation". Gene Therapy. 6 (9): 1499–1511. doi:10.1038/sj.gt.3300981. PMID 10490759.
- ^ Yuan X, Paez-Cortez J, Schmitt-Knosalla I, D'Addio F, Mfarrej B, Donnarumma M, et al. (December 2008). "A novel role of CD4 Th17 cells in mediating cardiac allograft rejection and vasculopathy". The Journal of Experimental Medicine. 205 (13): 3133–3144. doi:10.1084/jem.20081937. PMC 2605226. PMID 19047438.